18.8:
배터리와 연료 전지
18.8:
배터리와 연료 전지
배터리는 특정 응용 분야에 대한 전력공급원으로 사용되는 갈바닉 셀입니다. 최신 배터리는 손목 시계에 전원을 공급하는 것과 같은 작은 버튼 배터리에서 부터 시 전력 망에 백업 에너지를 공급하는 데 사용되는 매우 큰 배터리에 이르기까지 다양한 응용 프로그램을 수용할 수 있는 다양한 형태로 존재합니다. 일부 배터리는 일회용 응용 프로그램을 위해 설계되었으며 재충전할 수 없으며(1차 셀) 다른 배터리는 외부 전원소스(보조 셀)에 의한 충전을 허용하는 편리한 가역가능한 셀 반응을 기반으로 합니다.
일회용(기본) 배터리
드라이 셀은 아연을 용기와 양극(“–“단자)과 흑연 막대를 음극(“+” 단자)으로 사용하는 일반적인 기본 배터리입니다. Zn캔은 망간(IV) 산화물, 아연(II) 염화물, 염화암모늄 및 물을 함유한 전해질 페이스트로 채워져 있습니다. 흑연 막대는 전해질 페이스트에 침지되어 셀을 완성합니다. 자발적인 세포 반응은 관련시킵니다:
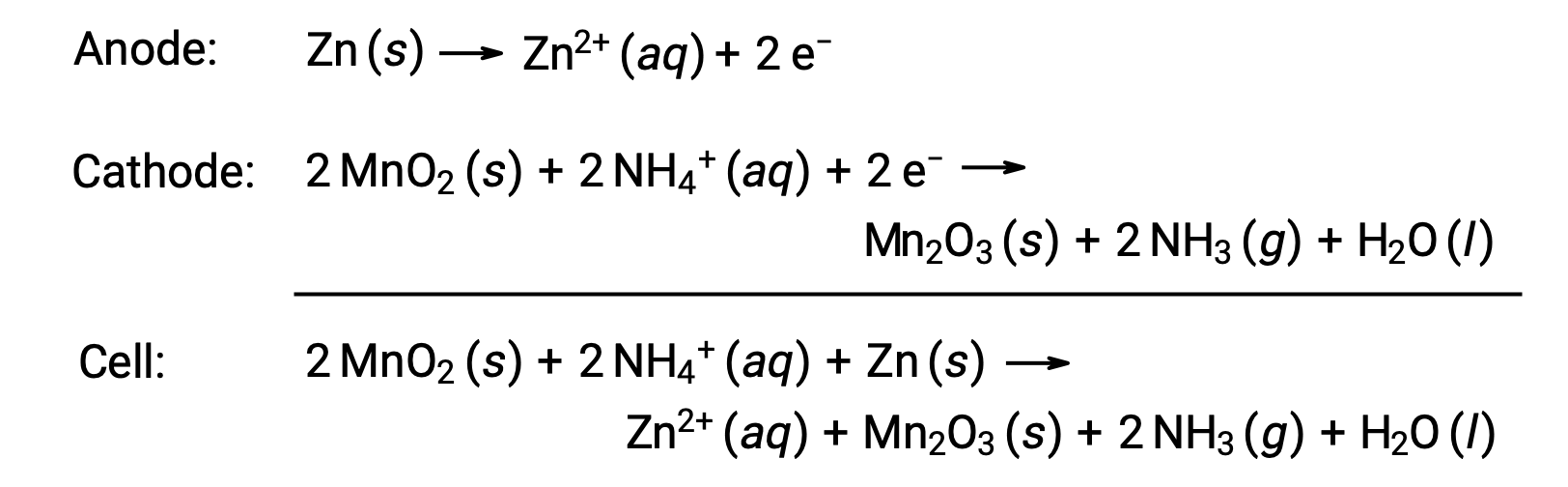
건식 셀의전압(셀 전위)은약 1.5V(E셀 ~ 1.5V)이다. 건조 세포는 다양한 크기(예: D, D, C, AA, AAA)에서 사용할 수 있습니다. 건조 세포의 모든 크기는 동일한 구성 요소를 구성하고 동일한 전압을 나타내지만, 더 큰 세포는 더 많은 양의 레독스 반응제를 함유하고 따라서 그에 상응하는 더 많은 양의 충전을 전송할 수 있습니다. 다른 갈바닉 셀과 마찬가지로, 건조한 셀은 필요한 경우 더 큰 전압 출력을 가진 배터리를 산출하기 위해 연열로 연결될 수 있습니다.
알칼리성 배터리는 건조 셀과 동일한 레독스 커플 주위에 설계되었습니다. 그들의 이름에서 알 수 있듯이, 배터리의 이 모형은 알칼리성 전해질을, 수시로 수산화칼륨을 사용합니다. 반응은
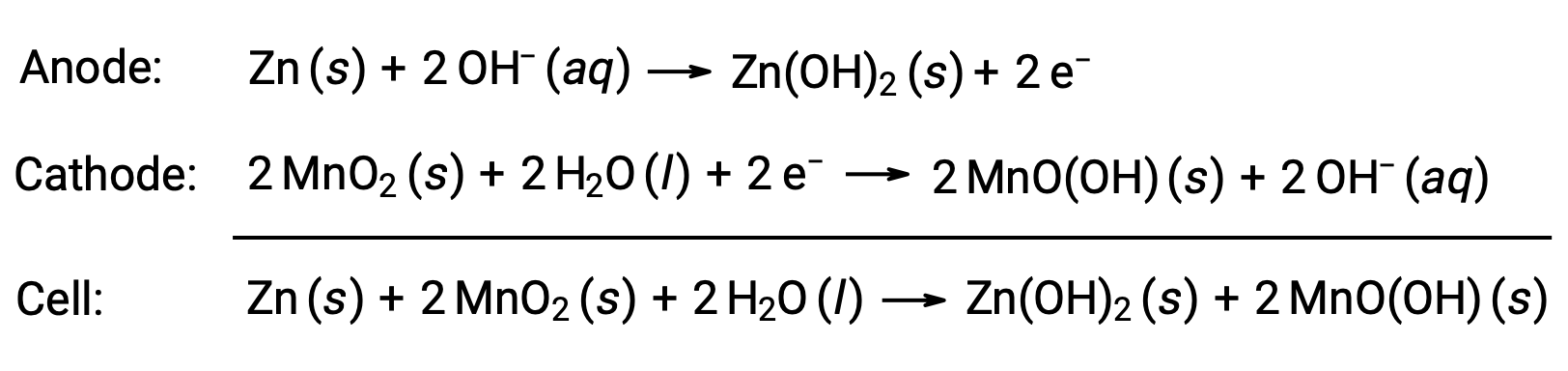
알칼리성 배터리는 비슷한 크기의 건조 셀의 약 3~5배 의 에너지를 제공할 수있습니다(E셀 = +1.43 V). 알칼리성 배터리는 수산화 칼륨누출이 발생하기 쉽기 때문에 장기간 보관하려면 장치에서 제거해야 합니다. 일부 알칼리성 배터리는 충전식이지만 대부분은 충전할 수 없습니다.
충전식(보조) 배터리
니켈 카드뮴 또는 NiCd, 배터리는 니켈 도금 음극, 카드뮴 도금 양극 및 수산화 칼륨 전극으로 구성됩니다. 분리기의 단락을 방지하는 양수 및 음수 플레이트가 함께 압연되어 케이스에 넣습니다. 이 설계를 통해 NiCd 셀은 비슷한 크기의 알칼리성 배터리보다 훨씬 더 많은 전류를 제공할 수 있습니다. 반응은
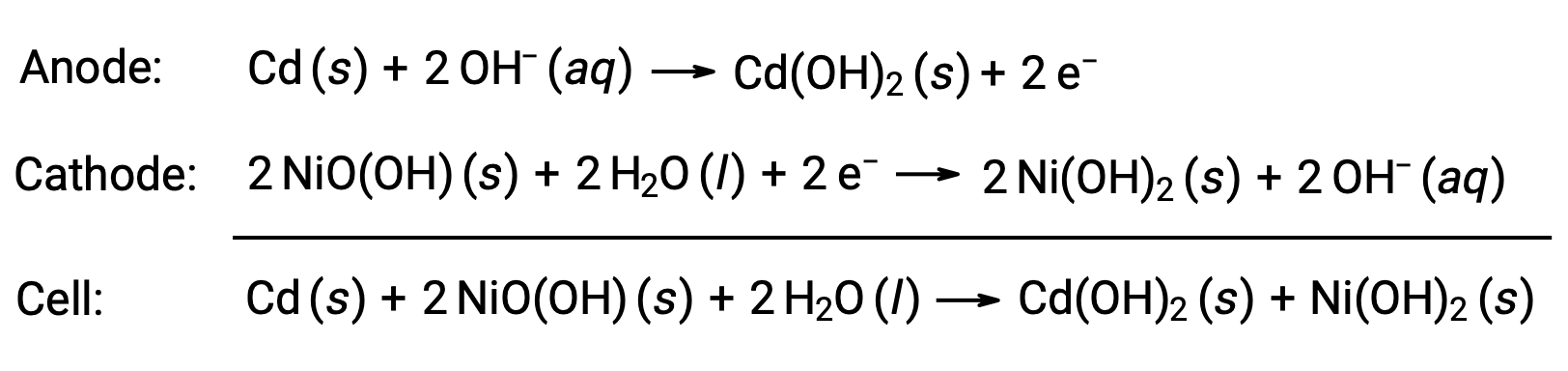
제대로 처리하면 NiCd 배터리를 약 1000회 충전할 수 있습니다(E셀 ~ 1.3 V). 카드뮴은 독성 중금속이므로 NiCd 배터리는 파열되거나 소각되어서는 안되며 관련 독성 폐기물 지침에 따라 폐기해야 합니다.
리튬 이온 배터리는 가장 인기있는 충전식 배터리 중 하나이며 많은 휴대용 전자 장치에서 사용됩니다. 반응은
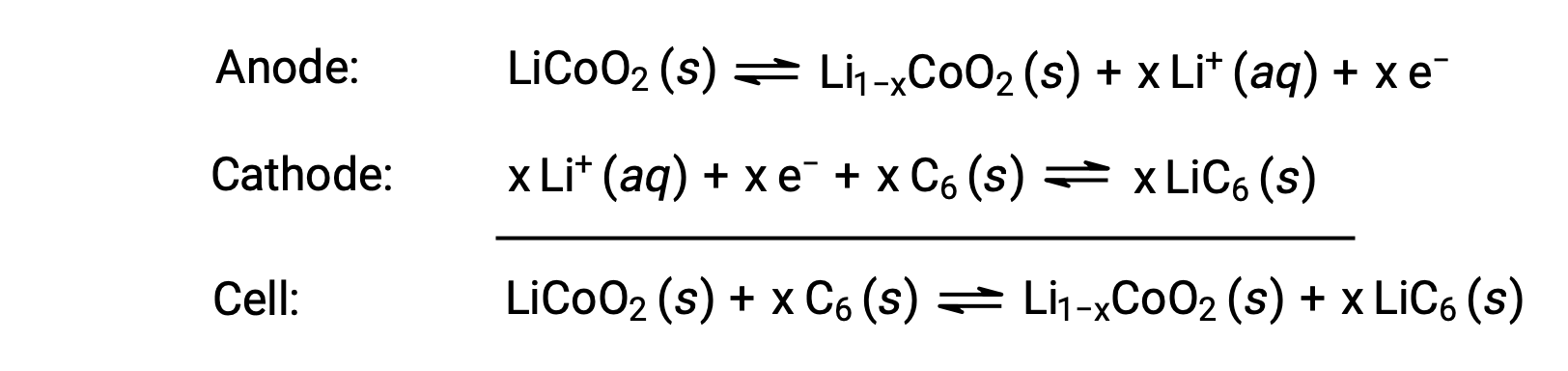
세포 반응의 가변 적 증식은 세포 전압의 변이를 유도하지만, 일반적인 조건에 대 한, x는 일반적으로 0.5, 셀 전압은 약 3.7 V(E셀 ~ 3.7). 리튬 배터리는 많은 양의 전류를 제공 할 수 있기 때문에 인기가 있으며, 다른 유형의 유사한 배터리보다 가볍고, 방전시 거의 일정한 전압을 생성하며, 저장 시 천천히 충전을 잃게됩니다.
납산 배터리는 자동차에 일반적으로 사용되는 이차 배터리의 일종이기도 합니다. 그것은 저렴하고 자동차 스타터 모터에 필요한 높은 전류를 생산 할 수 있습니다. 납산 배터리에 대한 반응은
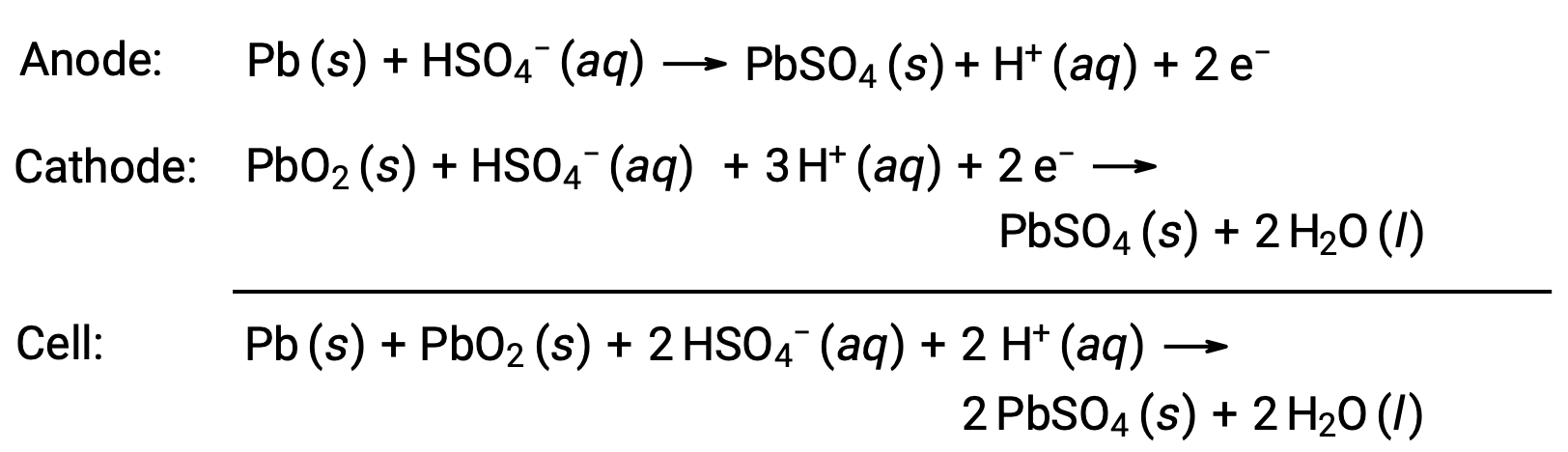
각 셀은 2V(E셀 ~ 2 V)를 생성하므로 6 개의 셀이 연이어 연결되어 12-V 자동차 배터리를 생산합니다. 납산 배터리는 무겁고 가성 액체 전해질, H2SO4 (aq)를함유하고 있지만, 높은 전류 밀도때문에 여전히 선택의 배터리입니다. 이러한 배터리에는 상당한 양의 납이 포함되어 있기 때문에 항상 제대로 폐기해야 합니다.
연료 전지
연료 전지는 산화제와 함께 세포로 지속적으로 공급되는 전통적인 연소 연료, 가장 자주 수소 또는 메탄을 사용하는 아연 도금 전지입니다. 전지 내에서 연료와 산화제는 연소될 때와 동일한 레독스 화학작용을 하지만, 촉매전기화학을 통해 훨씬 더 효율적입니다. 예를 들어, 일반적인 수소 연료 전지는 백금 기반 촉매에 내장된 흑연 전극을 사용하여 두 개의 반전 반응을 가속화합니다.
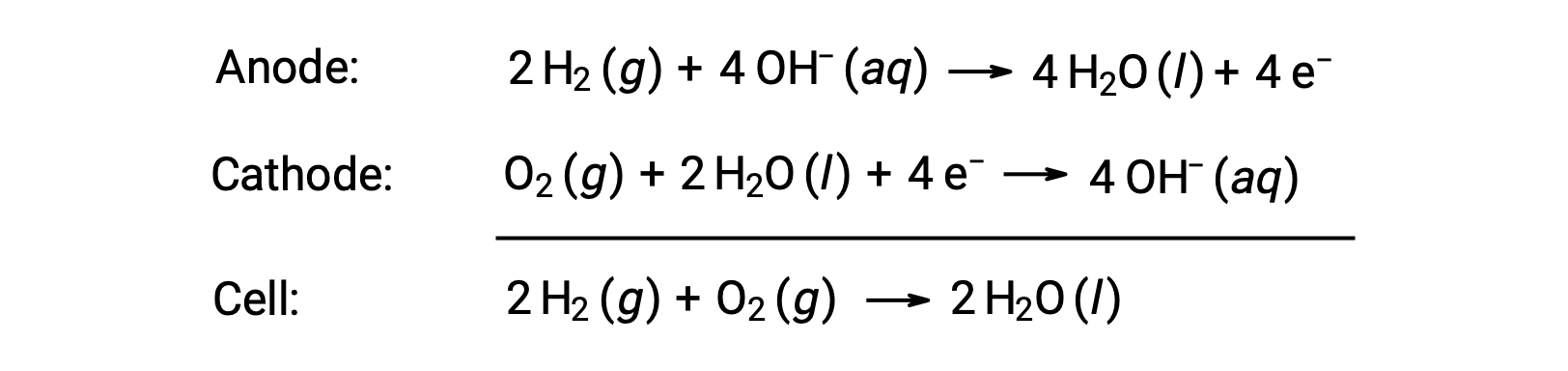
이러한 유형의 연료 전지는 일반적으로 약 1.23 V(E셀 ~ 1.23 V)의 전압을 생성합니다. 내연 기관과 비교하여, 동일한 레독스 반응을 사용하는 연료 전지의 에너지 효율은 전형적으로 두 배 이상입니다(~20%-25% 엔진의 경우 ~50%-75%). 수소 연료 전지는 확장 된 우주 임무에 일반적으로 사용되며 개인 용 차량용 프로토 타입이 개발되었습니다.
