18.8:
Baterias y Celdas de Combustible
18.8:
Baterias y Celdas de Combustible
Una batería es una celda galvánica que se utiliza como fuente de energía eléctrica para aplicaciones específicas. Las baterías modernas existen en una multitud de formas para adaptarse a diversas aplicaciones, desde diminutas baterías de botón como las que alimentan relojes de pulsera hasta las baterías más grandes utilizadas para suministrar energía de reserva a las redes eléctricas municipales. Algunas baterías están diseñadas para aplicaciones de un solo uso y no se pueden recargar (celdas primarias), mientras que otras se basan en reacciones de celda convenientemente reversibles que permiten la recarga mediante una fuente de alimentación externa (celdas secundarias).
Baterías de un solo uso (primarias)
Una celda seca es una batería principal común que utiliza zinc como contenedor y ánodo (terminal “–”) y una varilla de grafito como cátodo (terminal “+”). La lata de Zn se llena con una pasta electrolítica que contiene óxido de manganeso (IV), cloruro de zinc (II), cloruro de amonio y agua. Una varilla de grafito se sumerge en la pasta electrolítica para completar la celda. La reacción de celda espontánea implica:
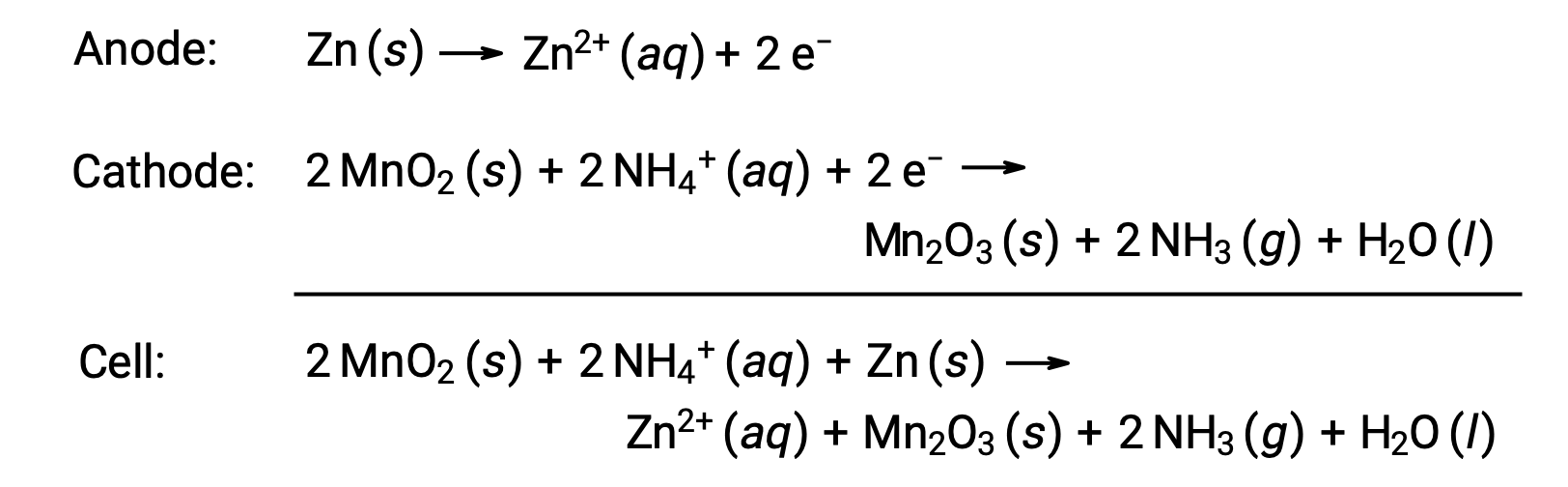
El voltaje (potencial de celda) de una celda seca es de aproximadamente 1,5 V (Ecelda ~ 1,5 V). Las celdas secas están disponibles en varios tamaños (por ejemplo, D, C, AA, AAA). Todos los tamaños de celdas secas comprenden los mismos componentes y presentan el mismo voltaje, pero las celdas más grandes contienen mayores cantidades de reactivos redox y, por lo tanto, son capaces de transferir cantidades de carga proporcionalmente mayores. Al igual que otras celdas galvánicas, las celdas secas se pueden conectar en serie para producir baterías con mayores salidas de voltaje, si es necesario.
Las baterías alcalinas fueron diseñadas alrededor de las mismas parejas redox que la celda seca. Como su nombre lo indica, estos tipos de baterías utilizan electrolitos alcalinos, a menudo hidróxido de potasio. Las reacciones son
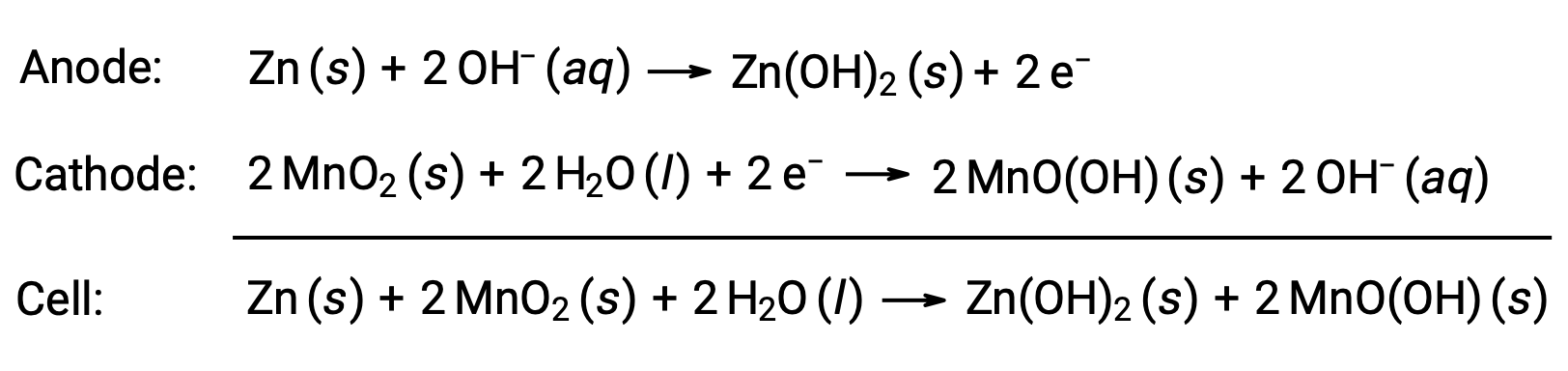
Una pila alcalina puede suministrar entre tres y cinco veces la energía de una pila seca de tamaño similar (Ecelda = +1,43 V). Las baterías alcalinas son propensas a fugas de hidróxido de potasio, por lo que deben retirarse de los dispositivos para su almacenamiento a largo plazo. Aunque algunas pilas alcalinas son recargables, la mayoría no lo son.
Baterías recargables (secundarias)
Las baterías de níquel-cadmio, o NiCd, constan de un cátodo chapado en níquel, un ánodo chapado en cadmio y un electrodo de hidróxido de potasio. Las placas positiva y negativa, las cuales el separador evita que hagan cortocircuito, se enrollan juntas y se colocan en la caja. Este diseño permite que la celda NiCd proporcione mucha más corriente que una pila alcalina de tamaño similar. Las reacciones son
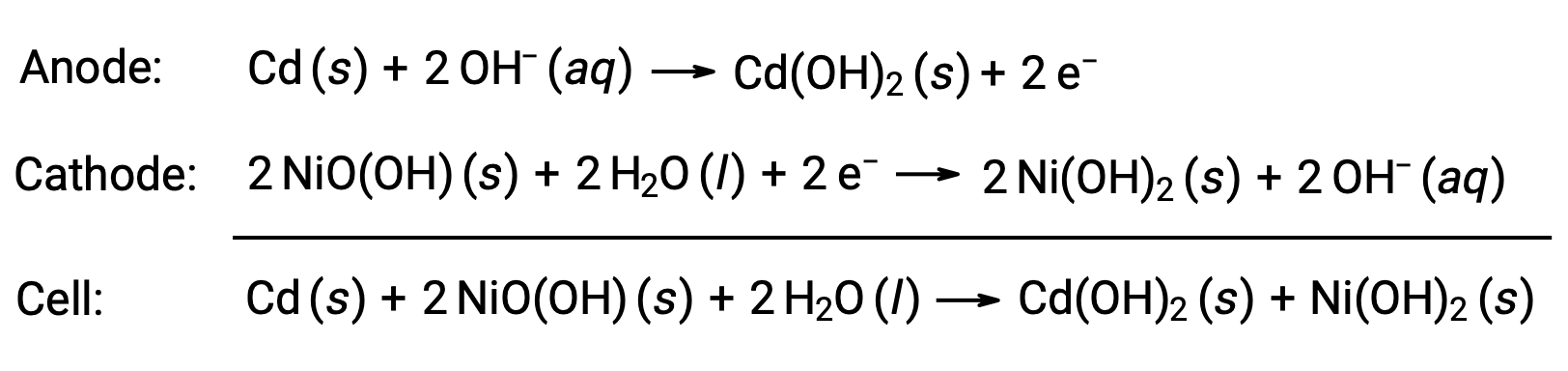
Si se trata correctamente, una batería NiCd puede recargarse unas 1000 veces (Ecelda ~ 1,3 V). El cadmio es un metal pesado tóxico, por lo que las baterías de NiCd nunca deben romperse ni incinerarse, y deben desecharse de acuerdo con las directrices pertinentes acerca de residuos tóxicos.
Las baterías de iones de litio se encuentran entre las baterías recargables más populares y se utilizan en muchos dispositivos electrónicos portátiles. Las reacciones son
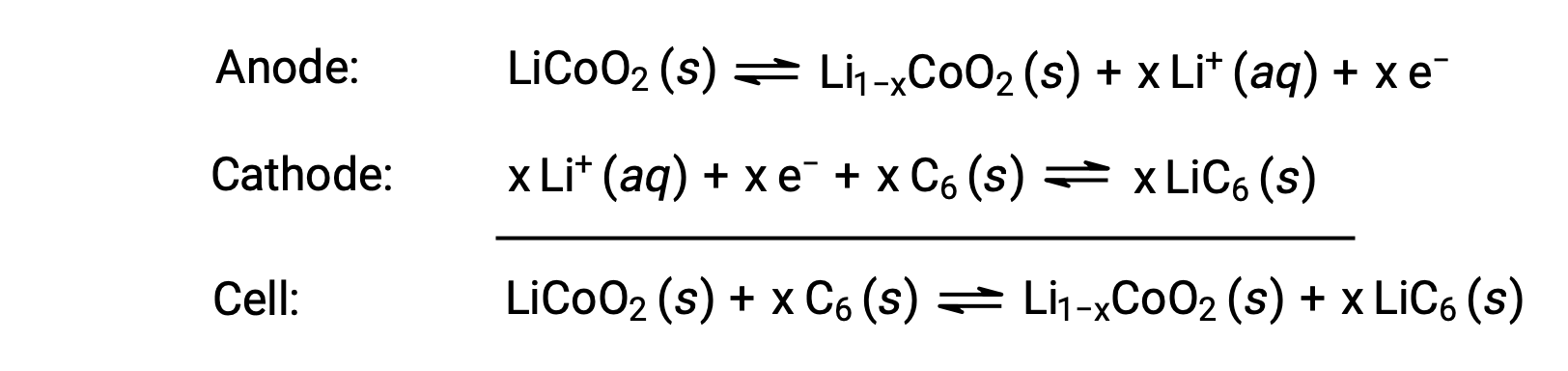
La estequiometría variable de la reacción de celda conduce a la variación en los voltajes de celda, pero para condiciones típicas, x no suele ser superior a 0,5, y el voltaje de celda es de aproximadamente 3,7 V (Ecelda ~ 3,7). Las baterías de litio son populares porque pueden proporcionar una gran cantidad de corriente, son más ligeras que los otros tipos de baterías comparables, producen un voltaje casi constante a medida que se descargan y sólo pierden lentamente su carga al estar almacenadas.
La batería de plomo-ácido es también un tipo de batería secundaria que se usa comúnmente en los automóviles. Es económica y capaz de producir la alta corriente requerida por los motores de arranque de los automóviles. Las reacciones para una batería de plomo-ácido son
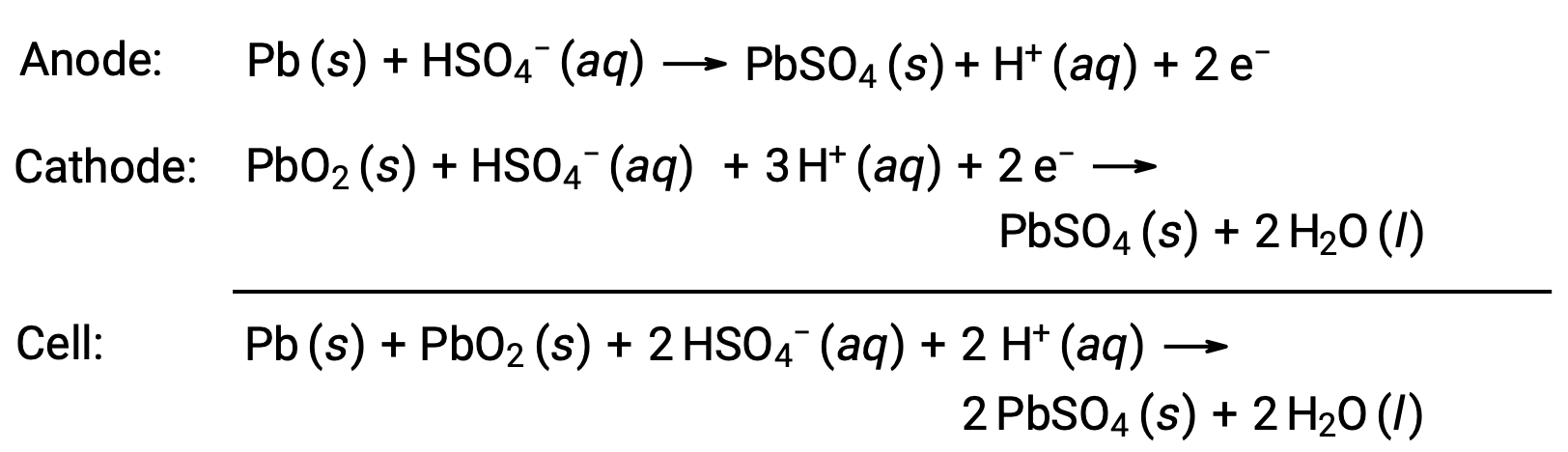
Cada celda produce 2 V (Ecelda ~ 2 V), por lo que seis celdas se conectan en serie para producir una batería de automóvil de 12 V. Las baterías de plomo-ácido son pesadas y contienen un electrolito líquido cáustico, H2SO4 (ac), pero a menudo siguen siendo la batería de elección debido a su alta densidad de corriente. Puesto que estas baterías contienen una cantidad significativa de plomo, siempre deben desecharse correctamente.
Celdas de combustible
Una celda de combustible es una celda galvánica que utiliza combustibles tradicionales, más a menudo hidrógeno o metano, que son continuamente alimentados en la celda junto con un oxidante. Dentro de la celda, el combustible y el oxidante experimentan la misma química redox que cuando están en combustión, pero a través de un electroquímico catalizado que es perceptiblemente más eficiente. Por ejemplo, una típica celda de combustible de hidrógeno utiliza electrodos de grafito incrustados con catalizadores a base de platino para acelerar las dos reacciones de semi-celda:
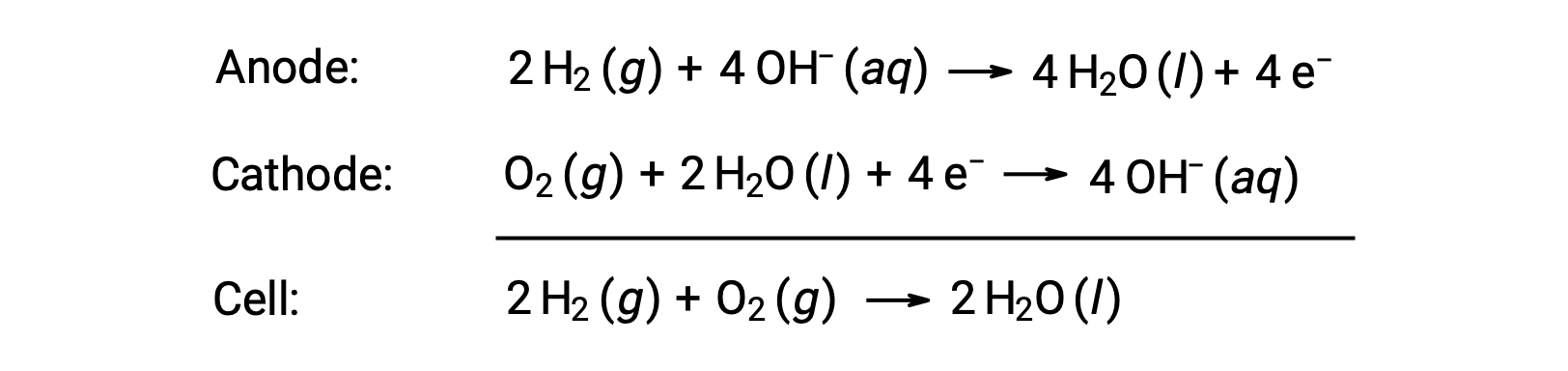
Estos tipos de pilas de combustible suelen producir voltajes de aproximadamente 1,23 V (Ecelda ~ 1,23 V). En comparación con un motor de combustión interna, la eficiencia energética de una celda de combustible que utiliza la misma reacción redox suele ser más del doble (~20%–25% para un motor frente a ~50%–75% para una celda de combustible). Las celdas de combustible de hidrógeno se utilizan comúnmente en misiones espaciales extendidas, y se han desarrollado prototipos para vehículos personales.
Este texto es adaptado de Openstax, Química 2e, Sección 17.5: Baterías y Celdas de Combustible.
