18.8:
Аккумуляторы и топливные элементы
18.8:
Аккумуляторы и топливные элементы
Аккумуляторная батарея представляет собой гальваническую ячейку, которая используется в качестве источника электропитания для определенных областей применения. Современные батареи существуют в различных формах для различных областей применения, от миниатюрных батареек, таких как батареи, которые наручные часы, до очень больших батарей, используемых для подачи резервной энергии в муниципальные электросети. Некоторые аккумуляторы предназначены для одноразового использования и не могут быть перезаряжены (основные ячейки), в то время как другие батареи основаны на удобной реакции обратимая, которая позволяет подзаряжать аккумуляторы от внешнего источника питания (вторичные ячейки).
Одноразовые (основные) батареи
Сухой элемент питания — это обычная основная батарея, в которой в качестве контейнера и анода используется цинк («–») и графитовый стержень в качестве катода («+» клемма). В емкость Zn заливается электролитная паста, содержащая оксид марганца (IV), хлорид цинка (II), хлорид аммония и воду. Графитовый стержень погружается в электролитную пасту для заполнения ячейки. Спонтанная клеточная реакция включает:
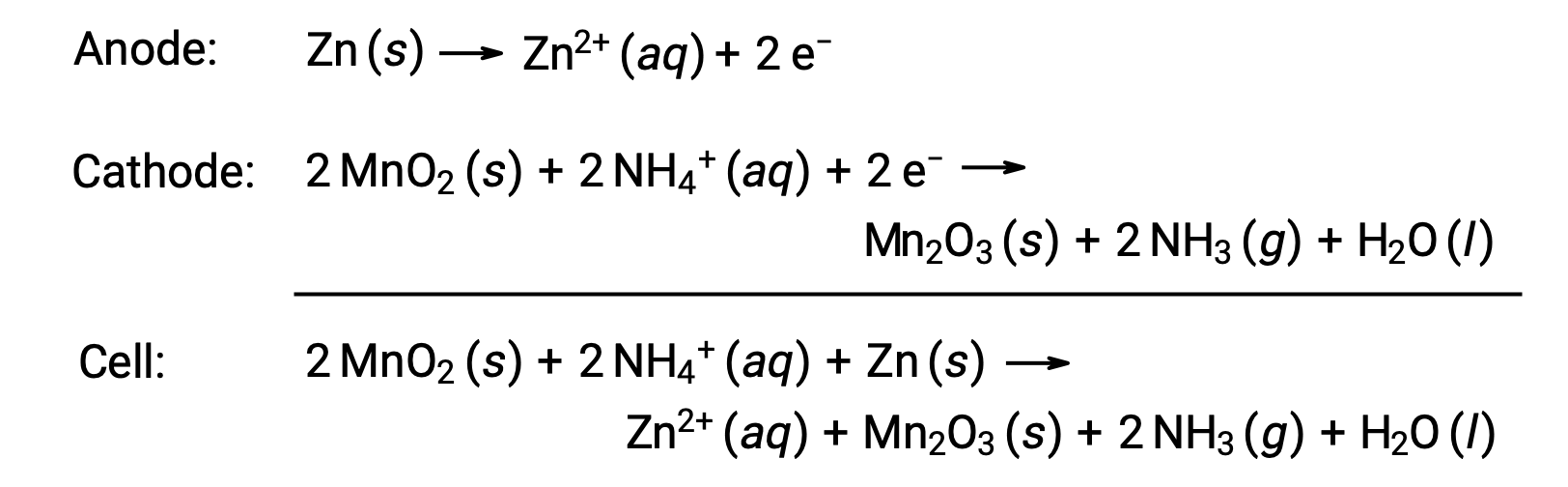
Напряжение (потенциал ячейки) сухой ячейки составляет приблизительно 1.5 в (Эклет ~ 1.5 в). Сухие ячейки доступны в различных размерах (например, D, C, AA, AAA). Все размеры сухих элементов состоят из одних и тех же компонентов и имеют одинаковое напряжение, но более крупные ячейки содержат большее количество окислительно-восстановительного реагенты и, следовательно, способны передавать соответственно большее количество заряда. Как и другие гальванические элементы, сухие ячейки могут быть соединены последовательно для получения батарей с более высоким выходным напряжением, если это необходимо.
Щелочные батареи были разработаны для тех же пар ОВП, что и сухие батареи. Как показывает их название, в этих типах батарей используются щелочные электролиты, часто гидроксид калия. Реакция на это
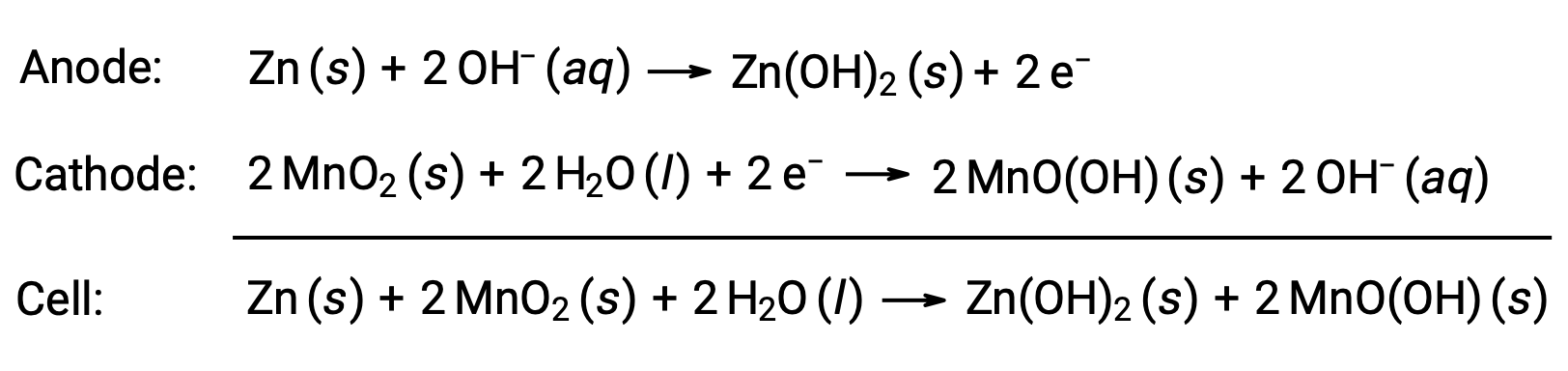
Щелочная батарея может обеспечивать в три-пять раз больше энергии сухой ячейки аналогичного размера (Ecell = +1,43 в). Щелочные батареи подвержены утечке гидроксида калия, поэтому их следует извлекать из устройств для длительного хранения. Хотя некоторые щелочные батареи перезаряжены, большинство из них не являются.
Перезаряжаемые (вторичные) батареи
Никель-кадмиевые батареи, или NiCd, состоят из никелированного катода, анода с кадмием и гидроксида калия. Положительные и отрицательные пластины, которые не могут быть закоращены сепаратором, свернуты и помещены в корпус. Такая конструкция позволяет аккумулятору NiCd подавать гораздо больше тока, чем щелочной батареке аналогичного размера. Реакция на это
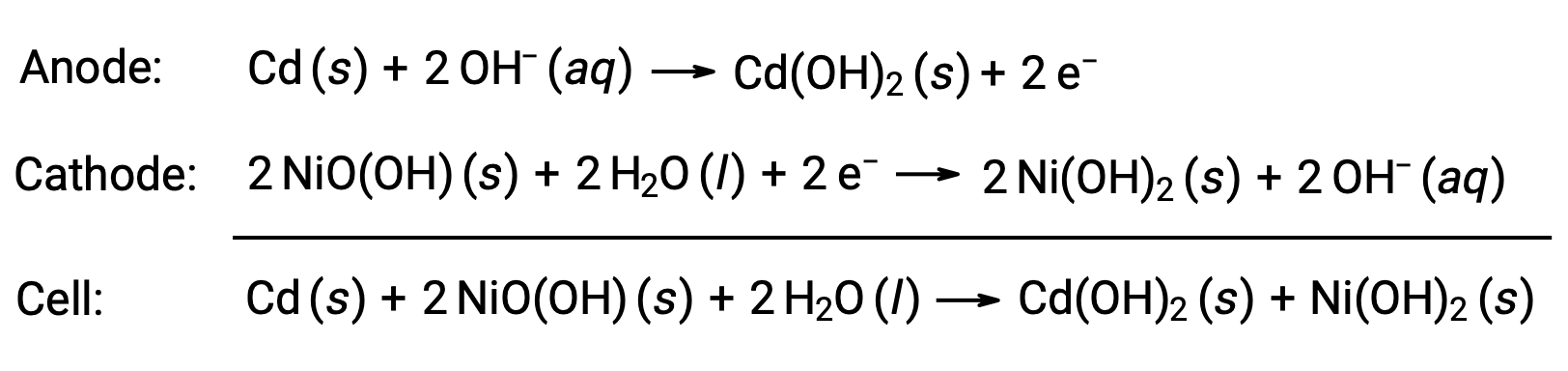
При правильном обращении никель-кадмиевый аккумулятор можно перезаряжать примерно 1000 раз ( Ecell ~ 1.3 в). Кадмий является токсичным тяжелым металлом, поэтому никель-кадмиевые батареи никогда не должны быть разорваны или сожжены, и их следует утилизировать в соответствии с соответствующими рекомендациями по утилизации токсичных отходов.
Литий-ионные аккумуляторы являются одними из самых популярных аккумуляторов и используются во многих портативных электронных устройствах. Реакция на это
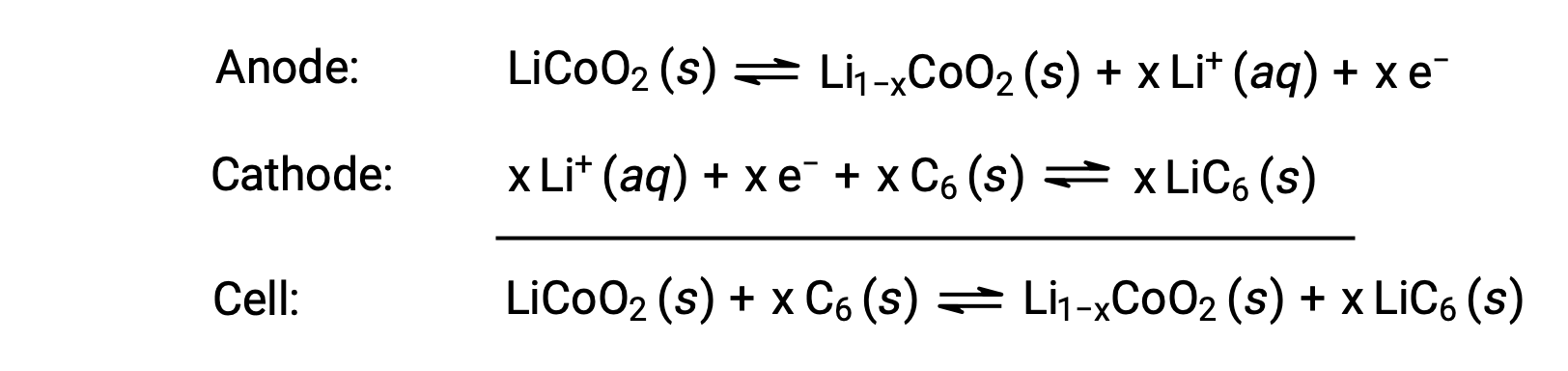
Переменная стехиометрия реакции клетки приводит к колебаниям напряжения клеток, но для типичных условий x обычно не превышает 0.5, а напряжение ячейки составляет приблизительно 3.7 в (Экатель ~ 3.7). Литиевые батареи популярны, потому что они могут обеспечивать большой ток, легче, чем аналогичные батареи других типов, вырабатывают почти постоянное напряжение при разрядке и лишь медленно теряют заряд при хранении.
Свинцово-кислотный аккумулятор также является типом вторичной аккумуляторной батареи, обычно используемой в автомобилях. Он недорог и способен вырабатывает ток, необходимый автомобильным стартеорам. Реакции на свинцово-кислотную батарею составляют
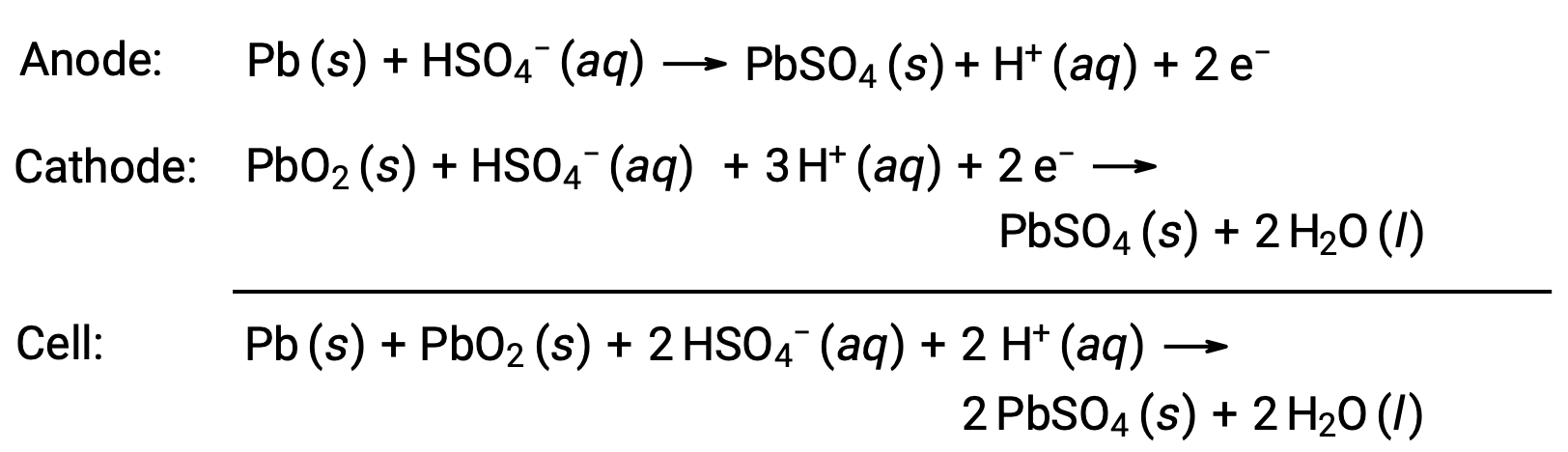
Каждая ячейка производит 2 в (Ecell ~ 2 в), так что шесть ячеек соединены последовательно, чтобы создать 12-вольтную автомобильную батарею. Свинцово-кислотные батареи тяжелые и содержат едкий жидкий электролит H2SO4 (aq), но часто остаются предпочтительными по своему выбору из-за высокой плотности тока. Так как в этих аккумуляторах содержится большое количество свинца, их необходимо утилизировать надлежащим образом.
Топливные элементы
A fuel cell is a galvanic cell that uses traditional combustive fuels, most often hydrogen or methane, that are continuously fed into the cell along with an oxidant. Within the cell, fuel and oxidant undergo the same redox chemistry as when they are combusted, but via a catalyzed electrochemical that is significantly more efficient. For example, a typical hydrogen fuel cell uses graphite electrodes embedded with platinum-based catalysts to accelerate the two half-cell reactions:
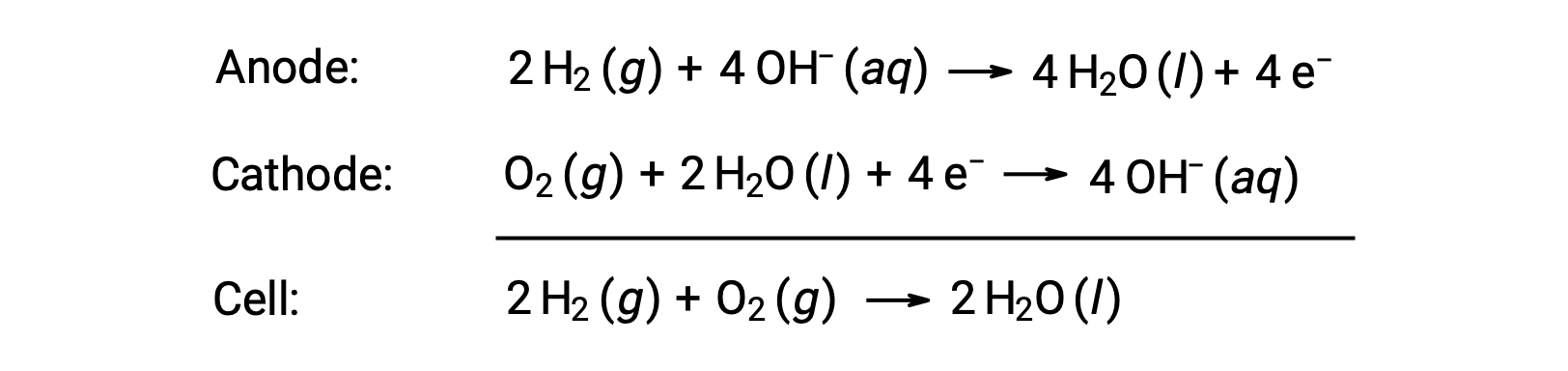
These types of fuel cells generally produce voltages of approximately 1.23 V (Ecell ~ 1.23 V). Compared to an internal combustion engine, the energy efficiency of a fuel cell using the same redox reaction is typically more than double (~20%–25% for an engine versus ~50%–75% for a fuel cell). Hydrogen fuel cells are commonly used on extended space missions, and prototypes for personal vehicles have been developed.
This text is adapted from Openstax, Химия 2е изд., Section 17.5: Batteries, and Fuel Cells.
