Summary
Ectodermo embrionario de Xenopus se ha convertido en un atractivo modelo para el estudio de la polaridad celular. Un ensayo se describe, en el que la distribución subcelular de las proteínas fluorescentes se evalúa en las células de ectodermo. Este protocolo ayudará a contestar preguntas relacionadas con el control espacial de la señalización.
Abstract
Polaridad celular es una propiedad fundamental de las células eucariotas que es dinámica regulada por factores tanto intrínsecos como extrínsecos durante el desarrollo embrionario de 1, 2. Una de las vías de señalización implicadas en el presente Reglamento es la vía Wnt, que se utiliza muchas veces durante la embriogénesis y la crítica de la enfermedad humana 3, 4, 5. Múltiples componentes moleculares de esta vía de señalización de forma coordinada regular de manera espacialmente restringida, pero los mecanismos subyacentes no se comprenden totalmente. Xenopus células epiteliales embrionarias es un excelente sistema para estudiar la localización subcelular de las diferentes proteínas de señalización. Las proteínas fluorescentes de fusión se expresan en los embriones de Xenopus por microinyección de ARN, los explantes ectodérmica se preparan y localización de la proteína es evaluada por epifluorescencia. En este protocolo experimental se describe cómo la localización subcelular de Diversin, una proteína citoplasmática que se ha implicado en la señalización celular y la determinación de la polaridad de 6, 7 se visualiza en Xenopus células ectodérmicas para estudiar la transducción de señales Wnt 8. Co-expresión de un ligando Wnt o un receptor Frizzled altera la distribución de Diversin fusionada con la proteína fluorescente de color rojo, RFP, y recluta a la membrana celular de una manera polarizada 8, 9. Este protocolo ex vivo debe ser una adición útil a los estudios in vitro de células de mamífero cultivadas, en el que el control espacial de la señalización difiere de la del tejido intacto y es mucho más difícil de analizar.
Protocol
1. Fertilización In Vitro de Xenopus huevos
- Obtener huevos de las ranas hembra que fueron inyectados con gonadotrofina coriónica humana (400 unidades / rana) 12 horas antes del experimento.
- Coloque los huevos en una pequeña cantidad (0,5-1 ml) de 1 x Marc solución de Ringer modificadas (MMR) 10 a los huevos y fertilizar in vitro con un pequeño trozo de testículo disecado. Después de 2-3 minutos, añadir 0,1 x MMR para cubrir toda la superficie de los huevos. En 20 minutos, el huevo capa gelatinosa se elimina en un 3% cisteína - HCl (pH ajustado a 8 con hidróxido de sodio). Los huevos son lavados con 0,1 x MMR tres veces y se fue en una fría incubadora (13 ° C) para inyección.
- Los huevos fertilizados se les permite desarrollarse a la etapa de células 2-4. Para las inyecciones, los embriones se transfieren a la solución que contiene 3% de Ficoll, 0,5 x MMR.
2. ARN microinyección
- ARN se sintetiza a partir de plantillas de ADN lineal con mMessage mMachine kit (Ambion) y se diluye con agua libre de RNasa en la concentración de acciones de 0,1-1 mg / l. Las dosis óptimas de ARN para la inyección son determinados en experimentos piloto. ARN para Diversin-RFP, el marcador de membrana GFP-CAAX Frizzled y 8 se utilizan en 0.1-1 ng por inyección.
- Agujas de inyección se preparan con un extractor de la aguja de un capilar y luego con un molinillo de aguja. Antes de la inyección, cada aguja se calibra con agua para expulsar 10 nl de inyección de líquido por habitante.
- Para las inyecciones, los embriones se colocan en un plato de plástico en una gran gota de 3% Ficoll, 0,5 x MMR. Un microlitro de solución de ARN se aspira en una aguja de inyección con Narishige microinyector. 10 nl de ARN se inyecta en animales de 8 blastómeros de embriones de células 2-3 veces. Los embriones inyectados se transfieren a un pozo de la placa de 12 pocillos.
3. Preparación de explantes ectodérmica
- Cuando los embriones inyectados llegar a las primeras etapas de gástrula, se transfieren a 0,6 x solución de MMR en un plato de 3 cm de plástico recubiertas con agarosa al 1%. Membrana vitelina se elimina manualmente con un par de pinzas. Explantes ectodérmica son extirpados de los embriones con una aguja de tungsteno y un hairloop.
- Explantes ectodérmica se transfieren a un frasco de vidrio y se fija con 3,7% de formaldehído en tampón fosfato salino (PBS) durante 30 minutos. Explantes fija se lavan tres veces con PBS (10 minutos cada uno). DAPI se incluye en el tercer lavado para teñir los núcleos.
- Los explantes se montan en un portaobjetos de vidrio. Dos tiras de cinta adhesiva se unen a la diapositiva y los explantes se colocan entre las dos bandas. Puesto que la superficie exterior de los explantes se pigmenta, la parte interna de los explantes debe mirar hacia el objetivo del microscopio. Añadir dos-tres 20 gotas l de la solución de montaje (70% de glicerol en PBS como 25 mg / ml DABCO, anti-fading reactivo) 11. Ponga un cubreobjetos en la parte superior.
4. Imágenes de explantes bajo un microscopio fluorescente
- Las muestras son examinadas bajo microscopio Zeiss Axioplan fluorescente con filtros adecuados.
- Las imágenes son tomadas con el archivo adjunto apótoma de visualizar un plano específico de varios explantes independiente.
5. Muestras criostáticas
Muestras criostáticas es una forma alternativa de visualizar la distribución de las proteínas fluorescentes en la célula y más aplicable para inmunotinción. En la 10 ª etapa, los embriones son fijos durante 1-2 horas con el fijador de Dent (20% DMSO, 80% de metanol), se lava con PBS, y embebidos en una solución de sacarosa al 15% de pescado gelatin/15 11%. Los embriones son incorporados rápidamente congelado en hielo seco y cryosections se generan en el criostato Leica. Las secciones transversales se incluyen las células ectodérmicas que heredan ARN inyectada y sus productos proteicos traducido. Las secciones de mantener la fluorescencia y se immunostained con anticuerpos específicos y con anticuerpos secundarios conjugados con fluorescencia. Los núcleos se tiñeron con DAPI. Los medios de montaje son las mismas que las descritas anteriormente. Imágenes se pueden realizar como se describe anteriormente.
6. Los resultados representativos:
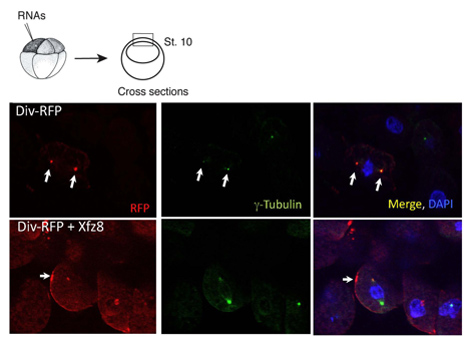
Figura 1. Receptor rizado reclutas Diversin a la membrana celular. Ectodermo células que expresan Frizzled 8 (Xfz8) y ARN Div-RFP revelan Div-RFP en la membrana celular, en lugar del centrosoma (según lo revelado por g-tubulina co-tinción). El esquema del experimento es en la parte superior, una sección transversal típica se muestra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Hemos utilizado el protocolo anterior para caracterizar la localización subcelular de Diversin. En los explantes de polo animal, Diversin-RFP se detectó al lado del núcleo y colocalized con g-tubulina, un marcador centrosomal, en cryosections (Figura 1). Una vez que la localización subcelular de una proteína se identifica, supresión construcciones se pueden generar para establecer dominios de la proteína que son necesarias y suficientes para la localización subcelular. Con este enfoque, los dominios de la localización de centrosomal Diversin se han localizado en el centro y en los dominios carboxi-terminal de la proteína, tanto que contiene el motivo espiral de la bobina 8.
El mismo protocolo se puede utilizar en los estudios, en los que la localización de proteínas se altera en respuesta a la señalización. Hemos encontrado que las proteínas secretadas Wnt actuar para reubicar Div-RFP a las estructuras adyacentes punteada a la membrana celular, mientras que FZ8 reclutas RFP Div-a los parches de la membrana celular (Figura 1). Más adelante, descubrimos que el dominio carboxi-terminal no es esencial para la membrana de la contratación en sí, pero necesaria para la contratación de membrana polarizada.
En resumen, el protocolo experimental anterior le ayudará en diversos estudios de las interacciones proteína-proteína y localización de proteínas de diferentes compartimentos celulares después de la estimulación de las células con factores de crecimiento específicos o proteínas de señalización.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
No hay conflictos de interés declarado.
Acknowledgments
Investigación en el laboratorio Sokol es patrocinado por el institutos agregados Nacional de Salud.
References
- Gurdon, J. B. Embryonic induction --- molecular aspects. Development. 99, 285-306 (1987).
- Principles of Developmental Genetics. Moody, S. A. , Academic Press. (2007).
- Clevers, H. Wnt/beta-catenin signaling in development and disease. Cell. 127, 469-480 (2006).
- Klaus, A., Birchmeier, W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 8, 387-398 (2008).
- Gordon, M. D., Nusse, R. Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors. J Biol Chem. 281, 22429-22433 (2006).
- Schwarz-Romond, T., Asbrand, C., Bakkers, J., Kuhl, M., Schaeffer, H. J., Huelsken, J., Behrens, J., Hammerschmidt, M., Birchmeier, W. The ankyrin repeat protein Diversin recruits Casein kinase Iepsilon to the beta-catenin degradation complex and acts in both canonical Wnt and Wnt/JNK signaling. Genes Dev. 16, 2073-2084 (2002).
- Moeller, H., Jenny, A., Schaeffer, H. J., Schwarz-Romond, T., Mlodzik, M., Hammerschmidt, M., Birchmeier, W. Diversin regulates heart formation and gastrulation movements in development. Proc Natl Acad Sci U S A. 103, 15900-15905 (2006).
- Itoh, K., Jenny, A., Mlodzik, M., Sokol, S. Y. Centrosomal localization of Diversin and its relevance to Wnt signaling. J. Cell Sci. 122, 3791-3798 (2009).
- Itoh, K., Jacob, J., Sokol, Y. S. A role for Xenopus Frizzled 8 in dorsal development. Mech Dev. 74, 145-157 (1998).
- Newport, J., Kirschner, M. A major developmental transition in early Xenopus embryos: I. characterization and timing of cellular changes at the midblastula stage. Cell. 30, 675-686 (1982).
- Itoh, K., Brott, B. K., Bae, G. U., Ratcliffe, M. J., Sokol, S. Y. Nuclear localization is required for Dishevelled function in Wnt/beta-catenin signaling. J Biol. 4, 3-3 (2005).



