Summary
Xenopus ectoderma embrionário tornou-se um modelo atraente para os estudos da polaridade celular. Um ensaio é descrito, em que a distribuição subcelular de proteínas fluorescentes é avaliada em células ectoderma. Este protocolo vai ajudar abordar as questões relacionadas ao controle espacial de sinalização.
Abstract
Polaridade celular é uma propriedade fundamental das células eucarióticas que é dinamicamente regulada por fatores intrínsecos e extrínsecos durante o desenvolvimento embrionário 1, 2. Uma das vias de sinalização envolvidas neste regulamento é o caminho Wnt, que é usado muitas vezes durante a embriogênese e críticas para a doença humana 3, 4, 5. Múltiplos componentes moleculares desta via coordenadamente regular a sinalização de uma forma espacialmente restrito, mas os mecanismos subjacentes não são totalmente compreendidos. Células embrionárias epiteliais Xenopus é um excelente sistema para o estudo de localização subcelular de várias proteínas de sinalização. Proteínas de fusão fluorescentes são expressos em embriões Xenopus por microinjeção RNA, explantes ectodérmica são preparados e localização de proteínas é avaliado por epifluorescência. Neste protocolo experimental que descrevem como localização subcelular de Diversin, uma proteína citoplasmática que tem sido implicado na sinalização celular e determinação de polaridade 6, 7 é visualizado em células Xenopus ectodérmica para estudar transdução de sinal Wnt 8. Co-expressão de um ligante Wnt ou um receptor Frizzled altera a distribuição de Diversin fundido com proteína fluorescente vermelha, RFP, e recruta-o para a membrana celular de uma forma polarizada 8, 9. Este protocolo ex vivo deve ser uma adição útil para estudos in vitro de culturas de células de mamíferos, em que o controle espacial de sinalização difere daquela do tecido intacto e é muito mais difícil de analisar.
Protocol
1. Fertilização In Vitro de Xenopus Ovos
- Obtenção dos ovos de rãs do sexo feminino que foram injetados com gonadotrofina coriônica humana (400 unidades / rã) 12 horas antes do experimento.
- Coloque os ovos em uma pequena quantidade (0,5-1 ml) de uma solução de Ringer x Marc modificados (MMR) 10 a os ovos e fertilizá-los in vitro com um pequeno pedaço de testículos dissecados. Depois de 2-3 min, adicione 0,1 x MMR para cobrir toda a superfície dos ovos. Em 20 minutos, o ovo casaco geléia é removido por cisteína 3% - HCL (pH ajustado para 8 com hidróxido de sódio). Os ovos são lavados com 0,1 x MMR três vezes e deixado em uma incubadora de frio (13 ° C) para injectáveis.
- Ovos fertilizados são autorizados a desenvolver a 2-4 estágio celular. Para injectáveis, os embriões são transferidos para a solução contendo Ficoll 3%, 0,5 x MMR.
2. Microinjeção RNA
- RNAs são sintetizados a partir de modelos DNA linearizado usando mMessage mMachine kit (Ambion) e diluído com água livre de RNase na concentração de ações de 0,1-1 mg / mL. Doses ótimas de RNAs para injectáveis são determinados em experimentos-piloto. RNAs para Diversin-RFP, o marcador de membrana GFP-CAAX Frizzled e 8 são utilizados em 0,1-1 ng por injeção.
- Agulhas de injeção são preparados com um puxador de uma agulha de uma capilar e, em seguida, com um moedor de agulha. Antes da injecção, cada agulha é calibrado com água para ejetar 10 nl de injeção de líquido por.
- Para injectáveis, os embriões são colocados em um prato de plástico em uma gota grande de Ficoll 3%, 0,5 x MMR. Um microlitro de solução de RNA é sugado para uma agulha de injeção com Narishige microinjetor. Nl 10 de RNA é injetado em animais de 8 blastômeros de embriões de células 2-3 vezes. Os embriões injetados são transferidos para um poço da placa de 12 poços.
3. Preparando Explantes Ectodérmica
- Quando os embriões injetados atingir o estádio de gástrula inicial, eles são transferidos para solução 0,6 x MMR em um prato de 3 centímetros de plástico revestidas com agarose 1%. Membrana vitelina é removida manualmente com uma pinça. Explantes ectodérmica são excisadas dos embriões usando uma agulha de tungstênio e um hairloop.
- Explantes ectodérmica são transferidos para um frasco de vidro e fixado com formol a 3,7% em tampão fosfato salino (PBS) por 30 minutos. Explantes fixos são lavados com PBS por três vezes (10 minutos cada). DAPI está incluído na terceira lavagem de manchar núcleos.
- Explantes são montados em um copo de slides. Duas tiras de fita adesiva estão ligados ao slide e os explantes são colocados entre as duas tiras. Uma vez que a superfície externa de explantes é pigmentada, o lado interno dos explantes deve enfrentar a objetiva do microscópio. Adicionar 2-3 gotas 20 mL da solução de montagem (70 glicerol% em PBS, incluindo 25 mg / ml DABCO, anti-fading reagente) 11. Coloque uma lamela por cima.
4. Imagem de explantes Sob um microscópio de fluorescência
- As amostras são vistas sob microscópio Zeiss Axioplan fluorescentes com filtros adequados.
- As imagens são tiradas com o anexo ApoTome para visualizar um plano específico de vários explantes independente.
5. Cryosectioning
Cryosectioning é uma forma alternativa de visualizar a distribuição de proteínas fluorescentes na célula e mais aplicável para a imunocoloração. No estágio 10, os embriões são fixos por 1-2 horas, com fixador Dent (20% DMSO, 80% de metanol), lavados com PBS, e embebidos em solução de sacarose 15% dos peixes gelatin/15 11%. Os embriões congelados são rapidamente incorporados em gelo seco e criosecções são gerados em Leica Criostato. Seções transversais incluiria células ectodérmicas que herdam RNAs injetado e seus produtos de proteína traduzida. As secções mantêm fluorescência e pode ser com os anticorpos específicos e, em seguida, rotulados com anticorpos secundários conjugados com fluorescência. Núcleos são corados com DAPI. Os meios de comunicação de montagem são os mesmos descritos acima. Imagem pode ser realizada como descrito acima.
6. Resultados representativos:
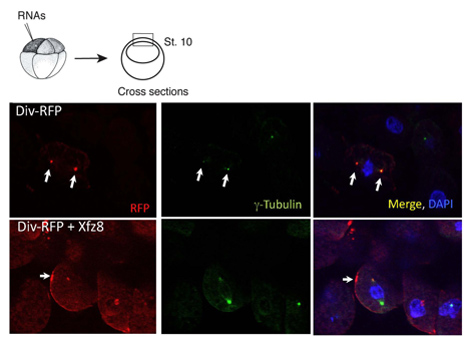
Figura 1. Receptor Frizzled recrutas Diversin à membrana celular. Células ectodérmicas expressar 8 Frizzled (Xfz8) e Div-RFP RNAs revelar Div-RFP na membrana celular, em vez de o centrossoma (como revelado por g-tubulina co-coloração). O esquema do experimento está no topo; uma típica seção transversal é mostrada.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Temos utilizado o protocolo acima para caracterizar a localização subcelular de Diversin. Em explantes pólo animal, Diversin-RFP foi detectado junto ao núcleo e colocalized com g-tubulina, um marcador centrosomal, em criosecções (Figura 1). Uma vez que a localização subcelular de uma proteína é identificada, constrói a exclusão pode ser gerado para estabelecer quais domínios de proteína são necessárias e suficientes para a localização subcelular. Usando essa abordagem, os domínios de localização centrosomal de Diversin foram mapeadas para o meio e nos domínios carboxi-terminal da proteína, ambos contendo o motivo coiled coil-8.
O mesmo protocolo pode ser utilizado em estudos, em que localização de proteínas é alterado em resposta à sinalização. Descobrimos que Wnt proteínas secretadas agir para mudar Div-RFP para estruturas puntiformes adjacentes à membrana celular, enquanto FZ8 recrutas Div-RFP aos remendos da membrana celular (Figura 1). Nós também descobriu que o domínio carboxi-terminal não é essencial para a membrana de recrutamento per se, mas necessário para o recrutamento de membrana polarizada.
Em resumo, o protocolo experimental acima ajudará em diversos estudos de interações proteína-proteína e localização de proteínas para diferentes compartimentos celulares após a estimulação das células com fatores de crescimento específicos ou proteínas de sinalização.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Não há conflitos de interesse declarados.
Acknowledgments
Pesquisa no laboratório Sokol é patrocinado pela Institues Nacional de Saúde.
References
- Gurdon, J. B. Embryonic induction --- molecular aspects. Development. 99, 285-306 (1987).
- Principles of Developmental Genetics. Moody, S. A. , Academic Press. (2007).
- Clevers, H. Wnt/beta-catenin signaling in development and disease. Cell. 127, 469-480 (2006).
- Klaus, A., Birchmeier, W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 8, 387-398 (2008).
- Gordon, M. D., Nusse, R. Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors. J Biol Chem. 281, 22429-22433 (2006).
- Schwarz-Romond, T., Asbrand, C., Bakkers, J., Kuhl, M., Schaeffer, H. J., Huelsken, J., Behrens, J., Hammerschmidt, M., Birchmeier, W. The ankyrin repeat protein Diversin recruits Casein kinase Iepsilon to the beta-catenin degradation complex and acts in both canonical Wnt and Wnt/JNK signaling. Genes Dev. 16, 2073-2084 (2002).
- Moeller, H., Jenny, A., Schaeffer, H. J., Schwarz-Romond, T., Mlodzik, M., Hammerschmidt, M., Birchmeier, W. Diversin regulates heart formation and gastrulation movements in development. Proc Natl Acad Sci U S A. 103, 15900-15905 (2006).
- Itoh, K., Jenny, A., Mlodzik, M., Sokol, S. Y. Centrosomal localization of Diversin and its relevance to Wnt signaling. J. Cell Sci. 122, 3791-3798 (2009).
- Itoh, K., Jacob, J., Sokol, Y. S. A role for Xenopus Frizzled 8 in dorsal development. Mech Dev. 74, 145-157 (1998).
- Newport, J., Kirschner, M. A major developmental transition in early Xenopus embryos: I. characterization and timing of cellular changes at the midblastula stage. Cell. 30, 675-686 (1982).
- Itoh, K., Brott, B. K., Bae, G. U., Ratcliffe, M. J., Sokol, S. Y. Nuclear localization is required for Dishevelled function in Wnt/beta-catenin signaling. J Biol. 4, 3-3 (2005).



