Summary
L'application d'un paradigme classique conditionnement à la peur du comportement de la recherche auditive prothétique chez le rat est décrit. Ce paradigme fournit un mécanisme pour identifier à la fois la détection, et la discrimination entre, d'acoustique et distincte des stimuli électriques en utilisant la fréquence cardiaque comme mesure des résultats.
Abstract
Préparations animales aigues ont été utilisés dans la recherche prospective de l'enquête conceptions d'électrodes de stimulation et des techniques pour l'intégration dans les prothèses auditives de neurones, tels que les implants du tronc cérébral auditif et 1-3 implants auditifs mésencéphale 4,5. Bien que les expériences aiguës peuvent donner un aperçu initial de l'efficacité de l'implant, de tester les animaux chroniquement implantés et éveillé offre l'avantage d'examiner les propriétés psychophysiques des sensations induites à l'aide de dispositifs implantés 6,7.
Plusieurs techniques comme récompense basée sur le conditionnement opérant 6-8, l'évitement conditionné 9-11, ou conditionnement de la peur classique 12 ont été utilisées pour fournir une confirmation de la détection comportementale d'un attribut de stimulus pertinent. Sélection d'une technique concerne des aspects d'équilibrage, notamment un gain de temps (souvent pauvres en récompense des approches fondées sur), la possibilité de tester une pluralité derelance attribue simultanément (limitée dans le conditionnement d'évitement), et la fiabilité de la mesure des stimuli répétés (une contrainte potentielle lorsque des mesures physiologiques sont employées).
Ici, une méthode classique peur conditionnement comportemental est présentée, qui peut être utilisé pour tester simultanément à la fois la détection d'un stimulus, et la discrimination entre deux stimuli. De fréquence cardiaque est utilisé comme une mesure de réaction de peur, ce qui réduit ou élimine la nécessité pour les temps de codage vidéo pour le comportement de gel ou d'autres mesures de ce type (même si de telles mesures pourraient être inclus afin de fournir des preuves convergentes). Les animaux ont été conditionnés à l'aide de ces techniques en trois séances de conditionnement de 2 heures, chacun fournissant 48 essais de relance. Séances d'essais ultérieurs de 48 essais ont ensuite été utilisés pour tester pour la détection de chaque stimulus en paires présentées, et la discrimination entre les stimuli de test membres de chaque paire.
Cette méthode comportementale est présentée dansle contexte de son utilisation dans la recherche auditive prothétique. L'implantation de dispositifs de télémétrie de l'électrocardiogramme est montré. Implantation ultérieure d'électrodes cérébrales dans le noyau cochléaire, guidé par la surveillance des réponses neuronales à des stimuli acoustiques, et la fixation de l'électrode en place pour l'utilisation chronique est également montré.
Protocol
1. Implantation du dispositif de télémesure pour électrocardiogrammes
- Une heure avant le début une chirurgie d'implantation, d'administrer carprofène (4 mg / kg sc) pour fournir une analgésie postopératoire.
- Injecter la kétamine / xylazine (Ke: 70 mg / kg, Xy: 10 mg / kg, ip) pour l'anesthésie pour permettre la préparation des animaux initiale, y compris le rasage et l'insertion de barres d'oreilles avant de passer à l'isoflurane qui est plus stable au cours de la chirurgie permettant une meilleure régulation de la profondeur et raccourcit la durée de récupération post-chirurgicale de l'anesthésie.
- Au début de la anesthésie, appliquer du lubrifiant pour les yeux les yeux de l'animal et puis raser le thorax de l'abdomen et la gorge. Essuyez la peau exposée à l'aide lavage chirurgical, suivie de la préparation cutanée alcoolique, suivie par une solution antiseptique. Placez la cage sur une couverture de chaleur pour réchauffer.
- Placez l'animal dans la position couchée sur une plaque homéotherme. Insérez ouate sous le col d'élever et d'exposer la gorge.
- Placez le nez-cone (délivrant 1-3% vol / vol isoflurane en oxygène, L 2 par minute) sur le nez de l'animal et de fixer la membrane en place.
- Fixer les membres antérieurs dans une position semi-étendue pour générer tension de la peau sur le thorax et la gorge, et pour empêcher le nez de glisser libre du nez-cône.
- Insérez la sonde de la couverture homéotherme dans le rectum de l'animal.
- Faire une incision dans la peau ligne médiane s'étendant à partir du processus xiphoïde 20 mm caudale d'exposer la couche musculaire. Faire une incision le long de la correspondance alba linea, puis la cavité péritonéale.
- Insérez le dispositif de télémétrie ECG dans la cavité péritonéale avec des fils s'étendant de l'extrémité rostrale de l'ouverture, et suturer la caudale 15 mm de l'ouverture dans le péritoine.
- Faire une incision médiane dans la gorge recouvrant la trachée, ce qui expose le muscle sterno.
- Insérez une pince crocodile oreilles dans l'espace sous-cutanée de l'incision rostrale face caudale, et les utiliser pour former un subcuttunnel aneous de la rostrale à l'incision caudale. Saisir le positif (rouge) de plomb dans les forceps et retirer le plomb à travers le tunnel.
- Soulevez le muscle sterno aide d'une pince et insérer l'extrémité de la borne positive dorsalement vers le médiastin antérieur droit, en laissant environ une boucle de 1 mm de câble rostrale à l'insertion. Suturer le plomb où il s'étend depuis la cavité thoracique et au sommet de la boucle du muscle sous-jacent.
- Exposer la paroi dorsale de la pointe du sternum, et suturer la pointe de la borne négative de la surface exposée.
- Contrôler le signal dispositif implanté pour assurer une de l'ECG peut être obtenu.
- Nourrissez l'excédent de câble dans la cavité péritonéale. Suture fermé la paroi péritonéale, la ligne blanche, et la peau de l'abdomen.
- Suture fermé la peau de la gorge.
- Cessez de livraison de l'isoflurane, et de continuer à fournir de l'oxygène jusqu'à ce que le mouvement spontané est observé.
- Lorsque le mouvement est observé, libérer les membres antérieurs uned retourner l'animal à sa cage. Déplacer la cage de sorte qu'environ la moitié de la cage est sur le pad thermique. Cela permettra à l'animal, si le portable, pour vous déplacer entre les zones plus chaudes et plus froides de la cage. Surveiller l'animal jusqu'à ce déambulatoire, et de laisser la cage sur la couverture de la chaleur pendant 24 heures.
- Administrer carprofène (4 mg / kg sc) toutes les 24 heures pendant 3-5 jours.
2. Implant électrode cérébrale
- Une heure avant le début d'implantation, d'administrer carprofène (4 mg / kg sc) pour l'analgésie postopératoire.
- Injecter la kétamine / xylazine (Ke: 70 mg / kg, Xy: 10 mg / kg, ip) pour l'anesthésie.
- Au début de la anesthésie, appliquer une pommade oculaire afin de protéger les yeux, puis raser la tête de l'animal. Essuyez la peau exposée à l'aide Betadine scrub, suivie par l'alcool, suivie par la bétadine.
- Placez l'animal dans la position couchée sur une plaque homéotherme.
- Position une barre creuse l'oreille dans environ la position finale prévue,et lever et positionner l'animal de telle sorte que la barre oreille est situé dans le conduit auditif externe.
- Faites glisser la barre de la deuxième oreille creuse dans le méat acoustique externe controlatéral.
- Utilisation de rat-dents pince, ouvrir la mâchoire de l'animal et accrocher les incisives supérieures au cours de la titulaire de la dent.
- Faites glisser le nez de cône sur le nez, et de commencer la livraison de l'isoflurane (1-3% vol / vol en oxygène). Les animaux sont désormais maintenue tout au long de cette chirurgie avec anesthésie.
- Faire une incision dans la peau de la tête, d'environ 1 mm à gauche de la ligne médiane et s'étendant à partir de 3-4 mm à 2-3 mm rostrale caudale de lambda.
- Rentrer la peau et le muscle latéralement à partir de l'incision, ce qui expose l'os pariétal et l'os interpariétal. Frotter la surface de l'os exposé en utilisant 20% de solution de peroxyde d'hydrogène et un tampon de gaze.
- Percez un petit trou dans les os pariétaux gauche et droit, et visser une vis en acier chirurgical dans chaque trou en laissant une petite (0,5 mm) d'espace entre la HEAd de chaque vis et de l'habileté. Connecter ces vis à la masse et des points de référence de l'électrode à haute impédance headstage.
- Percez un trou d'environ 2 mm carré dans l'étendue latérale plus de l'os interpariental. Rincer le trou à l'aide du sérum physiologique stérile pour éliminer toute la poussière d'os ou de fragments d'os qui peuvent endommager l'électrode.
- Fixez le haut-parleur de couplage à la barre de l'oreille gauche creuse.
- Avec la pointe d'une aiguille, faire une incision dans la dure-mère sur le plan sagittal.
- Amener le manipulateur électrode en place au-dessus de l'ouverture, avec un angle de 10 ° caudorostral. Insérer l'électrode manuellement environ 2 mm dans la surface du cerveau. Assurez-vous de l'amplificateur est sous tension, puis sceller la chambre d'enregistrement.
- Commencer la livraison cyclique de faible (2-8 kHz), milieu de gamme (16-24 kHz) et haute (32 kHz-44kHz) la fréquence passe-bande de bruit filtré. La vitesse maximale à laquelle éclate devrait être livré est une salve toutes les 200 ms. Surveiller l'activité neuronale unet chaque canal pour détecter des réponses à la présentation du bruit.
- Continuer l'insertion de l'électrode jusqu'à ce que soit la distance totale inséré s'approche 8 mm. Si la limite de 8 mm est atteinte sans réponses neurales être détecté, retirer et repositionner l'électrode pour une autre insertion. Si le noyau cochléaire (NC) a été atteint, les sites à la pointe de l'électrode doit être présente des réponses principalement à haute fréquence des stimuli. Si électrodes sont situées dans le noyau ventral cochléaire (VCN), les réponses aux stimulus acoustique doit avoir une composante forte apparition (1-5 ms), suivie d'une diminution rapide de l'activité.
- Continuez à insérer l'électrode jusqu'à ce que les extrémités de l'électrode de détecter les réponses à basse fréquence des stimuli auditifs, ou axée sur l'activité cesse de se produire (dans ce cas, l'électrode peut avoir complètement franchi le CN et il peut être nécessaire de réviser l'électrode placement).
- Construire une carte de réponse fréquence-amplitude des neurones à l'électrode sites. Ceci est réalisé par son présentés à travers la gamme de fréquence désirée (généralement 1-44 kHz ou 1-80 kHz) à des amplitudes de 1 à 70 dB, avec 10 répétitions de chaque stimulus. Un stimulus peut être livré toutes les 300 ms quand la cartographie de la CN. Si la carte est insuffisante, envisager de réviser le placement de l'électrode.
- Appliquer une couche mince d'élastomère de silicium légèrement au-dessus des tiges d'électrodes exposées, de telle sorte que l'élastomère s'écoule vers le bas des tiges et les tiges à la fois manteau et la surface exposée du cerveau.
- Appliquer une première couche de ciment de polymère prothèse autour de l'électrode. Le ciment doit être minimale visqueuse, pour réduire le risque de l'électrode étant déplacée dans le processus d'application. Veiller à ce que le polymère ne couvre pas les vis dans les os pariétaux ou les câbles. Attendre pour l'acrylique à durcir, ce qui prend généralement 5-10 minutes.
- Détachez le sol et les fils de référence de l'headstage des vis dans les os pariétaux. En utilisant le forceps, gently enrouler le fil de masse de l'électrode autour de la vis dans l'os pariétal gauche.
- Appliquer une deuxième couche de prothèse ciment polymère. Cette deuxième couche doit encapsuler les deux vis, et se jettent dans l'espace entre la tête de la vis et le crâne. Ce faisant, les vis tiendra l'acrylique et l'électrode sur le crâne. Attendre pour l'acrylique à durcir.
- Retirez le headstage du connecteur de l'électrode.
- En utilisant des pinces à dents de rat, soulever la peau latérale du polymère sur le polymère, et d'utiliser une suture en bourse pour refermer la peau autour du connecteur d'électrode à découvert.
- Retirer les barres d'oreilles, en libérant la tête.
- Fin de la livraison isoflurane, et de continuer à fournir de l'oxygène à travers le cône de nez jusqu'à ce que le mouvement spontané est observé.
- Retour à l'animal de la cage. Déplacer la cage de sorte qu'environ la moitié de la cage est sur le pad thermique. Cela permettra à l'animal, si le portable, pour vous déplacer entre les zones plus chaudes et plus froides de lala cage.
- Surveiller l'animal jusqu'à ce déambulatoire. Laisser la cage sur le pavé de la chaleur pendant 24 heures.
- Administrer carprofène (4 mg / kg sc) toutes les 24 heures pendant 3-5 jours.
3. Conditionnement
- Placez l'animal dans la chambre d'essai.
- Activez le dispositif de télémétrie ECG.
- Permettre aux animaux de s'acclimater à la chambre d'essai pendant cinq minutes avant le début de la climatisation. Cela permettra de fréquence cardiaque pour revenir à un point de référence, comme la manipulation conduit à une élévation du rythme cardiaque.
- Effectuer la procédure de conditionnement:
- Livrer un membre choisi au hasard de la paire de stimulus acoustique à plusieurs reprises en rafales ms 250, séparés par 250 ms de silence pour 80-170 s. Chaque présentation du stimulus doit avoir un temps de montée et chute de 10 ms pour éviter un "clic" d'être perçu, qui couvre perceptuellement une gamme de fréquences sonores.
- Commencer alternatif du second élément de la paire stimulus acoustique avec la première, présentant biston ch pour 250 ms suivie par un les 250 ms de silence.
- Après 9,5 s de la période de 10 s en alternance présentation ton, administrer un ms 0,5 pied-choc (0,7 mA).
- Cessez présentations de tonalité pour les 30 s pour permettre à la fréquence cardiaque se stabilise.
- Recommencer la livraison paire de tonalité (à partir de 3.4.1). Paires de tonalité devrait être présenté de manière optimale dans un ordre aléatoire, et au moins 12 paires de tonalités doivent être utilisés pour assurer que le conditionnement se généralise à toutes les paires de fréquences et n'est pas spécifique à la fréquence des sons utilisés. Continuez ce processus jusqu'à 48 cycles de la procédure (les essais) ont été achevés.
- Désactiver l'appareil ECG, et de retourner à l'animal de la cage.
4. Test
- Anesthésie de l'animal à l'aide isoflurane (1-3% vol / vol en oxygène).
- Fixez le câble de stimulation de neurones pour le connecteur d'électrode à découvert.
- Placez l'animal dans la chambre d'essai.
- Activez le dispositif de télémétrie ECG. </ Li>
- Permettre à l'animal à se remettre de l'anesthésie à l'isoflurane et s'acclimater à la chambre d'essai pendant dix minutes avant le début des essais. Cela permettra de fréquence cardiaque pour revenir à un point de référence et la récupération de l'effet courte anesthésie.
- Effectuer la procédure de test.
- Livrer un membre choisi au hasard d'une paire de stimuli acoustiques à plusieurs reprises en rafales ms 250, séparés par 250 ms de silence pour 80-170s. Chaque présentation du stimulus doit avoir un temps de montée et chute de 10 ms pour éviter un "clic" d'être perçu, qui couvre perceptuellement une gamme de fréquences sonores.
- Commencer alternatif du second élément de la paire stimulus acoustique avec la première, présentant chaque tonalité pour 250 ms suivie par 250 ms de silence.
- Après 9,5 s de la période de 10 s en alternance présentation ton, administrer un 0,5 ms pied-choc.
- Cessez présentations de tonalité pour les 30 s pour permettre à la fréquence cardiaque se stabilise.
- Commencer la livraison d'un hasard selemembre DECT d'une paire de stimulation électrique du cerveau à plusieurs reprises, en utilisant 250 ms périodes de stimulation séparés par 250 ms de non-stimulation pour 80-170 s.
- Commencer alternatif du second élément de la paire de stimulation à la première, présentant chaque stimulus pour 250 ms suivie par une 250 ms non stimulation période. Continuez à alterner la stimulation pendant 10 s.
- Cessez présentations de relance de 30 s pour permettre à la fréquence cardiaque se stabilise.
- Recommencer la livraison paire de stimuli (à partir de 4.6.5 ou 4.6.1). Paires de stimulation doivent être présentés dans un ordre aléatoire, et au moins 20 essais de chaque paire de stimuli devrait être livré à garantir un nombre suffisant de données de fréquence cardiaque est recueillie afin de fournir un résultat clair et moyen de minimiser la variabilité. Distribution des essais en utilisant des stimuli acoustiques tout au long de la séance de test réduit la probabilité que l'extinction se produira lors de la procédure.
- Détacher le câble de stimulation de l'animal.
- Désactiver le devi ECGCE.
- Retour à l'animal de la cage.
5. Les résultats représentatifs
Dispositif d'enregistrement d'ECG échantillon en faisant appel au dispositif de télémétrie implanté une semaine après l'implantation est représenté sur la figure 1. Un tel enregistrement peut généralement être obtenue à partir des dispositifs implantés, et les dispositifs de continuer à fonctionner de manière adéquate pour l'enregistrement de plus de six mois, même si de suture soluble est utilisé pour les câbles à apposer musculaire. L'enregistrement ECG montre la figure 2 a été obtenue à partir d'un animal de plus de huit mois après l'implantation.
Les figures 3 montre l'emplacement d'une implantation réussie. Le placement des électrodes possède des sites d'électrodes dans le noyau de nombreuses postéroventrale cochléaire (PVCN), une stimulation et d'enregistrement accès à une grande partie de l'aspect dorso-ventral. Les réponses en fréquence de chaque emplacement de l'électrode pour l'implantation de cette sont présentées à la figure 4. La zone de temps de le CAP dans lequel des électrodes sont réparties conduit à des populations de cellules accessibles pour l'enregistrement et la stimulation 'syntonisée' à une large gamme de fréquences. En outre, les populations elles-mêmes sont étroitement écoute - ils répondent seulement à une étroite bande de fréquences sonores (voir figure 5).
En revanche, un mauvais positionnement est illustré à la figure 6. Dans ce cas, l'électrode a été placée trop en dedans, et non pas inséré assez profondément pour pénétrer le CAP. En conséquence, les sites d'électrodes seulement à proximité des réponses Afficher Conseil de sonner comme le montre la Figure 7. En outre, la gamme de fréquences à laquelle les populations de cellules accessibles sont à l'écoute est très limitée. L'accord des populations elles-mêmes est étroit (voir figure 8), mais la distribution en cluster des fréquences centrales des populations de cellules rend la stimulation des régions de fréquence distinctes impossible.
_content "> Les données de base de la fréquence cardiaque varie entre climatisées présentations stimulus acoustique. pour tenir compte de cette variabilité, la fréquence cardiaque premières (RH) de données a été normalisé en tant que proportion des RH observée lorsque l'alternance de relance a commencé (temps 0). La figure 9 montre des données dans divers formes recueillies au cours de la session de conditionnement d'abord. Un exemple des résultats obtenus en matière de RH dans un autre animal au cours de la dernière partie des séances de conditionnement initial est présenté dans la Figure 10. Le processus de conditionnement à des stimuli acoustiques est rapide, et de forts changements dans les ressources humaines peuvent être observées avec peu d'essais; 7. dans le cas des figures 9 et 10 Le changement dans les ressources humaines observée immédiatement après le début de l'alternance de relance (voir 3.4.1 et 3.4.2) apporte la preuve que l'animal est capable de discriminer entre le répète initiale stimulus et le second stimulus ensuite ajoutés.Après des sessions de test à compter, dans lequel électriCal stimuli neuronaux plutôt que des stimuli acoustiques sont généralement livrés, l'inclusion de présentations stimulus acoustique permet de confirmer que les effets de conditionnement sont toujours présents. Un changement général dans les ressources humaines en réponse à la présentation début de stimulus acoustique confirme qu'un effet conditionné à des stimuli acoustiques reste présent, comme le montre la Figure 11. De même, la figure 12 présente l'évolution des ressources humaines autour de la moyenne proportionnelle début de l'alternance signal sonore dans le première séance d'essais. Comme à la figure 9 et 10, le RH relativement stable avant l'introduction de la deuxième stimulus en contraste avec l'évolution rapide des ressources humaines après l'introduction de la deuxième stimulus apporte la preuve que la discrimination entre les deux tons a eu lieu.
En revanche, l'absence de détection peut être vu dans la figure 13 dans laquelle la stimulation électrique est débutant. La moyenne proportionnelle des ressources humaines chan ge dans 10 essais ne montre aucun signe de la baisse constante observée lors de la détection rapide se produit, comme dans la Figure 11. De même, l'absence d'un changement uniforme et rapide de la fréquence cardiaque dans la figure 14 suggère que les deux stimuli électriques étant livrés ne sont pas suffisamment différents pour que la discrimination se produisent. Les deux avant le début de la période d'alternance (avant que le temps 0) et après l'alternance commence, la variation moyenne proportionnelle en matière de RH reste proche de la ligne de non changement.
Un modèle plus caractéristique de la discrimination entre les membres de deux une paire de stimuli neuronal est montré dans la figure 15. Une diminution de la fréquence cardiaque survient rapidement après le début de l'alternance de relance, suivie d'une augmentation substantielle de la fréquence cardiaque. La stratégie de stimulation particulière utilisée dans ce cas a réussi à produire une réponse pertinente comportemental.
"Src =" / files/ftp_upload/3598/3598fig1.jpg "/>
Figure 1. Un enregistrement ECG obtenue en utilisant le dispositif de télémétrie implanté une semaine après l'implantation. Le signal d'enregistrement vu dans ce type est en grande partie des enregistrements obtenus à l'aide de ces dispositifs.

Figure 2. Dispositif d'enregistrement d'ECG obtenues en utilisant le dispositif de télémétrie implanté six mois après implantation. Il ya une dégradation négligeable du signal en cours d'enregistrement au cours de cette période, et ce signal est certainement suffisante pour le calcul de la fréquence cardiaque des animaux.

Figure 3. Une reconstruction 3D d'un placement des électrodes de succès, à l'aide combinée des rayons X et la tomodensitométrie des coupes histologiques. Les deux tiges d'électrodes pénétré le noyau cochléaire avec des électrodes postéroventrale orientationTed à faire face à la structure.

Figure 4. La carte des réponses électrophysiologiques enregistrées avec le placement des électrodes de la figure 3. Chaque histogramme montre les données pour l'activité moins un site de l'électrode en réponse à la présentation d'une fréquence acoustique; chaque colonne représente une période de 25 ms. Sur les deux branches de la matrice d'électrodes, les réponses sont détectés à chaque emplacement de l'électrode individuelle uniquement en réponse à une bande très étroite de fréquences, mais ces bandes étroites sont réparties sur un large éventail de fréquences. Une telle distribution est idéale, car de nombreux distinctes fréquence associés régions du cerveau peut être stimulé indépendamment.

Figure 5. La réponse électrophysiologique au canal 10 de l'implant présentés dans les figures 3 & amp; 4. Idéalement, les placements d'électrodes devrait conduire à des réponses neuronales à un stimulus acoustique étant détecté sur plusieurs canaux avec une amplitude sonore aussi bas que 10 dB, apparaît comme dans cet exemple.

Figure 6. Une reconstruction 3D d'un placement des électrodes pauvres. Alors que l'angle caudorostral de l'électrode est correcte, il était trop médiale. En outre, l'électrode a été inséré pas suffisamment profonde, la résultante dans des sites plus proches de la pointe de l'électrode étant situé à l'intérieur du noyau cochléaire dorsal.

Figure 7. La carte des réponses électrophysiologiques enregistrées avec le placement des électrodes comme indiqué dans la figure 6. Activité qui se passe à l'extrémité de chaque tige de la matrice d'électrodes, mais il ya peu de variation dans le stimulus acoustique fréquencequence qui suscite l'activité à chaque emplacement de l'électrode. Une telle implantation ne permet pas la stimulation de la couche de fréquence distincte pour les tests de discrimination.

Figure 8. La réponse électrophysiologique au canal 28 sur le placement des électrodes montré dans les figures 6 et 7. Stimulus acoustique produire rafales fortes de l'activité, à l'instar de la fréquence des pointes à celle observée dans l'implantation très réussie (Figure 3). Seuil est également très faible, avec des réponses étant détectée en réponse à des sons à 20 dB. S'il y avait une plus grande variation dans les fréquences pour lesquelles les réponses les plus fortes ont eu lieu à travers d'autres canaux de la matrice de ce canal serait certainement suffisante pour la stimulation.
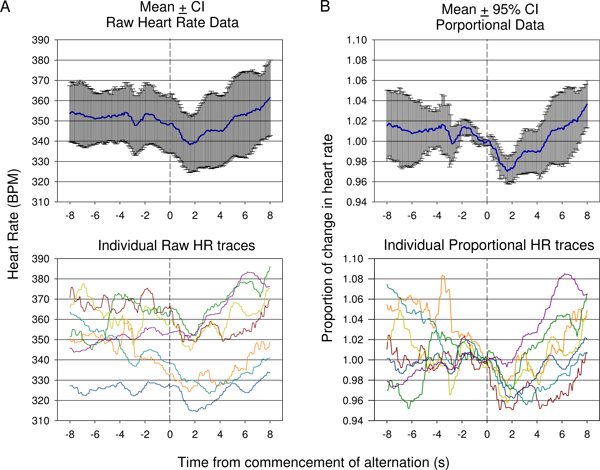
Figure 9. Comparaison de la fréquence cardiaque première (A) verses moyenne proportionnelle (B) les données recueillies au cours de la session de conditionnement d'abord dans un animal. Les réponses des 7 présentations sont affichées. En raison de la variation de la fréquence cardiaque de départ avant le début de l'altération ton, la fréquence cardiaque moyenne brute (± intervalles de confiance à 95%) ne montraient pas suffisamment bien le degré de changement d'une baisse initiale de la fréquence cardiaque suivie par la hausse comme indiqué dans crus individuelle traces (A inférieure,). Variation moyenne proportionnelle dans les données de fréquence cardiaque dans lequel la fréquence cardiaque est divisé par la fréquence cardiaque au moment de la présentation du stimulus conditionné acoustique pour chaque trace est présentée dans (B). Cela montre une baisse statistiquement significative suite à la présentation stimulus conditionné avec une hausse significative reflète la fin de l'aide des intervalles de confiance à 95%. Individuels proportionnelles traces de la fréquence cardiaque sont affichées (B, bas).
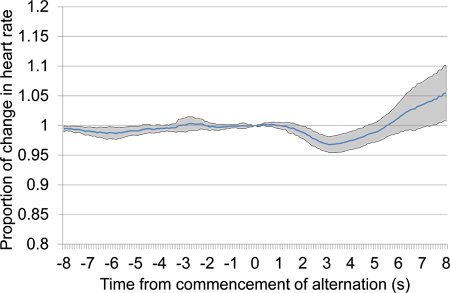
Figure 10. Moyenne coeur proportionnelle r mangé changement de 8 s avant 8 s après le début de la présentation alternée stimulus acoustique, la combinaison de données provenant des sessions de conditionnement deuxième et troisième. Les données présentées comprennent sept essais présentés au cours des deux séances de conditionnement, quatre dans la session de conditionnement d'abord et trois dans le second. En réponse à la présentation du stimulus en alternance, une forte baisse initiale de la fréquence cardiaque s'est produite suivie d'une augmentation tardive de la fréquence cardiaque.
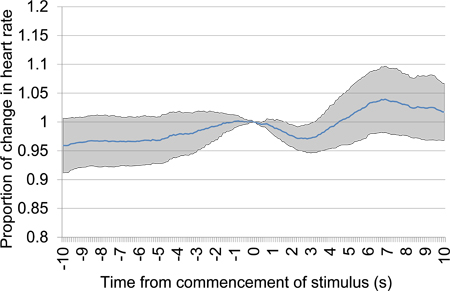
Figure 11. Moyenne proportionnelle changement de la fréquence cardiaque à partir de 10 s avant 10 s après le début de la présentation du stimulus acoustique après la période de silence de 30 s. Les données d'essais a été prise à partir de la session de test d'abord et comprend six présentations stimulus acoustique. Une nette baisse au début de la fréquence cardiaque fournit une preuve de la discrimination entre les stimuli acoustiques présentés.
es/ftp_upload/3598/3598fig12.jpg "/>
Figure 12. Moyenne proportionnelle changement de la fréquence cardiaque à partir de 8 s avant le 8 s après le début d'une alternance de la présentation du stimulus acoustique, prises à partir de la session de test d'abord et dont cinq présentations stimulus acoustique. Une nette baisse au début de la fréquence cardiaque fournit une preuve de la discrimination entre les stimuli acoustiques présentés.
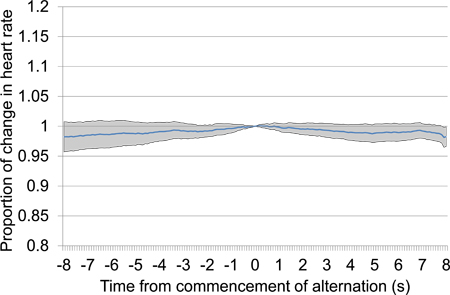
Figure 13. Moyenne proportionnelle changement de la fréquence cardiaque à partir de 10 s avant le 10 s après le début de la stimulation électrique du cerveau après la période de silence de 30 s. Les données d'essais a été prise à partir des premiers essais et la deuxième et comprend 18 présentations de stimulation électrique, tous les en utilisant les paramètres de stimulation mêmes. L'absence de toute baisse notamment de la fréquence cardiaque, en particulier proximale à 0 heure à laquelle la stimulation commence, suggère que l'animal est incapable de détecter la stimulnous.

Figure 14. Moyenne proportionnelle changement de la fréquence cardiaque à partir de 8 s avant le 8 s après le début d'une alternance de la présentation du stimulus électrique (voir 4.6.5 et 4.6.6), prises à partir de la session de test d'abord et y compris 33 présentations de stimulation électrique. Aucun modèle cohérent de changement de la fréquence cardiaque se produit de temps proche de 0, ce qui suggère que les stimuli en alternance ne sont pas suffisamment différents pour que la discrimination se produisent.
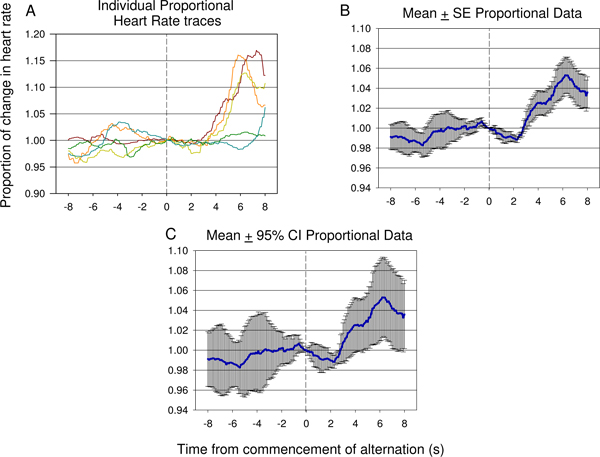
Figure 15. Des exemples représentatifs de traces individuelles (A) et moyenne proportionnelle données de fréquence cardiaque (B, C) de 8 s avant 8 s après le début de la présentation du stimulus électrique alternatif, prises à partir de la session de test septième un second animal, et dont 12 présentations de stimulation électrique. Une diminution significative de HR se produit rapidement après l'introduction du second stimulus neuronal suivie par une augmentation significative de la fréquence cardiaque reflète suggérant la différence entre le stimulus premier et le deuxième a été détecté par l'animal. Le degré d'erreur et la variance de la réponse peut être vu dans la moyenne proportionnelle ± erreur (SE) tracé standard indiqué dans (B). L'importance de l'immersion et hausse suite à la présentation second stimulus peut être vérifiée à l'aide des intervalles de confiance à 95% appliqués aux données indiquées dans (C). La réponse vu dans (C) est similaire à la réponse voir à la figure 9 chambres.
Discussion
Les techniques décrites ici sont un moyen pour tester une gamme de tâches de discrimination rapidement, avec des temps de formation de courte durée et permettant une automatisation substantielle, réduisant ainsi le temps nécessaire pour chercheur de traitement des données. En utilisant les données obtenues à partir de l'ECG implanté, le calcul de la fréquence cardiaque (HR) changement dans les moments de la présentation du stimulus peut être automatisé. Les erreurs dans le traitement ECG (comme manquant un seul battement de cœur) peut être facilement identifiés car ils produisent des changements importants dans faussement apparente du rythme cardiaque pour une période très brève, et une telle détection d'erreur facile minimise l'exigence des temps intensive révision manuelle des données .
La technique décrite à l'implantation de l'appareil de télémétrie ECG produit régulièrement des enregistrements avec peu ou pas d'interférence (voir les figures 1 et 2). Toutefois, des variations relativement faibles dans la mise en place du plomb dans la région du médiastin peut conduire à une ingérence du muscle à proximités et en particulier la respiration associée à du bruit. Vérification de placement correct des conducteurs au cours du processus d'implantation, en particulier après la suture fils en place, permet des réglages fins de placement de plomb pour minimiser les interférences.
Le processus d'implantation du cerveau dans le noyau cochléaire est difficile. En utilisant des présentations de série de passe-bande de bruit filtré plusieurs gammes de fréquences, plutôt que de bruit à large bande comme cela a déjà été utilisé 3, les réponses des populations de cellules sur les sites d'électrodes peuvent être rapidement en revue en termes de réponse en fréquence plutôt que le moins de bruit spécifique réponse. La capacité d'identifier rapidement quand un éventail suffisant de populations de cellules fréquence accordés sont accessibles est essentiel dans la recherche lorsque la discrimination stimulus électrique est mis à l'essai. Si insuffisante fréquence de distribution est obtenue, puis la comparaison entre la stimulation des zones de fréquence distinctes n'est tout simplement pas possible. Néanmoins, le processus plus longde la fréquence d'amplitude de cartographie de réponse reste essentielle pour fournir de détails sur la largeur de la mise au point des populations de cellules et doit être effectuée préalablement à la fixation de l'électrode en place.
Dans la formation comportementale et l'essai, l'inclusion d'un non-relance (ou silencieuse) période entre les essais, avant le début du stimulus, la réponse permet à l'apparition de relance initiale à être examinée. Lorsque vous utilisez la stimulation électrique de neurones, une réponse à l'apparition de relance apporte la preuve pour la simple détection du stimulus. Ainsi, quand il n'ya pas de réponse le début du stimulus, mais une réponse quand le stimulus deuxième alternance est introduit, il peut être déduit que seul le stimulus-ci peut être détecté. Sans l'inclusion d'une telle période de silence, il n'y aurait aucun moyen de déterminer que le stimulus ancienne n'a pas été détecté.
Une limitation de cette technique est que les tests de comportement de l'absence de pied-chocs livrés après la présentation de neurala stimulation l peut conduire à l'élaboration de la spécificité dans la peur conditionnée, tels que la peur est seulement exprimé lors stimulus acoustique est présenté. C'est, l'animal peut apprendre que les effets particuliers sensoriels de la stimulation neuronale sont associés à la non réception d'un choc à la patte. En revanche, la mise à pied des chocs après la présentation de la stimulation neuronale pourrait conduire à une peur conditionnée du stimulus neuronal lui-même, distincte de toutes les propriétés du son, comme le stimulus de neurones peuvent avoir. Les résultats obtenus lors de l'exclusion d'un pied-choc après la stimulation neuronale certainement fournir des preuves plus solides de relance de neurones étant son type que ceux qui utilisent un pied-choc après la stimulation neuronale, comme dans le premier cas, la peur conditionnée a généralisé de l'acoustique à la stimulation neuronale. Néanmoins, le risque de développer la spécificité à l'acoustique plutôt que la stimulation neuronale est présente. L'utilisation de passe-bande filtrée bruit stimulus acoustique plutôt que salves de son pur, dont la premièrepeut mieux refléter l'expérience perceptive de la stimulation neuronale, pourrait réduire le risque de développer une telle spécificité. Toutefois, une telle procédure introduit la variable supplémentaire de bande passante du filtre, ce qui aura une incidence sur des tâches de discrimination.
Une limitation supplémentaire associé à une implantation chronique neuronal, comme requis pour l'essai du comportement, est le changement de la fonction de l'électrode ou le tissu neuronal associé au fil du temps. La stimulation de tissu neural peut conduire à la fois la suppression temporaire de 13 l'activité neuronale et changements dans les tissus tels que la perte de cellules du tissu cérébral de réponse 14 et direct à l'électrode 15.
L'approche décrite à l'implantation et tests comportementaux fournit un moyen de tester à la fois la détection et la discrimination de stimuli acoustiques et électriques avec une brève formation, et la capacité d'exercer un contrôle de la fréquence d'essai. La technique de utilisant un changement de la fonction RH un de mesuree de la peur conditionnée peut être applicable à l'absence de dépistage auditif seulement, mais plus généralement à toute analyse sensorielle dans laquelle les stimuli peuvent être présentés pour une période discrète, et dans lequel la détection de la discrimination sensorielle est souhaitée.
Disclosures
Dr Antonio Paolini est directeur de Bioengenesis Technologies Pty Ltd, qui sont les représentants de l'Australie pour Tucker Technologies Davis et le distributeur australien de sondes NeuroNexus.
Acknowledgments
Le financement de cette recherche a été fourni par les passes Garnett et Rodney Williams Memorial Foundation et l'Université La Trobe.
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



