Summary
Die Anwendung einer klassischen Konditionierung Angst Verhaltensstörungen Paradigma für die auditive prothetischen Forschungen an Ratten beschrieben. Dieses Paradigma stellt einen Mechanismus zur Identifizierung sowohl Erkennung und Unterscheidung zwischen, deutliche akustische und elektrische Reize mittels Herzfrequenz als Zielparameter.
Abstract
Akute Tierpräparate haben in der Forschung verwendet wurden prospektiv untersucht Elektrode Designs und Verfahren zur Stimulation für die Integration in neuronalen Hörgeräten, wie Hirnstammimplantate 1-3 und auditorischen Mittelhirn Implantate 4,5. Während akute Experimente können erste Einblicke auf die Wirksamkeit des Implantats zu geben, die Prüfung der chronisch implantierten Tiere wach und bietet den Vorteil einer Untersuchung der psycho-physischen Eigenschaften der Empfindungen induziert mit implantierten Geräten 6,7.
Verschiedene Techniken, wie belohnungsbasierten operante Konditionierung 6-8, bedingt Vermeidung 9-11, oder klassische Angstkonditionierung 12 sind, um Verhaltensänderungen Bestätigung der Erfassung eines relevanten Stimulus Attribut angeben. Auswahl einer Technik umfasst Ausgleich Aspekte, einschließlich der Zeiteffizienz (oft eine schlechte Belohnung Ansätze), die Fähigkeit, eine Vielzahl von TestStimulus Attribute gleichzeitig (begrenzt in konditionierten Vermeidungs-) und Zuverlässigkeit der Maßnahme wiederholt Reize (eine potentielle Einschränkung, wenn physiologische Maßnahmen eingesetzt werden).
Hier wird eine klassische Konditionierung Angst Verhaltensstörungen Methode vorgestellt, die verwendet werden, um gleichzeitig zu testen sowohl die Erkennung eines Reizes, und einer Diskriminierung zwischen zwei Stimuli werden. Herz-Rate wird als Maß für Angstreaktion, reduziert oder eliminiert die Notwendigkeit für zeitraubende Videocodierung für Gefrier Verhalten oder andere ähnliche Maßnahmen verwendet (obwohl solche Maßnahmen enthalten, um konvergente nachweisen können). Die Tiere wurden konditioniert, die diese Methoden in drei 2-stündige Konditionierung Sitzungen, die jeweils 48 Stimulus-Studien. Nachfolgende 48-Studie Testfahrten wurden dann verwendet, um für den Nachweis von jedem Stimulus präsentiert in Paaren, und Test-Diskriminierung zwischen den Mitglied Reize von jedem Paar zu testen.
Diese Verhaltensweisen Verfahren ist in dargestelltdie Rahmenbedingungen der Nutzung der auditiven prothetischen Forschung. Die Implantation von EKG-Telemetrie-Geräte angezeigt wird. Nachfolgende Implantation in das Gehirn Elektroden Cochlear Nucleus, durch die Überwachung der neuronalen Antworten auf akustische Stimulation geführt, und die Fixierung der Elektrode in Platz für chronische Anwendung ist ebenfalls dargestellt.
Protocol
1. Elektrokardiogramm Telemetrie-Implantation
- Eine Stunde vor der Implantation Beginn der Operation, Administration Carprofen (4 mg / kg sc) zur postoperativen Analgesie.
- Inject Ketamin / Xylazin (Ke: 70 mg / kg, XY: 10 mg / kg, ip) für die Anästhesie zu ersten Tier Vorbereitung einschließlich Rasierschaum und das Einfügen Ohr Bars vor dem Wechsel zu Isofluran-Anästhesie, die stabiler ist während der Operation eine bessere Regulierung der Tiefe ermöglichen und verkürzt die nach der Operation aus der Narkose.
- Zu Beginn Anästhesie, gelten Auge Schmiermittel auf die Augen des Tieres und dann den Bauch rasieren Thorax und Hals. Wischen Sie die unbedeckte Haut mit chirurgischem Peeling, das durch alkoholische Vorbereitung der Haut, gefolgt von einer antiseptischen Lösung. Setzen Sie den Käfig nach Hause auf einer Heizdecke zu wärmen.
- Platzieren Sie das Tier in Rückenlage auf einer Platte homöothermen. Legen Watte unterhalb des Halses zu erheben und setzen die Kehle.
- Legen Sie die Nase-cone (liefernde 1-3% Vol / Vol Isofluran, 2 l pro min) über der Nase des Tieres und fixieren die Membran an Ort und Stelle.
- Befestigen der vorderen Extremitäten in einem halb-ausgefahrenen Position in die Hautspannung über den Brustkorb und Hals zu erzeugen, und um die Nase rutschfestem des Nasenkonus zu verhindern.
- Stecken Sie die Sonde des homöothermen Decke in das Rektum des Tieres.
- Einen Mittellinie Einschnitt in der Haut, die sich von der Xiphoid 20 mm kaudal, um den Muskel zu exponieren. Machen Sie einen passenden Schnitt entlang der Linea alba, und dann die Bauchhöhle.
- Legen Sie die EKG-Telemetrie-Gerät in die Bauchhöhle mit Leitungen, die sich von der rostralen Ende der Öffnung, und nähen Sie die Schwanzflosse 15 mm von der Öffnung des Bauchfells.
- Machen Sie einen Medianschnitt im Hals, die über der Luftröhre, Aussetzen des M. sternohyoideus.
- Legen Alligator Ohrzängchen in den subkutanen Raum des rostralen Schnitt kaudal konfrontiert, und mit diesen einen subcut bildenaneous Tunnel von der rostral nach kaudal Einschnitt. Fassen Sie die positiven (roten) Blei in der Zange und Einfahren die Führung durch den Tunnel.
- Heben Sie den M. sternohyoideus mit einer Pinzette und legen Sie die Spitze der positiven Leitung dorsal in Richtung der rechten vorderen Mediastinum, so dass ungefähr eine 1 mm Kabelschleife rostral Insertion. Vernähen die Führung in der er sich von der Brusthöhle und an der Spitze der Schleife, um den darunterliegenden Muskeln.
- Setzen Sie die hintere Wand der xiphoid, und nähen Sie die Spitze der negativen Leitung die exponierte Oberfläche.
- Überprüfen Sie das implantierte Gerät Signal, die einen hinreichenden EKG gewonnen werden können.
- Führen Sie das überschüssige Kabel in die Bauchhöhle. Naht geschlossen das Bauchfell, die Linea alba, und der Bauchhaut.
- Naht geschlossen in die Haut des Halses.
- Hört Lieferung von Isofluran, und weiterhin Sauerstoff liefern, bis spontane Bewegung beobachtet wird.
- Wenn eine Bewegung beobachtet wird, lassen Sie den Vorderbeinen eind Rückkehr das Tier in das Haus Käfig. Bewegen Sie den Käfig nach Hause, so dass etwa die Hälfte der Käfig auf dem Heizkissen ist. Dies ermöglicht es, das Tier, wenn das Handy, um zwischen wärmeren und kühleren Bereichen des Käfigs zu bewegen. Überwachen Sie das Tier bis zur ambulanten, und die Wohnung verlassen Käfig auf der Heizdecke für 24 Stunden.
- Verwalten Carprofen (4 mg / kg sc) alle 24 Stunden für 3-5 Tage.
2. Hirnelektrode Implant
- Eine Stunde vor der Implantation Beginn, verwalten Carprofen (4 mg / kg sc) zur postoperativen Analgesie.
- Inject Ketamin / Xylazin (Ke: 70 mg / kg, XY: 10 mg / kg, ip) für die Anästhesie.
- Zu Beginn Anästhesie, gelten Augensalbe zum Schutz der Augen, dann rasieren Sie den Kopf des Tieres. Wischen Sie die unbedeckte Haut mit Betadin Gestrüpp, durch Alkohol, gefolgt von Betadin.
- Platzieren Sie das Tier in Bauchlage auf einem homöothermen Platte.
- Position ein hohles Ohr bar in etwa der erwarteten endgültigen Position,und heben und positionieren Sie das Tier so, dass das Ohr bar in den äußeren Gehörgang befindet.
- Schieben Sie den zweiten hohlen Ohr bar in die kontralaterale äußere Gehörgang.
- Unter Verwendung von Ratten-Zahn-Zange, öffnen Sie das Tier Kiefer und haken Sie die oberen Schneidezähne über den Zahn Halter.
- Schieben Sie den Nasenkonus über die Nase, und beginnen Lieferung von Isofluran (1-3% vol / vol in Sauerstoff). Die Tiere werden nun im gesamten Operation mit dieser Betäubung erhalten.
- Einen Einschnitt in der Haut des Kopfes, etwa 1 mm von der Mittellinie nach links und sich von 3-4 mm rostral 2-3 mm kaudal Lambda.
- Ziehen Sie die Haut und Muskeln seitlich aus dem Einschnitt, Aussetzen der Scheitelbein und die interparietalen Knochen. Reiben Sie die Oberfläche des freiliegenden Knochen mit 20% Wasserstoffperoxid-Lösung und einem Tupfer.
- Bohren Sie ein kleines Loch in der linken und rechten Scheitelbein, und schrauben einen chirurgischen Stahl Schraube in jedes Loch nur noch ein kleiner (0,5 mm) Raum zwischen der HEAd jeder Schraube und der Fähigkeit. Verbinden Sie diese Schrauben auf den Boden und Referenzelektrode Punkte des High-Impedanz headstage.
- Ein Loch etwa 2 mm im Quadrat in der seitlichen am weitesten Umfang der interpariental Knochen. Spülen Sie das Loch mit einer sterilen Kochsalzlösung auf jeden Knochen Staub-oder Knochenfragmente, welche die Elektrode beschädigen können, zu entfernen.
- Befestigen Sie die Kupplung Lautsprecher mit dem linken Ohr hohlen bar.
- Mit der Spitze einer Nadel, einen Einschnitt in der Dura auf der Sagittalebene.
- Bringen Sie die Elektrode in Manipulator Platz über der Öffnung, mit einem caudorostral Winkel von 10 °. Die Elektrode manuell etwa 2 mm in die Oberfläche des Gehirns. Sicherstellen, dass die Endstufe eingeschaltet ist, dann verschließen Sie die Aufnahme Kammer.
- Beginnen zyklische Lieferung von niedrig (2-8 kHz), Mid-Range (16-24 kHz) und hoher (32 kHz-44kHz) Frequenz bandpaßgefilterten Lärm. Die maximale Rate, mit der Bursts geliefert werden sollte, ist ein Burst alle 200 ms. Überwachen neuronale Aktivität eint jeder Kanal, um Antworten auf Lärm-Präsentation zu erkennen.
- Weiter Einführen der Elektrode, bis entweder insgesamt eingeschobenen nähert 8 mm. Wenn die 8 mm-Grenze ohne neuronale Antworten erkannt erreicht ist, zurückzutreten und Neupositionierung der Elektrode zur anderen Insertion. Wenn die Cochleakern (CN) erreicht ist, sollte Stellen an der Spitze der Elektrode werden in erster Linie auf eine Remission Hochfrequenz-Impulse. Wenn die Elektroden in der ventralen Cochleakern (VCN), auf akustische Impulse befinden sollte ein starkes Einsetzen Komponente (1-5 ms), durch eine rasche Abnahme der Aktivität an.
- Weiter, um die Elektrode ein, bis die Spitzen der Elektrode erkennen Reaktionen auf niederfrequente Impulse oder auditiven angetriebenen Tätigkeit nicht mehr auftreten (in diesem Fall kann die Elektrode vollständig durch den CN bestanden haben und kann es erforderlich sein, um die Elektrode zu überarbeiten Platzierung).
- Konstruieren Sie einen Frequenz-Amplituden-Karte der Neuronen an der Elektrode siten. Dies wird durch dargestellt Ton über den gewünschten Frequenzbereich (typischerweise 1 bis 44 kHz oder 1-80 kHz) bei Amplituden 1-70 dB, mit 10 Wiederholungen jedes Stimulus erreicht. Ein solcher Reiz kann alle 300 ms ausgeliefert werden, wenn die Abbildung der KN. Wenn die Karte nicht ausreicht, über eine Änderung der Anordnung der Elektrode.
- Eine dünne Schicht aus Silikon-Elastomer leicht über den freiliegenden Elektrodenschäfte, so dass das Elastomer fließen die Schenkel und Mantel sowohl die Schenkel und die freigelegte Oberfläche des Gehirns.
- Tragen Sie eine erste Schicht der Prothese Zement Polymer um die Elektrode herum. Der Zement sollte minimal viskosen, um das Risiko der Elektrode in dem Prozess der Anwendung bewegt zu reduzieren. Stellen Sie sicher, dass das Polymer erstreckt sich nicht auf die Schrauben in die Scheitelbeine oder den angeschlossenen Kabel. Warten Sie auf die Acryl zu verhärten, das dauert in der Regel 5-10 Minuten.
- Nehmen Sie den Grund-und Referenz-Drähte des headstage von den Schrauben in den Scheitelbein. Mit einer Pinzette, gently wickeln Sie das Erdungskabel der Elektrode um die Schraube im linken Scheitelbein.
- Tragen Sie eine zweite Schicht aus Polymer Prothese Zement. Diese zweite Schicht sollte die beiden Schrauben, und strömt in den Raum zwischen dem Kopf der Schraube und dem Schädel zu kapseln. Dabei werden die Schrauben halten die Acryl und Elektrode mit dem Schädel. Warten Sie auf die Acryl zu verhärten.
- Entfernen Sie die headstage von der Elektrode Anschluss.
- Mit Ratte Zahnzange, heben Sie die Haut seitlich an das Polymer über das Polymer, und verwenden Sie eine Tabaksbeutelnaht, um die Haut um den freigelegten Elektrode Stecker schließen.
- Entfernen Sie die Ohr-Bars, die Freigabe der Kopf.
- End Lieferung von Isofluran, Sauerstoff und weiterhin durch die Nase Kegel zu liefern, bis spontane Bewegung beobachtet wird.
- Bringen Sie das Tier auf dem Weg nach Hause Käfig. Bewegen Sie den Käfig nach Hause, so dass etwa die Hälfte der Käfig auf dem Heizkissen ist. Dies ermöglicht es, das Tier, wenn das Handy, um zwischen wärmeren und kühleren Lagen die bewegenKäfig.
- Überwachen Sie das Tier bis zur ambulanten. Lassen Sie den heimischen Käfig auf dem Heizkissen für 24 Stunden.
- Verwalten Carprofen (4 mg / kg sc) alle 24 Stunden für 3-5 Tage.
3. Conditioning
- Platzieren Sie das Tier in der Prüfkammer.
- Aktivieren Sie die EKG-Telemetrie-Gerät.
- Lassen Sie das Tier auf der Prüfkammer für fünf Minuten vor Beginn der Konditionierung zu akklimatisieren. Dies ermöglicht die Herzfrequenz auf einem Basiseffekt zurück, da Handhabung führt zu Erhöhung der Herzfrequenz.
- Führen Sie die Konditionierung vor:
- Liefern Sie ein zufällig ausgewähltes Mitglied der akustischen Reiz Paar wiederholt in 250 ms-Bursts von 250 ms Schweigeminute für 80-170 s getrennt. Jeder Stimulus Präsentation muss einen Aufstieg und Fall von 10 ms, um einen "Klick" wahrgenommen, die Wahrnehmung deckt eine Reihe von Sound-Frequenzen zu vermeiden.
- Beginnen alternierenden das zweite Element des akustischen Reiz mit dem ersten Paar, präsentiert STch Ton für 250 ms, gefolgt von einer 250 ms des Schweigens.
- Nach 9,5 s 10 s der Periode der alternierenden Ton-Präsentation, die Verwaltung eine 0,5 ms Fuß-Schock (0,7 mA).
- Cease Ton Präsentationen für 30 s, damit die Herzfrequenz zu stabilisieren.
- Wieder aufzunehmen Tonpaar Versandkosten (ab 3.4.1). Tone Paare sollten optimal in einer zufälligen Reihenfolge präsentiert werden, und mindestens 12 Ton-Paare sollten verwendet werden, um sicherzustellen, dass Konditionierung verallgemeinert für alle Frequenz-Paare und ist nicht spezifisch für den Tonfrequenzen verwendet werden. Setzen Sie diesen Vorgang bis zu 48 Zyklen des Verfahrens (Prüfungen) abgeschlossen sind.
- Deaktivieren Sie das EKG-Gerät, und senden Sie das Tier auf dem Weg nach Hause Käfig.
4. Testing
- Betäuben das Tier mit Isofluran (1-3% vol / vol in Sauerstoff).
- Befestigen Sie das neuronale Stimulation Kabel an den freiliegenden Elektroden-Anschluss.
- Platzieren Sie das Tier in der Prüfkammer.
- Aktivieren Sie die EKG-Telemetrie-Gerät. </ Li>
- Damit das Tier aus der Isofluran-Anästhesie und gewöhnen mit der Prüfkammer für zehn Minuten vor Beginn der Prüfung zu erholen. Dies ermöglicht die Herzfrequenz auf einem Basiseffekt und Erholung von der kurzen betäubende Wirkung zurück.
- Führen Sie das Testverfahren.
- Liefern Sie ein zufällig ausgewähltes Mitglied der akustischen Reiz Paar wiederholt in 250 ms-Bursts von 250 ms Schweigeminute für 80-170s getrennt. Jeder Stimulus Präsentation muss einen Aufstieg und Fall von 10 ms, um einen "Klick" wahrgenommen, die Wahrnehmung deckt eine Reihe von Sound-Frequenzen zu vermeiden.
- Beginnen alternierenden das zweite Element des akustischen Reiz mit dem ersten Paar, präsentiert jeden Ton für 250 ms gefolgt von 250 ms der Stille.
- Nach 9,5 s 10 s der Periode der alternierenden Ton-Präsentation, die Verwaltung eine 0,5 ms Fuß-Schock.
- Cease Ton Präsentationen für 30 s, damit die Herzfrequenz zu stabilisieren.
- Beginnen Lieferung von einem nach dem Zufallsprinzip SeleCTED Mitglied einer elektrischen Stimulation des Gehirns Paar immer wieder, mit 250 ms Perioden der Stimulation von 250 ms von Nicht-Stimulation für 80 bis 170 s getrennt.
- Beginnen alternierenden das zweite Element des Reizes, welches mit dem ersten, präsentiert jedes Stimulus für 250 ms, gefolgt von einer 250 ms nicht Stimulationsperiode. Weiter abwechselnd Stimulation für 10 s.
- Cease Stimulus-Präsentationen für 30 s, damit die Herzfrequenz zu stabilisieren.
- Wieder aufzunehmen Stimulus Paar ohne Versandkosten (ab 4.6.5 oder 4.6.1). Stimulus-Paare sollten in einer zufälligen Reihenfolge präsentiert werden, und mindestens 20 Studien jedes Stimulus Paar sollte geliefert, um eine ausreichende Herzfrequenz-Daten gesammelt werden, um eine klare durchschnittliche Ergebnis zu liefern und die Variabilität zu minimieren werden. Verteilen Versuche mit akustischen Reizen in der Test-Session reduziert die Wahrscheinlichkeit, dass vom Aussterben wird während des Verfahrens auftreten.
- Lösen Sie das Kabel vom Stimulation des Tieres.
- Deaktivieren Sie die EKG-device.
- Bringen Sie das Tier auf dem Weg nach Hause Käfig.
5. Repräsentative Ergebnisse
Eine Probe EKG aufgenommen mit der implantierten Telemetrieeinrichtung eine Woche nach der Implantation in 1 gezeigt. Eine solche Aufzeichnung kann typischerweise von der implantierten Vorrichtungen erhalten werden, und die Vorrichtungen weiterhin angemessen funktionieren zum Aufzeichnen in über sechs Monaten, auch wenn lösliche Naht zu befestigen Kabel Muskeln verwendet wird. Die EKG-Aufzeichnung in 2 gezeigt wurde von einem Tier über acht Monate nach der Implantation erhalten.
Die 3 zeigt die Position eines erfolgreichen Implantation. Die Platzierung der Elektroden hat viele Standorte in der Elektrode posteroventralen Nucleus cochlearis (PVCN), Bereitstellung von Stimulation und Ableitung Zugriff auf einen Großteil der dorsoventralen Aspekt. Die Frequenz-Reaktionen jeder Elektrode Website für dieses Implantation in 4 dargestellt. Die langen Fläche des PVCN, bei dem Elektroden verteilt sind führt zu Zellpopulationen zugänglich Ableitung und Stimulation "abgestimmt" auf ein breites Spektrum von Frequenzen. Darüber hinaus werden die Populationen sich eng abgestimmt - sie reagieren nur auf ein schmales Band von Ton-Frequenzen (siehe Abb. 5).
Im Gegensatz dazu ist ein schlechter Platzierung in Abbildung 6 dargestellt. In diesem Fall wurde die Elektrode zu weit medial, platziert und nicht tief genug eindringen, um die PVCN eingefügt. Als Folge davon nur in der Nähe der Elektrode Sites Spitze zeigen Reaktionen klingen wie in Abbildung 7 gezeigt. Darüber hinaus wird der Bereich der Frequenzen, auf die die zugänglichen Zellpopulationen abgestimmt sind sehr eingeschränkt. Die Stimmung der Bevölkerung selbst ist schmal (siehe Abbildung 8), aber der gruppierte Verteilung der zentralen Frequenzen der Zellpopulationen stimuliert macht deutliche Frequenz Regionen unmöglich.
_content "> Baseline Herzfrequenz-Daten zwischen bedingten akustischen Reiz Präsentationen variiert. Um dieser Variabilität Rechnung, roh Herzfrequenz (HF)-Daten wurde als Anteil der HR beobachtet werden, wenn Stimulus Wechsel begonnen (Zeitpunkt 0) normiert. Abbildung 9 zeigt Daten in verschiedenen Formen in der ersten Sitzung Klimaanlage gesammelt. Ein Beispiel für die HR-Ergebnisse in einem anderen Tier während des letzten Teils der ursprünglichen Anlage erhalten Sitzungen in Abbildung 10 dargestellt. Die Konditionierung auf akustische Reize ist eine schnelle und starke Veränderungen in der HR beobachtet werden kann mit wenigen Versuchen;. 7 im Falle von 9 und 10 Die Veränderung der HR unmittelbar beobachtet nach Beginn des Stimulus Wechsel (siehe 3.4.1 und 3.4.2) weist nach, dass das Tier in der Lage, zwischen dem ursprünglichen wiederholt zu unterscheiden ist Stimulus und der zweite Reiz zugegeben.Nach Beginn der Test-Sessions, in denen elektriCal neuronalen Reize statt akustischer Reize in der Regel ausgeliefert werden, ermöglicht die Aufnahme von akustischen Reiz Präsentationen Bestätigung, dass Konditionierung Effekte noch vorhanden sind. Eine allgemeine Änderung in HR als Reaktion auf Beginn des akustischen Reiz Präsentation bestätigt, dass ein bedingter Effekt auf akustische Reize vorhanden bleibt, wie in Abbildung 11 dargestellt. Ebenso stellt Abbildung 12 die mittlere HR proportionale Änderung um den Beginn der akustischen Ton abwechselnd in der ersten Test-Session. Wie bei den 9 und 10 stellt die relativ konstante HR vor der Einführung des zweiten Stimulus im Gegensatz zu der raschen Veränderung HF nach der Einführung des zweiten Stimulus Beweise, dass die Diskriminierung zwischen den beiden Tönen aufgetreten ist.
Im Gegensatz dazu kann die Abwesenheit einer Erfassung in 13, in dem elektrische Stimulation beginnt zu sehen. Die mittlere prozentuale HR chan GE über 10 Studien zeigt keine Anzeichen der konsequenten schnellen Abfall beobachtet werden, wenn Erkennung stattfindet, wie in Abbildung 11. Ebenso deutet das Fehlen einer konsequenten und raschen Veränderung der Herzfrequenz in Abbildung 14, dass die zwei elektrische Reize der Auslieferung nicht ausreichend verschieden sind für Diskriminierung auftreten. Sowohl vor Beginn der Wechselperiode (vor dem Zeitpunkt 0) und nach der Umlenkung beginnt, bleibt die mittlere prozentuale Änderung HR nahe an der Linie über keine Änderung enthält.
Ein Muster eher charakteristisch für Diskriminierung zwischen den beiden Teilen eines neuronalen Stimulus-Paar wird in Abbildung 15 dargestellt. Eine Abnahme der Herzfrequenz erfolgt rasch nach Beginn des Stimulus Wechsel, gefolgt von einem erheblichen Anstieg der Herzfrequenz. Die besondere Stimulation Strategie in diesem Fall verwendet wurde, war erfolgreich bei der Herstellung eines verhaltensrelevantes Antwort.
"Src =" / files/ftp_upload/3598/3598fig1.jpg "/>
Abbildung 1. Ein EKG-Aufzeichnung unter Verwendung des implantierten Telemetriegerät 1 Woche nach der Implantation. Das Signal in dieser Aufnahme zu sehen ist weitgehend typisch für die Aufnahmen unter Verwendung dieser Geräte.

Abbildung 2. Ein EKG-Aufzeichnung unter Verwendung des Telemetrie-Gerät implantiert sechs Monate nach der Implantation. Es ist vernachlässigbar Abbau des Signals, das über diesen Zeitraum erfasst, und dieses Signal ist durchaus für die Berechnung des Tieres Herzfrequenz.

Abbildung 3. Eine 3D-Rekonstruktion einer erfolgreichen Platzierung der Elektroden, mit kombinierter Röntgen-Computertomographie und histologische Schnitte. Beide Elektroden-Schäfte durchdrang die posteroventralen Nucleus cochlearis mit Elektroden OrientierungTed, um die Struktur zu stellen.

Abbildung 4. Die Karte von elektrophysiologischen Reaktionen mit der Platzierung der Elektroden von Abbildung 3 aufgezeichnet. Jedes Histogramm zeigt die Daten für die Aktivität bei einer Elektrode Ort in Reaktion auf die Vorlage einer akustischen Frequenz; jede Spalte ein 25 ms Zeitdauer. Auf beiden Schenkeln des Elektroden-Arrays, werden die Antworten auf jede einzelne Elektrode Seite nur in Reaktion auf eine sehr schmales Band von Frequenzen detektiert, aber diese schmale Bänder werden in einem breiten Frequenzbereich verteilt. Eine solche Verteilung ist ideal, da viele unterschiedliche Frequenz-assoziierten Regionen des Gehirns unabhängig stimuliert werden kann.

Abbildung 5. Die elektrophysiologische Reaktion auf Kanal 10 aus dem Implantat in den Abbildungen 3 & bin vorgestelltp, 4. Idealerweise sollte Elektrodenanordnungen auf neuronale Reaktionen auf akustischen Stimulus auf mehreren Kanälen mit Schallamplitude so niedrig wie 10 dB erfasst führen, wie in diesem Beispiel angezeigt.

Abbildung 6. Eine 3D-Rekonstruktion eines armen Platzierung der Elektroden. Während die caudorostral Winkel der Elektrode korrekt war, war es zu medial. Darüber hinaus wurde die Elektrode nicht ausreichend tief eingeführt, was die im nächsten Seiten der Spitze der Elektrode im dorsalen Cochlea Kern.

7. Die Karte der elektrophysiologischen Reaktionen mit der Platzierung der Elektroden aufgezeichnet, wie in 6 gezeigt. Die Aktivität wird bei den Spitzen der Schaft des Elektroden-Anordnung auftritt, aber es gibt wenig Variation in der Frequenz akustischen Reizquenz, die Aktivität entlockt an jeder Elektrode Website. Solch eine Implantation nicht ermöglicht Stimulation von bestimmten Frequenz Schicht für Diskriminierungstests.

Abbildung 8. Die elektrophysiologische Reaktion auf Kanal 28 an der Platzierung der Elektroden in den Abbildungen 6 und 7 dargestellt. Akustische Reize erzeugen starke Ausbrüche von Aktivität, ähnlich wie in Spike-Frequenz auf, dass in der sehr erfolgreichen Implantation (Bild 3) zu sehen. Schwelle ist auch relativ gering, mit Antworten in Reaktion auf Töne bei 20 dB erfasst. Wenn es größere Variation in den Frequenzen, auf die die stärksten Reaktionen traten auf andere Kanäle der Anordnung dieser Kanal wäre sicher angemessen Stimulation.
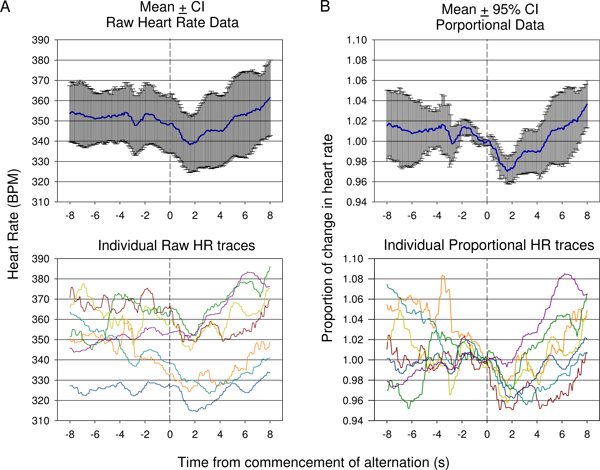
Abbildung 9. Vergleich von Roh-Herzfrequenz (A) verses mittlere Proportionale (B) Daten, die während der ersten Sitzung Konditionierung bei einem Tier gesammelt. Antworten von sieben Präsentationen gezeigt werden. Durch die Variation bei der Gründung der Herzfrequenz vor Beginn des Tons Veränderung, das heißt roh Herzfrequenz (± 95% Konfidenzintervall) nicht adäquat zeigen den Grad der Veränderung von einem anfänglichen Abfall der Herzfrequenz durch Aufstieg folgte wie in einzelnen Rohstoffen angegeben Spuren (A, unten). Mittlere prozentuale Veränderung der Herzfrequenz-Daten in dem sich die Herzfrequenz von der Herzfrequenz zum Zeitpunkt der bedingten akustischen Reiz Präsentation für jede Spur wird unterteilt in (B) präsentiert. Dies zeigt eine statistisch signifikante Rückgang im Anschluss bedingten Reiz Präsentation mit einem späten deutlichen Anstieg spiegelt mit 95%-Konfidenzintervalle. Individuelle Herzfrequenz proportional Spuren werden gezeigt (B, unten).
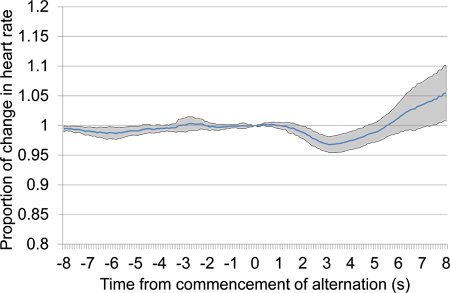
Abbildung 10. Mittlere Proportionale Herz r gegessen Änderung von 8 s vor bis 8 s nach dem Beginn der alternierenden akustischen Stimulus Präsentation Kombinieren von Daten aus der zweiten und dritten Konditionierungssitzungen. Die präsentierten Daten umfasst sieben Studien über die beiden Sitzungen Klimaanlage, vier in der ersten Sitzung Konditionierung und drei in der zweiten vorgestellt. Als Reaktion auf die wechselnden Stimulus-Präsentation, eine große anfängliche Rückgang der Herzfrequenz aufgetreten ist, durch einen späten Anstieg der Herzfrequenz gefolgt.
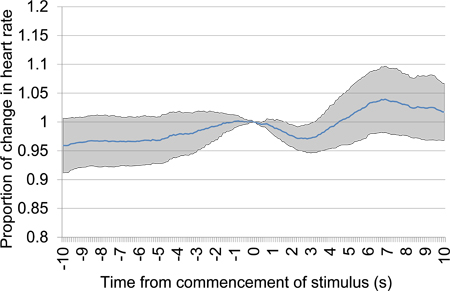
Abbildung 11. Mittlere prozentuale Veränderung der Herzfrequenz von 10 s vor 10 s nach dem Beginn der akustischen Reiz Präsentation nach einer 30 s Stille Zeit. Studiendaten wurde aus dem ersten Test-Session getroffen und umfasst sechs akustischen Reiz Präsentationen. Eine klare frühen Rückgang der Herzfrequenz einen Nachweis über die Diskriminierung zwischen den akustischen Reizen präsentiert.
es/ftp_upload/3598/3598fig12.jpg "/>
Abbildung 12. Mittlere prozentuale Veränderung der Herzfrequenz von 8 s vor 8 s nach dem Beginn der wechselnden akustischen Reiz Präsentation, von der ersten Test-Session getroffen und darunter fünf akustischen Reiz Präsentationen. Eine klare frühen Rückgang der Herzfrequenz einen Nachweis über die Diskriminierung zwischen den akustischen Reizen präsentiert.
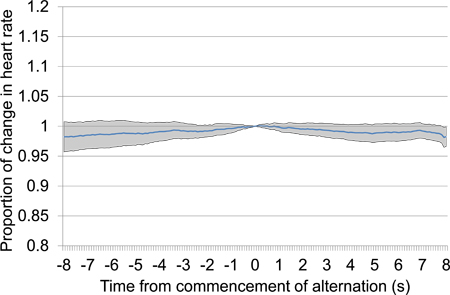
Abbildung 13. Mittlere prozentuale Veränderung der Herzfrequenz von 10 s vor 10 s nach dem Beginn der elektrischen Stimulation des Gehirns nach einer 30 s Stille Zeit. Demo-Daten wurden aus der ersten und zweiten Test-Sessions aufgenommen und umfasst 18 elektrische Stimulation Präsentationen, die alle mit denselben Einstellungen Stimulation. Das Fehlen eines bestimmten Abfall der Herzfrequenz, besonders proximal Zeitpunkt 0, bei der Stimulation beginnt, legt nahe, dass das Tier nicht in der Lage stimul erkennen istmit uns auf.

Abbildung 14. Mittlere prozentuale Veränderung der Herzfrequenz von 8 s vor 8 s nach Beginn des alternierenden elektrischen Stimulus-Präsentation (siehe 4.6.5 und 4.6.6), entnommen aus dem ersten Test-Session und einschließlich 33 elektrischen Stimulus-Präsentationen. Kein einheitliches Muster der Veränderung der Herzfrequenz tritt in der Nähe Zeitpunkt 0, was bedeutet, dass die abwechselnden Reize nicht ausreichend für unterschiedliche Diskriminierung auftreten, sind nahe legt.
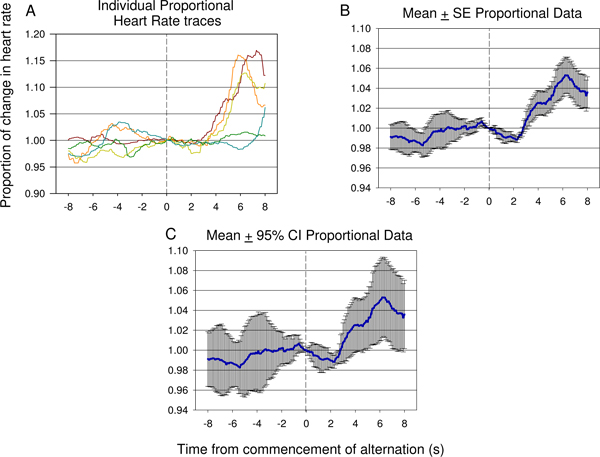
15. Repräsentative Beispiele einzelner Spuren (A) und die mittlere Herzfrequenz proportional Daten (B, C) von 8 s vor 8 s nach Beginn des alternierenden elektrischen Stimulus zu betrachten, von der siebten Testsitzung einer zweiten Tier entnommen, und darunter 12 elektrischen Stimulus-Präsentationen. Eine signifikante Abnahme der HR tritt schnell nach der Einführung des zweiten neuronalen Stimulus durch einen signifikanten Anstieg der Herzfrequenz anschloss darauf hindeutet, die Differenz zwischen dem ersten und zweiten Impulse von dem Tier erfasst worden ist. Der Grad der Fehler und der Varianz der Reaktion kann im Proportional-Mittelwert ± Standardabweichung (SE)-Diagramm in (B) ersichtlich ist. Die Bedeutung des Dip und nach dem zweiten Anstieg Stimuluspräsentation verifiziert unter Verwendung von 95% Konfidenzintervalle, die auf die Daten in (C) gezeigt werden. Die Reaktion in (C) zu sehen ist vergleichbar mit der Immunantwort in Abbildung 9 B.
Discussion
Die hier beschriebenen Techniken stellen ein Mittel zum Testen einer Reihe von Diskriminierung und damit schnell, mit kurzen Trainingszeiten und damit für eine wesentliche Automatisierung und minimiert so Forscher Zeit für die Datenverarbeitung erforderlich. Anhand der Daten aus dem implantierten EKG, Berechnung der Herzfrequenz (HR) Veränderung in Zeiten der Stimulus-Präsentation erhalten kann automatisiert werden. Fehler bei der EKG-Verarbeitung (z. B. fehlende einen einzigen Herzschlag) können leicht identifiziert werden, da sie fälschlicherweise große Veränderungen in der scheinbaren Herzfrequenz für einen sehr kurzen Zeitraum zu produzieren, und wie leicht Fehlererkennung minimiert die Voraussetzung für die zeitintensive manuelle Sichtung von Daten .
Die Technik für die Implantation des EKG-Telemetrie-Gerät beschrieben, die durchgängige Produktion von Aufnahmen mit wenig oder gar keine Störungen (siehe Abbildungen 1 und 2). Allerdings können relativ kleine Schwankungen in der Platzierung der Elektrode in das Mediastinum Region, um Störungen aus dem nahe gelegenen Muskel führens und insbesondere Atmung-assoziierten Lärm. Überprüfen der korrekten Platzierung der Elektroden während der Implantation, insbesondere nach der Naht führt an Ort und Stelle, erlaubt Feineinstellungen von Blei Platzierung um Störungen zu minimieren.
Der Prozess der Hirn-Implantation in den Nucleus cochlearis ist schwierig. Durch die Verwendung von seriellen Präsentationen von bandpaßgefilterten Lärm von mehreren Frequenzbereichen, anstatt breitbandiges Rauschen wie zuvor bereits 3 verwendet, können Antworten von Zellpopulationen an der Elektrode Sites schnell im Hinblick auf Frequenz-Antwort eher werden als die weniger spezifischen Lärm bewertet Antwort. Die Fähigkeit, schnell zu identifizieren, wenn eine ausreichende Frequenzbereich abgestimmt Zellpopulationen zugänglich sind kritisch in der Forschung, wenn elektrische Impulse Diskriminierung getestet wird. Wenn nicht genügend Frequenz-Verteilung erhalten wird, dann Vergleich zwischen Stimulation der unterschiedlichen Frequenzbereichen ist einfach nicht möglich. Dennoch ist die längeren Prozessder Frequenz-Amplituden-Mapping bleibt entscheidend für die Bereitstellung Detail in Bezug auf die Breite des Tunings von Zellpopulationen und sollten vor der Befestigung der Elektroden an Ort und Stelle durchgeführt werden.
Im Verhaltenstraining und Tests, ermöglicht die Aufnahme eines nicht-Stimulus (oder stumm) Zeitraum zwischen Studien, vor Beginn des Stimulus, das Ansprechen auf eine initiale Reizbeginn untersucht werden. Beim Gebrauch von elektrischen Nervenstimulation, bietet eine Antwort auf Reizbeginn Beweis für die einfache Erkennung des Reizes. Somit wird, wenn es keine Stimulusbeginn Antwort, aber dann reagieren, wenn der zweite Impuls abwechselnd eingebracht wird, kann gefolgert werden, dass nur diese Impulse detektiert werden kann. Ohne Aufnahme einer solchen Ruhephase, gäbe es keine Möglichkeit festzustellen, dass der frühere Reiz nicht erkannt wurde.
Eine Einschränkung in diesem Verhaltens-Tests Technik ist, dass das Fehlen der Maul-Schocks nach der Präsentation des NEURA geliefertl Stimulation kann zur Entwicklung von Spezifität in konditionierter Furcht führen wird, dass Angst nur zum Ausdruck, wenn der akustische Reiz dargeboten wird. Das heißt, dass das Tier erfahren, dass die sensorische Effekte insbesondere von neuronalen Stimulation mit empfängt kein Fußschock zugeordnet sind. Im Gegensatz dazu konnte die Bereitstellung Fuß-Schocks nach der Präsentation des neuronalen Stimulation auf eine konditionierte Furcht des neuronalen Stimulus selbst, sich von allen Sound-ähnlichen Eigenschaften der neuronalen Reiz haben können führen. Ergebnisse erhält man, wenn ohne einen Fuß-Schock nach neuronale Stimulation sicherlich stärkere Beweise für neuronale Impulse als Ton-wie als diejenigen mit einem Fuß-Schock nach neuronaler Stimulation, wie im ersten Fall konditionierte Furcht von der akustischen zur Neurostimulation verallgemeinert hat. Dennoch ist das Risiko der Entwicklung Spezifität für akustische als neuronale Stimulation auf. Die Verwendung von bandpaßgefilterten Lärm als akustischer Reiz, anstatt reiner Ton-Bursts, von denen die ersterekann besser auf die Wahrnehmungserlebnis neuronaler Stimulation, könnte das Risiko von solchen Spezifität zu entwickeln. Allerdings führt ein solches Verfahren eine zusätzliche Variable der Bandbreite des Filters, der die Diskriminierung Aufgaben, beeinträchtigt wird.
Eine zusätzliche Einschränkung mit einer chronischen Implantation neuronalen wie erforderlich für Verhaltenstests, zugeordnet ist, die Änderung in Abhängigkeit von der Elektrode oder des dazugehörigen neuronalen Gewebe über die Zeit. Die Stimulation von Nervengewebe kann sowohl temporäre Unterdrückung der neuronalen Aktivität 13 und Gewebeveränderungen wie Zellverlust 14 und Hirngewebe direkte Reaktion auf die Elektrode führen. 15
Der beschriebene Ansatz zur Implantation und Verhaltenstests bietet ein Mittel, um sowohl Erkennung und Unterscheidung von akustischen und elektrischen Reize mit einer kurzen Ausbildung, und die Fähigkeit zur Steuerung von Prozess-Frequenz ausüben zu testen. Die Technik der Verwendung Änderung in HR als Messe von konditionierter Furcht könnten erhoben werden, nicht nur auditive Tests, sondern ganz allgemein zu allen sensorischen Tests, in denen Impulse für jeden einzelnen Zeitraum erbracht werden kann, und in denen der Nachweis der sensorischen Diskriminierung gewünscht wird.
Disclosures
Dr. Antonio Paolini ist ein Direktor von Bioengenesis Technologies Pty Ltd, die die australischen Vertreter für Tucker Davis Technologies und dem australischen Distributor von NeuroNexus Probes sind.
Acknowledgments
Die Finanzierung dieser Forschung wurde von The Garnett Pässe und Rodney Williams Memorial Foundation und der La Trobe University zur Verfügung gestellt.
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



