Summary
ラットの聴覚補綴研究のための古典的な恐怖条件付け行動パラダイムのアプリケーションが記述されています。このパラダイムは、検出、およびアウトカム指標として心拍数を使用して別個の音響および電気刺激の間の差別の両方を識別するためのメカニズムを提供します。
Abstract
急性動物製剤は前向きにそのような聴性脳幹インプラント1-3と聴覚中脳インプラント4,5のような神経聴覚義肢に電極の設計と統合のための刺激技術を調査研究に使用されている。急性実験では、インプラントの有効性に最初の洞察力を与えることができますが、慢性的に移植し、覚醒動物をテストすることは感覚の心理物理学的特性を調べることの利点は、移植デバイスの6,7を使用して誘導しています。
そのような報酬ベースのオペラント条件6-8、条件回避9-11、または古典的な恐怖条件付け12などのいくつかの技術は、関連する刺激属性の検出の行動確認を提供するために使用されている。技術の選択は、時間効率(多くの場合、貧しい報酬ベースのアプローチ)で、複数のテストをする機能など、バランスの側面が含まれます刺激(条件回避に限る。)同時に属性、繰り返し刺激(生理的な措置が採用されている潜在的な制約)の尺度の信頼性。
ここでは、古典的な恐怖条件付け行動の方法は、同時に刺激の検出、および2つの刺激の間に差別の両方をテストするために使用されるかもしれない提示されます。心拍数は、凍結の動作や他のそのような対策のためのコーディング時間のかかるビデオの必要性を低減または排除する恐怖反応の指標として使用されます(そのような措置が収束の証拠を提供するために含まれている可能性がありますが)。動物はそれぞれ48刺激試験を提供し、3つの2時間のコンディショニングセッションでこれらの技術を使用して調整した。その後の48試行のテストセッションは、その後提示ペアで各刺激の検出、および各ペアのメンバーの刺激の間にテストの弁別をテストするために使用されました。
この行動のメソッドは、で表示されます聴覚補綴研究におけるその活用のコンテキスト。心電図テレメトリ装置の注入が表示されます。慢性的な使用のための所定の位置に音響刺激に対する神経応答のモニタリングによって導か蝸牛神経核、および電極の固定に脳電極のそれ以降の注入は、同様に表示されます。
Protocol
1。心電図テレメトリデバイスの注入
- 移植手術の開始前に1時間、術後鎮痛を提供するために、カルプロフェン(4 mg / kgを皮下)投与する。
- 深さのより良い規制を可能にする手術中に、より安定しているイソフルラン麻酔に切り替える前にシェービングを挿入耳のバーを含む初期の動物の準備を可能にするために麻酔のためにケタミン/キシラジン(10 mg / kgのは、ip:70 mg / kgで、XY柯)を注入する麻酔から短縮術後の回復。
- 麻酔開始時に、動物の目に目の潤滑剤を適用し、腹部胸部と喉を剃る。消毒液、続いてアルコールの皮膚の準備に続いて外科スクラブを使用して、露出した皮膚を拭きます。暖めるために熱の毛布の上にホームケージを置きます。
- 恒温プレート上に仰臥位で動物を配置します。喉を高め、公開するために首の下に詰め物を挿入します。
- 鼻共に置き動物の鼻の上にね(酸素の体積/体積イソフルラン1から3パーセントを提供し、毎分2リットル)と場所でコーンを固定します。
- 胸部と喉の皮膚の緊張を生成するための半延長位置でフォア手足を修正し、ノーズコーンの自由な滑り鼻を防ぐことができます。
- 動物の直腸に恒温毛布のプローブを挿入します。
- 尾筋層を露出させる剣状突起20ミリメートルから伸びる皮膚に正中切開を行います。その後マッチング白線に沿って切開し、腹腔内を確認します。
- 開口部の吻側端から延びるリードを腹腔内にECGテレメトリー装置を挿入し、腹膜の開口部の尾15ミリメートルを縫合。
- 胸骨舌骨筋を露出し、気管を覆う喉の正中切開を行います。
- 尾側に面し吻側切開の皮下空間にワニの耳鉗子を挿入し、腹水を形成するために、これらを使用し吻側から尾側切開にaneousトンネル。グリップは、正(赤)鉗子の鉛とトンネルを介してリードを撤回する。
- 鉗子を用いて胸骨舌骨筋を持ち上げて、挿入するケーブル吻側の約1 mmのループを残して、右縦隔に向かって背側正極リードの先端を挿入します。それは胸腔から、基礎となる筋肉へのループの先頭で拡張リードを縫合。
- 剣状突起の背壁を露出し、負極リード露出面の先端を縫合。
- 適切な心電図を得ることができるように注入デバイスの信号を確認してください。
- 腹腔内に余分なケーブルを通します。縫合糸は、腹膜壁、白線、腹部皮膚を閉じた。
- 縫合糸は、喉の皮膚を閉じた。
- イソフルランの配信を中止し、自発的な動きが観察されるまで酸素を供給し続けています。
- 動きが観察されたときに、前肢解放Dそのホームケージに動物を返します。約半分ケージは熱パッドの上になるようにホームケージに移動します。これは、ケージの暖かく、より涼しいエリア間を移動するには、ときに携帯電話、動物をできるようになります。外来まで、動物を監視し、24時間熱毛布の上にホームケージにしておきます。
- メーカー·在庫多1-3日のためにカルプロフェン(4 mg / kgを皮下)24時間ごとに管理することができます。
2。脳電極インプラント
- 注入開始前に1時間、術後鎮痛のためにカルプロフェン(4 mg / kgを皮下)投与する。
- 麻酔にケタミン/キシラジン(10 mg / kgのは、ip:70 mg / kgで、XY柯)を注入します。
- 麻酔開始時に、目を保護するために眼軟膏を適用し、動物の頭を剃る。 betadine、続いてアルコールに続いてbetadineスクラブを使用して露出した皮膚を拭いてください。
- 恒温プレート上に腹臥位で動物を配置します。
- およそ予想される最終位置の位置1の中空耳バー、と持ち上げて、耳バーが外耳道に位置していますように動物を配置します。
- 反対側の外耳道への第2の中空耳バーをスライドさせます。
- ラット歯鉗子を用いて、動物の顎を開いて、歯のホルダー上に上顎をフックします。
- 鼻の上鼻コーンをスライドさせ、イソフルランの配信を開始する(酸素の百分の1から3 vol / vol)の。動物は今、この麻酔で手術を通して維持されています。
- 、頭の皮膚の切開を行う正中線の左に約1 mmとラムダの尾2〜3ミリメートルの吻側3〜4ミリメートルから伸びる。
- 頭頂骨と頭頂間骨を露出、切開から横方向に皮膚と筋肉を縮める。 20%の過酸化水素溶液とガーゼパッドを使用して露出した骨の表面をこすります。
- 左と右頭頂骨に小さな穴をドリルダウンし、HEAの間に小さな(0.5 mm)のスペースを残してそれぞれの穴にサージカルステンレスネジを締め各ねじとスキルのd。高インピーダンスヘッドステージのグランドおよび基準電極ポイントにこれらのネジに接続します。
- interpariental骨の横方向の最も程度の約2mm角穴を開けます。電極を損傷する恐れがあり、任意の骨塵や骨片を除去するために滅菌生理食塩水を使って穴をフラッシュします。
- 左耳中空バーにカップリングスピーカーを取り付けます。
- 針の先端を使用して、矢状面に硬膜の切開を行います。
- 10°のcaudorostral角度では、開口部上に所定の位置に電極マニピュレータを持参してください。脳の表面に約2mm手動で電極を挿入します。録音室を密封し、アンプの電源がオンになっていることを確認します。
- 低循環配信(2-8 kHz)を、ミッドレンジ(16-24 kHz)とハイ(32kHzの-44kHz)周波数バンドパスフィルタのノイズを開始する。バーストが配信されるべきで、最大レートは1バースト毎に200 msです。神経活動をモニターするトンノイズプレゼンテーションへの応答を検出するために、各チャネル。
- どちらかの合計を挿入距離が8ミリメートルに接近されるまで電極の挿入を続行します。 8ミリメートルの制限は神経応答が検出されずに到達した場合、撤回し、別の挿入するための電極の位置を変更します。蝸牛神経核(CN)に達した場合、電極の先端部位は、主に高頻度刺激に対する応答を示す必要があります。電極は腹側蝸牛神経核(VCN)に配置されている場合、音響刺激に対する応答は、活動の急速な減少が続いて強い発現成分(1-5 ms)を、持っている必要があります。
- 電極の先端が低周波刺激、または聴覚主導のアクティビティが発生しなくなる(この場合、電極は、CNを介して完全に通過した可能性があり、それは電極を修正する必要があるかもしれませんへの応答を検出するまで電極を挿入し続け配置)。
- 電極sでのニューロンの周波数振幅応答マップを構築するITES。これは、各刺激の10回の振幅が1〜70デシベルで、所望の周波数範囲(通常は1から44 kHzまたは1から80 kHz)で、全体の提示音によって実現されます。 CNをマッピングする際に一つの刺激は、すべて300ミリ秒配信されることがあります。マップが不十分な場合、電極の配置の見直しを検討してください。
- エラストマーは、シャンクとコートの両方のシャンクと脳の露出面を流下するような、わずかに露出した電極シャンク上にシリコンエラストマーの薄層を適用します。
- 電極の周り義歯セメントポリマーの第一層を適用します。セメントは、アプリケーションのプロセスに移動されている電極のリスクを軽減するために、最小限の粘性でなければなりません。ポリマーは頭頂骨または付属ケーブルのネジをカバーしていないことを確認してください。通常5〜10分かかり硬化にアクリルを待ちます。
- 頭頂骨のネジからヘッドのグランドおよび基準線を切り離します。 gは、鉗子を用いてently左頭頂骨にネジの周りに電極のアース線を巻く。
- 義歯セメントポリマーの第二の層を適用します。この第二の層は、ねじの頭と頭蓋骨の間の空間に両方のネジ、およびフローをカプセル化する必要があります。そうすることで、ネジが頭蓋骨にアクリルや電極を保持します。硬化アクリルのを待ちます。
- 電極コネクタからヘッドを外します。
- ラットの歯の鉗子を用いて、ポリマー上のポリマーへの横方向の皮膚を持ち上げ、露出電極コネクタの周りの皮膚を閉じるには、巾着縫合を使用しています。
- 頭を解放し、耳バーを削除します。
- イソフルランの配信を終了し、自発的な動きが観察されるまで、ノーズコーンを介して酸素を供給し続けています。
- ホームケージに動物を返します。約半分ケージは熱パッドの上になるようにホームケージに移動します。これは暖かいとより涼しいエリア間を移動するには、ときに携帯電話、動物を許可しますケージ。
- 外来まで、動物を監視します。 24時間の熱パッドの上にホームケージにしておきます。
- メーカー·在庫多1-3日のためにカルプロフェン(4 mg / kgを皮下)24時間ごとに管理することができます。
3。コンディショニング
- 試験室に動物を配置します。
- ECGテレメトリー装置をアクティブにします。
- 動物がコンディショニングを開始する前に5分間の試験室に慣れることができます。これは、処理が心拍数の上昇につながるとして、心拍数は、ベースラインに戻るには、許可されます。
- コンディショニングの手順を実行します。
- 80から170秒250 msの無音で区切られた250ミリ秒のバーストで繰り返し音響刺激のペアのいずれかのランダムに選択されたメンバを提供します。各刺激提示は、知覚的に音の周波数範囲をカバーして知覚される "クリック"を避けるために、10ミリ秒の立ち上がり時間と立ち下がり時間を持つ必要があります。
- は、最初に提示するEAで音響刺激のペアの2番目のメンバーが交互に開始250ミリ秒のためにchの音が250 msの無音が続く。
- トーンのプレゼンテーションを交互に10秒周期の9.5秒後、0.5ミリのフットショック(0.7 mA)を管理することができます。
- 心拍数が安定するまで30秒のトーンプレゼンテーションを停止する。
- (3.4.1から)トーン·ペアの配信を再開。トーンのペアが最適にランダムな順序で提示されるべきであり、少なくとも12トーンのペアは、エアコンがすべての周波数のペアに一般化して使用されるトーンの周波数に固有のものではありませんことを確実にするために使用されるべきである。手順(試験)の48サイクルが完了するまで、このプロセスを続行します。
- ECGデバイスを無効にし、ホームケージに動物を返します。
4。テスト
- イソフルランを用いた動物をAnesthetise(酸素の1から3パーセントvol / vol)の。
- 露出した電極コネクタに神経刺激ケーブルを接続します。
- 試験室に動物を配置します。
- ECGテレメトリー装置をアクティブにします。</ LI>
- 動物が開始前テストまで10分間の試験室にイソフルラン麻酔と慣れるから回復することができます。これは心拍数がベースラインと簡単な麻酔効果からの回復に戻るには、許可されます。
- テストの手順を実行します。
- 80-170S用に250 msの無音で区切られた250ミリ秒のバーストで繰り返し音響刺激のペアのいずれかのランダムに選択されたメンバを提供します。各刺激提示は、知覚的に音の周波数範囲をカバーして知覚される "クリック"を避けるために、10ミリ秒の立ち上がり時間と立ち下がり時間を持つ必要があります。
- 第一の音響刺激のペアの2番目のメンバーが交互に開始し、250の各トーンを提示するMSは、250 msの無音が続く。
- トーンのプレゼンテーションを交互に10秒周期の9.5秒後、0.5ミリのフットショックを管理します。
- 心拍数が安定するまで30秒のトーンプレゼンテーションを停止する。
- 1ランダムセレの配信を開始繰り返し電気脳刺激ペアのCTEDメンバー、80から170秒の非刺激が250 msの区切られた刺激が250 msの期間を使用します。
- 第一の刺激のペアの2番目のメンバーが交互に開始し、250のそれぞれの刺激を提示するミリ秒250ミリ秒、非刺激期間が続く。 10秒間の刺激を交互に続ける。
- 心拍数が安定するまで30秒刺激プレゼンテーションを停止する。
- (4.6.5または4.6.1から)刺激のペアの配信を再開。刺激のペアはランダムな順序で提示されるべきであり、各刺激対の少なくとも20の試験は十分な心拍数のデータがクリアの平均結果を提供し、ばらつきを最小限に抑えるために収集されていることを確認するために提供されるべきである。テストセッションを通して音刺激を使用して配布する試験では、絶滅の手順の実行中に発生する可能性を減らすことができます。
- 動物からの刺激ケーブルを外します。
- ECGデビを無効にするCE。
- ホームケージに動物を返します。
5。代表的な結果
移植後一週間を注入遠隔測定装置を用いて採取したサンプルの心電図記録を図1に示されています。そのような記録は、通常、水溶性の縫合糸が筋肉に接辞ケーブルに使用されている場合でも、注入装置から得られ、デバイスは6ヶ月を超えるために記録するために十分に機能し続けることができます。 図2に示すECG記録は、8ヶ月後の移植上の動物から得られた。
図3は、正常着床の位置を示しています。電極配置は、背腹側面の多くに刺激と記録へのアクセスを提供し、posteroventral蝸牛神経核(PVCN)の多くの電極部位を持っています。この移植のために各電極部位の周波数応答を図4に示されています。電極が配布されているPVCNの長い領域は、広範囲の周波数に "チューニング"の記録と刺激のためのアクセス可能な細胞集団につながります。さらに、集団自体が狭く調整されている-彼らは音の周波数の狭帯域( 図5を参照)にのみ対応しています。
対照的に、貧しい人々の配置を図6に示します。この例では、電極があまりにも内側に配置され、PVCNを貫通するように十分に深く挿入されていません。 図7に示すように、結果として、先端ショー応答の近くに電極部位のみが鳴ります。さらに、アクセス可能な細胞集団がチューニングされたように周波数の範囲は非常に制約されています。集団のチューニング自体は狭いです( 図8を参照)が、細胞集団の中心周波数のクラスタ化されたディストリビューションは不可能異なる周波数領域を刺激することができます。
_content "はエアコン音響刺激のプレゼンテーションの間で変化>ベースラインの心拍数のデータをアカウントにこのばらつきのために、生の心拍数(HR)データが刺激交代(時間0)を開始したときに観察HRの割合として標準化した。 図9は、様々のデータを示しています。フォームは、最初の空調セッション中に収集された。初期コンディショニングセッションの後半に別の動物で得られたHR結果の一例を図10に示されています。音響刺激に対するコンディショニングプロセスは迅速であり、HRの強力な変化を観察することができるいくつかの臨床試験で、 図9と図10の場合は7刺激交代の開始直後に観察され、HRの変化は、(3.4.1と3.4.2を参照してください)動物が繰り返される初期区別することができるという証拠を提供しています。刺激と第二の刺激は、その後追加されました。テストセッションを開始した後、これであるelectriCalの神経刺激ではなく、音刺激は通常、配信され、音響刺激のプレゼンテーションを含めることは、コンディショニング効果が依然として存在していることを確認することができます。音響刺激のプレゼンテーションの開始に応答して、HRの一般的な変化は図11に示すように、音響刺激に対する調節効果は、現在のままであることを確認します。同様に、 図12は、最初のテストセッションでのアコースティックトーン交代の開始前後の平均HR比例した変化を示します。 図9および図10と同様に、前の第二刺激の導入後のHRの急激な変化とは対照的に第二刺激の導入には比較的安定したHRは、2つのトーンの間に差別が発生したことを証拠を提供しています。
対照的に、検出の有無は、電気刺激が開始されている図13に見られることがあります。平均比例HRちゃん 10回にわたってGEは、 図11に示すように、検出が発生したときに観察され一貫性の急速な低下の兆候を示していません。同様に、 図14の心拍数の一貫した急激な変化がない場合は、配信される2電気刺激は、差別が発生するのは十分に異なっていないことを示唆している。両方を交互に期間の開始(時間0前)の前に、交代が開始した後、HRの平均比例する変化は、変更なしの行に近いままである。
神経刺激ペアの2つのメンバー間の差別の多くの特徴的なパターンを図15に示します。心拍数の減少は、心拍数の大幅な増加に続いて、刺激交代の開始後に急速に発生します。このケースで使用される特定の刺激の戦略は、行動に関連する応答を生成することに成功しました。
"SRC =" / files/ftp_upload/3598/3598fig1.jpg "/>
図1心電図の記録は移植後一週間を注入遠隔測定装置を用いて得られた。この記録に見られる信号は、これらのデバイスを用いて得られたレコーディングの大部分は典型的である。

図2心電図記録は6ヵ月移植後に移植遠隔測定装置を用いて得られた。そこにその時間の期間にわたって記録されている信号の劣化は無視であり、この信号は確かに動物の心拍数の計算に適しています。

図3を組み合わせたX線CTおよび組織切片を用いて成功した電極配置の3次元再構築、。両方の電極シャンクは、電極orienでposteroventral蝸牛神経核を貫通構造に直面するテッド。

図4図3の電極配置で記録した電気生理学的応答の地図。各ヒストグラムは、1音響周波数のプレゼンテーションへの応答の1つの電極部位での活動のためのデータを示しています。各列は25 msの期間を表しています。電極アレイの両方のシャンクで、応答は周波数だけの非常に狭帯域に応じて個々の電極部位で検出されますが、これらの狭いバンドは広い周波数範囲に分散されています。脳の多くの異なる周波数に関連した領域は独立して刺激することができるような分布が、理想的です。

図5図3&AMで提示インプラントからチャンネル10での電気生理学的応答P 4。理想的には、電極の配置は、10デシベルという低い音の振幅を持つ複数のチャネル上で検出されている音響刺激に対する神経応答をもたらすべきであるこの例のように表示されます。

図6。貧しい電極配置の3次元再構成。電極のcaudorostral角度が正しいでしたが、それはあまりにも内側であった。さらに、電極は背側蝸牛神経核内に位置している電極の先端に最も近いサイトで、その結果、十分に深く挿入されていません。

図7、図6に示すように電極配置で記録した電気生理学的応答の地図。活動は、電極アレイの各シャンクの先端に発生しているが、音響刺激にはほとんど変動は周波数があります各電極部位での活性を誘発する周波数。このような移植は差別テストのための異なる周波数層の刺激を有効にしません。

図8、図6および7に示すように、電極配置のチャンネル28で電気生理学的応答。音響刺激は非常に成功した注入( 図3)に見られるものとスパイク頻度で同様の活動の強力なバーストを生成します。しきい値は、応答が20デシベルで、音に反応して検出されると、また非常に低いです。アレイの他のチャネル間で最強の応答が発生する周波数の大きな変動があった場合、このチャネルは確かに刺激のために適切でしょう。
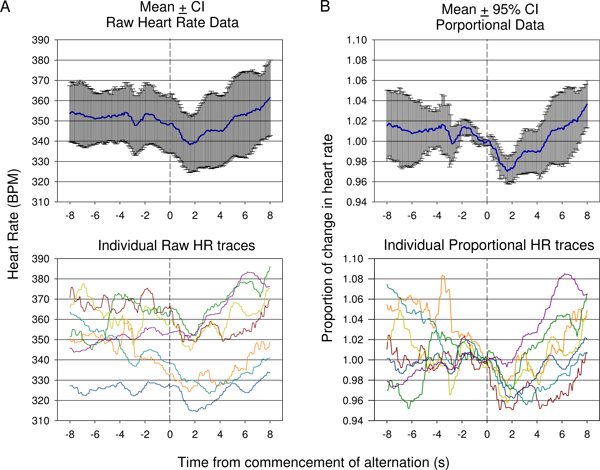
図9生の心拍数の比較()Versesは一匹の最初のコンディショニングセッション中に収集された比例した(B)のデータを意味します。 7プレゼンテーションからの応答が表示されます。ためのトーン変化の開始前に心拍数を開始の変動は、個々の生に示されるように十分に上昇し、続いて心拍数の初期降下の変化の度合いが表示されない生の心拍数(±95%信頼区間)を意味するトレース(下)。心拍数は、各トレースのためにエアコン音響刺激提示時の心拍数で割っされた心拍数データの比例した変化が(B)に示されているを意味します。これは、95%信頼区間を用いた反射後半大幅に上昇したエアコン刺激提示後に統計的に有意な低下を示しています。個々の比例した心拍数のトレースは(B、下部)が表示されます。
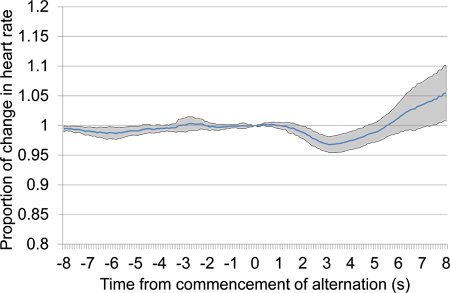
図10。比例心rを平均 2番目と3番目のコンディショニングのセッションからのデータを組み合わせることで、音響刺激のプレゼンテーションを交互開始後8秒前に8秒からの変更を食べました。提示されたデータは、2つのエアコンのセッションは、最初の空調セッションで4と第三の上に提示さ7件の試験が含まれています。刺激提示を交互に応答して、心拍数の大規模な初期低下は心拍数の増加が遅れて続いて発生しました。
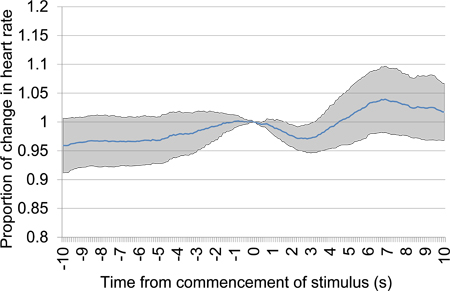
図11は 30秒の沈黙の期間の後に音響刺激提示の開始後に前に10秒〜10秒から比例した心拍数の変化を意味します。試験データは、最初のテストセッションから取得され、6音響刺激のプレゼンテーションが含まれていました。心拍数の明確な初期の低下が示された音響刺激の間に差別の証拠を提供しています。
es/ftp_upload/3598/3598fig12.jpg "/>
図12は前の最初のテストセッションから取得され、5音響刺激のプレゼンテーションを含む音響刺激のプレゼンテーションを、交互の開始後8秒〜8秒から比例した心拍数の変化を意味します。心拍数の明確な初期の低下が示された音響刺激の間に差別の証拠を提供しています。
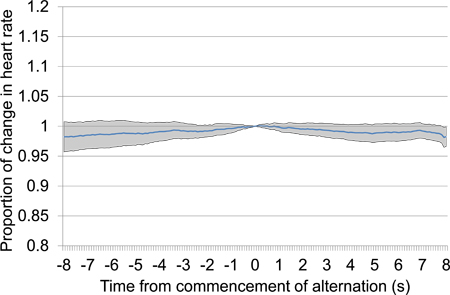
図13は、10秒から30秒前に、沈黙の期間後の電気脳刺激開始後10秒に比例した心拍数の変化を意味します。試験データはすべて、同じ刺激の設定を使用して、第一および第二のテストセッションから取得した、18の電気刺激のプレゼンテーションが含まれていました。刺激が開始された時刻を0に特に近位の心拍数の任意の特定の低下の有無は、動物がstimulを検出できないことを示唆している私達。

図14は、最初のテスト·セッションから取得した電気刺激のプレゼンテーション(4.6.5と4.6.6を参照)、交互に、33電気刺激のプレゼンテーションなどの開始後に前の8秒、8秒から比例した心拍数の変化を意味します。心拍数の変化の一貫したパターンが交互に刺激が差別が発生するのは不十分に異なっていることを示唆している時間0付近で発生しません。
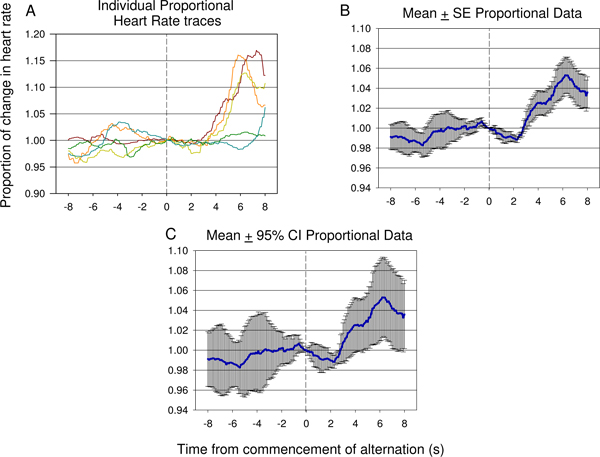
図15代表的な個々のトレースの例(A)と前の2番目の動物の第七のテストセッションから取得した交互電気刺激のプレゼンテーションの開始後8秒〜8秒から比例した心拍データ(A、B、C)を意味し、 12電気刺激のプレゼンテーションを含む。 Hの有意な減少心拍数の大幅な上昇に続いて第二神経刺激の導入は、第1及び第2の刺激の違いは、動物で検出された示唆を反映した後にRが急速に発生します。応答の誤差と分散の度合いは、(B)に示すように比例した平均値±標準誤差(SE)のプロットで見ることができます。第二刺激提示後にディップと立ち上がりの重要性は(C)に示されるデータに適用される95%信頼区間を使用して検証することができます。 (C)に見られる応答は、 図9のBに表示される応答に似ています。
Discussion
テクニックは、このようにデータ処理に必要な研究時間を最小限に抑え、短いトレーニング時間で、急速に差別タスクの範囲をテストし、実質的な自動化を可能にするための手段を提供するここで説明する。移植心電図から得られたデータを、刺激提示のタイミングで心拍数(HR)の変化の計算を自動化することができます使用します。彼らは非常に短い期間のために明らかに心拍数の見かけ上大きな変化を生成し、そのような簡単なエラー検出は、時間のかかる手動のデータのレビューのために要件を最小限に抑えることがECG処理中にエラー(例えば、単一のハートビートの欠落など)を容易に識別することができます。
ECGテレメトリ装置の注入のために説明する手法は一貫してほとんど、あるいは全く干渉の録音を( 図1&2を参照)を生成します。しかし、縦隔地域でのリードの配置は比較的小さなバリエーションが近くの筋肉からの干渉につながることができますsおよび特定の呼吸に関連したノイズ。特に場所にリードを縫合した後、注入プロセスの間にリード線の正しい配置を確認し、リード配置の微調整は、干渉を最小限に抑えることができます。
蝸牛神経核への脳移植のプロセスは困難である。バンドパスフィルタをいくつかの周波数範囲のノイズではなく、広帯域ノイズとして、以前に3を使用されているのシリアルプレゼンテーションを使用することにより、電極部位での細胞集団の応答は急速に周波数応答ではなく、以下の固有のノイズの観点から検討することができます応答。周波数同調細胞集団の十分な範囲にアクセスできる場合に迅速に識別する能力は、電気刺激の弁別がテストされている研究において重要である。不十分な周波数分布が得られる場合には、異なる周波数域の刺激間の比較は単純にはできません。それにもかかわらず、長いプロセス周波数 - 振幅応答マッピングの細胞集団のチューニングの広に関する詳細を提供するために重要なままで、代わりに電極を固定する前に実行する必要があります。
行動訓練とテストでは、刺激開始前に試験の間の非刺激(またはサイレント)の期間を含めると、初期刺激の発症への対応を検討することができます。電気的神経刺激を使用する場合は、刺激の発症への応答は、刺激の単純な検出のための証拠を提供しています。したがって、どんな刺激開始応答、2回目の交互刺激が導入された応答が存在しない場合、それは後者のみ刺激を検出することができる推定することができます。このようなサイレント期間を含めることなく、元の刺激が検出されなかったことを決定する方法はありません。
この行動試験法の制限は、フットショックの不在がneuraのプレゼンテーション後に配信することです。音響刺激が提示されたときにLの刺激が恐怖条件で特異性の開発につながる可能性があり、そのような恐怖にのみ発現している。つまり、動物は、神経刺激の特定の感覚の影響が足の衝撃を受けていないに関連付けられていることを学ぶことができます。対照的に、神経刺激の提示後、足の衝撃を提供することは神経の刺激が持つかもしれない音のような特性とは異なる神経刺激自体の恐怖条件につながる可能性があります。神経刺激後のフットショックを除いたときに得られた結果は確かに恐怖条件はアコースティックから神経刺激に一般化されている前者の場合のように、神経刺激後のフットショックを使っている人よりも音のようである神経刺激のための強力な証拠を提供しています。それにもかかわらず、アコースティックではなく、神経刺激に特異性を発症するリスクが存在しています。音響刺激ではなく、純粋なトーンバーストとしてバンドパスフィルタされるノイズを使用し、そのうちの前者開発などの特異性のリスクを減らすことができる優れた、神経刺激の知覚経験を反映するかもしれません。しかし、このような手順では、差別のタスクに影響を与えるフィルタの帯域幅の追加の変数が導入されています。
そのような行動テストのために必要に応じて、任意の慢性的な神経移植に関連付けられた追加の制限は、時間の経過とともに電極または関連する神経組織の機能の変化である。神経組織の刺激は、細胞の損失14と電極への直接の脳組織の応答として、神経活動の13組織変更の一時的な抑制の両方につながることができます15。
注入に説明したアプローチと行動テストは簡単な訓練、試験周波数の制御を行使する能力を音と電気刺激の検出と識別の両方をテストする手段を提供します。 measurとHRの変化を用いる手法恐怖条件付けの電子は、聴覚検査のみならず、しかし、より一般的に刺激を任意の離散期間のために提示することができ、どの感覚で差別の検出が望まれる任意の官能検査にも適用可能である。
Disclosures
博士アントニオパオリーニは、タッカーデービステクノロジーズとNeuroNexusプローブのオーストラリア代理店のためのオーストラリア代表であるBioengenesis技術Pty Ltdのディレクターです。
Acknowledgments
この研究のための資金は、ガーネットパスとロドニー·ウィリアムズ記念財団とラ·トローブ大学によって提供されました。
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



