Summary
Elegan <em> Caenorhabditis </ em> הוא מודל שימושי כדי לחקור את הפונקציות של חומצות שומן רב בלתי רוויות בפיתוח ופיזיולוגיה. פרוטוקול זה מתאר שיטה יעילה להשלמת ג <em> elegans </ em> דיאטה עם חומצות שומן רב בלתי רוויות.
Abstract
חומצות שומן חיוניות לתפקודים תאיים רבים. הם משמשים מולקולות אחסון אנרגיה יעילה כמו, מרכיבים את הליבה ההידרופובי של ממברנות, ולהשתתף במסלולי איתות שונים. Caenorhabditis elegans מסנתז את כל האנזימים הדרושים לייצור מגוון של חומצות אומגה -6 ואומגה -3. זה, בשילוב עם האנטומיה ומגוון של כלים גנטיים זמינים הפשוטים, להפוך אותו למודל אטרקטיבי ללמוד לתפקד של חומצות שומן. על מנת לחקור את המסלולים הגנטיים המתווכים את ההשפעות הפיזיולוגיות של חומצות שומן בתזונה, פיתחנו שיטה כדי להשלים את ג דיאטת elegans עם חומצות שומן בלתי רוויות. תוספת היא אמצעי יעיל כדי לשנות את הרכב חומצות שומן של תולעים ויכולה לשמש גם כדי להציל את הפגמים במוטנטים חומצת שומן לקוי. השיטה שלנו משתמשת באגר נמטודות צמיחה הבינוני (NGM) בתוספת מלחי acidsodium השומן. חומצות השומן בתוספת הצלחות הפכו incorporaטד לממברנות של מקור החיידקים שבמזון, אשר לאחר מכן הוא נלקח על ידי ג elegans שניזונים מהחיידקים בתוספת. גם אנו מתארים פרוטוקול גז כרומטוגרפיה לעקוב אחר השינויים בהרכב חומצות שומן המתרחשים בתולעים בתוספת. זוהי דרך יעילה כדי להשלים את התזונה של אוכלוסיות קטנות וגדולות של ג elegans, המאפשר מגוון רחב של יישומים לשיטה זו.
Introduction
חומצות שומן הם מרכיבים חיוניים מבניים של ממברנות, כמו גם מולקולות אחסון אנרגיה יעילה. בנוסף, יכולות להיות ביקע חומצות שומן מקרומים תאיים על ידי lipases ולהיות שונה אנזימים כדי לייצר effectors איתות 1. חומצות שומן רב בלתי רוויות באופן טבעי (PUFAs) מכילות שניים או יותר קשרים כפולים cis. אומגה 3, חומצות השומן וחומצות שומן אומגה 6 נבדלות זה מזה המבוססים על עמדותיהם של קשרים כפולים ביחס לסוף מתיל של חומצת השומן. תזונה בריאה דורשת שתי אומגה 3, חומצות שומן אומגה 6 ו. עם זאת, תזונה מערבית עשירה במיוחד באומגה 6 וחומצות שומן ודלות באומגה 3, חומצות שומן. גבוהה של אומגה 6 לאומגה 3 יחס חומצת שומן קשורה לסיכון מוגבר למחלות לב וכלי דם ודלקת, עם זאת, הפונקציות מועילות ומזיקות המדויקים של חומצות שומן מסוימות אינן מובנות 2 כן. Elega Caenorhabditis התולעת העגולהNS הוא שימושי בחקר התפקוד של חומצות שומן כי זה מסנתז את כל האנזימים הדרושים לייצור מגוון של חומצות אומגה -6 ואומגה -3, כולל desaturase אומגה 3, פעילות שאינה קיים ברוב בעלי החיים 3,4. מוטנטים חסרי אנזימי desaturase חומצת שומן מצליחים לייצר PUFAs הספציפית, מה שמוביל למגוון של ליקויים התפתחותיים ונוירולוגי 4-6.
כדי לחקור את ההשפעות הפיזיולוגיות של חומצות שומן בתזונה, פיתחנו assay ביוכימיים בקנה אחד עם ניתוח גנטי הן באמצעות מוטציה וטכניקות לדפוק למטה RNAi בג elegans. תוספת של PUFAs הספציפית מושגת על ידי הוספת תמיסת מלח נתרן חומצת שומן למדיום אגר לפני המזיגה. התוצאה היא ספיגת PUFA על ידי א ' מקור מזון coli, שבו הוא מצטבר בקרומים חיידקיים. ג elegans לבלוע חיידקי PUFA המכיל, ותוספי תזונה די בכך כדי להציל את defects של מוטציות PUFA לקויות. תוספת של רוב חומצות שומן אין השפעות מזיקות על בעלי חיים מסוג בר, לעומת זאת, חומצות ספציפיות אומגה 6 וחומצות שומן, במיוחד חומצת dihomo גמא לינולנית (DGLA, 20:03 n-6) גורם להרס קבוע של ג תאי נבט elegans 7,8.
גז כרומטוגרפיה משמשת כדי לפקח על הספיגה של חומצות שומן בתוספת במקור חיידקי מזון (או OP50 או HT115), כמו גם בנמטודות. התוספת של Tergitol חומר הניקוי (NP-40) בתקשורת מאפשרת חלוקה שווה של חומצות שומן דרך כל הצלחת והספיגה יעילה יותר של חומצות שומן על ידי א ' coli ונמטודות. מצאנו כי חומצות שומן בלתי רוויות נלקחות בקלות על ידי חיידקים וג elegans, אבל הספיגה של חומצות שומן רוויות היא הרבה פחות יעיל. מאמר זה יתאר צעד אחר צעד כיצד להשלים את התקשורת אגר עם חומצות שומן, כמו גם כיצד לפקח על ספיגת חומצת שומן בהנמטודות דואר באמצעות גז כרומטוגרפיה.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
חומצות שומן רב בלתי רוויות הן רגישות לחום, אור וחמצן. לכן, יש להקפיד בעת הכנת צלחות תוספי חומצת שומן כך שחומצות שומן אינן חשופות לחום והאור עודפים. תקשורת NGM מכילה 0.1% Tergitol (NP-40) היא autoclaved ומקורר באופן חלקי, לאחר שמלחי נתרן חומצת שומן נוספים עם ערבוב מתמיד. הצלחות להתייבש בחושך. ספיגה של חומצות שומן על ידי ג elegans תרבית על צלחות אלה אז יכולים להיות במעקב על ידי גז כרומטוגרפיה.
1. הכנה של חומצות שומן בתוספת תקשורת
- למדוד את רכיבי תקשורת לבקבוק בגודל מתאים. לכל 1 ליטר, להוסיף 17 גרם Bacto-אגר, 2.5 tryptone גרם, 3 גרם NaCl, 1 מיליליטר כולסטרול 5 מ"ג / מיליליטר מומס באתנול, ו10 מיליליטר 10% Tergitol מומסים במים.
- הוסף 80% מנפח רצוי הסופי של המים Millipore וחיטוי התקשורת יחד עם בקבוקי זכוכית ריקה (שווה למספר שונהריכוז חומצות שומן להיבדק), כמו גם מתאים סיים צילינדרים.
- מדיה מגניב באמבט מים מוגדר 55 ° C. בעוד התקשורת היא הקירור להכין פתרון המניות החוזרת בסך של מלח נתרן של חומצות שומן על ידי שבירה הפתוחה בקבוקון הזכוכית, תוך שימוש באמצעי בטיחות ולהבטיח חלקיקי זכוכית לא מתערבבים עם חומצות השומן. לשקול את חומצת שומן מספיק כדי להפוך את המניה עובדת 100 מ"מ.
- תביא את פתרון חומצת שומן לריכוז סופי של במים מטוהרים 100 מ"מ. מלא המסת מלח נתרן חומצת שומן בדרך כלל לוקחת בערך 20-30 דקות. טהר את המניות החוזרות של חומצת שומן עם ארגון או חנקן, בגלל מגע עם גז אינרטי מונע חמצון. מכסה את הבקבוקון ולאחסן את המניה עובדת בחושך עד התקשורת התקררה.
- (אופציונאלי) אם תקשורת RNAi היא רצויה, למדוד אמפיצילין ופתרונות איזופרופיל β-D-1-thiogalactopyranoside (IPTG) כאן.
- כאשר אגר מתקרר ל55 ° C להוסיף לL 1: 1מיליליטר של 1 M MgSO 4, 1 מיליליטר של 1 M CaCl 2, ו25 מיליליטר של חיץ פוספט (ז KH 108.3 2 PO 4 ו35.6 g K 2 HPO 4 לL 1 autoclaved). הוסף את אמפיצילין מעוקר המסנן ופתרונות IPTG אם עושה צלחות RNAi. לכל סוגי צלחות, להוסיף מים סטריליים כדי להביא את הנפח הסופי תקשורת ל1 ל '
- ליד להבה, להעביר את התקשורת לautoclaved והגודל מתאים גליל סיים ולאחר מכן להוסיף את המים סטריליים חמים לעצמה רצויה. להעביר את התקשורת בחזרה לבקבוק ראשוני ומערבבים על ידי ערבוב.
- ליד להבה, להעביר את התקשורת למספר הבקבוקים שווים למספר של ריכוזים להיבדק על ידי מדידה עם autoclaved וגודל מתאים גליל סיים. לשמור על תקשורת aliquoted כנוזלי באמצעות אמבט מים עד שהמנייה פועלת חומצת השומן נמסה באופן מלא.
- הנח בקבוק אחד בצלחת ומערבבים ומערבבים עד שהתקשורת היא חמה למגע, אך לא חמה. הקפד להשאיר את עצמך מספיקזמן לבחוש בפתרון מניות חומצת שומן ויוצקים צלחות לפני התקשורת מתחילה לחזק. אם צלחת ומערבבים יש בקרת טמפרטורה, להגדיר אותו 55 ° C.
- לדלל את המניות פועלות חומצת שומן 100 מ"מ לתוך התקשורת לריכוז הסופי הרצוי. תקשורת ומערבבים עד שהמשקע הלבן היא בפתרון (כ 1 דק '). תקשורת עדיין עשויה להיות מעט מעונן לאחר מכן.
- (אופציונאלי) אם תקשורת RNAi היא רצויה אמפיצילין תוספת ל0.1 מ"ג / מיליליטר ו IPTG ל2 מ"מ ריכוז סופי.
- יוצקים תקשורת באמצעות סיוע פיפטה אוטומטית וטפטף מיליליטר סטרילי 25, והוסיף 8 מיליליטר של תקשורת ל60 צלחת מ"מ או 25 מיליליטר של תקשורת לכל 100 צלחת מ"מ. חזור בנוסף חומצת שומן וצלחת לשפוך צעדים לבקבוקים שנותרו.
- לאחר אגר יש הקרושה, לכסות את הצלחות בתוספת חומצת שומן עם תיבה או לאחסן בטמפרטורת חדר במגירה פרקה היטב כדי להגן מפני התחמצנות אור.
- זרע E. coli OP50 לצלחות יומיים לאחר הצלחות התייבשו.לצלחות 60 מ"מ, פיפטה 300 μl של תרבות לילה OP50 (גדלה על 37 מעלות צלזיוס). אם צלחות RNAi נוצקו, זרע עם 300 μl של חיידקי RNAi לאחר הצלחות התייבשו במשך ארבעה ימים. זמן ייבוש פלייט ייתכן שיצטרך להיות מותאם, בשל הבדלים בלחות בסביבות מעבדה שונות.
- דגירה הצלחות בסביבה חשוכה בטמפרטורת חדר ואילו דשא החיידקים מתייבש.
2. גרימת הרס תאים נבט על ידי תוספת של DGLA
- C. elegans גדל על צלחות המכילות 0.3 מ"מ DGLA (20:03 n-6) הפך עקר בשל ההרס של תאי נבט בשני נמטודות הבמה והמבוגר הזחל.
- הכן את אוכלוסייה מסונכרנת של זחלי L1 ידי טיפול הרמפרודיטים הרה להולדת עם פתרון היפוכלוריט אלקליין (לפתרון 10 מיליליטר: 0.5 מיליליטר של 5M NaOH, 2.5 מיליליטר של אקונומיקה, ו7 מיליליטר H 2 O). נער בעדינות את הרמפרודיטים הרה להולדת בפתרון זה עד שהתולעת הבוגרתים לפזר. ביצים יישמרו, וניתן pelleted על ידי צנטריפוגה במהירות הנמוכה.
- שטוף הכנת ביצה 3 פעמים בחיץ M9 (ז KH 3 2 PO 4, 6 גרם Na 2 HPO 4, 5 גרם NaCl, 1 מיליליטר 1 M MgSO 4, H 2 O ל 1 ל הוסף 4 MgSO לאחר מעוקר). כדי לספק מספיק חמצן, resuspend את הביצים בצינור פלסטיק 15 מיליליטר לנפח סופי של 5 מיליליטר של חיץ M9 ורוק על שייקר לילה.
- זחלי L1 יש להוסיף לצלחות בתוספת שני ימים לאחר זריעה עם OP50, או יום אחד לאחר ציפוי חיידקי RNAi. דגירה תולעים ב20 מעלות צלזיוס למשך שלושה ימים או עד שהם מגיעים לשלב הבוגר.
- תולעים בוגרות יכולות להיות הבקיע על סטריליות באמצעות מיקרוסקופ לנתח עם הגדלה גבוהה מספיק כדי לדמיין את העוברים המתפתחים ברחם. אובדן תאי נבט מוצלח יופיע כחלל רחם ברור של ביצים.
- יכולים גם להיות הבקיע תולעים על ידי תיקון וצביעה עם הגרעיןdiamindinophenylindole CID צבע (DAPI), המאפשר ההדמיה של גרעינים בתאי נבט ועוברים מתפתחים. כתם DAPI מהיר מושגת על ידי בחירת תולעים לירידה של חיץ M9 על watchglass 9.
- מבול שעון זכוכית עם 1 מיליליטר של 0.2 ng / m. DAPI ב95% אתנול פתרון, תנו לשבת במשך כ 5 דקות.
- פיק תולעים לירידה של Vectashield בשקופית, ולאחר מכן לכסות עם coverslip.
- coverslip החותם ולאחסן ב 4 מעלות צלזיוס בלילה החשוך עבור מכתים אופטימלי, עם זאת, ניתן גם לראות שקופיות באופן מיידי. ציון לקיומו או העדרו של גרעין תא חיידק באמצעות מיקרוסקופ פלואורסצנטי מצויד במנורת UV ומסנן.
3. המאשר את חומצת שומן ספיגה על ידי גז כרומטוגרפיה
הרכב חומצות שומן כולל של ג elegans יכול להיקבע על ידי ייצור אסטרים מתילים של חומצות שומן (fames) אשר לאחר מכן הם נפרדו ולכמת באמצעות Chr גזomatography 4.
- לאסוף 500-1,000 תולעים בוגרות על ידי שטיפתם מעל הצלחות עם מים והעברה לצינור silanized 13 מ"מ x 100 מ"מ בורג זכוכית עליון.
- בואו תולעים ליישב על ידי כוח הכבידה, ולאחר מכן להסיר כמה שיותר מים ככל האפשר עם זכוכית פיפטה פסטר.
- לשטוף תולעי פעם אחת עם מים, ולאחר מכן שוב להסיר כמה שיותר מים ככל האפשר.
- Fames נוצרים על ידי הוספת 1 מיליליטר של .2.5% H 2 SO 4 במתנול, ולאחר מכן חימום ב70 מעלות צלזיוס במשך שעה 1 באמבט מים.
- הסר את הצינורות מן אמבט המים ולקרר דקות 1.
- לחלץ fames ידי הוספת 1.5 מיליליטר מים ו0.25 מיליליטר של הקסאן.
- צינורות וRecap לנער במרץ.
- צנטריפוגה צינורות בצנטריפוגה קלינית שולחן 1 דקות במהירות המרבית כדי להפריד הקסאן מממס מימיים.
- העבר הקסאן (שכבה עליונה) כדי להוסיף בקבוקון GC בתוך בקבוקון GC, נזהר שלא להעביר כל השלב מימי. לGCnalysis, 1-2 μl של fames בהקסאן מוזרק על עמודת גז כרומטוגרפיה קוטב נימים מתאימה לניתוח fames. מזרק GC Agilent 7890 מוגדר ב250 מעלות צלזיוס, עם קצב זרימה של 1.4 מיליליטר / דקה, ותנור GC מתוכנת לטמפרטורה ההתחלתית של 130 ° C, המוחזקת על דקות 1. בהמשך לכך, הטמפרטורה היא ramped 10 ° C / min עד 190 מעלות צלזיוס, ולאחר מכן שוב בramped 5 ° C / min עד 210 מעלות צלזיוס והוחזקה במשך 1 דקות נוספות.
- כדי להבטיח ספיגה של DGLA אירעה, לנתח fames ידי זיהוי להבת יינון (FID) או ספקטרומטריית מסת זיהוי (MS), תוך שימוש בסטנדרטים אותנטיים לזיהוי ג elegans חומצות שומן.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
תוספת של ג דיאטת elegans היא מוגבלת על ידי יכולתו של מקור חיידקים שבמזון לספיג ולשלב חומצת שומן לתוך קרום החיידק. כדי לקבוע את היכולת של א ' coli OP50 להטמיע חומצות שומן שונות לקרומיו, OP50 היה מצופה על תקשורת ללא תוספת, 0.1 מ"מ ו0.3 ריכוזי מ"מ של חומצה סטארית (18:00), oleate נתרן (18:01 n-9), ונתרן DGLA (20 : 3N-6). צלחות היו יבשות בטמפרטורת חדר למשך 2 ימים בחושך, וטופחו על 20 מעלות צלזיוס במשך 3 ימים. מדשאות חיידקים נאספו על ידי בעדינות מגרד את הדשא למים עם מרית מעוקרת להבה. חיידקי pelleted ידי צנטריפוגה, וטופלו ב2.5% H 2 SO 4 במתנול כדי להפיק אסטרים מתילים של חומצות שומן, אשר נותחו על ידי GC / MS הבאה השיטות מפורטות בנוהל, שלב 3. התוצאות מראות כי חומצות שומן בלתי רווי (oleate וDGLA) לשלב OP50 בסכומים גבוהים יותר מאשר לא הוא רווי חומצת שומן חומצה סטארית (איור 1 א).
בנוסף, זחלי N2 שלב L1 גדלו באותה הקבוצה של צלחות בתוספת ושנקטפו לאחר צמיחת שלושה ימים ב20 ° C. תולעים נשטפו הנחה של הצלחות וחומצות שומן בסך הכל preps תולעת נותחו על ידי GC / MS. השינוי בחומצות שומן בתוספת בגרף באיור 1. מחקרים אלה הראו כי תוספת של חומצות שומן רוויות אינה משנה את הכמות היחסית של חומצות שומן רוויות ברקמות תולעת, בעוד שמתן תוספת של חומצות שומן בלתי רוויות העלתה את הכמויות היחסית של חומצות שומן בלתי רוויות בג שומני elegans. יחדיו, נתונים שמוצגים באיור 1 א 'ואיור 1 מראים כי ההצטברות היחסית של חומצות שומן בתוספת בג elegans קושר ישירות עם ההצטברות היחסית של חומצות שומן בתזונת E. coli.
e_content "> יש לנו הראינו בעבר כי DGLA התזונתי גורם לעקרות אצל C. elegans 10. איור 2 ממחיש את התגובה במינון של האינדוקציה DGLA של עקרות ב C. elegans. הריכוז של DGLA בשומני תולעת שבי 50% מהאוכלוסייה יהיו סטרילי הוא כ 12%. מעניין לציין, כי בתגובה לDGLA ניתן לשנות על ידי מוטציות גנטיות בC. elegans. ממצא האחרון הוא שמסלולי מתח הגורם תלוי צמיחת אינסולין יכולים לדכא את הרס תאי נבט-Induced DGLA 8. השלמת הדיאטה תולעים המכילים מוטציות מזיקות בכל קולטן אינסולין / IGF daf-2, DAF-2 (e1370), או גורם שעתוק daf-16/FOXO, (mu86) daf-16, ממחיש את התועלת של שיטה זו כדי לפענח מסלולים גנטיים השפעת שההשפעות הפיזיולוגיות של שומנים בתזונה. זחלים מסונכרן L1 היו pipetted על גבי מדיה DGLA להשלימו. אחרי 3-4 ימים של צמיחה, תולעים דורגולעקרות, כפי שנקבע על ידי היעדר הביצים ברחם של תולעים בוגרות. DGLA תוספת daf-2 מוטציות (e1370) היו פורה, עם לא מעט אובדן תאי נבט מושרה בהשוואה לסוג בר תולעים (N2) בשני 0.15 מ"מ ו0.3 supplementations מ"מ (איור 3). לעומת זאת, DGLA תוספת תולעים עם FOXO לא פעיל ((Mu86) daf-16) מוצג אחוז גבוה יותר של תולעי סטרילי בהשוואה לסוג בר כאשר נמאסו על צלחות המכילות 0.15 מ"מ DGLA (איור 3).
איור 1. ספיגה והטמעה של חומצות שומן בתוספת א ' coli OP50 וג elegans. א E. coli OP50 היה גדל על צלחות המכילות 0.1 מ"מ או 0.3 מ"מ חומצה סטארית, oleate נתרן, או DGLA נתרן, כמו גם צלחות בתוספת של האו"ם. לאחר FIVימי דואר של צמיחה על צלחות ב20 ° C, E. coli נקצרו ואסטרים מתילים של חומצות שומן נוצרו לניתוח על ידי GC / MS. בגלל OP50 אינו מייצר חומצה אולאית או DGLA, ומייצר כמויות רק עקבות של חומצה סטארית, אחוז של כל חומצת שומן בתוספת בE. שומני coli מגלה את היכולת של OP50 לשלב את חומצות שומן בתוספת. ברים שגיאה הם SD. ב '. שינוי בג elegans חומצות שומן בצעירים גדלו במשך שלושה ימים, החל בשלב L1, על E. coli צלחות המכילות 0.1 מ"מ או 0.3 מ"מ חומצה סטארית, oleate נתרן, או DGLA. הערכים לשינוי בחומצה סטארית וDGLA התקבלו על ידי הפחתת כמות היחסית של 18:00 או 20:03 בתולעים גדלו על צלחות בתוספת מאלו של תולעים גדלו על צלחות unsupplmented. כדי לפקח על ספיגה של חומצה אולאית, הסכום של חומצה אולאית ועוד במורד הזרם C20 PUFAs (20:03, 20:04 n-6, 20:04 n-3, ו20:05) חושבו בPLA בתוספת וunsupplemented tes, כי חומצה אולאית שולבה היא desaturated נוסף ומוארכת. ברים שגיאה הם SD. לחצו כאן לצפייה בתמונה גדולה יותר.

איור 2. ריכוזים הולך וגדל של DGLA בשומני תולעת לתאם עם עקרות הולכות וגוברות בג elegans. סוג Wild תולעים (N2) טופלו בריכוזים שונים של DGLA. DGLA% בסך שומני תולעת ו% מהאוכלוסייה שהיא סטרילי הוא להתוות להוא להתוות עבור 17 נקודות נתונים מחמישה ניסויי האכלה עצמאיים באמצעות ריכוזי DGLA תזונתיים הנעים 0-0.3 מ"מ DGLA. לחצו כאן לצפייה בתמונה גדולה יותר.
ether.within-page = "תמיד"> 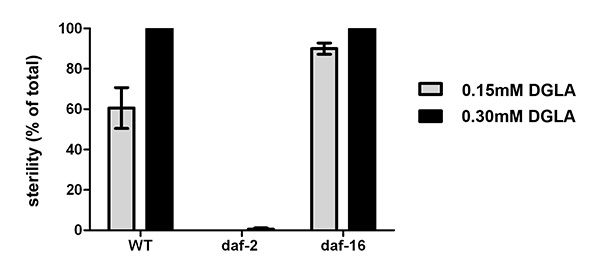
איור 3. השפעות פיסיולוגיות של השלמת ג elegans עם DGLA. סוג המורעב L1 זחל פראי, DAF-2 (e1370), או daf-16 (mu86) היו מצופה על-תוספת של האו"ם, 0.15 מ"מ או 0.3 מ"מ DGLA תוספת תקשורת וגדל עד לשלב הבוגר. לפחות 150 תולעים בודדים לאחר מכן דורגו על סטריליות. מוטציות daf-2 (e1370) היו כמעט פורה לחלוטין, אפילו ב0.3 מ"מ DGLA, ואילו מוטציות daf-16 (mu86) להציג מספר גדל של תולעי סטרילי בהשוואה לסוג בר ב0.15 מ"מ DGLA. ברים שגיאה הם SEM. לחצו כאן לצפייה בתמונה גדולה יותר.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
כאן אנו מתארים שיטה של תוספת של ג elegans עם חומצות שומן בלתי רוויות בתזונה. כפי שהוזכר לעיל, יש להקפיד בהכנת צלחות PUFA תוספת בגלל אופי התגובה של הקשרים כפולים בPUFAs גורם לחומצות שומן אלו להיות רגישות לחמצון באמצעות חום ו11 אור. כדי למנוע חמצון, חשוב להוסיף PUFA למדיום אגר הנוזלי לאחר שהתקשורת מקורר 55 מעלות צלזיוס וצלחות חנויות בסביבה חשוכה.
אחרים הציגו חומצות שומן חופשיות לג elegans באמצעות DMSO או ספק אתנול, או אחר ישירות על ידי הוספת חומצות שומן על ידי microinjection ל12-14 הפות. הצלה חלקית של פנוטיפים מוטציה הושגה על ידי תוספת של חומצות שומן מצלחות גידול ללא השימוש בTergitol (NP40) 14-15. יש כנראה מגוון של דרכים יעילות להציג את חומצת שומן לג elegans, למרות שהוא דיfficult כדי להשוות את היעילות של שיטות שונות, כי, ברוב הניסויים, את הספיגה של חומצות השומן בנמטודות לא הייתה במעקב. אנו מוצאים כי השיטה שלנו מאפשרת תוספת של חומצת שומן בלתי רוויה עקבית ויעילה לגודל אוכלוסייה של כמה נמטודות לעשרות אלפים.
מצאנו את זה חיוני כדי לפקח על הספיגה של חומצות שומן בתוספת בג elegans כדי לסייע בפרשנות של תוצאות ניסוי. למשל, הספיגה של חומצות שומן על ידי מזון החיידקים תלוי בE. זן חיידק המשמש כמקור מזון לנמטודות. מצאנו כי OP50 תופס כמויות גדולות יותר של חומצות שומן בלתי רוויות מE. coli זני HT115, HB101, או NA22, זנים המשמשים בדרך כלל להאכלת ניסויי RNAi (HT115) או משמשים לצמיחת נמטודות צפיפות גבוהה (HB101 וNA22). בגלל השינוי בספיגה של חומצות שומן מסוימות, חשוב לבדוק כמה ריכוזים של חומצות שומן וכדי לפקח על ספיגה באמצעות גז כרומטוגרפיה. רוב המעבדות השיגו הצלה של פנוטיפים מוטציה באמצעות ריכוז חומצות שומן בטווח של .08-0.2 מ"מ 5,6,15-18, עם זאת, השפעות על תוחלת חיים כבר דיווחו עם תוספת של חומצה הארכידונית בריכוז נמוך כמו 0.01 מ"מ 14 , ואחרים השתמשו במינונים גבוהים ככל 0.6 מ"מ להצלתו של פנוטיפ הנגרם על ידי האכלת RNAi באמצעות ה HT115 coli להתאמץ 19. בידיים, בתוספת של א coli OP50 עם ריכוזים גבוהים מאוד של PUFAs, גדול יותר מ0.4 מ"מ, לגרום להצטברות PUFA התזונתית מופרזת בשומני תולעת, עד 50% מכלל חומצות שומן. זה מוביל לצמיחה ספציפי וליקויים איטיים של הפות.
מגבלה של השיטה היא חוסר היכולת להשלים ביעילות עם חומצות שומן רוויות. נושאי מסיסות בעת הוספת התוסף לתקשורת, כמו גם את הספיגה וההטמעה של שבת לא יעילותחומצות שומן urated בE. coli להשאיר שיטה זו מתאימה יותר להשלמת חומצות שומן בלתי רוויות (איור 1).
השיטה שלנו מספקת תוספים לשחזור של חומצות מונו ושומן רב בלתי רווי, כולל חומצות שומן בדרך כלל לא מיוצרות על ידי ג elegans, כגון חומצת docosahexaenoic (DHA, 22:06 n-3). צמיחה ופגמים נוירולוגיים במוטנטים PUFA לקויים כגון שומן 3 יכולים להינצל על ידי רמות נמוכות היחסי של PUFA התזונתי 5. תוספי חומצת שומן יכולים להיות בשימוש על ידי חוקרים המבקשים לשנות את הרכב חומצות השומן של ג elegans באמצעות תזונה כדי ללמוד מגוון רחב של תהליכים פיסיולוגיים.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgments
אנו מודים לכריס ובסטר לביצוע הניסויים הראשוניים שמוצגים באיור 3 תוצאות הנציג וג'ייסון ווטס וכריס וובסטר על הערות מועילות על כתב היד. מימון למחקר זה מסופק על ידי מענק מהמכון הלאומי לבריאות (ארה"ב) (R01DK074114) לJLW. זני נמטודות חלקם משמשים בעבודה זו סופקו על ידי המרכז לגנטיקת Caenorhabditis, אשר ממומן על ידי משרד NIH של תוכניות תשתיות מחקר (OD010440 P40).
Materials
| Name | Company | Catalog Number | Comments |
| Bacto-Agar | Difco | 214010 | |
| Tryptone | Difco | 211705 | |
| NaCl | J.T. Baker | 3624-05 | |
| Tergitol | Sigma | NP40S-500mL | |
| Cholesterol | Sigma | C8667-25G | (5 mg/mL in ethanol) |
| MgSO4 | J.T. Baker | 2504-01 | |
| CaCl2 | J.T. Baker | 1311-01 | |
| K2HPO4 | J.T. Baker | 3254-05 | |
| KH2PO4 | J.T. Baker | 3246-05 | |
| Sodium dihomogamma linolenate | NuCHEK | S-1143 | |
| Warm sterile Millipore water | |||
| Sterile water for collecting worms | |||
| Nuclease-free Water for DGLA stock solution | Ambion | AM9932 | |
| Ampicillin | Fisher Scientific | BP1760-25 | 100 mg/ml in water (for RNAi plates) |
| Isopropyl-beta-D-thiogalactopyranoside (IPTG) | Gold Biotechnology | 12481C100 | 1 M in water (for RNAi plates) |
| HSO4 | J.T. Baker | 9681-03 | |
| Methanol | Fisher Scientific | A452-4 | |
| Hexane | Fisher Scientific | H302-4 | |
| diamindinophenylindole (DAPI) | Sigma | D9542 | |
| VectaShield | Vector Laboratories | H-1000 | |
| Glass Flask | Corning | 4980-2L | |
| Autoclaveable Glass bottles with stirbars | Fisherbrand | FB-800 | |
| Autoclaveable Glass Graduated Cylinder | Fisherbrand | 08-557 | |
| Stir Plate | VWR | 97042-642 | |
| Waterbath at 55+ °C | Precision Scientific Inc. | 66551 | |
| Screwcap Brown Glass Vial | Sun SRI | 200 494 | |
| Argon gas tank | |||
| Automated Pipette aid | Pipette-Aid | P-90297 | |
| Sterile Serological Pipettes (25 ml) | Corning | 4489 | |
| Bunsen Burner | VWR | 89038-534 | |
| Dissection microscope | Leica | TLB3000 | |
| Silanized glass tube | Thermo Scientific | STT-13100-S | for FAMEs derivitization |
| PTFE Screw caps | Kimble-Chase | 1493015D | |
| Clinical tabletop centrifuge | IEC | ||
| GC Crimp Vial | SUN SRi | 200 000 | |
| GC Vial Insert | SUN SRi | 200 232 | |
| GC Vial cap | SUN SRi | 200 100 | |
| Gas Chromatograph | Agilent | 7890A | |
| Mass Spectrometry Detector | Agilent | 5975C | |
| Column for gas chromatography | Suppelco | SP 2380 | 30 m x 0.25 mm fused silica capillary column |
References
- Haeggstrom, J. Z., Funk, C. D. Lipoxygenase and leukotriene pathways: biochemistry, biology, and roles in disease. Chem. Rev. 111, 5866-5898 (2011).
- de Lorgeril, M., Salen, P. New insights into the health effects of dietary saturated and omega-6 and omega-3 polyunsaturated fatty acids. BMC Med. 10, 50 (2012).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal omega-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proc. Natl. Acad. Sci. U.S.A. 94, 1142-1147 (1997).
- Watts, J. L., Browse, J. Genetic dissection of polyunsaturated fatty acid synthesis in Caenorhabditis elegans. Proc. Natl. Acad. Sci. U.S.A. 99, 5854-5859 (2002).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 Polyunsaturated Fatty Acids Cause Behavioral and Developmental Defects in Caenorhabditis elegans fat-3 Mutants. Genetics. 163, 581-589 (2003).
- Kahn-Kirby, A. H., et al. Specific Polyunsaturated Fatty Acids Drive TRPV-Dependent Sensory Signaling In Vivo. Cell. 119, 889-900 (2004).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PLoS Genet. 2, e108 (2006).
- Webster, C. M., Deline, M. L., Watts, J. L. Stress response pathways protect germ cells from omega-6 polyunsaturated fatty acid-mediated toxicity in Caenorhabditis elegans. Dev. Biol. 373, 14-25 (2013).
- Kadyk, L. C., Lambie, E. J., Kimble, J. glp-3 is required for mitosis and meiosis in the Caenorhabditis elegans germ line. Genetics. 145, 111-121 (1997).
- Watts, J. L., Browse, J. Dietary manipulation implicates lipid signaling in the regulation of germ cell maintenance in C. elegans. Dev. Biol. 292, 381-392 (2006).
- Pryor, W. A., Stanley, J. P., Blair, E. Autoxidation of polyunsaturated fatty acids: II. A suggested mechanism for the formation of TBA-reactive materials from prostaglandin-like endoperoxides. Lipids. 11, 370-379 (1976).
- Kniazeva, M., Shen, H., Euler, T., Wang, C., Han, M. Regulation of maternal phospholipid composition and IP(3)-dependent embryonic membrane dynamics by a specific fatty acid metabolic event in C. elegans. Genes Dev. 26, 554-566 (2012).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Dev. Cell. 19, 858-871 (2010).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. omega-6 Polyunsaturated fatty acids extend life span through the activation of autophagy. Genes Dev. 27, 429-440 (2013).
- Taubert, S., Van Gilst, M. R., Hansen, M., Yamamoto, K. R. A Mediator subunit, MDT-15, integrates regulation of fatty acid metabolism by NHR-49-dependent and -independent pathways in C. elegans. Genes Dev. 20, 1137-1149 (2006).
- Lesa, G. M., et al. Long chain polyunsaturated fatty acids are required for efficient neurotransmission in C. elegans. J. Cell Sci. 116, 4965-4975 (2003).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176, 865-875 (2007).
- Goudeau, J., et al. Fatty acid desaturation links germ cell loss to longevity through NHR-80/HNF4 in C. elegans. PLoS Biol. 9, e1000599 (2011).
- Yang, F., et al. An ARC/Mediator subunit required for SREBP control of cholesterol and lipid homeostasis. Nature. 442, 700-704 (2006).



