18.4:
Potentiels d'oxydoréduction
18.4:
Potentiels d'oxydoréduction
En comparant la réactivité de l’argent et du plomb, on observe que les deux espèces ioniques, Ag+ (aq) et Pb2+ (aq), affichent une différence dans leur réactivité redox envers le cuivre : l’ion argent subit une réduction spontanée, alors que l’ion plomb ne le fait pas. Cette activité redox relative peut être facilement quantifiée dans les cellules électrochimiques par une propriété appelée le potentiel de cellule. En électrochimie, on appelle généralement cette propriété la tension de la cellule et c’est une mesure de l’énergie qui accompagne le transfert de charge. Les potentiels sont mesurés en utilisant l’unité SI volts, définie comme un joule d’énergie par coulomb de charge. Ainsi,
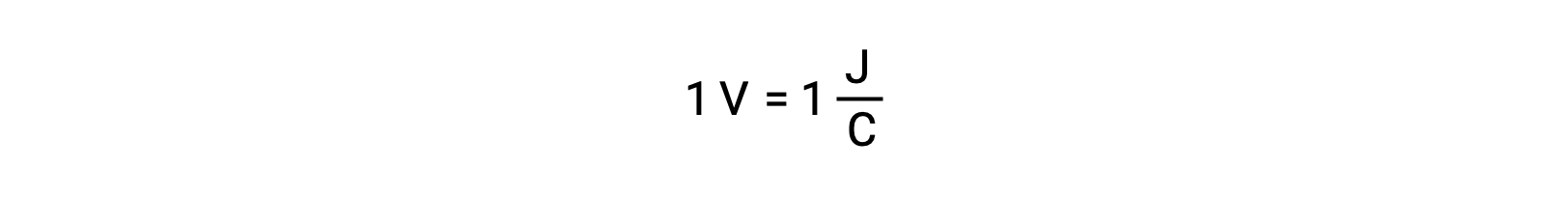
Potentiel d’électrode standard
Lorsqu’il est mesuré à des fins électrochimiques, le potentiel de cellule est une mesure de la force motrice pour un type précis de processus de transfert de charge, à savoir le transfert d’électrons entre les réactifs. Le potentiel d’une seule électrode ou d’une seule demi-cellule ne peut pas être mesuré car le transfert d’électrons nécessite un donneur et un receveur, ou respectivement un réducteur et un oxydant. Au lieu de cela, un potentiel de demi-cellule ne peut être mesuré que par rapport à une autre demi-cellule. Ainsi, il est seulement possible de mesurer la différence de potentiel entre deux demi-cellules, Ecellule, qui est définie comme

où Ecathode et Eanode représentent les potentiels de deux demi-cellules différentes fonctionnant respectivement comme cathode et anode. Le potentiel standard de cellule, E°cellule, est le potentiel de cellule mesuré aux conditions de l’état standard des deux demi-cellules ( c.-à-d., concentrations de 1 M, pressions de 1 bar, 298 K)

Pour calculer facilement les potentiels de demi-réaction, la communauté scientifique a désigné une demi-cellule particulière comme référence universelle pour toutes les mesures de potentiel de cellule, avec un potentiel de 0 V. Cette demi-cellule est connue sous le nom d’électrode standard à hydrogène (ESH), et elle est basée sur la demi-réaction ci-dessous :
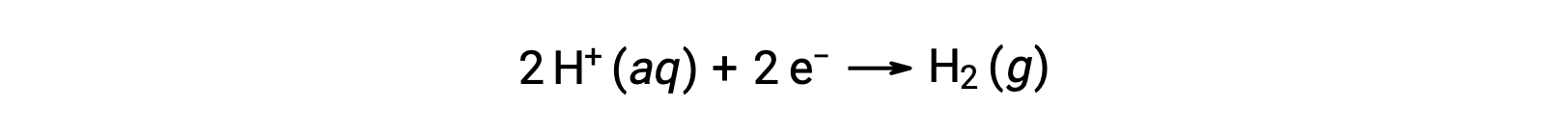
Généralement, l’ESH se compose d’une électrode en platine inerte qui est immergée dans 1 M de H+ aqueux avec un flux de gaz H2 barbottant à une pression de 1 bar, et maintenue à une température uniforme de 298 K. Le potentiel de l’électrode (EX) pour une demi-cellule X est donc défini comme le potentiel mesuré pour une cellule X, qui agit comme une cathode, tandis que l’ESH agit comme une anode.
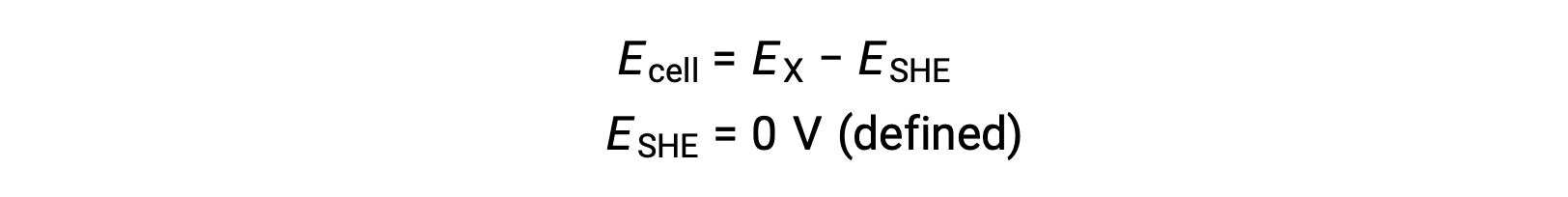
Par conséquent,
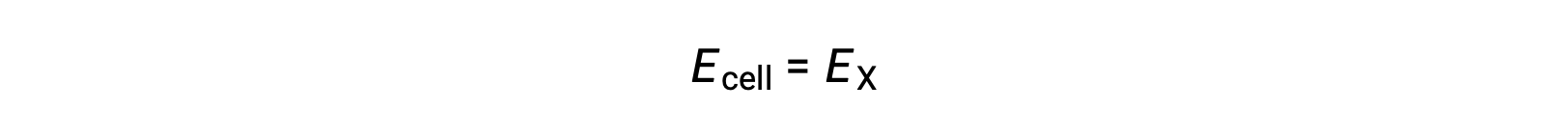
Dans des conditions d’état standard, le potentiel de la demi-cellule X est égal au potentiel standard d’électrode, E°X. Comme la définition du potentiel de cellule exige que les demi-cellules fonctionnent comme des cathodes, ces potentiels sont également appelés des potentiels de réduction standard.
Prévision de la spontanéité et du sens d’une réaction redox
Les potentiels de cellule et d’électrode dictent la spontanéité des réactions d’oxydoréduction. On observe que les réactions spontanées affichent un potentiel de cellule positif, alors que le processus non spontané affiche un potentiel de cellule négatif. Si la somme des potentiels d’électrode est positive, on dit que la réaction est spontanée. Les réactions des demi-cellules ayant un potentiel d’électrode positif se produisent dans le sens direct, alors que celles ayant des valeurs inférieures à l’électrode à hydrogène se produisent généralement dans l’ordre inverse.
Un oxydant plus fort présente un potentiel d’électrode standard, E°, plus grand. Comme les potentiels d’électrode mesurent le pouvoir réducteur, une augmentation de E° correspond à une force motrice accrue à l’origine de la réduction des espèces et à de meilleures capacités d’oxydation. Ainsi, E°cellule est positif lorsque E&176;cathode > E°anode.
Compte tenu de cela, on comprend pourquoi le cuivre est oxydé par l’argent, mais pas par le plomb :
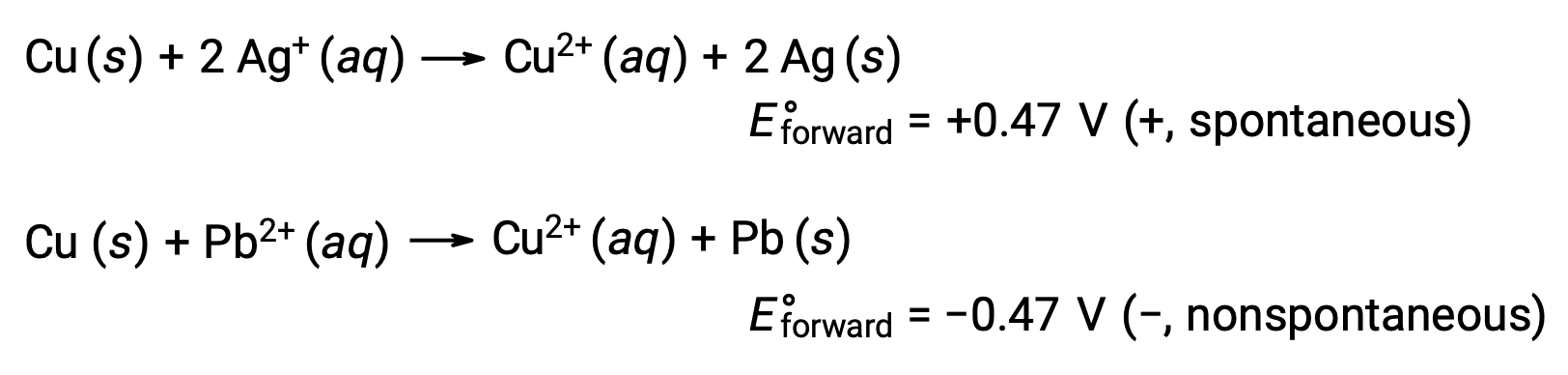
Prévision de la dissolution d’un métal dans les acides minéraux
Une des applications essentielles des potentiels de demi-cellules est de comprendre si un métal particulier va se dissoudre dans un acide minéral. La plupart des acides comme l’acide chlorhydrique dissolvent les métaux par la réduction des protons en hydrogène gazeux et l’oxydation des métaux en leurs ions respectifs. Dans le cas du zinc qui réagit avec l’acide chlorhydrique, la réaction est spontanée car le potentiel d’électrode standard du zinc est inférieur à celui de l’hydrogène. Toutefois, le cuivre ne réagit pas avec l’acide chlorhydrique en raison de son potentiel d’électrode plus élevé.
Ce texte est adapté de OpenStax, Chimie 2e, Section 17.3 : Potentiels d’électrode et de cellule.
