18.4:
標準電極電位
18.4:
標準電極電位
銀と鉛の反応性を比較すると、Ag+ (aq)とPb2+ (aq)という2種類のイオンは、銅に対する酸化還元反応性が異なり、銀イオンは自発的に還元されるが、鉛イオンは還元されないことがわかります。この相対的な酸化還元反応性は、電気化学的な系において、電極電位と呼ばれる値によって定量化することができます。これは、電荷移動に伴うエネルギーの尺度でもあります。電位はSI単位のボルトで測定され、1クーロンの電荷につき1ジュールのエネルギーと定義されます。このように、
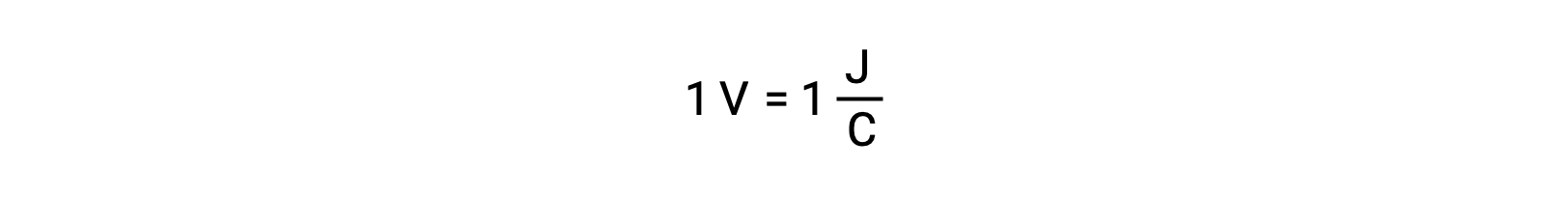
標準電極電位
電気化学測定を行う場合、電極電位は特定の種類の電荷移動プロセス、すなわち反応物間の電子移動の駆動力の尺度となります。電子移動には提供側と受け取り側、あるいは還元剤と酸化剤が必要なため、単一の電極や単一の半電池の電位は測定できません。その代わり、半電池の電位は、別の半電池との相対的な関係でしか測定できません。したがって、2つの半電池間の電位差Ecellを測定することしかできず、次のように定義されます。

ここで、EcathodeとEanodeは、それぞれカソードとアノードとして機能する2つの異なる半電池の電位を表します。標準的な電極電位であるE°cellは、両方の半電池が標準状態(すなわち、1 mol/Lの濃度、1 barの圧力、298 K)のときに測定された電極電位です。

半反応の電位を簡単に計算するために、すべての電極電位測定の普遍的な基準となるような、0 Vの電位を持つ特定の半電池が定義されています。この半電池は標準水素電極(SHE)と呼ばれ、以下の半反応に基づいています。
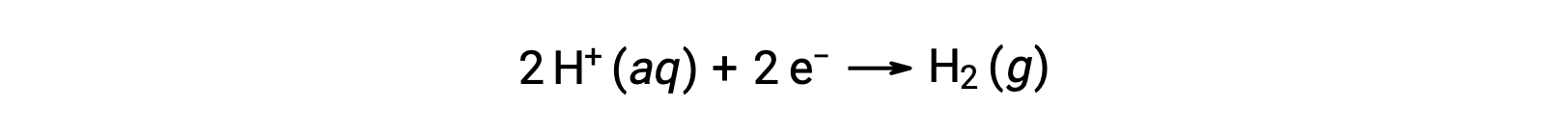
一般的なSHEは、1 mol/LのH+水溶液に浸さた不活性な白金電極からなり、水溶液中には1 barの圧力でバブリングしたH2ガスが流れており、温度は298 Kに保たれています。したがって、半電池Xの電極電位(EX)は、SHEが陽極として用いた際の、陰極として作用する半電池Xについて測定された電位として定義されます。
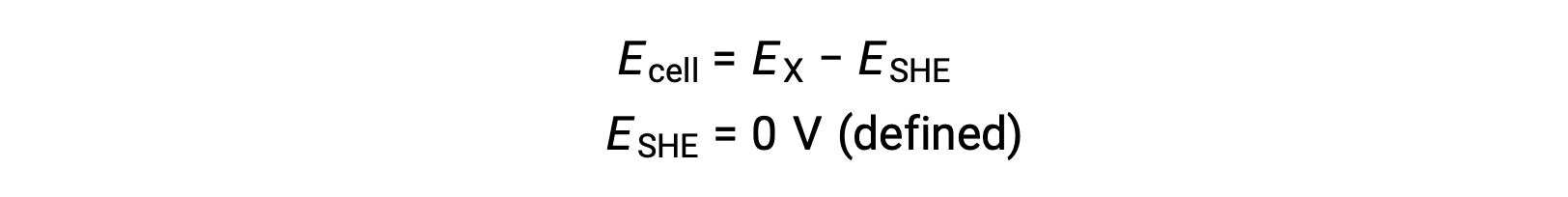
Therefore,
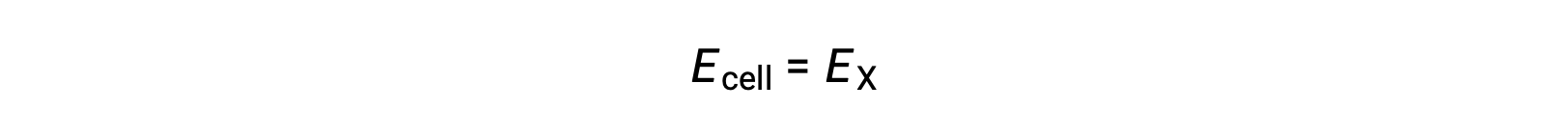
標準状態における半電池Xの電位は、標準電極電位E°Xと等しいです。電極電位の定義では、半電池が陰極として機能することが必要なため、これらの電位は標準還元電位とも呼ばれます。
酸化還元反応の自発性と方向性の予測
電池と電極の電位は、酸化還元反応の自発性を決定します。自発的な反応は正の電池電位を示し、非自発的な過程は負の電池電位を示します。電極電位の和が正であれば、その反応は自発生です。正の電極電位を持つ半反応は順方向に起こり、水素電極よりも小さな値を持つものは通常逆方向に起こります。
強い酸化剤は大きな標準電極電位E°を示します。E°が大きくなると、化学種が還元される力が大きくなり、酸化力が強くなることに対応します。したがって、E°cellは、E°cathode > E°anodeのときに正となります。
そう考えると、銅が銀により酸化されるが、鉛によっては酸化されないことも説明できます。
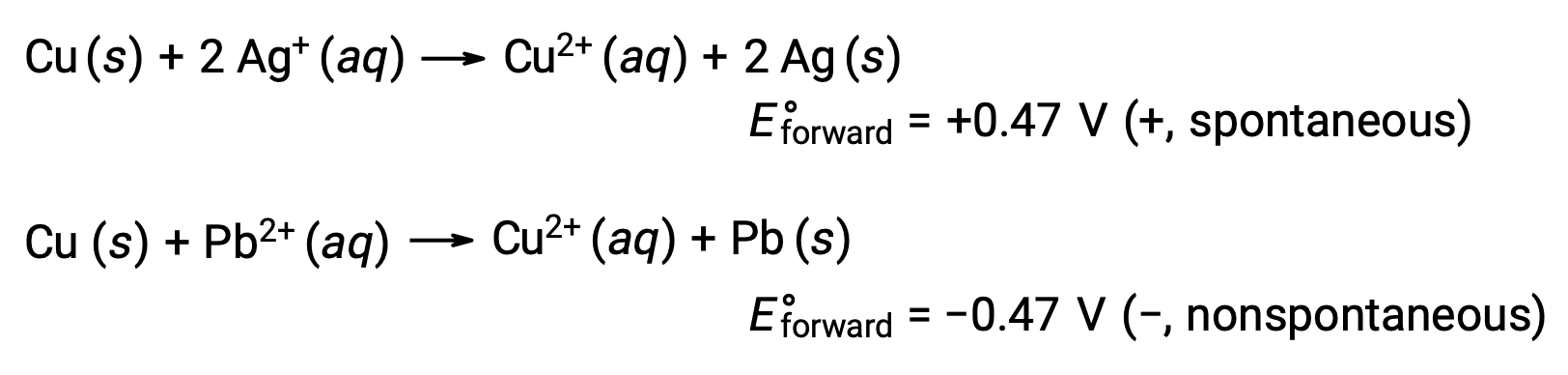
酸への金属の溶解の予測
半電池電位の重要な応用例として、ある金属が酸に溶けるかどうかを理解することが挙げられます。塩酸のようなほとんどの酸は、水素イオンが水素ガスに還元され、金属がそれぞれのイオンに酸化されることで金属が溶解します。亜鉛が塩酸と反応する場合、亜鉛の標準電極電位は水素の標準電極電位よりも低いため、反応は自発的に起こります。一方、銅は電極電位が高いため、塩酸とは反応しません。
上記の文章は以下から引用しました。 OpenStax, Chemistry 2e, Section 17.3: Electrode and Cell Potentials.
