18.4:
Potenciais Padrão de Eletrodos
18.4:
Potenciais Padrão de Eletrodos
Ao comparar a reatividade da prata com o chumbo, observa-se que as duas espécies iónicas, Ag+ (aq) e Pb2+ (aq), apresentam uma diferença na reatividade redox em relação ao cobre: o ião de prata sofre redução espontânea, enquanto que o ião de chumbo não. Essa atividade redox relativa pode ser facilmente quantificada em células eletroquímicas por uma propriedade chamada potencial celular. Esta propriedade é geralmente conhecida como voltagem da célula em eletroquímica, e é uma medida da energia que acompanha a transferência de carga. Os potenciais são medidos utilizando a unidade SI Volts, definida como um joule de energia por um coulomb de carga. Assim,
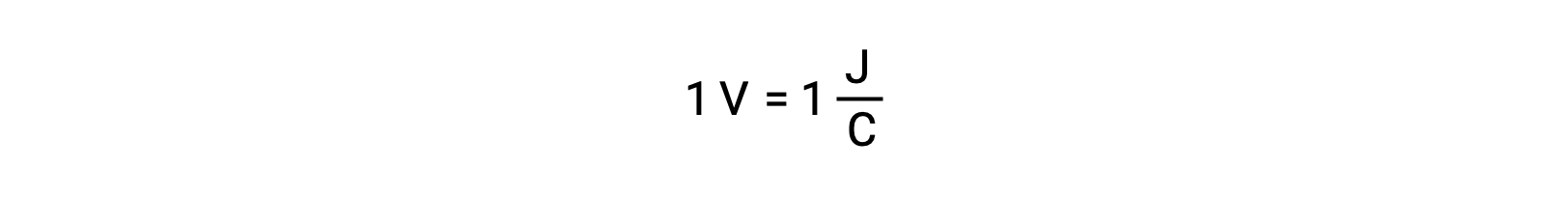
Potencial Padrão de Elétrodo
Quando medido para fins eletroquímicos, o potencial celular é uma medida da força motriz para um tipo específico de processos de transferência de carga, ou seja, a transferência de eletrões entre reagentes. O potencial de um único elétrodo ou de uma única semi-célula não pode ser medido uma vez que a transferência de eletrões requer um doador e um receptor ou um redutor e um oxidante, respectivamente. Em vez disso, um potencial de semi-célula só pode ser medido em relação a outra semi-célula. Assim, só é possível medir a diferença de potencial entre duas semi-células, Ecell, que é definida como

onde Ecátodo e Eânodo representam os potenciais de duas semi-células diferentes que funcionam como cátodo e ânodo, respectivamente. O potencial celular padrão, E°cell, é o potencial celular medido em condições de estado padrão de ambas as semi-células (ou seja, concentrações de 1 M, pressões de 1 bar, 298 K)

Para calcular facilmente potenciais de meia-reação, a comunidade científica designou uma semi-célula específica para servir como referência universal para todas as medições de potencial celular, com potencial de 0 V. Essa semi-célula é conhecida como o elétrodo padrão de hidrogénio (SHE), e é baseada na semi-reação abaixo:
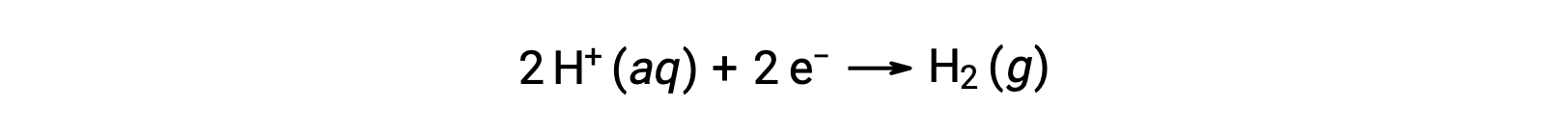
No geral, SHE consiste em um elétrodo de platina inerte, imerso em 1 M de H+ aquoso, com um fluxo de H2 gasoso borbulhante a uma pressão de 1 bar, mantida a uma temperatura uniforme de 298 K. O potencial do elétrodo (EX) para uma semi-célula X é então definido como o potencial medido para uma célula X, que actua como um cátodo, enquanto que SHE actua como ânodo.
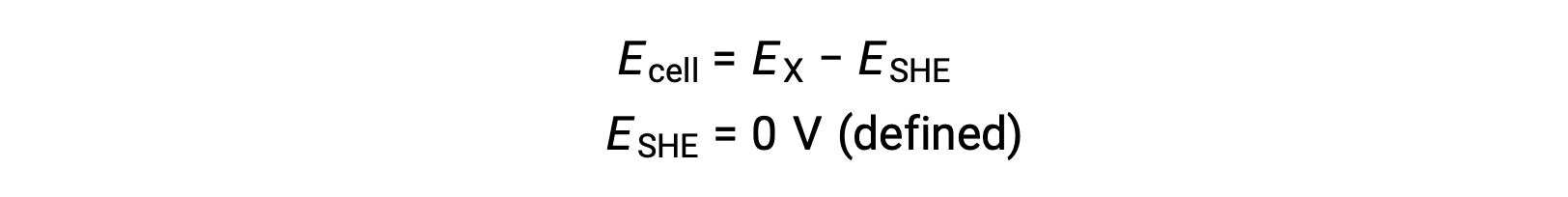
Por conseguinte,
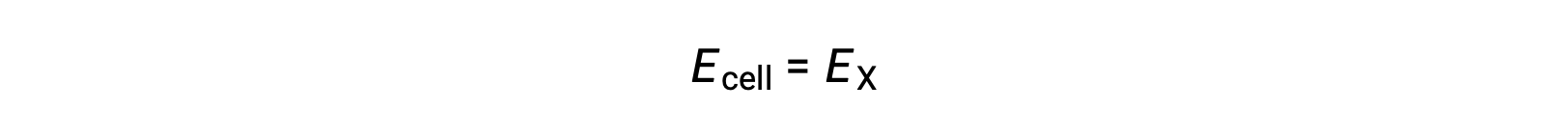
Em condições de estado padrão, o potencial da semi-célula X é igual ao potencial padrão do elétrodo, E°X. Como a definição de potencial celular requer que as semi-células funcionem como cátodos, esses potenciais também são chamados de potenciais padrão de redução.
Previsão da Espontaneidade e Direção de uma Reação Redox
Os potenciais das células e dos eléctrodos ditam a espontaneidade das reações redox. Observa-se que as reações espontâneas mostram um potencial celular positivo, enquanto que o processo não espontâneo mostra um potencial celular negativo. Se a soma dos potenciais dos elétrodos for positiva, a reação será espontânea. Reações de semi-célula com potencial de elétrodo positivo ocorrem na direção direta, enquanto que aquelas com valores menores que o elétrodo de hidrogénio geralmente ocorrem na ordem inversa.
Um oxidante mais forte apresenta um maior potencial padrão de elétrodo, E°. Como os potenciais de elétrodos medem a capacidade de redução, um aumento de E° corresponde a uma força motriz maior por trás da redução da espécie e melhores habilidades oxidantes. Assim, E°cell é positivo quando E°cátodo > E°ânodo.
Considerando isto, é explicado porque o cobre é oxidado pela prata, mas não pelo chumbo:
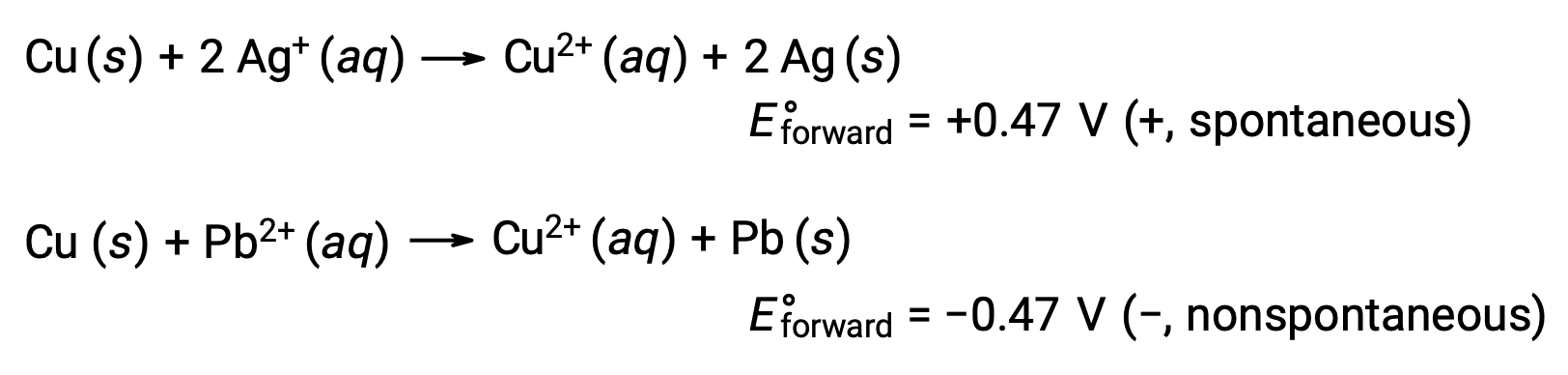
Previsão da Dissolução de Metal em Ácidos Minerais
Uma das aplicações essenciais dos potenciais de semi-células é compreender se um determinado metal se dissolverá em ácido mineral. A maioria dos ácidos, como o ácido clorídrico, dissolve metais através da redução de protões para hidrogénio gasoso e oxidação de metais para os respectivos iões. No caso do zinco a reagir com ácido clorídrico, a reação é espontânea, uma vez que o potencial padrão do elétrodo de zinco é inferior ao do hidrogénio. No entanto, o cobre não reage com o ácido clorídrico devido ao seu potencial de elétrodo mais elevado.
Este texto é adaptado de OpenStax, Chemistry 2e, Section 17.3: Electrode and Cell Potentials.
