18.4:
Standart Elektrot Potansiyelleri
18.4:
Standart Elektrot Potansiyelleri
Gümüş ve kurşunun reaktivitesini karşılaştırırken, iki iyonik türün, Ag+(aq) ve Pb+2(aq), bakıra karşı redoks reaktivitesinde bir fark gösterdiği görülmektedir: gümüş iyonu kendiliğinden azalmaya maruz kalırken, kurşun iyonu azalmaz. Bu göreceli redoks aktivitesi, elektrokimyasal hücrelerde, hücre potansiyeli adı verilen bir özellik tarafından kolayca ölçülebilir. Bu özellik genellikle elektrokimyada hücre voltajı olarak bilinir ve yük transferine eşlik eden enerjinin bir ölçüsüdür. Potansiyeller, bir coulomb yük başına bir joule enerji olarak tanımlanan SI birimi Volt kullanılarak ölçülür. Böylelikle,
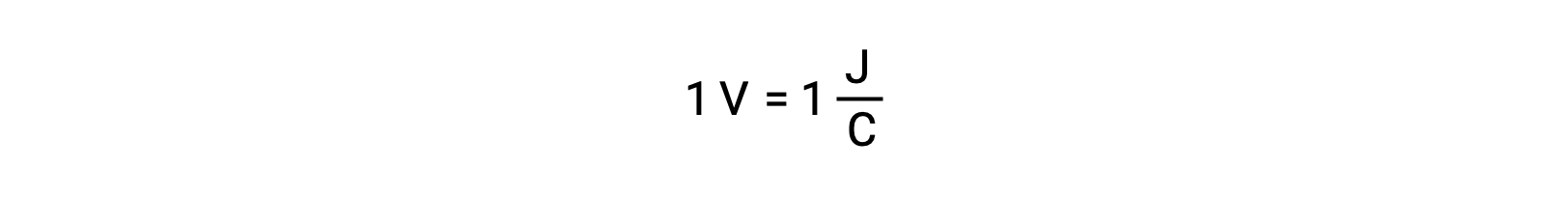
Standart Elektrot Potansiyeli
Elektrokimyasal amaçlar için ölçüldüğünde, hücre potansiyeli, belirli bir yük transfer işlemi türü yani reaktanlar arasındaki elektron transferi için itici gücün bir ölçüsüdür. Tek bir elektrotun veya tek bir hücrenin potansiyeli, elektron transferi olarak bir donör ve alıcı veya bir redüktör ve bir oksidan gerektirdiği için ölçülemez. Bunun yerine, bir yarım hücre potansiyeli sadece başka bir yarım hücreye göre ölçülebilir. Bu nedenle, sadece iki yarım hücre arasındaki potansiyel farkı ölçmek mümkündür, Ehücre, olarak tanımlanan

burada Ekatot ve Eanot, sırasıyla katot ve anot olarak işlev gören iki farklı yarım hücrenin potansiyellerini temsil eder. Standart hücre potansiyeli, E°hücre, her iki yarım hücrenin standart durum koşullarında ölçülen hücre potansiyelidir ( yani, 1 m konsantrasyonları, 1 bar basınçları, 298 K)

Yarı reaksiyon potansiyellerini kolayca hesaplamak için, bilimsel topluluk, 0 V potansiyeli olan tüm hücre potansiyeli ölçümleri için evrensel bir referans olarak hizmet etmek üzere belirli bir yarım hücre belirlenmiştir. Bu yarı hücre standart hidrojen elektrodu (SHE) olarak bilinir ve aşağıdaki yarı reaksiyona dayanır:
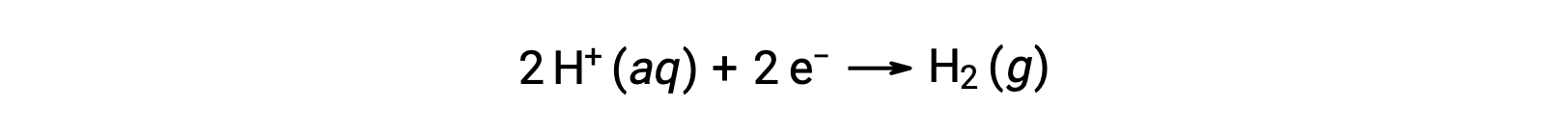
Tipik olarak, 1 M sulu H+‘ya daldırılmış, 1 bar basınçta köpüren H2 gazı akışı ile 298 K’lik bir üniform sıcaklıkta tutulan inert bir platin elektrottan oluşur. Bu nedenle, bir yarım hücre X için elektrot potansiyeli (EX), bir katot görevi gören bir hücre X için ölçülen potansiyel olarak tanımlanırken, SHE bir anot görevi görür.
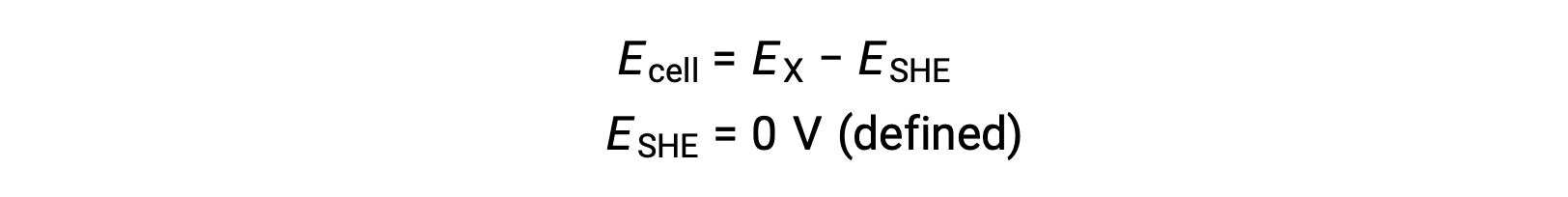
Bu nedenle,
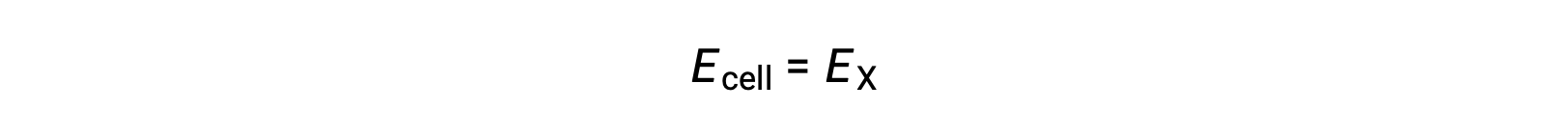
Standart durum koşulları altında, yarım hücre X’in potansiyeli standart elektrot potansiyeli olan E°X‘e eşittir. Hücre potansiyelinin tanımı, yarı hücrelerin, katot olarak işlev görmesini gerektirdiğinden, bu potansiyellere standart indirgeme potansiyelleri de denir.
Spontanlık Tahmini ve Redoks Reaksiyonunun Yönü
Hücre ve elektrot potansiyelleri redoks reaksiyonlarının spontanlığını belirler. Spontan reaksiyonların pozitif bir hücre potansiyeli gösterdiği, spontan olmayan sürecin ise negatif bir hücre potansiyeli gösterdiği görülmektedir. Elektrot potansiyellerinin toplamı pozitif ise, reaksiyonun spontan olduğu söylenir. Pozitif elektrot potansiyeline sahip yarı hücre reaksiyonları ileri yönde meydana gelirken, hidrojen elektrotundan daha düşük değerlere sahip olanlar genellikle ters sırada meydana gelir.
Daha güçlü bir oksidan, daha büyük standart elektrot potansiyeli sergiler,E°. Elektrot potansiyelleri indirgeme kapasitesini ölçtüğü için, artan bir E°, türlerin azaltılmasının ve daha iyi oksitleyici yetilerin ardındaki artan bir itici güce karşılık gelir. Böylece,E°katot > E°anot olduğunda E°hücre pozitiftir.
Bunu göz önünde bulundurarak, bakırın neden gümüşle oksitlendiğini ancak kurşunla oksitlenmediğini açıklarız:
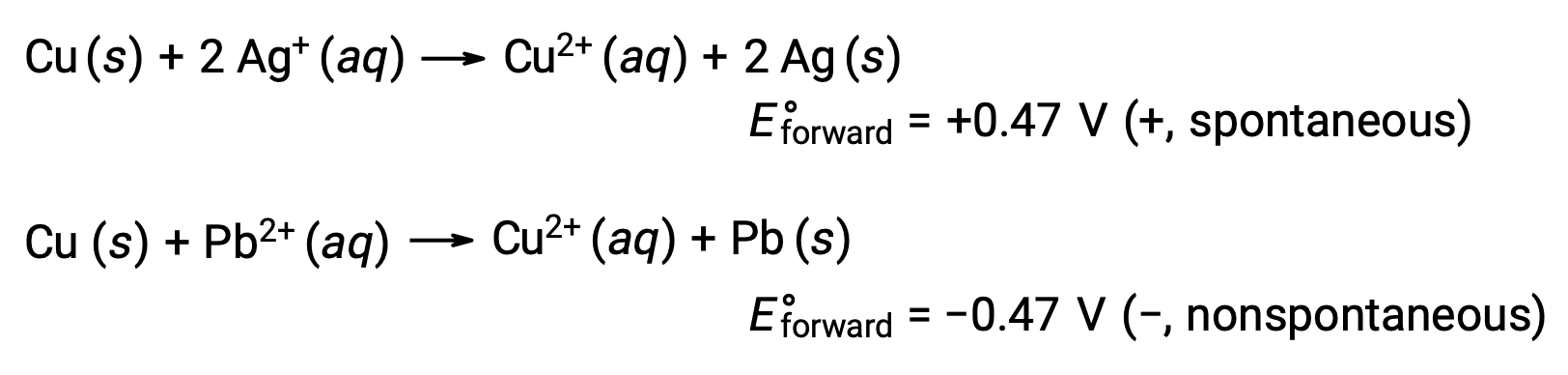
Mineral Asitlerde Metal Çözünmesinin Tahmini
Yarı hücre potansiyellerinin temel uygulamalarından biri, belirli bir metalin mineral asit içinde çözülüp çözülmeyeceğini anlamaktır. Hidroklorik asit gibi asitlerin çoğu, protonların hidrojen gazına indirgenmesi ve metallerin kendi iyonlarına oksidasyonu ile metalleri çözer. Çinkonun hidroklorik asit ile reaksiyona girmesi durumunda, çinkonun standart elektrot potansiyeli hidrojenden daha düşük olduğu için reaksiyon kendiliğinden gerçekleşir. Bununla birlikte, bakır, daha yüksek elektrot potansiyeli nedeniyle hidroklorik asit ile reaksiyona girmez.
Bu metin bu kaynaktan uyarlanmıştır: OpenStax, Chemistry 2e, Section 17.3: Electrode and Cell Potentials.
