18.4:
Potenciales de Electrodo Estándar
18.4:
Potenciales de Electrodo Estándar
Al comparar la reactividad de la plata y el plomo, se observa que las dos especies iónicas, Ag+ (ac) y Pb2+ (ac), muestran una diferencia en su reactividad redox hacia el cobre: El ion plata sufre una reducción espontánea, mientras que el ion plomo no. Esta actividad redox relativa puede cuantificarse fácilmente en las celdas electroquímicas por una propiedad llamada potencial de celda. Esta propiedad se conoce comúnmente como voltaje de celda en electroquímica, y es una medida de la energía que acompaña la transferencia de carga. Los potenciales se miden utilizando la unidad SI voltios, definidos como un joule de energía por una coulomb de carga. Así,
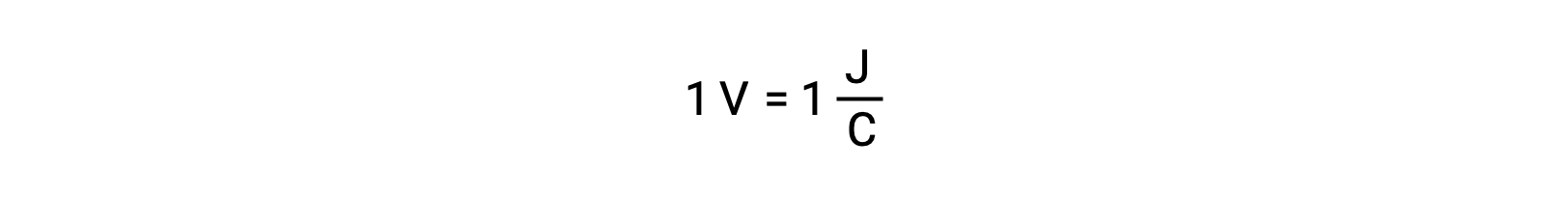
El potencial de electrodo estándar
Cuando se mide con fines electroquímicos, el potencial de celda es una medida de la fuerza motriz para un tipo específico de procesos de transferencia de carga, a saber, la transferencia de electrones entre reactivos. El potencial de un solo electrodo o de una sola semi-celda no puede medirse ya que la transferencia de electrones requiere un donante y un aceptor o un reductor y un oxidante, respectivamente. En cambio, un potencial de semi-celda sólo se puede medir en relación con otra semi-celda. Por lo tanto, sólo es posible medir la diferencia de potencial entre dos semi-celdas, Ecelda, que se define como

Donde Ecátodo y Eánodo representan los potenciales de dos semi-celdas diferentes que funcionan como cátodo y ánodo, respectivamente. El potencial de celda estándar, E°celda, es el potencial celda medido en condiciones de estado estándar de ambas semi-celdas (es decir, concentraciones de 1 M, presiones de 1 bar, a 298 K)

Para calcular fácilmente los potenciales de semirreacción, la comunidad científica ha designado una semi-celda en particular para que sirva como referencia universal para todas las mediciones de potencial de celda, con un potencial de 0 V. Esta semi-celda se conoce como electrodo estándar de hidrógeno (SHE por sus siglas en inglés), y se basa en la siguiente semirreacción:
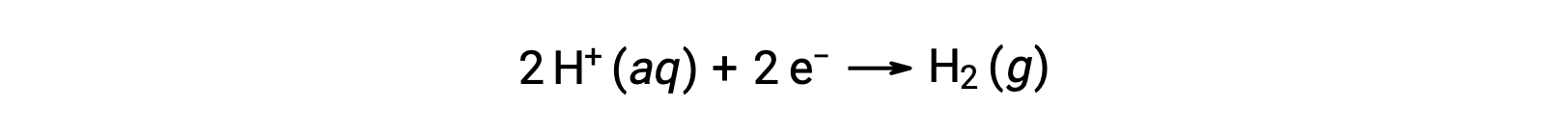
Normalmente, consta de un electrodo de platino inerte que se sumerge en H+ acuoso 1 M, con un flujo de has H2 burbujeante a una presión de 1 bar, mantenido a una temperatura uniforme de 298 K. El potencial de electrodo (EX) para una semi-celda X se define entonces como el potencial medido para una semi-celda X, que actúa como cátodo, mientras que la SHE actúa como ánodo.
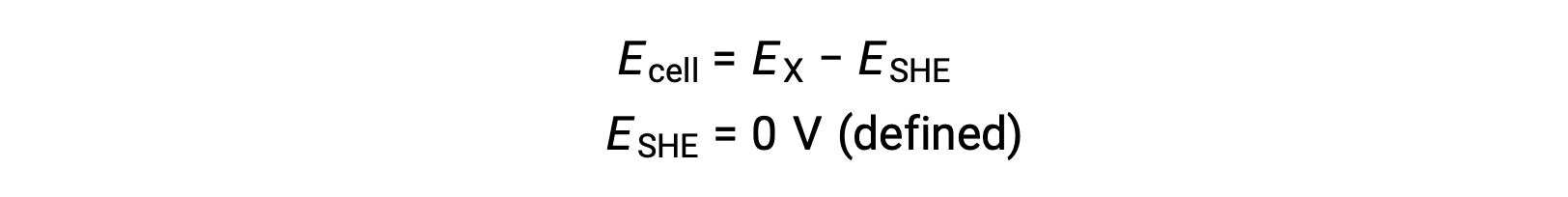
Por lo tanto,
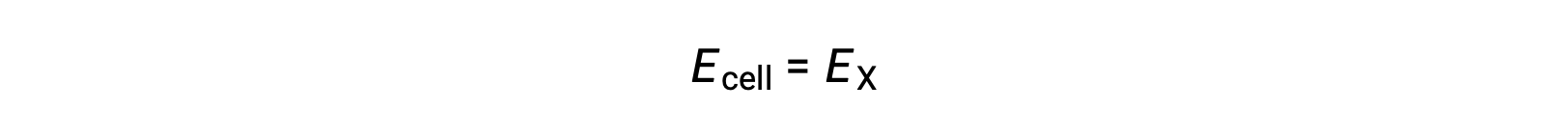
En condiciones de estado estándar, el potencial de la semi-celda X es igual al potencial del electrodo estándar, E°X. Como la definición del potencial de celda requiere que las semi-celdas funcionen como cátodos, estos potenciales también se llaman potenciales de reducción estándar.
Predicción de la espontaneidad y la dirección de una reacción de redox
Los potenciales de celda y de electrodos dictan la espontaneidad de las reacciones redox. Se observa que las reacciones espontáneas muestran un potencial de celda positivo, mientras que el proceso no espontáneo muestra un potencial de celda negativo. Si la suma de los potenciales del electrodo es positiva, se dice que la reacción es espontánea. Las reacciones de semi-celda con potencial de electrodo positivo se producen en la dirección de avance, mientras que las que tienen valores inferiores al electrodo de hidrógeno suelen ocurrir en el orden inverso.
Un oxidante más fuerte muestra un mayor potencial de electrodo estándar, E°. A medida que los potenciales de los electrodos miden la capacidad de reducción, un aumento de E° se corresponde con una mayor fuerza impulsora detrás de la reducción de la especie y mejores capacidades de oxidación. Por lo tanto, E°celda es positiva cuando E°cátodo > E°ánodo.
Al considerar esto, se explica por qué el cobre es oxidado por la plata, pero no por el plomo:
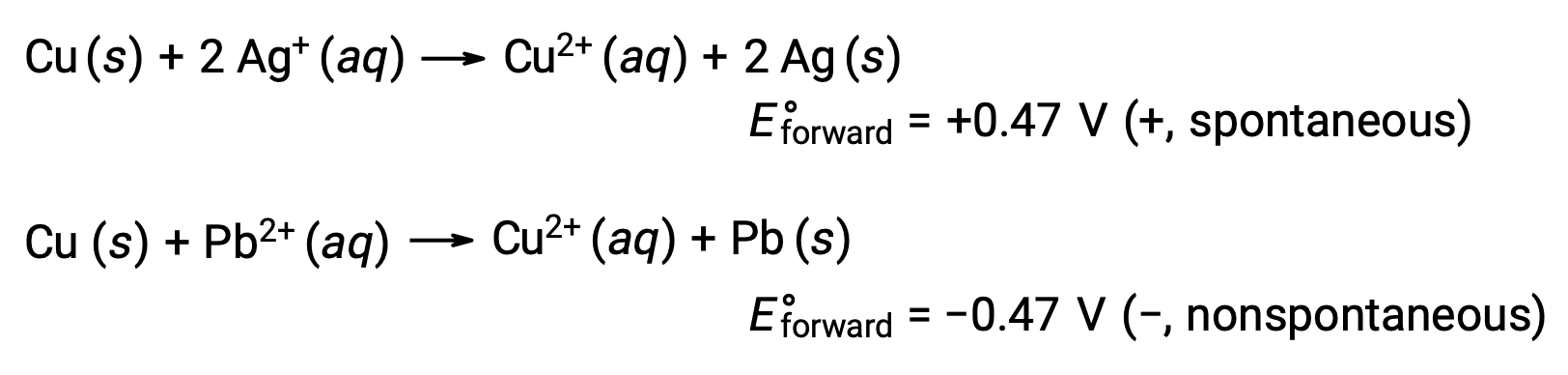
Predicción de la disolución de metales en ácidos minerales
Una de las aplicaciones esenciales de los potenciales de semi-celda es entender si un metal en particular se disolverá en ácido mineral. La mayoría de los ácidos como el ácido clorhídrico disuelven los metales mediante la reducción de protones a gas hidrógeno y la oxidación de metales a sus respectivos iones. En el caso de que el zinc reaccione con ácido clorhídrico, la reacción es espontánea, ya que el potencial de electrodo estándar del zinc es inferior al del hidrógeno. Sin embargo, el cobre no reacciona con el ácido clorhídrico debido a su mayor potencial de electrodo.
Este texto es adaptado de OpenStax, Química 2e, Sección 17.3: Potencial de Electrodos y Celdas.
