18.4:
표준 전극 전위
18.4:
표준 전극 전위
은과 납의 반응성을 비교할 때, 두 이온종, Ag+(aq)및 Pb2+(aq)가 구리를 향한 레독반응성에 차이를 보이는 것으로 관찰된다: 은이온은 자발적인 감소를 겪고, 리드 이온은 그렇지 않다. 이러한 상대적 레독 활성은 세포 전위라고 하는 특성에 의해 전기화학적 세포에서 쉽게 정량화될 수 있다. 이 특성은 일반적으로 전기 화학의 세포 전압으로 알려져 있으며 전하 전달과 함께 하는 에너지의 척도입니다. 잠재력은 충전의 한 coulomb 당 에너지의 하나의 줄로 정의 SI 단위 볼트를 사용하여 측정된다. 따라서
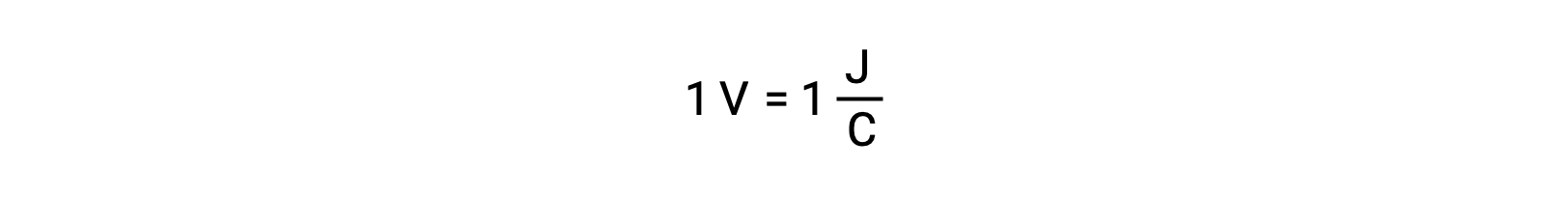
표준 전극 전위
전기화학적 목적을 위해 측정될 때, 세포 전위는 반응제 간의 전자 전달과 같은 특정 유형의 전하 전달 공정에 대한 원동력의 척도이다. 단일 전극 또는 단일 반세포의 전위는 각각 기증자와 수령인 또는 환원제 및 산화제를 필요로 하기 때문에 측정할 수 없습니다. 대신, 반 셀 전위는 다른 반 셀에 비해 측정될 수 있습니다. 따라서, 두 개의 반세포, E셀사이의 전위 차이를 측정할 수 있는 것은

여기서 E음극과 E양극은 각각 음극과 양극으로 작동하는 두 개의 다른 반 세포의 잠재력을 나타냅니다. 표준 세포 전위,E°셀은,두 반 세포의 표준 상태 조건에서 측정된 세포 전위(즉, 1M 농도, 1바 압력, 298 K)

반 반응 전위를 쉽게 계산하기 위해, 과학 계는 0 V의 잠재력을 가진 모든 세포 잠재적 인 측정에 대한 보편적 인 참조 역할을하기 위해 특정 반 셀을 지정했습니다. 이 반세포는 표준 수소 전극 (SHE)으로 알려져 있으며 아래반 반응을 기반으로합니다.
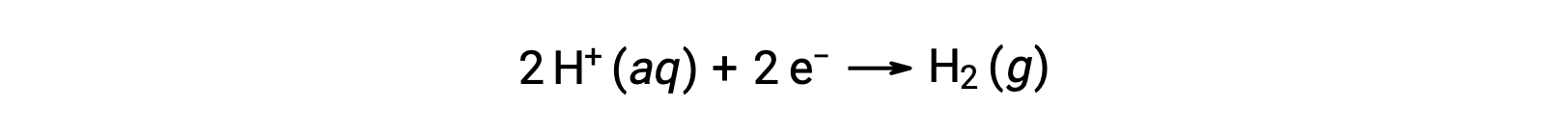
일반적으로 SHE는 1M 수성 H+에침지되는 불활성 백금 전극으로 구성되어 있으며, 1 bar 압력에서 H2 가스를 부글 부글 거리는 스트림이 298 K의 균일 한 온도에서 유지됩니다. 반세포 X에대한 전극 전위(EX)는따라서 음극역할을 하는 세포 X에 대해 측정된 전위로 정의되며, SHE는 양극역할을 한다.
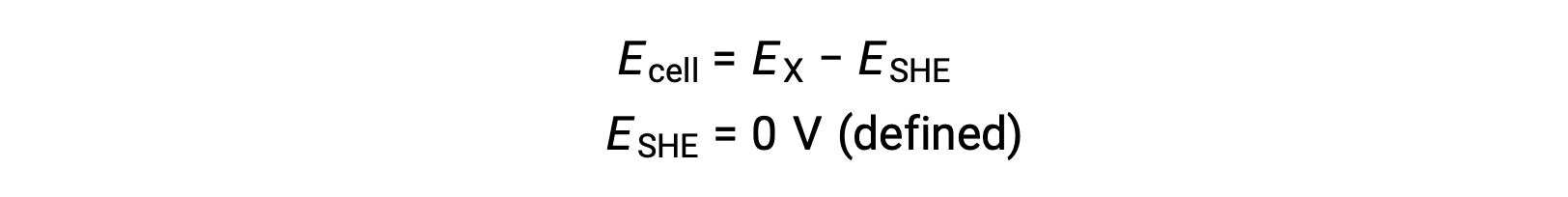
따라서
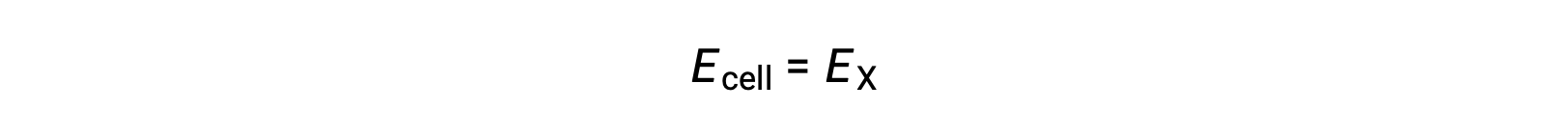
표준 상태 조건에서, 반셀 X의 잠재력은 표준 전극 전위, E°X와동일하다. 세포 잠재력의 정의는 음극으로 작동 하는 반 세포를 필요로, 이러한 잠재력은 또한 표준 감소 잠재력 이라고.
자발성 예측과 레독스 반응의 방향
세포 및 전극 전위는 레독스 반응의 자발성을 지시합니다. 자발적인 반응은 양성 세포 전위를 나타내고, 비자발적 과정은 음의 세포 전위를 나타낸다는 것을 관찰한다. 전극 전위의 합산이 긍정적이면 반응은 자발적이라고 합니다. 양극 전위를 갖는 반세포 반응은 전방 방향으로 발생하며, 수소 전극보다 값이 낮은 반전 반응은 일반적으로 역순으로 발생한다.
더 강한 산화는 더 큰 표준 전극 전위, E°를 나타낸다. 전극 전위가 감소 용량을 측정함에 따라, 증가된 E°는종의 감소와 더 나은 산화 능력의 뒤에 증가한 원동력에 해당합니다. 따라서, E°세포는 E°음극 및 E°양극시 양성이다.
이를 고려할 때 구리가 은으로 산화되는 이유를 설명하지만 납에 의해 산화되지는 않습니다.
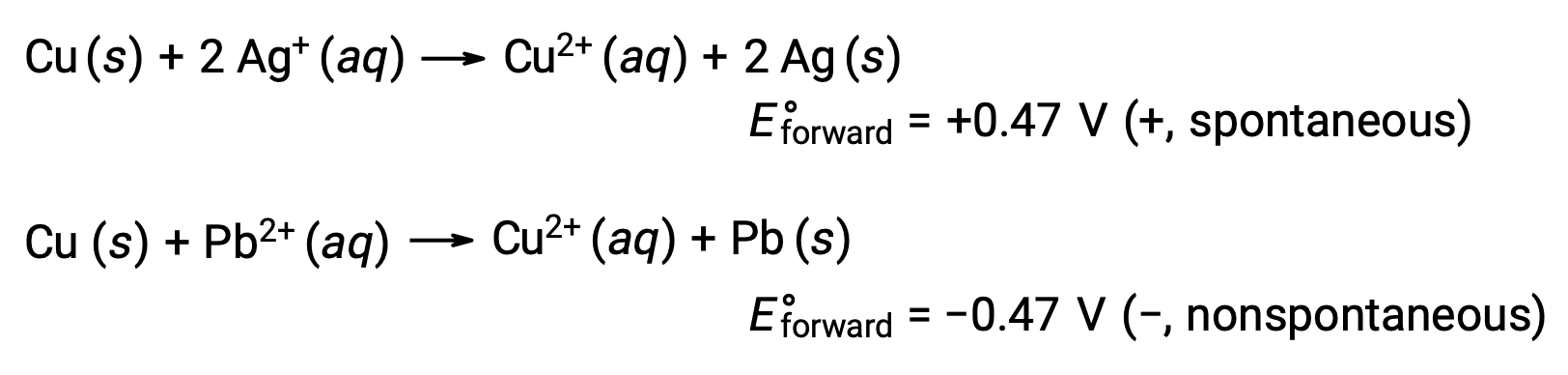
미네랄산금속용 용해 예측
반세포 전위의 필수적인 응용 분야 중 하나는 특정 금속이 미네랄 산에 용해될지 여부를 이해하는 것입니다. 염산과 같은 대부분의 산은 양성자를 수소 가스로 환원하고 금속을 각각의 이온으로 산화시킴으로써 금속을 용해합니다. 염산에 반응하는 아연의 경우, 아연의 표준 전극 전위가 수소보다 낮기 때문에 반응이 자발적입니다. 그러나 구리는 높은 전극 전위를 고려하여 염산과 반응하지 않습니다.
