18.4:
Potenziali elettrodi standard
18.4:
Potenziali elettrodi standard
Confrontando la reattività dell’argento e del piombo, si osserva che le due specie ioniche, Ag+ (aq) e Pb2+ (aq), mostrano una differenza nella loro reattività redox verso il rame: lo ione argentato subisce una riduzione spontanea, mentre lo ione piombo no. Questa relativa attività redox può essere facilmente quantificata nelle cellule elettrochimiche da una proprietà chiamata potenziale cellulare. Questa proprietà è comunemente nota come tensione cellulare in elettrochimica, ed è una misura dell’energia che accompagna il trasferimento di carica. I potenziali sono misurati usando l’unità SI Volts, definita come un joule di energia per un coulomb di carica. Così
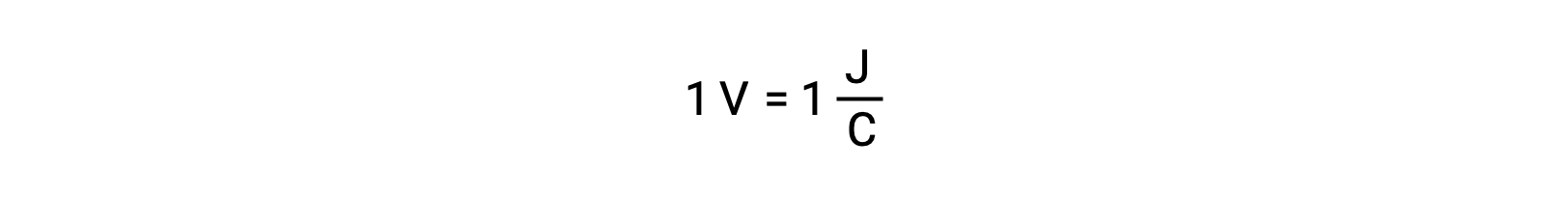
Potenziale di elettrodo standard
Se misurato per scopi elettrochimici, il potenziale cellulare è una misura della forza motrice per uno specifico tipo di processi di trasferimento della carica, vale a dire il trasferimento di elettroni tra reagenti. Il potenziale di un singolo elettrodo o di una singola mezza cellula non può essere misurato poiché il trasferimento di elettroni richiede rispettivamente un donatore e un ricevente o un riduttore e un ossidante. Invece, un potenziale di mezza cella può essere misurato solo rispetto a un’altra mezza cellula. Pertanto, è possibile misurare solo la differenza di potenziale tra due mezze celle, cella E,che è definita come

dove ilcatodo E e l’anodo E rappresentano le potenzialità di due diverse mezze cellule che funzionano rispettivamente come catodo e anodo. Il potenziale cellulare standard, cella E°,è il potenziale cellulare misurato in condizioni di stato standard di entrambe le mezze cellule (cioè concentrazioni di 1 M, pressioni di 1 barra, 298 K)

Per calcolare facilmente i potenziali di semireazione, la comunità scientifica ha designato una particolare mezza cellula per servire come riferimento universale per tutte le misurazioni del potenziale cellulare, con un potenziale di 0 V. Questa mezza cella è nota come elettrodo standard a idrogeno (SHE), ed è basata sulla semireazione riportata di seguito:
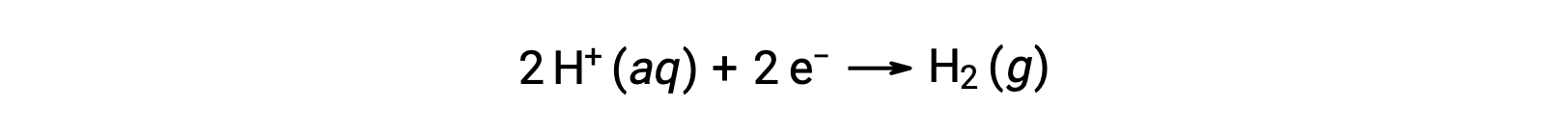
Tipicamente, SHE è costituita da un elettrodo di platino inerte che è immerso in H+acquoso 1 M, con un flusso di gas H2 gorgogliante a pressione di 1 bar, mantenuto ad una temperatura uniforme di 298 K. Il potenzialedell’elettrodo( EX) per una X a mezza cella è quindi definito come il potenziale misurato per una cella X, che agisce come un catodo, mentre lo SHE agisce come un anodo.
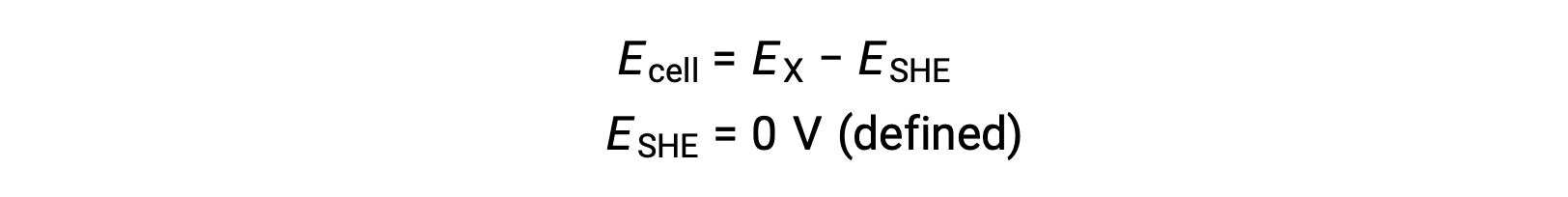
Quindi
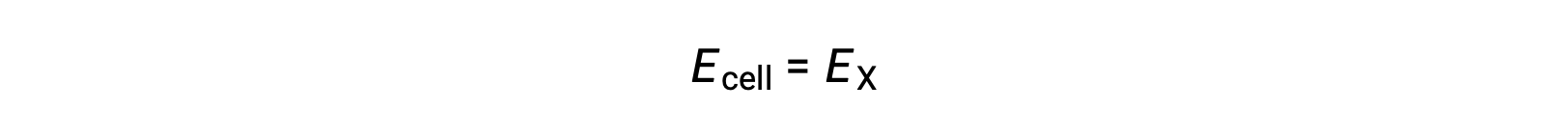
In condizioni di stato standard, il potenziale della semi-cella X è uguale al potenziale standard dell’elettrodo, E°X. Poiché la definizione di potenziale cellulare richiede che le mezze cellule funzionino come catodi, questi potenziali sono anche chiamati potenziali di riduzione standard.
Previsione della spontaneità e della direzione di una reazione Redox
I potenziali di cellule ed elettrodi dettano la spontaneità delle reazioni redox. Si osserva che le reazioni spontanee mostrano un potenziale cellulare positivo, mentre il processo nonpontaneo mostra un potenziale cellulare negativo. Se la somma dei potenziali dell’elettrodo è positiva, si dice che la reazione sia spontanea. Le reazioni a metà cella con potenziale di elettrodo positivo si verificano nella direzione in avanti, mentre quelle con valori inferiori all’elettrodo a idrogeno di solito si verificano nell’ordine inverso.
Un ossidante più forte mostra un maggiore potenziale standard di elettrodi, E°. Poiché i potenziali degli elettrodi misurano la capacità di riduzione, un aumento dell’E° corrisponde a una maggiore forza trainante dietro la riduzione della specie e migliori capacità ossidanti. Pertanto, lacellulaE ° è positiva quando E°catodo > E°anodo.
Considerando questo, spiega perché il rame è ossidato dall’argento, ma non dal piombo:
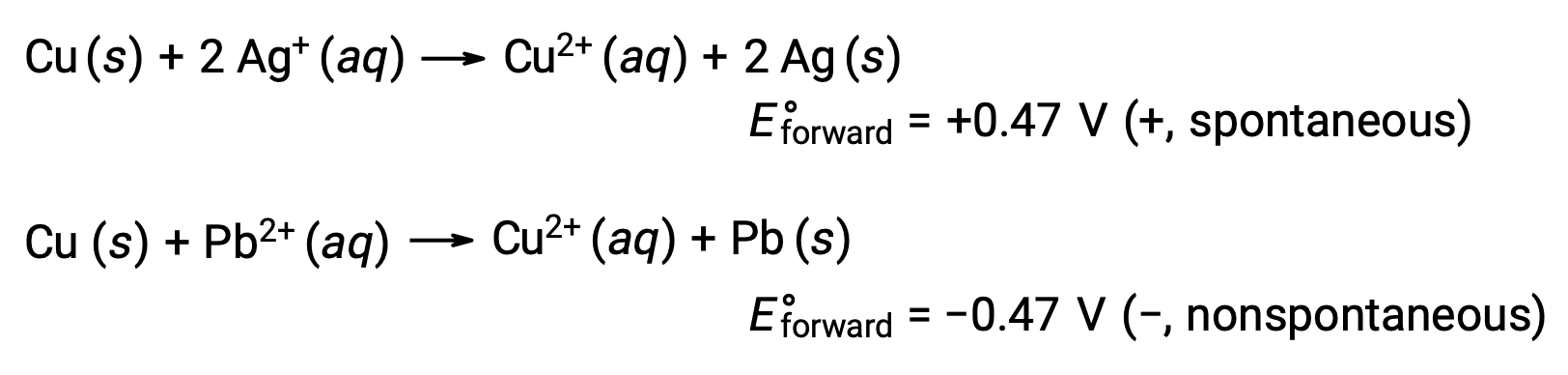
Previsione della dissoluzione del metallo negli acidi minerali
Una delle applicazioni essenziali del potenziale a mezza cellula è capire se un particolare metallo si dissolverà nell’acido minerale. La maggior parte degli acidi come l’acido cloridrico dissolvono i metalli con la riduzione dei protoni in idrogeno gassoso e l’ossidazione dei metalli ai rispettivi ioni. Nel caso dello zinco che reagisce con acido cloridrico, la reazione è spontanea in quanto il potenziale standard dell’elettrodo di zinco è inferiore a quello dell’idrogeno. Tuttavia, il rame non reagisce con l’acido cloridrico a causa del suo maggiore potenziale di elettrodi.
Questo testo è adattato da OpenStax, Chemistry 2e, Sezione 17.3: Elettrodi e potenziali cellulari.
