18.4:
Стандартные электродные потенциалы
18.4:
Стандартные электродные потенциалы
При сравнении реактивности серебра и свинца наблюдается, что два ионных вида, AG+ (aq) и Pb2+ (aq), показывают разницу в их окислительно-восстановительных действиях по отношению к меди: Ион серебра подвергается спонтанному сокращению, в то время как ион свинца не происходит. Относительную активность окислительного вещества можно легко количественно оценить в электрохимических клетках с помощью свойства, называемого клеточного потенциала. Это свойство обычно называют напряжением клеток в электрохимии, и оно является мерой энергии, которая сопровождает передачу заряда. Потенциалы измеряются с помощью единиц СИ в вольтах, определяемых как одна джоуль энергии на один кулон заряда. Таким образом,
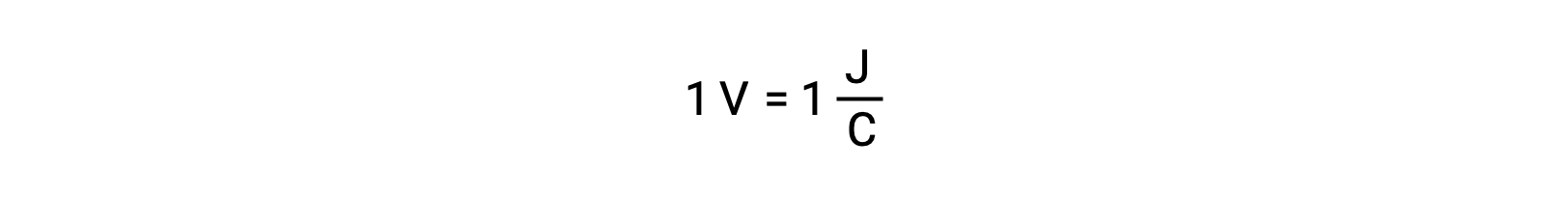
Стандартный потенциал электрода
При измерении в электрохимических целях клеточный потенциал является мерой движущей силы для определенного типа процессов передачи заряда, а именно, переноса электрона между реагенты. Потенциал одного электрода или одной полуячейки нельзя измерить, так как для переноса электронов требуется донорская и принимающая или восстановитель и окислитель соответственно. Вместо этого, полуклеточный потенциал может быть измерен только относительно другой полуячейки. Таким образом, можно измерить разницу потенциалов только между двумя полуклетками, Экеллом, которая определяется как

Где Экатод и εнод представляют потенциалы двух разных полуклеток, работающих соответственно как катод и анод. Стандартный потенциал ячейки, E°cell, — это потенциал ячейки, измеренный в стандартных состояниях обоих полуэлементов (т.е. концентрации 1 M, давления 1 бар, 298 K)

Чтобы легко рассчитать потенциалы полуреакции, научное сообщество выделит одну конкретную полуклеточную ячейку в качестве универсального эталона для всех измерений потенциала клеток, с потенциалом 0 В. Эта полуклетка известна как стандартный водородный электрод (SHE), и основана на половинной реакции ниже:
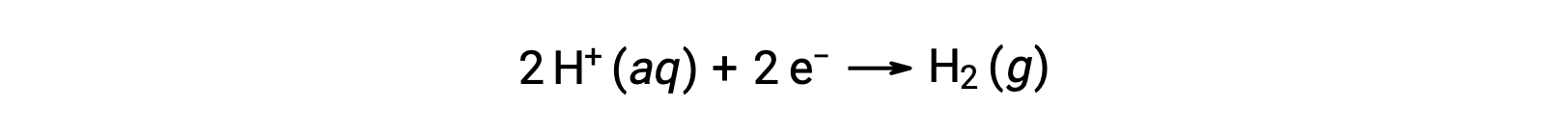
Обычно ОНА состоит из инертного платинового электрода, погруженного в воду H+ 1 м, с потоком пузырьков газа H2 при давлении 1 бар, Поддерживается при одинаковой температуре 298 K. потенциал электрода (EX) для полуячейки X определяется, таким образом, как потенциал, измеренный для ячейки X, которая действует как катод, в то время как она действует как анод.
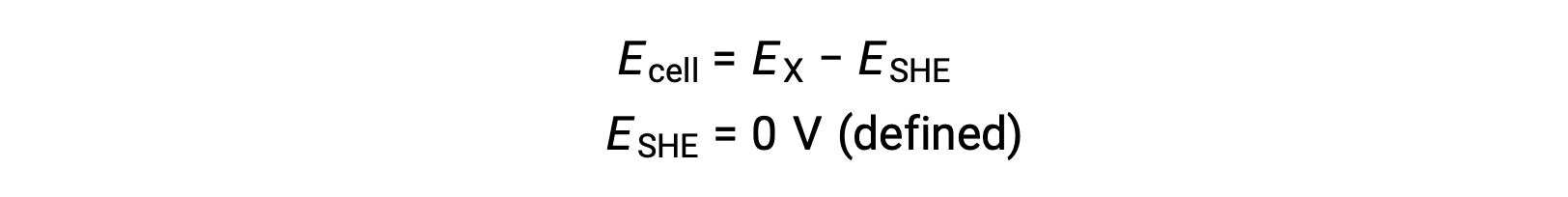
Поэтому
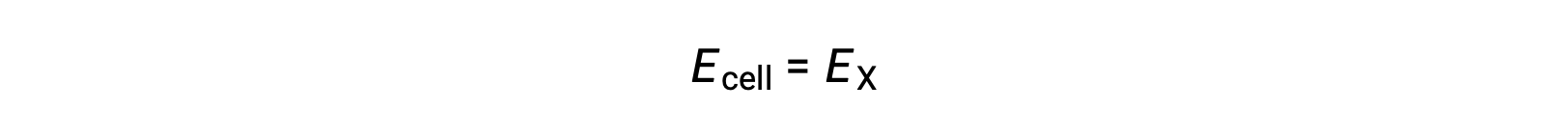
В стандартных условиях потенциал полуячейки X равен стандартному потенциалу электрода, E°X. Поскольку определение клеточного потенциала требует, чтобы полуклетки функционируют как катоды, эти потенциалы также называются стандартными потенциалами сокращения.
Прогнозирование спонтанности и направления реакции редокс
Клеточный и электродный потенциалы определяют спонтанность редокс-реакций. Отмечается, что спонтанные реакции демонстрируют положительный клеточный потенциал, в то время как спонтанный процесс показывает отрицательный клеточный потенциал. Если суммарное значение потенциалов электродов положительное, реакция считается спонтанной. Реакции полуклеток, имеющие положительный потенциал электрода, происходят в прямом направлении, в то время как реакции со значениями меньше, чем водородный электрод обычно происходят в обратном порядке.
Более сильный окислитель демонстрирует больший стандартный потенциал электрода, E°. По мере того как потенциал электродов измеряет мощность снижения, повышение E° соответствует увеличению движущей силы за счет уменьшения вида и улучшения окислительной способности. Таким образом, E–ячейка является положительной, когда E°катод > E°анод.
Учитывая это, он объясняет, почему медь окисляется серебром, но не свинцом:
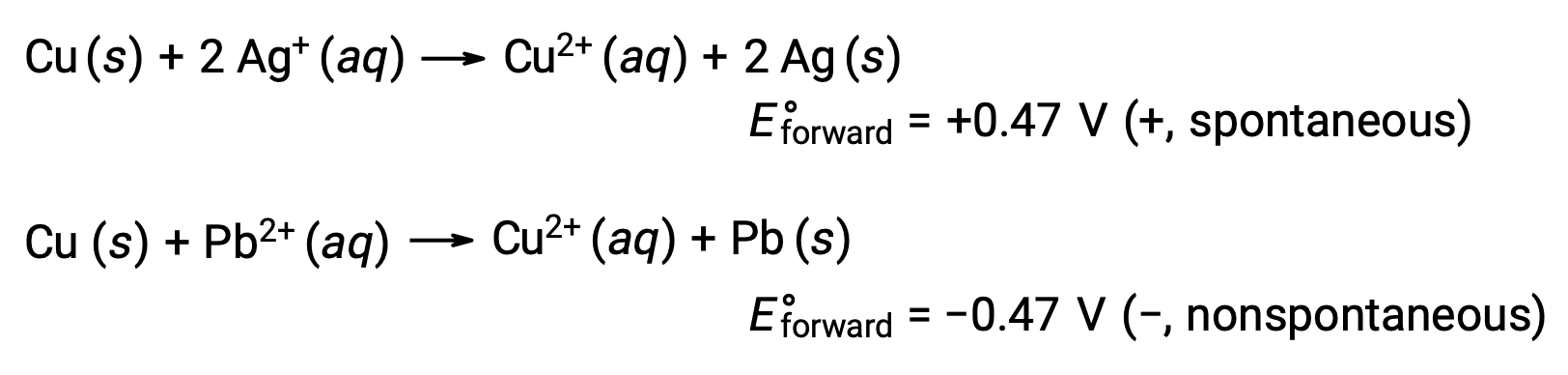
Прогнозирование растворения металла в минеральных кислотах
Одним из основных применений полуклеточных потенциалов является понимание того, растворится ли конкретный металл в минеральной кислоте. Большинство кислот, таких как соляная кислота, растворяют металлы путем сокращения протонов до газообразного водорода и окисления металлов до соответствующих ионов. В случае реакции цинка с соляной кислотой реакция является спонтанной, поскольку стандартный потенциал электрода цинка ниже, чем у водорода. Однако медь не реагирует с соляной кислотой из-за ее более высокого потенциала электрода.
Этот текст адаптирован из OpenStax, Химия 2е изд., раздел 17.3: Электродный и клеточные потенциалы.
