Summary
يوفر مجموع RNA الخلوية قالب الفقيرة لدراسة التغيرات قصيرة الأجل في تخليق الحمض النووي الريبي والاضمحلال وكذلك حركية معالجة RNA. هنا، نحن تصف وضع العلامات الأيضية من الحمض النووي الريبي المحولة حديثا مع 4 thiouridine تليها biotinylation ثيول محددة وتنقية RNA المحولة حديثا السماح للتغلب على هذه القيود.
Abstract
تطوير ميكروأرس كامل Transcriptome على وتسلسل الجيل القادم قد أحدثت ثورة فهمنا من تعقيد الخلوية التعبير الجيني. جنبا إلى جنب مع فهم أفضل للآليات الجزيئية المسؤولة، أصبحت قياسات دقيقة لحركية الكامنة ذات أهمية متزايدة. هنا، تواجه هذه المنهجيات قوية قيود كبيرة بسبب الخصائص الذاتية من العينات قالب التي يدرسونها، أي الحمض النووي الريبي مجموع الخلوية. في كثير من الحالات تغيرات في الحمض النووي الريبي مجموع الخلوية تحدث إما ببطء شديد أو بسرعة كبيرة جدا لتمثيل الأحداث الجزيئية الكامنة وحركية مع القرار كافية. وبالإضافة إلى ذلك، لم يتم التمييز بينها بسهولة مساهمة تغييرات في تركيب الحمض النووي الريبي، وتجهيز، والاضمحلال.
وضعنا مؤخرا عالية الدقة الجينات التنميط التعبير للتغلب على هذه القيود. ويستند نهجنا على وضع العلامات الأيضية من الحمض النووي الريبي المحولة حديثا مع 4 thiouriتناول الطعام (وبالتالي يشار إلى 4sU الجغرافية أيضا)، يليه تنقية صارمة من الحمض النووي الريبي كتب حديثا باستخدام biotinylation ثيول محددة والخرز المغناطيسي streptavidin المغلفة. وهو ينطبق على طائفة واسعة من الكائنات الحية بما فيها الحيوانات الفقارية، ذبابة الفاكهة، والخميرة. طبقنا بنجاح 4sU الجغرافية لدراسة حركية في الوقت الحقيقي من أنشطة عامل النسخ، وتوفير قياسات دقيقة من الحمض النووي الريبي نصف حياة، والحصول على رؤى جديدة في حركية معالجة RNA. وأخيرا، والنمذجة الحسابية يمكن استخدامها لتوليد تحليل متكامل وشامل من الآليات الجزيئية الكامنة.
Introduction
التنميط الجيني التعبير هي أداة رئيسية تستخدم لدراسة العمليات الخلوية وشبكة التفاعل المعقد المرتبطة بها. وكانت الدراسات على وفرة مرنا عادة الأسلوب المفضل للحصول على رؤى الأساسية في الآليات الجزيئية الكامنة. غذى تطوير ميكروأرس كامل Transcriptome على 1، وفي الآونة الأخيرة، تسلسل الجيل القادم من الحمض النووي الريبي (RNA وما يليها) 2-4 هذا النهج. في حين أن هذه التقنيات قد أحدثت ثورة فهمنا من تعقيد الخلوية التعبير الجيني، فإنهم يواجهون قيودا كبيرة بسبب الخصائص الذاتية من عينة قالب بهم، أي مجموع الخلوية الحمض النووي الريبي. التغييرات الأولى، على المدى القصير في مجموع مستويات الحمض النووي الريبي لا تتطابق التغيرات في أسعار النسخ، ولكنها تعتمد بطبيعتها على الحمض النووي الريبي نصف العمر من النصوص منها. في حين أن الاستقراء خمسة أضعاف من لم يدم طويلا نص، على سبيل المثال ترميز لعامل النسخ، وسوف يكون كشفها بسهولة في الحمض النووي الريبي مجموعفي غضون ساعة، نفس تحريض على الأجل الطويل نص، على سبيل المثال الترميز لانزيم الأيضية، وسوف تظل غير مرئية تقريبا. وبالإضافة إلى ذلك، حتى استكمال اغلاق القناة (> 1،000 أضعاف أسفل تنظيم) في معدل النسخ من الجين بمتوسط مع نصف عمر خمس ساعات RNA سوف ببساطة تأخذ خمس ساعات لمجموع مستويات الحمض النووي الريبي لينخفض بنسبة شقين فقط . ولذلك، فإن تحليل الحمض النووي الريبي مجموع تفضل الكشف عن ما يصل التنظيم من النصوص لم يدم طويلا، وكثير منها ترميز لعوامل النسخ والجينات مع المهام التنظيمية 5. وبالإضافة إلى ذلك، يتم حجب تتالي الحركية الحقيقية للتنظيم، ولا يمكن أن تكون متباينة الأحداث يشير الأساسي من الثانوي. كلا، بدوره، قد يؤدي إلى تحيز كبير في التحليلات المعلوماتية الحيوية المصب. ثانيا، لا يمكن أن تعزى التغيرات في إجمالي مستويات الحمض النووي الريبي للتغيرات في تركيب الحمض النووي الريبي أو تسوس. قياسات لهذه الأخيرة تتطلب نهجا الغازية الخلية، على سبيل المثال حظر transcriptiحول استخدام أكتينوميسين D 6، ورصد طويلة من الاضمحلال RNA الجارية مع مرور الوقت. بمتوسط مرنا نصف العمر في خلايا الثدييات من 5-10 ساعة 5،7، لن يؤدي إلا إلى فقد انخفضت مستويات مرنا من معظم الجينات بنسبة أقل من شقين بعد عدة ساعات من اعتقال النسخي. هذه الاختلافات الصغيرة بدلا يؤدي إلى قياسات غير دقيقة بشكل فاضح من مرنا نصف العمر بالنسبة لغالبية الجينات الخلوية نظرا لطبيعة الأسي من المعادلات الرياضية الكامنة. وأخيرا، بينما RNA وما يليها من الحمض النووي الريبي مجموع الخلوية كشفت أن ما يقرب من نصف جيناتنا تخضع لأحداث بديلة الربط 8، حركية الكامنة فضلا عن آليات ديناميكية توجيه الأنسجة ومحددة السياق تنظيم معالجة الحمض النووي الريبي لا تزال غير مفهومة تماما. وبالإضافة إلى ذلك، فإن مساهمة RNA تجهيز لتباين التعبير الجيني، ولا سيما بالنسبة للالرناوات غير الترميز، لا يزال يتعين تحديدها. وإجمالا، هذه القيود تمثل العقبات الرئيسية للالنمذجة المعلوماتية الحيوية الحركية من الآليات الجزيئية الكامنة.
وضعنا مؤخرا نهجا، ووصف الجينات وارتفاع القرار التنميط التعبير، للتغلب على هذه المشاكل 5،7،9. لأنه يقوم على وضع العلامات الأيضية من الحمض النووي الريبي المحولة حديثا باستخدام 4-thiouridine (4sU الجغرافية)، وهو مشتق يوريدين التي تحدث بشكل طبيعي، ويوفر الوصول المباشر إلى النصوص المحولة حديثا مع الحد الأدنى من التدخل في نمو الخلايا والتعبير الجيني (انظر الشكل 1) 5، 10-12. التعرض للخلايا حقيقية النواة إلى نتائج 4sU في امتصاص على وجه السرعة، الفسفرة إلى 4sU-ثلاثي الفوسفات، وإدماجها في الحمض النووي الريبي المحولة حديثا. بعد عزل الحمض النووي الريبي مجموع الخلوية، الكسر RNA 4sU المسمى هو البيروكسيديز ثيول على وجه التحديد توليد السندات ثاني كبريتيد بين البيوتين وRNA المحولة حديثا. 'مجموع RNA الخلوية' ثم يمكن فصل كميا في المسمى ('المحولة حديثا') وتوضيحها ("ما قبل existinز ') RNA مع نقاء عالية باستخدام الخرز المغناطيسي streptavidin المغلفة. وأخيرا، يتم استرداد المسمى الحمض النووي الريبي من الخرز ببساطة عن طريق إضافة عامل مختزل (على سبيل المثال dithiothreitol) الشق السندات ثاني كبريتيد والافراج عن RNA المحولة حديثا من الخرز.
كتب حديثا RNA يصور النشاط النسخي من كل جين خلال الإطار الزمني للتعرض 4sU. 4sU الجغرافية في مقياس الوقت من دقيقة وبالتالي يقدم صورة لقطة من حقيقية النواة التعبير الجيني وقالب مثالي لأسفل مجرى التحليلات المعلوماتية الحيوية (مثل تحليل المروج). في الحالات التي يمكن افتراض ظروف الحالة المستقرة، نسب المحولة حديثا / المجموع، كتب حديثا / الخالي من الملصقات وغير المسماة / الحمض النووي الريبي مجموع توفير وصول غير الغازية لRNA دقيق نصف حياة 7،13. وبالإضافة إلى ذلك، فمن المهم أن نلاحظ أن الحمض النووي الريبي المحولة حديثا تنقيته بعد اقل من 5 دقائق من 4sU الجغرافية (5 دقائق 4sU-RNA) هو أصغر من 15 و 60 دقيقة 4sU-RNA.عند تنفيذ كلا فائقة القصيرة والطويلة تدريجيا 4sU الجغرافية في إعداد تجريبية واحدة جنبا إلى جنب مع الحمض النووي الريبي وما يليها، وكشف حركية معالجة الحمض النووي الريبي في قرار النوكليوتيدات 9. وأخيرا، تحليلات الوقت طبعا من الحمض النووي الريبي المحولة حديثا ومجموع جنبا إلى جنب مع النمذجة الحاسوبية تسمح لتحليل تكاملية تخليق الحمض النووي الريبي والاضمحلال 14.
وفي الختام، فإن هذا النهج يسمح للتحليل المباشر لديناميات توليف الحمض النووي الريبي، وتجهيز، وتدهور في الخلايا حقيقية النواة. هذا ينطبق في جميع الكائنات الحية بما فيها الثدييات نموذج رئيسي والحشرات (ذبابة الفاكهة)، البرمائيات (الضفدع)، والخميرة 5،15،16. وهو متوافق مباشرة مع تحليل ميكروأري 5،17، RNA-يليها 9،13،14، وينطبق في الجسم الحي 12،15. هنا، ونحن بالتفصيل منهجية لتسمية وعزل، وتنقية RNA المحولة حديثا في خلايا الثدييات مثقف. وبالإضافة إلى ذلك، potentiوتناقش المشاكل القاعدة والمزالق.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. وصفها الأيضية مع 4 thiouridine
تقديم خطة مفصلة من الإعداد التجريبية / الجدول الزمني، على سبيل المثال عندما لإضافة 4sU لزراعة الخلايا، وعندما لجني العينات. خطة لمدة 5 دقائق على الأقل بين كل حالة. علاج الخلايا فقط من حالة واحدة في كل مرة. التعامل مع ماكس. 3-5 الأطباق في وقت معين. التعامل مع الخلايا في أسرع وقت ممكن للحد من التغيرات في درجات الحرارة ومستويات ثاني أكسيد الكربون 2. تجنب تعريض الخلايا للضوء الساطع بعد إضافة 4sU لأن هذا قد يؤدي إلى يشابك من الحمض النووي الريبي 4sU المسمى إلى البروتينات الخلوية.
بدء وضع العلامات
- ذوبان الجليد 4 thiouridine (4sU) فقط قبل الاستخدام وماصة المبلغ المطلوب من 4sU لكل حالة في أنبوب الصقر العقيمة.
- أخذ المبلغ المطلوب من مستنبت الخلية (5 مل لكل 10 سم الطبق) قبالة الأطباق وإضافة لاحتواء 4sU أنبوب فالكون وتخلط جيدا. إزالة وتجاهل المتوسطة المتبقية من الأطباق. <لى <تطبيق المحتوية 4sU الظهير المتوسطة إلى الأطباق.
نهاية وصفها
- إزالة مستنبت خلية من خلايا. إضافة 5 مل من Trizol إلى كل لوحة. لإجراء التجارب المعقدة بما في ذلك نقاط زمنية متعددة أو الظروف، من الأفضل القيام بهذه الخطوة من قبل شخصين، واحد إزالة المتوسطة، والآخر مضيفا Trizol وحصاد المحللة.
- احتضان لمدة 5 دقائق في درجة حرارة الغرفة لتحلل الخلايا كاملة.
- استخدام 10 مل ماصة لشطف لوحة بعناية مع Trizol المضافة. وهذا يساعد تحلل الخلية كاملة واسترداد العينة. التعامل مع الرعاية كما Trizol خطرة للغاية عند الحصول على اتصال مع الجلد أو العينين! لديك ترياق للحروق الفينول في متناول اليد (مثل البولي ايثيلين جلايكول 300 أو 400 في حالة معنوية ميثليته الصناعية (70:30)). نقل العينات إلى أنابيب البولي بروبلين. يرجى ملاحظة أن أنابيب فالكون القياسية لا تقاوم هذه القوات ز عالية). ويمكن تخزين العينات في -20 درجة مئوية لمدة شهر واحد على الأقل حتى الحمض النووي الريبي مجموع طو أعد.
2. إعداد الحمض النووي الريبي باستخدام بروتوكول معدلة Trizol
- إضافة 1 مل الكلوروفورم (0.2 مل لكل مل Trizol) ويهز بقوة لمدة 15 ثانية. يحضن في درجة حرارة الغرفة 2 - 3 دقيقة.
- الطرد المركزي في 13،000 × ز لمدة 15 دقيقة في 4 درجات مئوية.
- نقل المرحلة العليا مائي (التي تحتوي على الحمض النووي الريبي) إلى أنبوب جديد 15 مل البولي بروبلين.
- إضافة ½ حجم رد فعل كل من الحمض النووي الريبي هطول العازلة والأيزوبروبانول (على سبيل المثال إلى 3 مل طاف إضافة 1.5 مل RNA هطول العازلة و1.5 مل الأيزوبروبانول).
- تخلط جيدا. يحضن في درجة حرارة الغرفة لمدة 10 دقيقة.
- الطرد المركزي في 13،000 × ز لمدة 10 دقيقة في 4 درجات مئوية. تجاهل طاف.
- تدور باستمرار لفترة وجيزة (5،000 × ز لمدة 30 ثانية) وإزالة الأيزوبروبانول المتبقية مع 200 ميكرولتر ماصة.
- إضافة حجم مساو من 75٪ من الإيثانول ويهز الأنبوب حتى يفصل بيليه. تجنب كسرها إلى قطع صغيرة كثيرة لأن هذا قد جعل إزالة ثمالاتL الايثانول صعبا.
- الطرد المركزي في 13،000 × ز لمدة 10 دقيقة في 4 درجات مئوية. تجاهل طاف.
- تدور باستمرار لفترة وجيزة RNA وإزالة الإيثانول المتبقية مع ماصة 200 ميكرولتر. كرر الخطوة وإزالة الإيثانول المتبقية مع ماصة 20 ميكرولتر. بعد هاتين الخطوتين، يجب أن يتم تنفيذ أي التجفيف مزيد من بيليه.
- إضافة 100 ميكرولتر من H 2 O لكل 100 ميكروغرام RNA العائد المتوقع ومزيج جيد من قبل pipetting صعودا وهبوطا 5-6 مرات للمساعدة في حل الحمض النووي الريبي.
- حل وتفسد الحمض النووي الريبي عن طريق التسخين إلى 65 درجة مئوية لمدة 10 دقيقة (شاكر)، ووضع على الفور على الجليد.
- قياس الحمض النووي الريبي تركيز في 260 نانومتر باستخدام معمل NanoDrop، باتباع إرشادات الشركة المصنعة. ويمكن تخزين هذا الحمض النووي الريبي في -80 درجة مئوية لمدة شهر واحد على الأقل.
3. Biotinylation ثيول محددة من الحمض النووي الريبي كتب مؤخرا
- ابدأ مع 60-80 ميكروغرام من الحمض النووي الريبي مجموع الخلوية.
- تشكل رد فعل وصفها. ماصة في ما يليالنظام (في الحمض النووي الريبي ميكروغرام):
- 1 ميكرولتر العازلة 10X Biotinylation
- 7 ميكرولتر الحمض النووي الريبي (RNA يحتوي على 1 ميكروغرام مخففة في nuclease خالية-H 2 O)
- 2 ميكرولتر البيوتين HPDP (1 ملغ / مل DMF)
دائما إضافة البيوتين HPDP الماضي وخلط فورا من قبل pipetting. في حالة يترسب البيوتين، ويمكن زيادة محتوى DMF إلى تركيز النهائي من 40٪.
- يحضن في درجة حرارة الغرفة لمدة 1.5 ساعة مع دوران.
- إضافة حجم مساو من كلوروفورم. مزيج بقوة. احتضان لمدة 2 - 3 دقائق حتى تبدأ المراحل لفصل وفقاعات تبدأ تختفي.
- الطرد المركزي في 20،000 × ز لمدة 5 دقائق في 4 درجات مئوية. نقل بعناية الطبقه المائيه العليا في أنبوب جديد.
- كرر الخطوات من 3.4 و 3.5 مرة. قد تحتاج إلى تنفيذ هذه الخطوة في 2 مل المرحلة قفل جل الأنابيب الثقيلة للحد من فقدان الحمض النووي الريبي.
- RNA هطول: الوظيفة 1/10 من حجم 5 M كلوريد الصوديوم وحجم مساو منالأيزوبروبانول إلى مرحلة المياه.
- الطرد المركزي في 20،000 × ز لمدة 20 دقيقة في 4 درجات مئوية. تجاهل طاف.
- إضافة حجم مساو من 75٪ من الإيثانول، أجهزة الطرد المركزي في 20،000 × ز لمدة 10 دقيقة في 4 درجات مئوية، وتجاهل طاف.
- تدور لفترة وجيزة وإزالة الإيثانول المتبقية مع 200 ميكرولتر ماصة.
- تدور لفترة وجيزة وإزالة الإيثانول المتبقية مع ماصة 20 ميكرولتر.
- لا تسمح الحمض النووي الريبي لتجف. اعادة تعليق في 50-100 ميكرولتر H 2 O (~ 1 ميكرولتر لكل 1 ميكروغرام المدخلات RNA). مزيج جيد من قبل pipetting صعودا وهبوطا 5-6 مرات.
- التحقق من جودة RNA عن طريق التحليل electrophoretical لاستبعاد تدهور الحمض النووي الريبي.
4. نقطة لطخة تحليل 4sU التأسيس (اختياري)
دمج 4sU يمكن تحديد بسهولة عن طريق تحليل لطخة نقطة من الحمض النووي الريبي البيروكسيديز. هذه خطوة اختيارية التي تسمح الخلل وتقدير معدلات التأسيس 4sU نسبة إلى الحمض النووي المعقدة البيروكسيديز التحكم بنسبة ضئيلة. لهذا الاختبار نحن صecommend باستخدام iodoacetyl-البيوتين بدلا من البيوتين HPDP لbiotinylation من الحمض النووي الريبي 4sU المسمى في الخطوة 3.2. هذه النتائج في biotinylation لا رجعة فيه 4sU-RNA. لذلك، على أساس أساليب عمود (على سبيل المثال RNeasy) يمكن استخدامها لاسترداد المبالغ أصغر بكثير من الحمض النووي الريبي البيروكسيديز (مثلا 5 ميكروغرام). بينما البيروكسيديز الحمض النووي الريبي باستخدام البيوتين HPDP هو أيضا مناسبة لهذا الاختبار، وإشارة الناتج هو أضعف ونسبة الإشارة للضجيج أقل مواتاة (الشكل 3).
- اتبع بروتوكول لل4sU وضع العلامات وعزل الحمض النووي الريبي مجموع الخلوية كما هو موضح في المقاطع 1 و 2.
- Biotinylate 4sU المسمى RNA كما هو موضح في القسم 3 استبدال البيوتين HPDP مع iodoacetyl-البيوتين وأداء اثنين من كلوروفورم الاستخراج المفرط لإزالة بقايا iodoacetyl-البيوتين.
- استرداد RNA المعقدة البيروكسيديز بواسطة الأيزوبروبانول / الإيثانول هطول كما هو موضح أو باستخدام النهج القائم على عمود (على سبيل المثال RNeasy) في حالة كميات صغيرة من الحمض النووي الريبي (<10 ميكروغرام) وتستخدم.
- احتضان الغشاء زيتا في nuclease خالية من المياه مع هزاز لمدة 10 دقيقة.
- اتخاذ غشاء من الماء nuclease خالية وإزالة السوائل المفرط عن طريق وضع الغشاء في بين اثنين من المناشف الورقية النظيفة والضغط بقوة. تجفيف الهواء والغشاء لمدة 5 دقائق يؤدي إلى النقاط أجمل.
- لكل عينة، وإعداد 20 ميكرولتر من الحمض النووي الريبي 200 نانوغرام / ميكرولتر باستخدام الثلج نقطة لطخة العازلة ملزمة الباردة (10 ملي هيدروكسيد الصوديوم، 1 ملم EDTA). تطبيق 5 ميكرولتر من هذا التخفيف (أي 1 ميكروغرام من الحمض النووي الريبي)، فضلا عن ثلاثة التخفيفات 10 أضعاف اللاحقة (أي 100، 10، و 1 نانوغرام الحمض النووي الريبي، على التوالي) إلى غشاء زيتا بواسطة pipetting. pipetting لمن خلال رف فارغ من نصائح ماصة يمكن استخدامها لتوفير تباعد موزعة بالتساوي. بدلا من ذلك، استخدام جهاز لطخة نقطة وفقا لتعليمات الشركة الصانعة.
- تطبيق 5 ميكرولتر من الحمض النووي بنسبة ضئيلة البيوتين المسمى بتركيزات تتراوح من 20 نانوغرام / ميكرولتر إلى 20 جزء من الغرام / ميكرولتر (أي 100-،1 نانوغرام بنسبة ضئيلة) بوصفها تابع إيجابيةرول إلى الغشاء قبل pipetting. استخدام البيروكسيديز، عينة 4sU-السذاجة والسيطرة السلبية.
- الهواء الجاف الغشاء لمدة 5 دقائق.
- احتضان الغشاء لمدة 30 دقيقة في 40 مل عازلة تمنع مع هزاز.
- احتضان الغشاء مع 10 مل من 1:1،000 streptavidin الفجل البيروكسيداز-لمدة 15 دقيقة (5 مل PBS + 5 مل 20٪ SDS + 10 ميكرولتر streptavidin الفجل البيروكسيداز-)
- غسل غشاء مرتين في 40 مل PBS + 10٪ SDS (20 مل PBS + 20 مل 20٪ SDS) لمدة 5 دقائق.
- غسل غشاء مرتين في 40 مل PBS + 1٪ SDS (38 مل PBS + 2 مل 20٪ SDS) لمدة 5 دقائق.
- غسل غشاء مرتين في 40 مل PBS + 0.1٪ SDS (40 مل PBS + 200 ميكرولتر 20٪ SDS) لمدة 5 دقائق.
- إزالة السائل الزائد عن طريق وضع الغشاء في بين اثنين من المناشف الورقية النظيفة والضغط عليها بقوة.
- تصور HRP غشاء محدد باستخدام ECL فقا لتعليمات الشركة الصانعة.
- وضع غشاء في احباط البلاستيك / كيس، وإزالة فقاعات الهواء، واحتضان لمدة 2 دقيقة في الظلام.
- فضح الغشاء لفيلم عن 1-5 دقائق.
5. فصل الحمض النووي الريبي وصفت والخالي من الملصقات باستخدام الخرز المغناطيسي Streptavidin المغلفة
- حرارة غسل العازلة (3 مل لكل عينة) إلى 65 درجة مئوية في حمام مائي.
- إعداد الطازجة 100 ملي dithiothreitol (DTT) في nuclease خالية-H 2 O. القيام بذلك عن طريق الصب 15 - 30 ملغ من مسحوق DTT في نظيفة أنبوب 50 مل الصقر وضعت على نطاق وغاية في الدقة. وزن وإضافة المبلغ المطلوب من nuclease خالية-H 2 O.
- البيروكسيديز حرارة عينات الحمض النووي الريبي إلى 65 درجة مئوية لمدة 10 دقيقة لتفسد والمكان فورا على الجليد.
- مكان μMacs الأعمدة في الوقوف المغناطيسي. ونحن نوصي بعدم معالجة أكثر من 12 عينة في وقت واحد (6-8 عينات هي الأمثل).
- أعمدة Miltenyi قبل تتوازن مع 1 مل درجة حرارة الغرفة غسل العازلة. هذا سوف يستغرق حوالي 15 دقيقة.
- وفي الوقت نفسه، إضافة 100 ميكرولتر من الخرز streptavidin إلى 50-100 ميكرولتر من الحمض النووي الريبي البيروكسيديز. يحضن في درجة حرارة الغرفة لمدة 15 دقيقة مع التناوب. < لى> إذا كان أي من الأعمدة لم يشرع استنزاف حتى الآن هذا يمكن تيسيره عن طريق الضغط بلطف على الجزء العلوي من العمود مع إصبع القفاز. مرة واحدة وقد بدأ تدفق الأعمدة استنزاف بسهولة.
- تطبيق RNA / حبات إلى الأعمدة. تجاهل التدفق من خلال إلا إذا كنت تريد استرداد جزء الحمض النووي الريبي الخالي من الملصقات (انظر القسم 7).
- يغسل ثلاث مرات مع 0.9 مل من 65 درجة مئوية العازلة غسل (1 مل ماصة نصائح يتقلص عندما pipetting لمخازن عند 65 درجة مئوية).
- يغسل ثلاث مرات مع 0.9 مل درجة حرارة الغرفة غسل العازلة.
- ماصة 700 ميكرولتر RLT العازلة (RNeasy MinElute كيت تنظيف، QIAGEN) في 2 مل أنابيب جديدة ووضعها تحت الأعمدة.
- أزل الحمض النووي الريبي المحولة حديثا في المخزن المؤقت RLT عن طريق إضافة 100 ميكرولتر من 100 ملي DTT إلى الأعمدة.
- إجراء الجولة الثانية شطف 3 دقائق في وقت لاحق في نفس أنبوب عن طريق إضافة 100 ميكرولتر من آخر 100 DTT ملي.
6. الانتعاش من الحمض النووي الريبي كتب مؤخرا
ontent "> متابعة مع تنظيف MinElute RNeasy (QIAGEN) بروتوكول باتباع إرشادات الشركة المصنعة. أزل في 25 H 2 O. تركيزات الحمض النووي الريبي قياس nuclease خالية ميكرولتر باستخدام معمل NanoDrop. لتجنب الحاجة إلى ذوبان الجليد وإعادة تجميد الحمض النووي الريبي قبل تقديم لفحص عالية الإنتاجية، ونحن نوصي إعداد [كدنا] مباشرة بعد RNA المحولة حديثا يتم تنقيته. استخدام 2.5 ميكرولتر من الحمض النووي الريبي المحولة حديثا في 20 ميكرولتر مزيج التوليف [كدنا] لتخليق [كدنا] باتباع إرشادات الشركة المصنعة. تنفيذ ضوابط QRT-PCR باستخدام 1 : 10 التخفيفات من مزيج [كدنا] مخزن الحمض النووي الريبي في -80 درجة مئوية.7. انتعاش غير المسماة، غير منضم RNA (اختياري)
في حالة غير منضم RNA يحتاج إلى أن تعافى، وجمع والجمع بين التدفق من خلال (بعد إضافة حبات حل RNA-streptavidin إلى الأعمدة)، وغسل أول لهطول اللاحقة. وعادة ما يكفي لترسيب 50٪ فقط من الحمض النووي الريبي غير منضم كما ثيو سوف تحتوي على> 80٪ من المواد ابتداء.
- إضافة حجم مساو من الأيزوبروبانول (لا يحتاج إلى الملح تضاف باعتبارها منطقة عازلة غسل يحتوي بالفعل على 1 M كلوريد الصوديوم).
- الطرد المركزي في 20،000 × ز لمدة 20 دقيقة في 4 درجات مئوية. تجاهل طاف.
- إضافة حجم مساو من 75٪ من الإيثانول، أجهزة الطرد المركزي في 20،000 × ز لمدة 10 دقيقة في 4 درجات مئوية، وتجاهل طاف.
- تدور لفترة وجيزة وإزالة الإيثانول المتبقية مع 200 ميكرولتر ماصة.
- تدور لفترة وجيزة وإزالة الإيثانول المتبقية مع ماصة 20 ميكرولتر.
- لا تسمح الحمض النووي الريبي لتجف. Resuspend في 100 ميكرولتر H 2 O. مزيج جيد من قبل pipetting صعودا وهبوطا 5-6 مرات. احتضان عند 65 درجة مئوية لمدة 10 دقيقة مع اهتزاز ونقل مباشرة إلى جليد.
- التحقق من جودة RNA عن طريق التحليل electrophoretical لاستبعاد تدهور الحمض النووي الريبي.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
1. انطلاق مادة وعائدات المتوقعة
بعد 1 ساعة (HR) من 4sU التعرض RNA المحولة حديثا يمثل حوالي 1-4٪ من مجموع RNA الخلوية. هذا وسوف يكون أقل في الخلايا اعتقال النمو لأنها لم تعد توليف الحمض النووي الريبي لحساب لنمو الخلايا / النسخ المتماثل. عندما وصفها لمدة 1 ساعة، نوصي ببدء الفحص مع 60-80 ميكروغرام من الحمض النووي الريبي مجموع. بدءا من أقل من 30 ميكروغرام من الحمض النووي الريبي مجموع النتائج في الكريات الحمض النووي الريبي الصغيرة التي من الصعب أن نرى بعد خطوة biotinylation وبالتالي يمكن أن تضيع بسهولة. ويمكن زيادة مستويات الحمض النووي الريبي المدخلات إلى قدر 150 ميكروغرام لفترات قصيرة جدا من وضع العلامات (مثلا 5 - 10 دقيقة). عندما يتم تقصير المدة من الحمض النووي الريبي وضع العلامات من 1 ساعة إلى 5 دقائق مساهمة متواليات intronic لم يدم طويلا في زيادة RNA كتب حديثا من ~ ~ 60٪ إلى 80٪ 9. كما الإنترونات هي أطول بكثير بالمقارنة مع الترميز متواليات وكذلك 5'و3'-UTRs، وكمية من كتب حديثاالحمض النووي الريبي، والتي يمكن تنقيته عقب قصيرة أو حتى قصيرة جدا 4sU الجغرافية، لا يسهو خطيا. على هذا النحو، حصلنا على> 0.5٪ من مجموع الحمض النووي الريبي بعد 5 دقائق من 4sU الجغرافية في خطوط غير ملتصقة B-الخلية البشرية 9. ومع ذلك، ينبغي الإشارة إلى أن تركيز أعلى من فترات 4sU وأطول قليلا من وضع العلامات قد تكون هناك حاجة إلى تحقيق معدلات التأسيس 4sU مماثلة في الخلايا الملتصقة. بينما حتى معدل 4sU التأسيس منخفضة تسمح التقاط كفاءة وتنقية النصوص الكبيرة، الغنية يوريدين، نص قصير جدا مع المحتوى المنخفض يوريدين (على سبيل المثال miRNAs) من المرجح أن يهرب تنقية حتى عند استخدام تركيزات عالية 4sU (> 1 ملم). في الخلايا الليفية الفئران NIH-3T3، 1 ساعة من 200 ميكرومتر التعرض 4sU المسمى RNA المحولة حديثا مع حوالي واحد لكل 4sU بقايا 50-100 النيوكليوتيدات (NT) 5. وهذا ينبغي السماح باستعادة كفاءة عالية من النصوص> 500 - 1000 NT في طول. وفقا لذلك، لاحظنا فقط حجم النص قاصرالتحيز عندما وصفها لمدة 1 ساعة باستخدام 200 ميكرومتر 4sU في كل من الخلايا الليفية الفئران وخلايا B-7 الإنسان. بينما 1 ساعة من 200 ميكرومتر 4sU لم تسفر عن أي تعديلات كبيرة في مستويات النصوص الخلوية في الخلايا الليفية الفئران، والتعرض لفترات طويلة من الخلايا ل≥ 200 ميكرومتر 4sU لا يؤدي إلى العجز نمو قابلة للقياس في غضون 24 ساعة (بيانات غير منشورة). ولذلك، ينبغي التقليل من كل من مدة وضع العلامات و4sU-التركيز المستخدمة لتجنب الآثار خارج الرحم أو السامة. طريقة سهلة لتحديد الحد الأدنى 4sU-التركيز المطلوب لاستعادة كفاءة من الحمض النووي الريبي المحولة حديثا هو لتنقية RNA المحولة حديثا بعد 4sU وضع العلامات مع زيادة تركيزات 4sU (على سبيل المثال 50-1600 ميكرومتر). كما هو مبين في أرقام 2A و 2B، والانتعاش من الحمض النووي الريبي المحولة حديثا المسمى لمدة 1 ساعة في الخلايا الليفية الإنسان الابتدائي زيادة كبيرة 50-200 ميكرومتر 4sU ولكن بعد ذلك بدأت في الهضبة.
2. نقطةلطخة الكمي التأسيس 4sU (اختياري)
في بعض الحالات قد تكون ذات فائدة لقياس كمية التأسيس 4sU في الحمض النووي الريبي مجموع. من الأفضل القيام بذلك عن طريق تحليل لطخة نقطة على الحمض النووي الريبي البيروكسيديز باستخدام المكورات streptavidin. ونظرا لطبيعة الكيميائية iodoacetyl-البيوتين هو أكثر استجابة لمطالب ثيول مجموعات من البيوتين HPDP مما أدى إلى biotinylation من كافة المخلفات 4sU في الحمض النووي الريبي المحولة حديثا. ومن المهم أن نلاحظ أنه، مثل البيوتين HDPD، iodoacetyl-البيوتين ليس للذوبان في الماء، وبالتالي إزالة بكفاءة عن طريق استخراج كلوروفورم كما يؤديها لالبيوتين HPDP. ولذلك، ظروف التفاعل متطابقة وتركيزات يمكن توظيفه كأداة عند استخدام البيوتين HPDP. ومع ذلك، iodoacetyl-البيوتين لا يمكن عكسها. ويمكن بالتالي لا يمكن استخدامها لتنقية RNA المحولة حديثا في النهج القائم على العمود. في حين أن استخدام iodoacetyl-البيوتين يسمح لقياس 4sU التأسيس، والنظر في القياسات القائمة على البيوتين HPDP على حد سواء4sU التأسيس والكفاءة biotinylation. توظيف اثنين من الكواشف biotinylation لنفس العينة يسمح لقياس كفاءة biotinylation من الحمض النووي الريبي التي أدرجت 4sU. يبدو كفاءة Biotinylation من البيوتين HPDP ل4sU المسمى الحمض النووي الريبي إلى أن ما يقرب من ثلاثة أضعاف أقل من iodoacetyl-البيوتين تشير إلى أن حوالي واحد في ثلاثة 4sU المخلفات في الحمض النووي الريبي المحولة حديثا والمعقدة البيروكسيديز فعلا البيوتين HPDP (الشكل 3). عن طريق مقارنة شدة إشارة عينة مع التحكم المعقدة البيروكسيديز الحمض النووي بنسبة ضئيلة، ويمكن قياس كثافة biotinylation. بالنسبة لمعظم خطوط خلايا الثدييات إشارة إيجابية ينبغي أن يكون لا يزال يمكن اكتشافها في 10 نانوغرام من الحمض النووي الريبي البيروكسيديز بعد 1 ساعة من 200 ميكرومتر وضع العلامات 4sU. A إشارة الخلفية ضعيفة عادة للكشف عن أعلى تركيز (1 ميكروغرام) من الحمض النووي الريبي غير المسماة.
3. تنقية الحمض النووي الريبي كتب مؤخرا
الانتعاش من الحمض النووي الريبي المحولة حديثا هو تشيوان للغايةtitative. إذا كنت بدأت مع تركيز الحمض النووي الريبي نفسه هل يمكن أن نتوقع الحصول على نفس المبالغ المحولة حديثا من الحمض النووي الريبي لجميع العينات. مثل العديد من المقايسات القائمة على عمود، قد جمع من الحمض النووي الريبي المحولة حديثا باستخدام عدة MinElute RNeasy يؤدي إلى امتصاص إضافية في 230-260 نانومتر (وجود منظفات مشتقة من مخازن غسل) والتي قد تتداخل مع OD 260 القياسات. وينظر هذا إلى حد أقل عند استخدام 2 مل أنبوب جمع الطازجة لكل خطوة الطرد المركزي. ومع ذلك، ينبغي النظر في أي قياسات OD عالية بشكل غير معقول (> 2 أضعاف أكبر من عينات أخرى) مع الرعاية، لا سيما إذا OD 260/280 النسب <1.7. لتحاليل أسفل مجرى بالتالي فمن الأفضل غالبا إلى استخدام نفس الكمية من الحمض النووي الريبي حجم قالب لجميع العينات. في الحالات التي تكون فيها غلة من الحمض النووي الريبي المسمى أقل من المتوقع الاختيار بحثا عن علامات على تدهور الحمض النووي الريبي من خلال تحليل electrophoretical. RNA كتب حديثا يحتوي على كميات أكبر بكثير كبيرة، ونصوص unspliced مع العصابات الريباسي نموذجي كونها أقل بروزا (الشكل 4).
4. الكمي من الحمض النووي الريبي كتب مؤخرا
وأخيرا، ومعدلات إدماج 4sU في الحمض النووي الريبي المحولة حديثا يمكن أن يكون كميا عن طريق التحليل الطيفي مباشرة على أساس الحد الأقصى من امتصاص 4sU في 330 نانومتر وOD 330/260 نسبة 5،18. وهذا يتطلب> 3 ميكروغرام من الحمض النووي الريبي المسمى تتركز في حجم صغير (10-20 ميكرولتر) من خلال الأيزوبروبانول / هطول الإيثانول. لتجنب فقدان الحمض النووي الريبي بيليه صغيرة المشارك هطول مع 30 ميكروغرام من الجليكوجين nuclease خالية (Fermentas، # R0551) ينبغي أن يؤديها. وذروة إضافية مرئيا في 330 نانومتر وهو ما يعكس معدل إدماج 4sU في كتب حديثا RNA (الشكل 5).
/ files/ftp_upload/50195/50195fig1highres.jpg "/>
الشكل 1. يضاف مبدأ وضع العلامات الأيضية مع 4 thiouridine (4sU) 4sU إلى الخلايا ل(5-120 دقيقة) المطلوبة. وقت تليها إعداد الحمض النووي الريبي مجموع الخلوية. بعد biotinylation ثيول محددة، يتم فصل الحمض النووي الريبي مجموع الخلوية في 4sU المسمى، RNA المحولة حديثا، والخالي من الملصقات، RNA موجودة مسبقا باستخدام الخرز المغناطيسي streptavidin المغلفة. يتم استرداد كتب حديثا RNA من الخرز باستخدام عامل مختزل الذي يشق السندات ثاني كبريتيد التي تربط RNA المحولة حديثا إلى الخرز. انقر هنا لعرض أكبر شخصية .
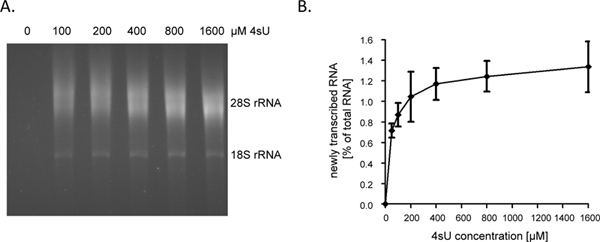
الشكل 2. الانتعاش من الحمض النووي الريبي المحولة حديثا بعد زيادة تركيزات 4sU. (A) وحضنت الخلايا الليفية الأولية القلفة الإنسان (HFF) مع 100، 200، 400، 800 أو 1،600 ميكرومتر من 4sU. تمت تنقية RNA المحولة حديثا من 50 ميكروغرام الحمض النووي الريبي مجموع الخلوية وتعرض لتحليل electrophoretical. كما هو متوقع، لوحظ وجود زيادة تعتمد على التركيز في الحمض النووي الريبي تعافى كتب حديثا والتي بدأت في هضبة بتركيزات أعلى. (B) وتم قياس كمية المبالغ المحولة من الحمض النووي الريبي تنقيته حديثا باستخدام برنامج 1.45s يماغيج. تعافى البيانات المجمعة من أربع تجارب مستقلة على المبالغ المحولة من الحمض النووي الريبي حديثا بعد تركيزات مختلفة من 4sU وضع العلامات تتراوح بين إما 50-800 ميكرومتر 4sU (ن = 2) أو 100 - ترد 1،600 ميكرومتر 4sU (ن = 2) اضغط هنا لعرض أكبر شخصية .
upload/50195/50195fig3.jpg "بديل =" الشكل 3 "FO: محتوى العرض =" 4.5in "FO: SRC =" / files/ftp_upload/50195/50195fig3highres.jpg "/>
الشكل (3). تم عزل تقدير التأسيس 4sU في الحمض النووي الريبي مجموع 4sU المسمى باستخدام تحليل لطخة نقطة. مجموع الحمض النووي الريبي من الخلايا الليفية الفئران NIH-3T3 أو الخلايا الليفية القلفة البشرية (HFF) حضنت مع 200 ميكرومتر 4sU لمدة ساعة واحدة. وأضيف لا 4sU إلى طبق واحد كما سيطرة سلبية. لHFF على حد سواء الاتصال مستعمل (ن = الخلايا غير نموا) تم تضمين والخلايا المتنامية (Y). تم عزل الحمض النووي الريبي باستخدام كاشف Trizol ومترافق في وقت لاحق إلى البيوتين HPDP أو iodoacetyl-البيوتين. تم تعديل تركيز كل عينة إلى 200 نانوغرام / ميكرولتر و 5 ميكرولتر من هذا التخفيف (أي 1 ميكروغرام من الحمض النووي الريبي)، فضلا عن ثلاثة التخفيفات 10 أضعاف اللاحقة (أي 100، 10، و 1 نانوغرام الحمض النووي الريبي، على التوالي)، وكانت جميع رصدت على قطعة من الغشاء زيتا. وضعت 5 ميكرولتر من التخفيفات البيوتين المسمى DNA بنسبة ضئيلة على الغشاء والضوابط الإيجابية في ويركزالأيونات تتراوح من 20 نانوغرام / ميكرولتر إلى 20 جزء من الغرام / ميكرولتر (أي 100-،1 نانوغرام، على التوالي). تم بحثها كثافة البيوتين باستخدام المكورات البيروكسيديز streptavidin-الفجل.
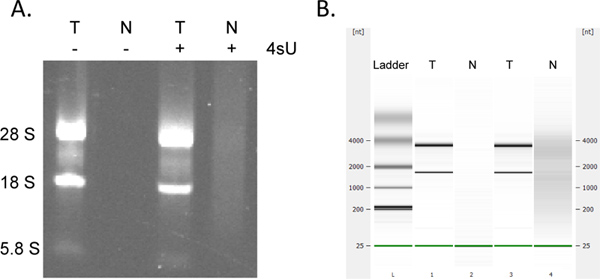
الشكل 4. تحليل Electrophoretical من الحمض النووي الريبي المحولة حديثا وتوتال. مجموع الحمض النووي الريبي (T) والحمض النووي الريبي المحولة حديثا (N) التي أعدت من الفئران الخلايا الليفية NIH-3T3 مثقف سواء في حضور وغياب 500 ميكرومتر 4sU لتم تحليل 1 ساعة بواسطة agarose هلام الكهربائي (A) و (في نفس الترتيب) باستخدام Bioanalyser اجيلنت (B). تم استرداد أي RNA دون علاج 4sU من الخلايا. تنقية كتب حديثا RNA يحتوي على كميات أكبر من ارتفاع mRNAs والوزن الجزيئي وrRNAs بشكل ملحوظ أقل نضجا من مجموعRNA كما ملحوظ بين 28S، 18S، و5.8S العصابات الريباسي. انقر هنا لعرض أكبر شخصية .
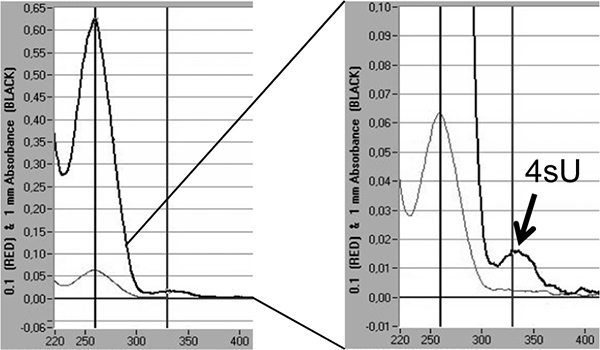
الشكل 5. الكمي التأسيس 4sU في الحمض النووي الريبي المحولة حديثا عن طريق التحليل الطيفي. RNA المحولة حديثا تنقيته من 2 × 100 الحمض النووي الريبي مجموع ميكروغرام بعد 1 ساعة من 200 ميكرومتر 4sU في الفئران الخلايا الليفية NIH-3T3. وقد عجلت RNA المحولة حديثا مع الأيزوبروبانول / الإيثانول بعد إضافة 30 ميكروغرام من الجليكوجين nuclease خالية. ويظهر التحليل الطيفي من الحمض النووي الريبي المحولة حديثا تم الحصول عليها من قبل معمل NanoDrop 1000 مقياس الطيف الضوئي. تمثل خطوط رمادية ضوء القياسات عند 0.1 ملم في حين تمثل وخطوط رمادية داكنة أكثر سمكا القياسات في 1 ملم عمود السائل. على اليمين، التكبير من ذروة انقراض تمثل روقال انه تدرج يظهر 4sU-المخلفات. استنادا إلى الانقراض المشترك الفعال لل4sU 18 يمكن تقدير معدلات إدماج 4sU.
| مدة وضع العلامات [دقيقة] | أوصت تركيز 4sU [ميكرومتر] |
| 120 | 100-200 |
| 60 | 200-500 |
| 15 - 30 | 500 - 1000 |
| <10 | 500 - 2000 |
الجدول 1. أوصت تركيزات 4sU.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
وضع العلامات الأيضية من الحمض النووي الريبي المحولة حديثا يعزز بشكل كبير من قوة تكنولوجيات عالية الإنتاجية مثل ميكروأرس وRNA وما يليها من خلال توفير قوالب أكثر ملاءمة لمعالجة هذه المسألة البيولوجية من الفائدة. خضع هذا البروتوكول الأمثل واسعة النطاق. لأنها تتيح تخصيب> 1،000 أضعاف من الحمض النووي الريبي المحولة حديثا ويوفر نتائج استنساخه للغاية.
التصميم التجريبي من تجربة 4sU الجغرافية يتسم بأهمية حاسمة كما RNA المحولة حديثا سوف تصور النشاط النسخي في الوقت الحقيقي فقط أثناء وقت التعرض من الخلايا ل4sU. إذا كانت التغييرات الفعلية في معدلات النسخ أعقاب التحفيز هدأت بالفعل، سيفتقد هذه عند تحليل الحمض النووي الريبي المحولة حديثا على الرغم من أن التغيرات في إجمالي مستويات الحمض النووي الريبي قد يكون لا يزال كشفها. لذلك، فهم جيد للبيولوجيا الأساسية من المهم أن تحدد الإعداد التجريبية وكذلك فترات الأمثل سالوقت و التعرض 4sU. أدناه، ونحن نقدم التوصيات وسبل لتجنب المخاطر المشتركة للخطوات الأكثر أهمية.
إعداد الحلول الأسهم والأدوات البلاستيكية
يجب أن يكون مستعدا جميع الحلول الأسهم باستخدام nuclease خالية من المياه. استخدام في المنزل تنقية الماء منزوع الأيونات قد يؤدي إلى مشاكل إذا كان الماء يحتوي على عوامل الاختزال. في حالة واحدة، أدى هذا إلى فقدان كامل لجميع الحمض النووي الريبي المسمى. ولذلك، فإننا نوصي بشدة شراء مسبقة الصنع nuclease خالية، كلوريد الصوديوم، تريس-CL، EDTA، سيترات الصوديوم والماء. ضمان ظروف nuclease خالية في جميع الأوقات. ثنائي ميثيل (DMF) يذوب بعض المواد البلاستيكية. لقد وجدنا أن استخدام 25 مل خلية ثقافة الماصات البلاستيكية لنقل DMF من قمقمه زجاج الأسهم إلى 50 مل أنابيب فالكون لإعداد محلول المخزون البيوتين HPDP كان كافيا للحد بشكل كبير غلة من الحمض النووي الريبي المحولة حديثا من الفحص كله. ومن المثير للاهتمام، وهذا لم يؤثر سلبا على biotinylكفاءة أوجه (كما تم اختبارها من قبل نقطة لطخة) ولكن أدت لل> فقدان 75 90٪ من الحمض النووي الريبي المحولة حديثا والتي يمكن استردادها من الخرز. كانت الخسارة أكثر وضوحا عندما تم تخفيض المدة من وضع العلامات من 60 إلى 30 دقيقة أو أقل. على الأرجح، مادة مزال من الماصات البلاستيكية من قبل DMF تدمير جزئي للطلاء من الخرز streptavidin. ولذلك، فإن استخدام المواد البلاستيكية غير معروف لتكون متوافقة مع DMF ينبغي تجنبها بكل الوسائل. لنفس الأسباب، مكاشط الخلية لا ينبغي أن تستخدم لتعزيز الانتعاش من عينات Trizol من لوحات ثقافة الخلية. ومن المثير للاهتمام أن نلاحظ أن المواد المفترضة مزال من البلاستيك من قبل DMF أو Trizol ما يبدو لا تزال من قبل كلوروفورم الاستخراج ولا الأيزوبروبانول / هطول الإيثانول.
خلية ثقافة
كثافة الخلايا على لوحات هي ذات أهمية حاسمة. في تجربة واحدة حيث يبدو أن الخلايا لتكون متموجة قليلا جدا (90 -100٪)، كنا نعامل والخلايا الليفية الفئران NIH-3T3 لمدة 30 دقيقة مع 100 U / مل مضاد للفيروسات (الإنترفيرون) α أو γ. في الخلايا أقل متكدسة حتى 15 دقيقة من العلاج الإنترفيرون أدى بالفعل في 5 - الحث على 8 أضعاف من الجينات مثل irf1 أو socs3 5. مع الخلايا كونه قليلا تحليل ميكروأري متموجة أيضا لم تظهر أي تحريض الجينات الإنترفيرون محرض حتى لقابل للتحريض معظم الجينات بسرعة مثل irf1 أو socs3. ولذلك، كثافة الخلية هو عامل حاسم للتجارب 4sU وضع العلامات وجميع لوحات زراعة الخلايا ينبغي أن تدرس بعناية قبل البدء في وضع العلامات.
4sU هو ريبونوكليوزيد photoactivatable وcrosslinked المحتوية 4sU-RNA بكفاءة للبروتينات بعد التعرض إلى 365 نانومتر مصدر الضوء. يجب أن يكون مثقف الخلايا المعالجة 4sU في الظلام والتعرض للضوء الساطع يجب تجنبها. بعد إزالة البروتينات الخلوية بواسطة Trizol عزل الحمض النووي الريبي هو انخفاض كبير من هذه المخاطر.
<فئة P = "jove_content" لم يتم إدراجها> 4sU في الحمض النووي الخلوي. ومع ذلك، ينبغي الإشارة إلى أن الحمض النووي الريبي مجموع سوف لا تزال تحتوي على كميات صغيرة من الحمض النووي الخلوي. عند استخدام 4sU الجغرافية والتحليل Q-RT-PCR لدراسة التعبير الجيني الفيروسي في عدوى الفيروس المضخم للخلايا وجدنا أنه من الضروري أن تشمل خلاصة خطوة DNaseI في بروتوكول لإزالة الجينوم الفيروسي concatemeric 19. هذا هو على الارجح وليس من الضروري عند استخدام بروتوكولات المصب التي ليست حساسة لوجود الحمض النووي.معدلات التأسيس 4sU وتركيز 4sU الأمثل
يؤخذ 4sU بسهولة حتى من قبل الخلايا مع مستويات داخل وخارج الخلوي على الأرجح تحقيق التوازن في أقل من دقيقة 9،16. امتصاص ودمج معدلات 4sU هي التي تعتمد على التركيز. ولذلك، تركيز 4sU يمكن تعديلها بسهولة وفقا لمدة يعملون لوضع العلامات. الجدول 1 يقدم المشورة بشأن تركيزات 4sU في RELأوجه لمدة صفها استنادا لدينا أفضل تجربة شخصية. لمدة 1 ساعة من وضع العلامات 4sU في خلايا الثدييات، وسوف 4sU 200 ميكرومتر تكون كافية بالنسبة لمعظم التطبيقات مما أدى إلى حوالي واحد لكل بقايا 4sU 50 إلى 100 النيوكليوتيدات في الحمض النووي الريبي في الخلايا الليفية المحولة حديثا.
في العامين الماضيين، وقد طبقنا 4sU الجغرافية لمجموعة واسعة من أنواع الخلايا من أصل الإنسان والفئران بما في ذلك الخلايا الليفية، الخلايا البطانية، والخلايا الظهارية وخلايا نخاع العظم سدى، الضامة، والخلايا التائية. وبالإضافة إلى ذلك، استخدمت بنجاح الخلايا من ذبابة الفاكهة والقيطم. في كل هذه التجارب، تم العثور على إدماج 4sU أن تكون ذات كفاءة عالية تتطلب التعديلات الطفيفة في تركيز 4sU لأنواع مختلفة من الخلايا. عند إعداد طريقة لأنواع الخلايا الجديدة، نود أن نوصي للخلايا التسمية مع زيادة 4sU-تركيزات (على سبيل المثال تتراوح 50-1600 ميكرومتر) وتحليل العلاقة بين تنقيته المحولة حديثا RNA إلى 4sU-تركيزات التطبيقية (انظر الشكل 2A / B). و4sU-تركيز عنده كمية من تنقية كتب حديثا RNA يدخل هضبة ينبغي اختيار.
في الحالات التي تستخدم فيها متكدسة للغاية، اتصل الخلايا مستعمل، فإننا نوصي لاستخدام تركيزات 4sU أعلى قليلا (مثل 500 بدلا من 200 ميكرومتر) لضمان إدماج 4sU كفاءة. بالإضافة إلى ذلك، في الحالات التي يكون فيها القبض على القصير جدا النصوص المحولة حديثا (<200 NT) هو موضع اهتمام خاص، قد تحتاج أيضا إلى أن زيادة تركيز 4sU. لا ينبغي الجمع بين هذا مع وضع العلامات مرات لفترات طويلة (على سبيل المثال> 1 ساعة) من أجل تجنب الآثار خارج الرحم أو سمية. وأخيرا، وجدنا أن استخدام صغيرة جدا وبلغ حجم التداول سائل الإعلام والثقافة الخلية قد يقلل من كفاءة التأسيس 4sU. ولذلك، فإننا نوصي باستخدام 5 مل أو 10 مل من المتوسط في 10 سم أو 15 سم طبق، على التوالي.
إعداد الحمض النووي الريبي مجموع الخلوية
لنجاح هذا البروتوكول فمن الأهمية بمكان الحصول على نظيفة، خالية من ريبونوكلياز الحمض النووي الريبي مجموع الخلوية. باستخدام Trizol 5 مل لكل 15 سم طبق تنتج RNA نظيفة خالية من nucleases. نوصي باستخدام بروتوكول Trizol تعديلها من قبل Chomczynski وآخرون. 20. الأولى، هي مناسبة بشكل أفضل لعزل كميات كبيرة من الحمض النووي الريبي (> 100 ميكروغرام) مثل تعزيز النتائج قوة الطرد المركزي في الكريات أكثر حزما والتي هي أسهل في التعامل معها خلال خطوات الغسيل. ومع ذلك، وهذا يتطلب استخدام أنابيب البولي بروبلين والمحولات الخاصة والعادية 15 مل معمل أنابيب فالكون لا البقاء على قيد الحياة أكثر من 6،000 × ز. ثانيا، ويحسن إزالة الحمض النووي والبروتينات السكرية. هذا يصبح واضحا بشكل خاص عند إعداد الحمض النووي الريبي من الأعضاء أو الأنسجة. ثالثا، فإنه لا يحد أكبر قدر ممكن من الحمض النووي الريبي مجموع والتي يمكن أن تكون معزولة. على الرغم من أننا أيضا العثور على طرق عزل الحمض النووي الريبي القائم على عمود (على سبيل المثال RNeasy) لتوفير نوعية مناسبة من الحمض النووي الريبي، والأعمدة القياسية عه فقط قادرة على التقاط ما يصل إلى 100 ميكروغرام من الحمض النووي الريبي مجموع مما يحد من كمية من المواد ابتداء. وأخيرا، عن طريق إزالة الإيثانول المتبقية مرتين مع ماصة، والتجفيف من الحمض النووي الريبي لإزالة الإيثانول المتبقية لم تعد مطلوبة. هذا يلغي مخاطر الإفراط في تجفيف الحمض النووي الريبي، والتي قد يكون من الصعب حل مرة أخرى بعد ذلك. من حيث المبدأ، 4sU الجغرافية ينطبق في الجسم الحي، على سبيل المثال عن طريق الحقن الرابع من الفئران. ومع ذلك، لاحظنا أن نقاء RNA يمثل مشكلة كبرى تتطلب تنقية النصوص بوليا قبل تنقية الحمض النووي الريبي المحولة حديثا (بيانات غير منشورة).
Biotinylation وإزالة البيوتين غير منضم
البيوتين HPDP هو 100٪ ثيول محددة، وتشكل السندات ثاني كبريتيد بين بقايا البيوتين وثيول المسمى RNA الجزيئات المحولة حديثا. كفاءة Biotinylation من 4sU المسمى RNA هو حوالي 30٪ وفقا لما يحدده دوت تحليل لطخة 5. كما البيوتين HPDP ليس للذوبان في الماءويمكن إزالته بكفاءة عن طريق استخراج كلوروفورم. في حين أن واحدة كلوروفورم خطوة الاستخراج كافية لإزالة الغالبية العظمى من البيوتين غير منضم نكرر هذه الخطوة بانتظام لضمان إزالة كاملة. للحد من فقدان الحمض النووي الريبي خلال استخراج خطوة الكلوروفورم 2 مل المرحلة قفل جل الأنابيب الثقيلة (إيبندورف) يمكن استخدامها باتباع إرشادات الشركة المصنعة. وعادة ما نستخدم أنابيب قفل المرحلة فقط لكلوروفورم الثانية الخطوة استخراج إذ بلغ حجم قالب من الخطوة الأولى غالبا ما تكون مرتفعة جدا لتكون متوافقة مباشرة مع هذه الأنابيب. بعد إزالة غير منضم البيوتين HPDP، يتم استرداد RNA بواسطة الأيزوبروبانول / هطول الإيثانول. ومن المهم أن نلاحظ أن مجموعات التجارية القائمة على عمود لاسترداد RNA المعقدة البيروكسيديز (على سبيل المثال RNeasy من QIAGEN) لا ينبغي أن تستخدم لأنها تحتوي على الحد من وكلاء في المخازن المؤقتة المقدمة، التي يلتصق السندات ثاني كبريتيد وإزالة البيوتين من RNA المحولة حديثا .
تنقية جديدةلاي RNA المحولة
لا تضيف أكثر من 100 RNA المعقدة البيروكسيديز ميكرولتر إلى 100 حبات streptavidin ميكرولتر. مضيفا أقل حجم هو المفضل. ومع ذلك، ينبغي أن يضاف نفس الحجم من الحمض النووي الريبي لجميع العينات. ضبط حجم المدخلات الحمض النووي الريبي (بين العينات) التي تضيفها إلى حبات streptavidin ببساطة عن طريق إضافة وحدة التخزين المطلوبة من 1X TE إلى الخرز. طريقة سهلة لجعل الطازجة nuclease خالية-100 ملي DTT هو صب كمية كافية من مسحوق DTT في أنبوب فالكون وضعت على نطاق فائقة الحساسية ثم قم بإضافة المبلغ المطلوب من nuclease خالية-H 2 O لتوليد 100 ملي DTT (64.8 ميكرولتر المياه لكل 1 ملغ DTT).
خلال تطوير 4sU الجغرافية اختبرنا حبات streptavidin من مختلف الموردين. إنشاء عدد منها كميات كبيرة من الخلفية. ولذلك، فإننا نوصي بشدة باستخدام الخرز Streptavidin Miltenyi كما، حتى الآن، ونحن لم تشهد أي مشاكل مع المرحل من الحمض النووي الريبي الخالي من الملصقات من الأنسجة جعينات الحمض النووي الريبي ulture المشتقة. في هذه الطريقة، اقل من 150 نانوغرام من الحمض النووي الريبي المسمى يمكن تنقيته وتحديدا من 150 ميكروغرام البيروكسيديز الحمض النووي الريبي (في 100 ميليلتر من الماء) باستخدام 100 ميكرولتر من الخرز streptavidin. موازنة من الخرز مع المخزن المؤقت موازنة المرفقة مع حبات يمكن أداؤها ويمكن أن تعزز طفيف في معدلات القبض على 13.
ضوابط الجودة
نوصي أداء الضوابط Q-RT-PCR RNA على المحولة حديثا قبل إخضاعها لتحاليل عالية الإنتاجية. ويمكن أن تشمل هذه الكمي لعدة جينات مرجعية المعروف أن ينظم بشكل مختلف في الإعداد التجريبية معين. في الحالات التي يعمل 4sU الجغرافية لدراسة معدلات تسوس RNA، نود أن نوصي لقياس نسخة قصيرة الأجل (مثل MYC، مكتب الإحصاء الاتحادي) وطويلة العمر واحد (على سبيل المثال GAPDH) في الحمض النووي الريبي مجموع والمحولة حديثا على حد سواء. نسبة RNA المحولة حديثا / مجموع ينبغي أن يكون أعلى بكثير (~ 5 - إلى 10 أضعاف)للنصوص قصيرة الأجل. استنادا إلى الحمض النووي الريبي نصف عمر الجين المرجعية، يمكن تحديد الحمض النووي الريبي نصف حياة. إذا يتم تحليل جميع الكسور RNA الثلاثة (الحمض النووي الريبي مجموع، RNA المحولة حديثا والخالي من الملصقات RNA موجودة من قبل) لمدة أربعة أو أكثر الجينات، تطبيع مجموعات فرعية الحمض النووي الريبي مختلفة لا يمكن أن يؤديها من خلال تحليل الانحدار الخطي وعشرات مراقبة الجودة يمكن تحديد كما هو موضح 7 ، 21.
لتحليل Q-RT-PCR، ونحن نوصي باستخدام 2.5 ميكرولتر من الحمض النووي الريبي المسمى في 20 ميكرولتر مزيج [كدنا] التوليف. وعلى سبيل المقارنة الأمثل للنتائج Q-RT-PCR تجميد كدنا] في aliquots من 5 ميكرولتر قبل الاستخدام الأول. أنابيب ذوبان الجليد فقط قبل الاستخدام، إضافة 45 ميكرولتر من H 2 O وموضوع 5 ميكرولتر من التخفيفات إلى تحليلات Q-RT-PCR. هذا يعزز بشكل ملحوظ مقارنة بين مختلف أشواط PCR.
يجب فحص عينات الحمض النووي الريبي المحولة حديثا بحثا عن علامات على تدهور الحمض النووي الريبي باستخدام Bioanalyser اجيلنت قبل تعريضهم للتحليل الإنتاجية العالية (ميكروأرس أو RNA وما يليها). ومع ذلك، ينبغي الإشارة إلى أن العصابات إضافية لوحظ في بعض الأحيان من قبل Bioanalyser اجيلنت. أهمية بيولوجية من هذا لا يزال غير واضح. كما كتب حديثا RNA يحتوي على الحمض النووي الريبي أقل بكثير الريباسي، هذه العينات أحيانا تفشل ضوابط الجودة Bioanalyser اجيلنت. إذا لم يكن هذا بسبب مرئية RNA عينات تدهور نوعية مقبولة وعادة ما تكون غرامة التعرض للتحليل الإنتاجية العالية.
توافق RNA المحولة حديثا مع تحليلات أسفل مجرى
RNA كتب حديثا يحتوي على أكثر بكثير مرنا من الحمض النووي الريبي مجموع. ويرجع ذلك أساسا إلى كميات أكبر من تسلسل الحمض النووي الريبي في intronic المحولة حديثا والتي تزيد عندما يتم تقصير مدة 4sU الجغرافية هذا. ولذلك، فإننا لا تقوم بانتظام استنزاف rRNAs من عينات الحمض النووي الريبي المحولة حديثا وهذا يتطلب كميات أكبر من المواد بدءا بينما يقوم بتقديمجي القليل بدلا كسب (~ شقين) في غير الريباسي يقرأ. وأخيرا، يبقى أن لاحظت أن نسبة أكبر من unspliced، وارتفاع الوزن الجزيئي النصوص موجودة في الحمض النووي الريبي المحولة حديثا قد تتطلب تجزئة إضافية عند إعداد مكتبات [كدنا] تسلسل للجيل القادم. لذا ينبغي أن تكون نتائج تفتيت خطوة حجم جودة تسيطر عليها بعناية.
تطبيع البيانات لRNA قياسات نصف الحية
النهج المعتاد لتطبيع البيانات التجريبية لRNA قياسات نصف العمر هو تطبيع كافة البيانات إلى RNA نصف عمر الجين منزل حفظ تتميز بشكل جيد أو الحمض النووي الريبي متوسط نصف العمر في نوع خلية معينة تحدد في التجارب السابقة. في خلايا الثدييات، وهذه الأخيرة تقع في نطاق 5-10 ساعة 6،7. في حين أن هذا النهج أيضا يعمل بشكل جيد جدا بالنسبة لقياسات 4sU، يطلب من وسائل أخرى للتطبيع إذا كان الحمض النووي الريبي متوسط نصف العمر غير معروف أو إذا كان MAY حتى تتأثر تغييرات في نظام الهاتف الخلوي قيد الدراسة، على سبيل المثال من قبل خروج المغلوب من مسار تسوس الحمض النووي الريبي. 4sU الجغرافية يوفر وسيلة فريدة من نوعها لتقدير RNA متوسط نصف العمر استنادا إلى تحليل الحمض النووي الريبي من جميع الكسور ثلاثة، أي الحمض النووي الريبي مجموع الخلوية، RNA المحولة حديثا، والخالي من الملصقات RNA موجودة من قبل. كما يتم فصل الحمض النووي الريبي مجموع الخلوية في الأخيرتين الكسور RNA ويمكن استخدام نموذج الانحدار الخطي البسيط لتطبيع الكسور RNA الثلاثة مع بعضها البعض وتحديد الحمض النووي الريبي متوسط عمر النصف 7،16. حزمة برامج متاحة على الانترنت لأداء هذه التحليلات 22.
القبض على مجدي من النصوص ذات المحتوى المنخفض من يوريدين قد تؤثر على الحمض النووي الريبي قياسات نصف العمر مما يؤدي إلى نسب منخفضة بشكل مصطنع RNA المحولة حديثا / مجموع والمطول RNA نصف حياة. ويمكن تقييم حجم هذه المشكلة عن طريق التآمر RNA نصف حياة أو سجل (مجموع نسب RNA المحولة حديثا /) ضد uridiمحتوى شمال شرق لجميع النصوص 7،15. وهذا يوفر أيضا مراقبة نوعية جيدة لتقييم الفروق في معدلات 4sU التأسيس بين العينات أو ظروف مختلفة. في الحالات التي لوحظ وجود علاقة كبيرة إلى المحتوى يوريدين هذا قد يكون تصحيح لمن قبل بيوينفورمتيك يعني 15. ومع ذلك، تجدر الإشارة إلى أن مساهمة النصوص الناضجة في الحمض النووي الريبي المحولة حديثا لا يمكن أن يفرق بسهولة من أكبر من ذلك بكثير، وبالتالي أكثر من ذلك بكثير السلائف الغنية يوريدين. ما لم يعرف حركية تجهيز نسخة معينة (التي هي عادة لا) ببساطة تصحيح لمحتوى منخفض يوريدين (التقاط غير فعال) يمكن أن تشوه بشكل فاضح RNA نصف حياة. على هذا النحو، وجدنا مؤخرا تجهيز معظم snoRNAs الإنسان أن تكون فعالة للغاية 9. إذا كنا قد صحح نسب RNA المحولة حديثا / المشاركات عن محتوى يوريدين منخفضة من صغيرة إلى حد ما (70-300 NT) snoRNAs، هذا من شأنه أن أدت في snoRNA قصيرة للغاية نصف ليفES (<5 دقائق) مع العديد من نسب RNA المحولة حديثا / إجمالية تزيد عن 100٪. ولذلك، ونحن عموما لا ننصح تصحيح لمحتوى منخفض يوريدين عند قياس الحمض النووي الريبي نصف حياة.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgments
ونود أن نشكر إيمي ريغان لقراءة متأنية للمخطوطة. وأيد هذا العمل من قبل NGFN زائد منحة # 01GS0801، MRC زمالة منحة G1002523 وNHSBT منحة WP11-05 إلى LD وDFG منحة FR2938/1-1 إلى CCF
Materials
| Name | Company | Catalog Number | Comments |
| 4-thiouridine | Carbosynth | T4509 | Prepare 50 mM stock in sterile H2O, store at -20 °C in aliquots of 50-500 μl, discard unused reagent, do not refreeze. |
| Trizol | Invitrogen | 15596026 (100 ml), 15596018 (200 ml) | WARNING - CORROSIVE and HAZARDOUS TO HEALTH! Ensure immediate access to Phenol antidote (PEG-Methanol); Store at 4 °C. |
| Chloroform | Sigma | 372978 | WARNING - HAZARDOUS TO HEALTH |
| Isopropanol | Sigma | 650447 | |
| Sodium citrate, nuclease-free | Sigma | C8532 | Prepare 1.6 M stock solution using nuclease-free water. |
| 5M nuclease-free NaCl | Sigma | 71386 | Stock solution |
| Nuclease-free H2O | Sigma | W4502 | Make 1 ml aliquots in nuclease-free tubes. |
| RNA precipitation buffer | 1.2 M NaCl, 0.8 M sodium citrate in nuclease free water. Prepare in advance under strictly nuclease-free conditions. Store at room temperature in 50 ml falcon tubes. | ||
| Ethanol | Sigma | 459844 | Use with nuclease-free water to prepare 80% ethanol, store at -20 °C. |
| 1 M nuclease-free Tris Cl, pH 7.5 | Lonza | 51237 | Stock solution |
| 500 mM nuclease-free EDTA, pH 8.0 | Invitrogen | 15575-020 | Stock solution |
| 10x Biotinylation Buffer (BB) | 100 mM Tris pH 7.4, 10 mM EDTA in nuclease-free water, make aliquots of 1 ml. | ||
| Dimethylformamide (DMF) | Sigma | D4551 | |
| EZ-Link biotin-HPDP | Pierce | 21341 | Prepare 1 mg/ml stock solution by dissolving 50 mg biotin-HPDP in 50 ml DMF. Gentle warming enhances solubilisation. Store at 4 °C in aliquots of 1 ml. |
| Phase Lock Gel Heavy tubes 2.0 ml | Eppendorf | 0032 005.152 | Optional for the chloroform extraction step. |
| Zeta membrane | BIORAD | 162-0153 | |
| 10x Dot blot binding buffer | 100 mM NaOH, 10 mM EDTA | ||
| Biotin-oligo | 5'-biotin, 25 nucleotides, any sequence | ||
| Sodium dodecyl sulphate | Fisher | BPE9738 | For 100 ml 20% stock solution, add 20 g SDS to 80 ml PBS pH 7-8 and adjust volume to 100 ml. Keep all high-percentage SDS solutions above 20 °C. Warm the solutions slightly should SDS precipitate. |
| EZ-Link Iodoacetyl-LC-Biotin | Pierce | 21333 | Prepare 1 mg/ml stock solution by dissolving 50 mg iodoacetyl-biotin in 50 ml DMF. Gentle warming enhances solubilisation. Store at 4 °C in aliquots of 1 ml. Generates irreversible, thiol-specific biotinylation. |
| Phosphate buffer saline | Gibco | 10010-015 | |
| Dot blot blocking buffer | Mix 20 ml 20% SDS with 20 ml 1 x PBS pH 7-8 and add EDTA to the final concentration of 1 mM. | ||
| Streptavidin-horseradish peroxidase | Vector Laboratories | SA5004 | Store at -20 °C. Mix 10 ml 20% SDS with 10 ml 1 x PBS. Add 20 μl Streptavidin-HRP before use. |
| ECL reagent | GE Healthcare | RNP2109 | Use following the manufacturer's instructions. |
| Super RX, X-RA Film, 18x24 cm | Fujifilm | 47410 19236 | |
| μMacs Streptavidin Kit | Miltenyi | 130-074-101 | Store the beads at 4 °C. |
| Tween 20 | Sigma | P1379 | |
| Washing buffer | 100 mM Tris pH 7.4, 10 mM EDTA, 1 M NaCl, 0.1% Tween 20 in nuclease-free H2O. | ||
| Dithiothreitol (DTT) | Sigma | 43817 | Prepare as 100 mM DTT in nuclease-free H2O, always prepare fresh before use. |
| RNeasy MinElute Kit | Qiagen | 74204 | Store columns at 4 °C, remaining components of the kit at room temperature. |
| 1.5 ml screw-top polypropylene tubes | Sarstedt | 72.692.005 | Compatible with Dimethylformamide |
| 2.0 ml screw-top polypropylene tubes | Sarstedt | 72.694.005 | Compatible with Dimethylformamide |
| 15 ml tubes | BD Falcon | 352096 | Compatible with Dimethylformamide |
| 50 ml tubes | BD Falcon | 352070 | Compatible with Dimethylformamide |
| All solutions/reagents should be stored at room temperature unless otherwise specified. | |||
| Equipment | |||
| UV/VIS spectrophotometer | Thermo Scientific | NanoDrop 1000 | Or equivalent. Use low volume (1-2 μl) for measurements of low RNA concentrations to avoid excessive sample loss. |
| Polypropylene 15 ml centrifuge tubes | VWR International | 525-0153 | In contrast to standard 15 ml tubes, these tolerate up to 15,000 × g |
| High-speed centrifuge | Beckman Coulter | Avanti J-25 | Or equivalent equipment capable of reaching 13,000×g |
| High-speed rotor | Beckman Coulter | JLA-16250 | Or equivalent equipment capable of reaching 13,000×g |
| Adaptors for 15 ml tubes | Laborgeräte Beranek | 356964 | Or equivalent equipment capable of reaching 13,000×g |
| Refrigerated table-top centrifuge | Eppendorf | 5430 R | Or equivalent. |
| Thermomixer | Eppendorf | Thermomixer compact | Or equivalent. |
| Magnetic stand | Miltenyi Biotec | 130-042-109 | One stand holds 8 μMacs columns. |
| Waterbath | Grant | SUB Aqua 5 | Or equivalent. |
| Ultra-fine scale | A&D | GR-202 | Or equivalent. |
| E-Gel iBase Power System | Invitrogen | G6400UK | For RNA gels; or equivalent. |
| E-Gel EX 1% agarose precast gels | Invitrogen | G4020-01 | For RNA gels; or equivalent. |
References
- Brown, P. O., Botstein, D. Exploring the new world of the genome with DNA microarrays. Nature Genetics. 21, 33-37 (1999).
- Mortazavi, A., Williams, B. A., Mccue, K., Schaeffer, L., Wold, B. Mapping and quantifying mammalian transcriptomes by RNA-Seq. Nature Methods. 5, 621-628 (2008).
- Nagalakshmi, U., Wang, Z., et al. The transcriptional landscape of the yeast genome defined by RNA sequencing. Science. 320, 1344-1349 (2008).
- Wilhelm, B. T., Marguerat, S., et al. Dynamic repertoire of a eukaryotic transcriptome surveyed at single-nucleotide resolution. Nature. 453, 1239-U1239 (2008).
- Dölken, L., Ruzsics, Z., et al. High-resolution gene expression profiling for simultaneous kinetic parameter analysis of RNA synthesis and decay. RNA. 14, 1959-1972 (2008).
- Yang, E., van Nimwegen, E., et al. Decay rates of human mRNAs: correlation with functional characteristics and sequence attributes. Genome Res. 13, 1863-1872 (2003).
- Friedel, C. C., Dölken, L., Ruzsics, Z., Koszinowski, U. H., Zimmer, R. Conserved principles of mammalian transcriptional regulation revealed by RNA half-life. Nucleic Acids Res. 37, e115 (2009).
- Nilsen, T. W., Graveley, B. R. Expansion of the eukaryotic proteome by alternative splicing. Nature. 463, 457-463 (2010).
- Windhager, L., Bonfert, T., et al. Ultra short and progressive 4sU-tagging reveals key characteristics of RNA processing at nucleotide resolution. Genome Res. , (2012).
- Melvin, W. T., Milne, H. B., Slater, A. A., Allen, H. J., Keir, H. M. Incorporation of 6-thioguanosine and 4-thiouridine into RNA. Application to isolation of newly synthesised RNA by affinity chromatography. Eur. J Biochem. 92, 373-379 (1978).
- Cleary, M. D., Meiering, C. D., Jan, E., Guymon, R., Boothroyd, J. C. Biosynthetic labeling of RNA with uracil phosphoribosyltransferase allows cell-specific microarray analysis of mRNA synthesis and decay. Nature Biotechnology. 23, 232-237 (2005).
- Kenzelmann, M., Maertens, S., et al. Microarray analysis of newly synthesized RNA in cells and animals. Proc. Natl. Acad. Sci. U.S.A. 104, 6164-6169 (2007).
- Schwanhäusser, B., Busse, D., et al. Global quantification of mammalian gene expression control. Nature. 473, 337-342 (2011).
- Rabani, M., Levin, J. Z., et al. Metabolic labeling of RNA uncovers principles of RNA production and degradation dynamics in mammalian cells. Nat. Biotechnol. , (2011).
- Miller, M. R., Robinson, K. J., Cleary, M. D., Doe, C. Q. TU-tagging: cell type-specific RNA isolation from intact complex tissues. Nat. Methods. 6, 439-441 (2009).
- Miller, C., Schwalb, B., et al. Dynamic transcriptome analysis measures rates of mRNA synthesis and decay in yeast. Mol. Syst. Biol. 7, 458 (2011).
- Weintz, G., Olsen, J. V., et al. The phosphoproteome of toll-like receptor-activated macrophages. Mol. Syst. Biol. 6, 371 (2010).
- Lipsett, M. N. The isolation of 4-thiouridylic acid from the soluble ribonucleic acid of Escherichia coli. Journal of Biological Chemistry. 240, 3975-3978 (1965).
- Marcinowski, L., Liedschreiber, M., et al. Real-time Transcriptional Profiling of Cellular and Viral Gene Expression during Lytic Cytomegalovirus Infection. PLoS Pathog. 8, e1002908 (2012).
- Chomczynski, P., Mackey, K. Short technical reports. Modification of the TRI reagent procedure for isolation of RNA from polysaccharide- and proteoglycan-rich sources. Biotechniques. 19, 942-945 (1995).
- Friedel, C. C., Dölken, L. Metabolic tagging and purification of nascent RNA: implications for transcriptomics. Mol. Biosyst. 5, 1271-1278 (2009).
- Friedel, C. C., Kaufmann, S., Dölken, L., Zimmer, R. HALO - A Java framework for precise transcript half-life determination. Bioinformatics. , (2010).



