Non-gjennomlysning kateter Tracking for Gjennomlysning Reduksjon i Intervensjonselektro
Summary
Radiation exposure is an underestimated risk in complex ablation procedures. Here, we describe a protocol to significantly decrease fluoroscopy time and dosage for both the patient and the lab staff by using a novel non-fluoroscopic catheter visualization system.
Abstract
En teknologisk plattform (MediGuide) har nylig blitt introdusert for ikke-gjennomlysning kateter sporing. I flere undersøkelser har vi vist at anvendelsen av denne ikke-fluoroskopisk kateter visualiseringssystem (NFCV) reduserer gjennomlysning tid og dosering av 90-95% i en rekke elektrofysiologiske (EP) prosedyrer. Dette kan være av betydning ikke bare for pasientene, men også til de sykepleiere og leger i EP laboratoriet. Videre i en undergruppe av indikasjoner som supraventrikulær takykardi, gjør NFCV et helt røyk gjennomlysning prosedyre og lar lab ansatte til å arbeide uten å ha bly forklær. Med denne protokollen, viser vi at selv komplekse prosedyrer som ablations av atrieflimmer, som vanligvis er forbundet med gjennomlysning tider> 30 min i konvensjonelle innstillinger, kan trygt utføres med en reduksjon på> 90% i gjennomlysning eksponering ved ytterligere bruk av NFCV.
Introduction
Kateterablasjon har blitt en standard terapi i behandlingen av mange arytmier. Mens ulike ablasjon strategier er blitt foreslått og er for tiden anvendes, er alle ablasjon prosedyrer dele en felles i deres nødvendighet for bruk av gjennomlysning for å visualisere katetre. Tung avhengighet av bruk av levende x-ray for ablasjon prosedyrer ble mildnet i 1990-årene med bruk av 3D electroanatomical kartsystemer (EAMS) som bidro til å redusere stråling tid og dosering. Integrering av hjerteavbildning bruker magnetic resonance imaging (MRI) og computertomografi (CT) ble vist å ytterligere redusere gjennomlysning eksponering under ablasjon prosedyrer en. Mer nylig har en ny teknologi for kateter visualisering, kalt MediGuide- (MG) teknologi, blitt introdusert som ytterligere kan lette reduksjon i stråling 2,3. Detaljer er tidligere blitt beskrevet 4,5. Kort, single-spiral sensorer embedded i kateterspissen kan bli nøyaktig lokalisert ved et elektromagnetisk felt. Informasjon om 3D-posisjon og orientering av verktøyene blir deretter overført til gjennomlysning systemet og brukes til å visualisere kateterspissen i en virtuell bi-planriss projisert på to forhåndsinnspilte cine sløyfer. Det har tidligere vært vist at anvendelsen av MG-teknologi kan føre til en betydelig reduksjon i gjennomlysning belastning ved hjelp av diagnostiske kateter i atrieflutter 4 og ved å bruke både diagnostisk og ablasjon katetre i flere supraventrikulær takykardi (SVT) 6 og atrial fibrillering (AF ) 7 saker. Det kan være bekymringer om at anvendelsen av ikke-fluoroskopisk kateter visualisering (NFCV) teknologi kan øke risikoen prosedyre i fravær av kateterskaftet visualisering og kateter lokalisering som er utelukkende basert på plasseringen av katetertuppen. Det ble demonstrert at komplikasjoner er lik eller enda lavere for å procedures utført med konvensjonelle redskaper 14. Dette kan forklares med en begrensning av konvensjonelle prosedyrer: bare i en viss prosentandel av prosedyren kateter vil være "synlig". Dette endret ved bruk av NFCV teknologi siden katetre vil være synlig under hele prosedyren på denne virtuelle biplanar visning.
I denne protokollen, utfører vi en ablasjon av atrieflimmer hos en pasient med paroksysmal, narkotika-ildfast og svært symptomatisk atrieflimmer. Målet med denne protokollen er å oppnå de samme sluttpunkter som i en konvensjonell fremgangsmåte, dvs., isolering av alle lungevenene med påvist toveis blokk, og for å redusere eksponering gjennomlysning for pasienten ved> 90% sammenlignet med konvensjonelle innstillinger via Ytterligere bruk av NFCV teknologi.
Protocol
Representative Results
Discussion
Stråling for intervensjons kardiologer og elektrofysiologer er en undervurdert risiko på grunn av sine uforutsigbare bivirkninger. Aktuell litteratur avslører en høyere forekomst av venstre-sidig hjernesvulster blant denne undergruppen av klinikere, noe som tyder på at nærhet til den venstre hjernehalvdelen til X-Ray Kilden kan være en gjerningsmann 12. Latensen mellom stråling og diagnostisering av neoplasi er blitt rapportert å være 20 år eller mer. Derfor bør dagens interventionalists bruke alle teknologiske muligheter for å redusere stråling til et minimum.
Den NFCV systemet kan bidra til å redusere gjennomlysning eksponering uten å påvirke prosedyretid 14,15 med en arbeidsflyt som var tilpasset flere ganger i løpet av de siste tre årene for å redusere stråling i henhold til ALARA-prinsippet.
3D-kartsystemer kan bidra til bedre forståelse av komplekse tre-dimensjonal structures, men den grunnleggende orientering for operatøren blir generert ved bruk av konvensjonell fluoroskopi.
Den transseptal punktering fortsatt den største medvirkende trinn (75-80%) av stråledosen under disse prosedyrene siden ingen sensor utstyrt materiale for bruk sammen med NFCV teknologien er for tiden tilgjengelig. Spesielt i uerfarne hender dette representerer den mest kritiske trinnet ved at procedure- andre bildediagnostikk (som intrakardiell eller transesophageal ekko) kan bidra til trygge punkteringer og lave komplikasjoner.
Den NFCV er ikke bare brukt i ablasjon prosedyrer, men også i komplekse implantasjoner eksempel hjerte resynkroniseringsbehandling (CRT). I disse fremgangsmåter, tillater systemet å redusere byrden med gjennomlysning 75-80% sammenlignet med konvensjonelle 13 implantasjoner. En fersk publikasjon kunne vise at etter en læringskurve av 30-40 prosedyrer en median gjennomlysning tid på 1,1 min for 50 påfølgende pasienterer gjennomførbart og trygt 14. Dette ble bekreftet ved forlengelse datainnsamlings- til> 500 pasienter (se figur 4).
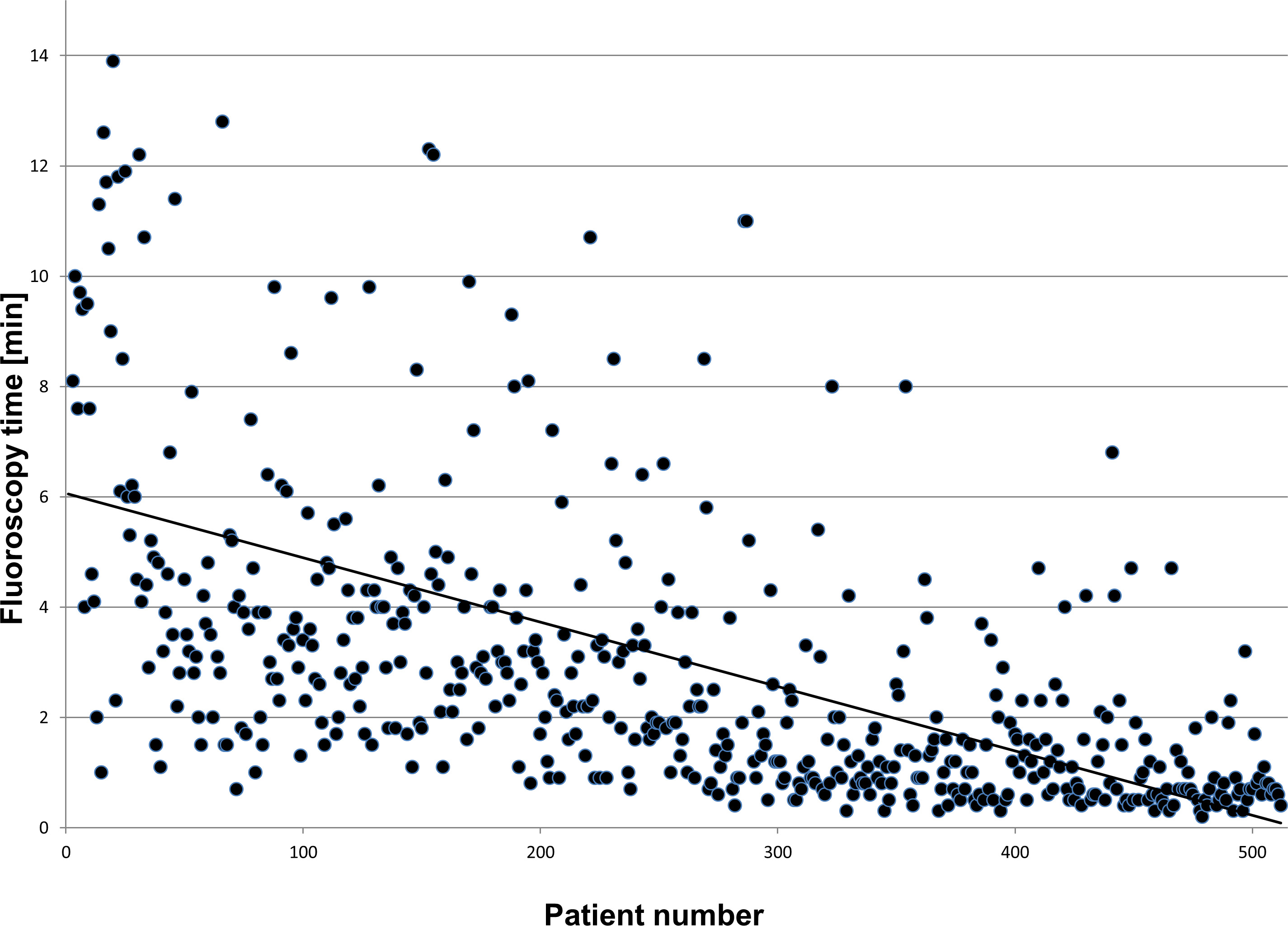
Figur 4: Klikk her for å se en større versjon av dette tallet.
Begrensningen av dagens tilgjengelige systemet er at bare tuppen av kateter er visualisert. Uerfarne operatører vil sannsynligvis ikke være i stand til å interpolere fra orienteringen av spissen for å vite hvordan posisjonen til kateterskaftet vil være. Videre er systemet ikke er i stand til å visualisere transseptal skjede ennå. Bare et begrenset utvalg av katetre er for tiden tilgjengelig-derfor bare et begrenset antall forskjellige fremgangsmåter er egnet ved hjelp av NFCV teknologi.
I nær fremtidflere anordninger og verktøy vil være tilgjengelig som er utstyrt med en sensor for å bli visualisert uten fluoroskopisk. Systemet fungerer her i utgangspunktet som et hjerte plattform for ulike prosedyrer; elektrofysiologi er bare det første programmet som har blitt innført.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We acknowledge the funding by SJM.
Materials
| MediGuide System | SJM | MG1000 | Non fluoroscopic mapping system |
| Patient Reference Sensor (PRS) Patch | SJM | H700071 | Reference sensor |
| Livewire™ Diagnostic Catheter MediGuide Enabled™ | SJM | D402058 | diagnostic catheter |
| Agilis Nxt steerable introducers 71cm small curle | SJM | 408309 | steerable sheath |
| BRK transseptal needle and stainless steel stylet | SJM | 408314 | transseptal needle |
| EnSite Velocity patch set | SJM | 100003331 | 3D mapping tools |
| Safire BLU | SJM | A088087 | Ablation catheter |
| Sensitherm | SJM | 26155ST | thermoprobe |
| Siemens Artis | Siemens | x | X Ray biplanar |
| Ensite Velocity v. 2.1 | SJM | x | 3D mapping system |
| Ampere generator | SJM | H700494 | RF generator |
| Ampere Remote control | SJM | H700490 | Remote control for generator |
| Cool point | SJM | IBI-89003 | Irrigation pump |
| Cool point tubing set | SJM | 85785 | Tubing set |
References
- Caponi, D., et al. Ablation of atrial fibrillation: Does the addition of three-dimensional magnetic resonance imaging of the left atrium to electroanatomic mapping improve the clinical outcome?), A randomized comparison of carto-merge vs. Carto-xp three-dimensional mapping ablation in patients with paroxysmal and persistent atrial fibrillation. Europace. 12, 1098-1104 (2010).
- Flugelman, M. Y., et al. Medical positioning system: A technical report. EuroIntervention. 4, 158-160 (2008).
- Jeron, A., et al. First-in-man (fim) experience with the magnetic medical positioning system (mps) for intracoronary navigation. EuroIntervention. 5, 552-557 (2009).
- Sommer, P., Rolf, S., Richter, S., Hindricks, G., Piorkowski, C. non-fluoroscopic catheter tracking: The mediguide system. Herzschrittmacherther Elektrophysiol. 23, 289-295 (2012).
- Sommer, P., et al. Initial experience in ablation of typical atrial flutter using a novel three-dimensional catheter tracking system. Europace. 15, 578-581 (2013).
- Sommer, P., et al. Mediguide in supraventricular tachycardia: Initial experience from a multicentre registry. Europace. 15, 1292-1297 (2013).
- Rolf, S., et al. Catheter ablation of atrial fibrillation supported by novel nonfluoroscopic 4d navigation technology. Heart Rhythm. 10, 1293-1300 (2013).
- Piorkowski, C., et al. Steerable versus nonsteerable sheath technology in atrial fibrillation ablation: A prospective, randomized study. Circ Arrhythm Electrophysiol. 4, 157-165 (2011).
- Eitel, C., et al. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: The pace-and-ablate approach. Heart Rhythm. 7, 157-164 (2010).
- Halm, U., et al. Thermal esophageal lesions after radiofrequency catheter ablation of left atrial arrhythmias. Am J Gastroenterol. 105, 551-556 (2010).
- Vallakati, A., et al. Impact of nonfluoroscopic mediguide tracking system on radiation exposure in radiofrequency ablation procedures (less-rads registry)-an initial experience. J Interv Card Electrophysiol. 38, 95-100 (2013).
- Roguin, A., Goldstein, J., Bar, O., Goldstein, J. A. Brain and neck tumors among physicians performing interventional procedures. Am J Cardiol. 111 (9), 1368-1372 (2013).
- Richter, S., et al. Cardiac resynchronization therapy device implantation using a new sensor-based navigation system: results from the first human use study. Circ Arrhythm Electrophysiol. 6 (5), 917-923 (2013).
- Sommer, P., et al. Non-fluoroscopic catheter visualization in AF ablation: experience from 375 consecutive procedures. Circ Arrhythm Electrophysiol. 7 (5), 869-874 (2014).
- Sommer, P., Richter, S., Hindricks, G., Rolf, S. Non-fluoroscopic catheter visualization using MediGuide technology: experience from the first 600 procedures. J Interv Card Electrophysiol. 40 (3), 209-214 (2014).
- Eitel, C., et al. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: the pace-and-ablate approach. Heart Rhythm. 7 (2), 157-164 (2010).
- Rolf, S., et al. Tailored Atrial Substrate Modification Based On Low-Voltage Areas in Catheter Ablation of Atrial Fibrillation. Circ Arrythm Electrophysiol. 7, 483-489 (2014).

