No fluoroscópica Seguimiento catéter para la Reducción de fluoroscopia en Electrofisiología Intervencionista
Summary
Radiation exposure is an underestimated risk in complex ablation procedures. Here, we describe a protocol to significantly decrease fluoroscopy time and dosage for both the patient and the lab staff by using a novel non-fluoroscopic catheter visualization system.
Abstract
Una plataforma tecnológica (MediGuide) se ha introducido recientemente para el seguimiento del catéter no fluoroscópica. En varios estudios, hemos demostrado que la aplicación de este sistema de visualización catéter no fluoroscópica (Nfcv) reduce el tiempo de fluoroscopia y la dosis por 90-95% en una variedad de procedimientos de electrofisiología (EP). Esto puede ser de relevancia no sólo para los pacientes, sino también a las enfermeras y médicos que trabajan en el laboratorio de EP. Además, en un subconjunto de indicaciones tales como taquicardias supraventriculares, Nfcv permite un procedimiento completamente no fluoroscópica y permite que el personal de laboratorio a trabajar sin llevar delantales de plomo. Con este protocolo, se demuestra que los procedimientos más complejos como ablaciones de la fibrilación auricular, que normalmente se asocian con tiempos de fluoroscopia de> 30 min en escenarios convencionales, con seguridad se puede realizar con una reducción de> 90% en la exposición fluoroscopia por el uso adicional de Nfcv.
Introduction
La ablación con catéter se ha convertido en una terapia estándar en el tratamiento de muchas arritmias. Aunque se han propuesto diferentes estrategias de ablación y se aplica en la actualidad, todos los procedimientos de ablación comparten una uniformidad en su necesidad para el uso de fluoroscopia para visualizar catéteres. La excesiva confianza en el uso de rayos X en vivo para procedimientos de ablación se alivió en la década de 1990 con el advenimiento de los sistemas de cartografía electroanatómica 3D (EAMS) que ayudaron a reducir significativamente el tiempo de la radiación y la dosis. Integración de imagen cardiaca utilizando imágenes de resonancia magnética (MRI) y tomografía computarizada (TC) ha demostrado reducir aún más la exposición fluoroscopia durante los procedimientos de ablación 1. Más recientemente, una nueva tecnología para la visualización del catéter, llamada la tecnología MediGuide- (MG), se ha introducido que puede facilitar una mayor reducción en la exposición a la radiación 2,3. Los detalles se han descrito previamente 4,5. En pocas palabras, los sensores de bobina simple embedded en la punta del catéter puede localizar exactamente por un campo electromagnético. Información acerca de la posición 3D y orientación de las herramientas se transfiere entonces al sistema de fluoroscopia y se utiliza para visualizar la punta del catéter en una vista bi-planar virtual proyectada en 2 bucles de cine pregrabados. Se ha demostrado previamente que la aplicación de la tecnología MG puede conducir a una reducción significativa en la carga de fluoroscopia utilizando catéteres de diagnóstico en el aleteo auricular 4 y mediante el uso de ambos catéteres de diagnóstico y ablación en varios taquicardias supraventriculares (SVT) 6 y la fibrilación auricular (FA 7) casos. Puede haber preocupación de que la aplicación de la tecnología de visualización catéter no fluoroscópica (Nfcv) puede aumentar los riesgos de procedimiento en ausencia de la visualización eje del catéter y la localización del catéter que se basa únicamente en la localización de la punta del catéter. Se demostró que la tasa de complicaciones es igual o incluso inferior a procedUres realiza con las herramientas convencionales 14. Esto podría explicarse por una limitación de los procedimientos convencionales: sólo en un cierto porcentaje de los catéteres procedimiento será "visible". Esto cambió con la aplicación de la tecnología Nfcv desde catéteres serán visibles durante todo el procedimiento en esta visión biplanar virtual.
En este protocolo, se realiza una ablación de la fibrilación auricular en un paciente con paroxística, refractaria a las drogas y la fibrilación auricular altamente sintomático. El objetivo de este protocolo es para lograr los mismos puntos finales como en un procedimiento convencional, es decir, el aislamiento de todas las venas pulmonares con bloque de bi-direccional probada, y para reducir la exposición de fluoroscopia para el paciente por> 90% en comparación con la configuración convencional a través de la uso adicional de la tecnología Nfcv.
Protocol
Representative Results
Discussion
Exposición a la radiación para los cardiólogos intervencionistas y electrofisiólogos un riesgo subestimado debido a sus impredecibles efectos secundarios. La literatura actual revela una mayor incidencia de tumores cerebrales del lado izquierdo entre este subgrupo de los médicos, lo que sugiere que la proximidad del hemisferio izquierdo a la fuente de rayos X puede ser un culpable 12. La latencia entre la exposición a la radiación y el diagnóstico de neoplasia ha sido informado de que 20 años o más. Por lo tanto, los intervencionistas de hoy en día deben utilizar todas las opciones tecnológicas para reducir la exposición a la radiación al mínimo.
El sistema Nfcv puede ayudar a reducir la exposición de fluoroscopia sin afectar el tiempo de procedimiento 14,15, con un flujo de trabajo que se ha adaptado varias veces en los últimos 3 años con el fin de reducir al mínimo la exposición de radiación de acuerdo con el principio ALARA.
Sistemas de cartografía 3D pueden ayudar a mejorar la comprensión de la compleja str 3 dimensionesuctures, pero la orientación básica para el operador se genera utilizando fluoroscopia convencional.
La punción transeptal sigue siendo el paso más grande que contribuye (75-80%) de la dosis de radiación durante estos procedimientos ya que ningún material sensor equipado para el uso con la tecnología Nfcv está disponible actualmente. Sobre todo en las manos inexpertos esto representa el paso más crítico en que otras modalidades de imagen Procedimiento (como intracardiaca o eco transesofágico) puede contribuir a los pinchazos seguras y bajas tasas de complicaciones.
El Nfcv no sólo se utiliza en procedimientos de ablación, sino también en implantaciones complejas, tales como la terapia de resincronización cardiaca (CRT). En estos procedimientos, el sistema permite la reducción de la carga fluoroscopia por 75-80% en comparación con los implantes convencionales 13. Una publicación reciente podría demostrar que después de una curva de aprendizaje de 30 a 40 procedimientos de un tiempo de fluoroscopia mediana de 1,1 min para 50 pacientes consecutivoses factible y segura 14. Esto se confirmó cuando la ampliación de la adquisición de datos a> 500 pacientes (ver Figura 4).
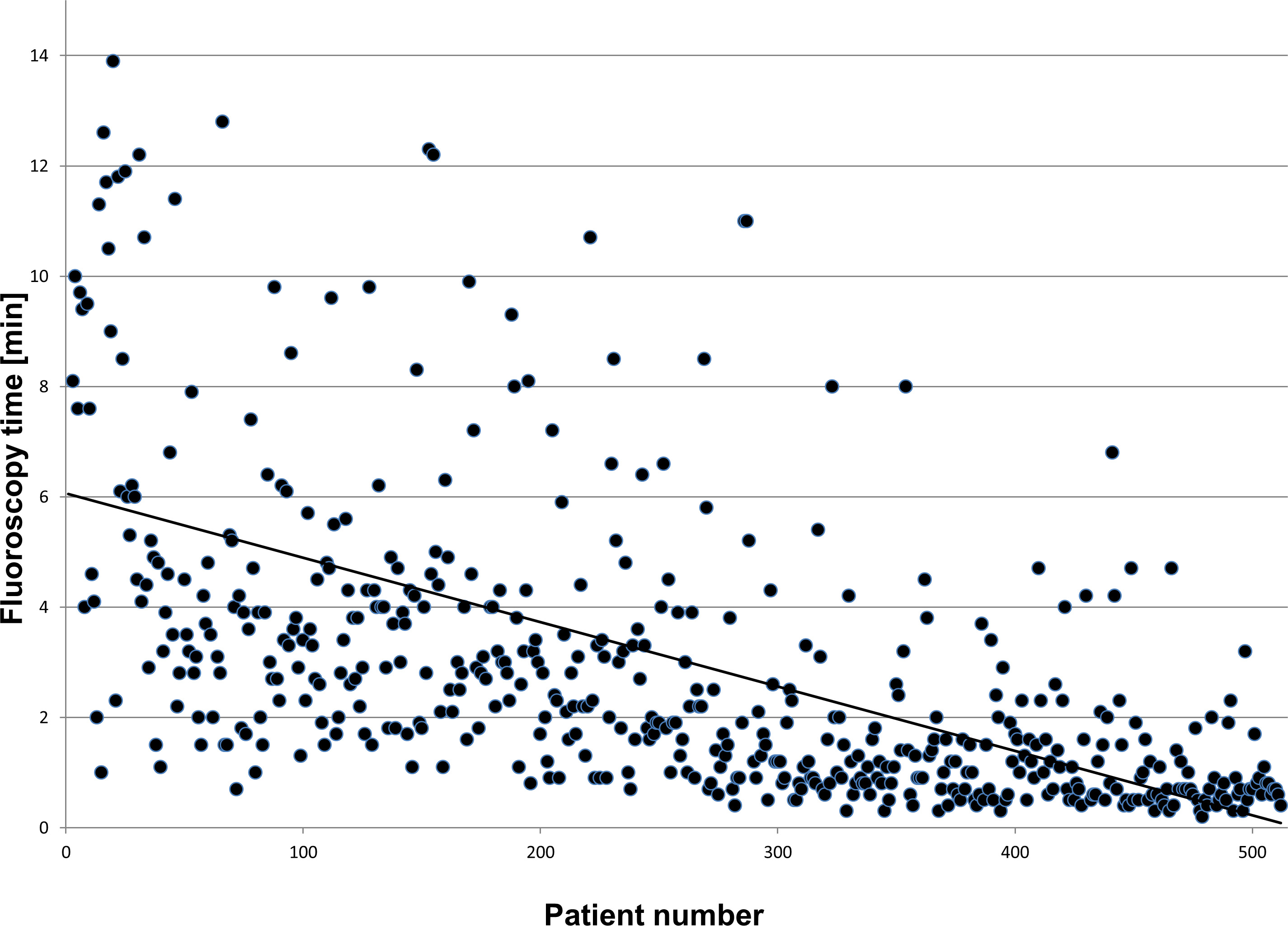
Figura 4: Haga clic aquí para ver una versión más grande de esta figura.
La limitación de la corriente disponible del sistema es que sólo las puntas de los catéteres se visualizan. Operadores inexpertos probablemente no serán capaces de interpolar a partir de la orientación de la punta para saber cuál será la posición del eje del catéter. Además, el sistema no es capaz de visualizar la vaina transeptal todavía. Sólo una selección limitada de los catéteres están actualmente disponible- por tanto, sólo un número limitado de diferentes procedimientos es adecuado utilizando la tecnología Nfcv.
En un futuro próximomás dispositivos y herramientas estarán disponibles que están equipados con un sensor para ser visualizado no fluoroscópica. El sistema aquí básicamente funciona como una plataforma cardiovascular para diferentes procedimientos; electrofisiología es sólo la primera aplicación que se ha introducido.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We acknowledge the funding by SJM.
Materials
| MediGuide System | SJM | MG1000 | Non fluoroscopic mapping system |
| Patient Reference Sensor (PRS) Patch | SJM | H700071 | Reference sensor |
| Livewire™ Diagnostic Catheter MediGuide Enabled™ | SJM | D402058 | diagnostic catheter |
| Agilis Nxt steerable introducers 71cm small curle | SJM | 408309 | steerable sheath |
| BRK transseptal needle and stainless steel stylet | SJM | 408314 | transseptal needle |
| EnSite Velocity patch set | SJM | 100003331 | 3D mapping tools |
| Safire BLU | SJM | A088087 | Ablation catheter |
| Sensitherm | SJM | 26155ST | thermoprobe |
| Siemens Artis | Siemens | x | X Ray biplanar |
| Ensite Velocity v. 2.1 | SJM | x | 3D mapping system |
| Ampere generator | SJM | H700494 | RF generator |
| Ampere Remote control | SJM | H700490 | Remote control for generator |
| Cool point | SJM | IBI-89003 | Irrigation pump |
| Cool point tubing set | SJM | 85785 | Tubing set |
References
- Caponi, D., et al. Ablation of atrial fibrillation: Does the addition of three-dimensional magnetic resonance imaging of the left atrium to electroanatomic mapping improve the clinical outcome?), A randomized comparison of carto-merge vs. Carto-xp three-dimensional mapping ablation in patients with paroxysmal and persistent atrial fibrillation. Europace. 12, 1098-1104 (2010).
- Flugelman, M. Y., et al. Medical positioning system: A technical report. EuroIntervention. 4, 158-160 (2008).
- Jeron, A., et al. First-in-man (fim) experience with the magnetic medical positioning system (mps) for intracoronary navigation. EuroIntervention. 5, 552-557 (2009).
- Sommer, P., Rolf, S., Richter, S., Hindricks, G., Piorkowski, C. non-fluoroscopic catheter tracking: The mediguide system. Herzschrittmacherther Elektrophysiol. 23, 289-295 (2012).
- Sommer, P., et al. Initial experience in ablation of typical atrial flutter using a novel three-dimensional catheter tracking system. Europace. 15, 578-581 (2013).
- Sommer, P., et al. Mediguide in supraventricular tachycardia: Initial experience from a multicentre registry. Europace. 15, 1292-1297 (2013).
- Rolf, S., et al. Catheter ablation of atrial fibrillation supported by novel nonfluoroscopic 4d navigation technology. Heart Rhythm. 10, 1293-1300 (2013).
- Piorkowski, C., et al. Steerable versus nonsteerable sheath technology in atrial fibrillation ablation: A prospective, randomized study. Circ Arrhythm Electrophysiol. 4, 157-165 (2011).
- Eitel, C., et al. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: The pace-and-ablate approach. Heart Rhythm. 7, 157-164 (2010).
- Halm, U., et al. Thermal esophageal lesions after radiofrequency catheter ablation of left atrial arrhythmias. Am J Gastroenterol. 105, 551-556 (2010).
- Vallakati, A., et al. Impact of nonfluoroscopic mediguide tracking system on radiation exposure in radiofrequency ablation procedures (less-rads registry)-an initial experience. J Interv Card Electrophysiol. 38, 95-100 (2013).
- Roguin, A., Goldstein, J., Bar, O., Goldstein, J. A. Brain and neck tumors among physicians performing interventional procedures. Am J Cardiol. 111 (9), 1368-1372 (2013).
- Richter, S., et al. Cardiac resynchronization therapy device implantation using a new sensor-based navigation system: results from the first human use study. Circ Arrhythm Electrophysiol. 6 (5), 917-923 (2013).
- Sommer, P., et al. Non-fluoroscopic catheter visualization in AF ablation: experience from 375 consecutive procedures. Circ Arrhythm Electrophysiol. 7 (5), 869-874 (2014).
- Sommer, P., Richter, S., Hindricks, G., Rolf, S. Non-fluoroscopic catheter visualization using MediGuide technology: experience from the first 600 procedures. J Interv Card Electrophysiol. 40 (3), 209-214 (2014).
- Eitel, C., et al. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: the pace-and-ablate approach. Heart Rhythm. 7 (2), 157-164 (2010).
- Rolf, S., et al. Tailored Atrial Substrate Modification Based On Low-Voltage Areas in Catheter Ablation of Atrial Fibrillation. Circ Arrythm Electrophysiol. 7, 483-489 (2014).

