Icke-genomlysning Kateter Tracking för genomlysning Minskning av interventionell Elektro
Summary
Radiation exposure is an underestimated risk in complex ablation procedures. Here, we describe a protocol to significantly decrease fluoroscopy time and dosage for both the patient and the lab staff by using a novel non-fluoroscopic catheter visualization system.
Abstract
En teknisk plattform (MediGuide) har nyligen införts för icke-fluoroskopisk kateter spårning. I flera studier har vi visat att tillämpningen av denna icke-fluoroskopisk katetervisualiseringssystem (NFCV) minskar genomlysningstid och dosen med 90-95% i en mängd olika elektrofysiologi (EP) förfaranden. Detta kan vara av betydelse inte bara för de patienter, utan även för de sköterskor och läkare som arbetar i EP labbet. Dessutom, i en delmängd av indikationer såsom supraventrikulär takykardi, NFCV möjliggör en helt icke-fluoroskopisk förfarandet och gör labbet personalen att arbeta utan att bära bly förkläden. Med detta protokoll visar vi att även komplicerade procedurer såsom ablationer av förmaksflimmer, som vanligtvis förknippas med genomlysningstider> 30 min i konventionella inställningar, säkert kan utföras med en minskning av> 90% i genomlysning exponering av ytterligare användning av NFCV.
Introduction
Kateterablation har blivit en standardbehandling vid behandling av många arytmier. Medan olika ablation strategier har föreslagits och är för närvarande tillämpas, alla ablationsprocedurer dela en enhetlighet i deras nödvändighet för användning av fluoroskopi att visualisera katetrar. Ensidig användning av användningen av levande röntgen för ablationsprocedurer lindrades på 1990-talet med tillkomsten av 3D electroanatomical kartläggning (EAMS) som hjälpte till att avsevärt minska strålningstiden och dosering. Integration av hjärt avbildning med magnetisk resonanstomografi (MRT) och datortomografi (CT) visade att ytterligare minska genomlysning exponering under ablationsprocedurer 1. På senare tid har en ny teknik för kateter visualisering, kallas tekniken MediGuide- (MG), införts som ytterligare kan underlätta minskning av strålningsexponering 2,3. Detaljer har tidigare beskrivits 4,5. I korthet, single-coil sensorer embedded i kateterspetsen exakt kan lokaliseras av ett elektromagnetiskt fält. Information om 3D-position och orientering av verktygen överföres därefter till den fluoroskopi systemet och används för att visualisera kateterspetsen i en virtuell bi-planvy projiceras på två förinspelade cine loopar. Det har tidigare visat att tillämpningen av MG-teknik kan leda till en betydande minskning av genomlysning börda genom att använda diagnostiska katetrar i förmaksfladder 4 och genom att använda både diagnostik och ablationskatetrar i flera supraventrikulär takykardi (SVT) 6 och förmaksflimmer (AF ) 7 fall. Det kan finnas farhågor att tillämpningen av den teknik som icke-genomlysning kateter visualisering (NFCV) kan öka processuella risker i frånvaro av kateterskaftet visualisering och kateter lokalisering som enbart grundar sig på platsen för kateterspetsen. Det visades att den komplikationsfrekvensen är lika med eller till och med lägre till procedgärder utförs med konventionella verktyg 14. Detta skulle kunna förklaras av en begränsning av konventionella förfaranden: endast i en viss procentandel av proceduren katetrar kommer att vara "synlig". Detta ändras genom tillämpning av NFCV teknik sedan katetrar kommer att vara synlig under hela proceduren på denna virtuella biplanar uppfattning.
I detta protokoll, vi utför en ablation av förmaksflimmer hos en patient med paroxysmal, läkemedels eldfast och mycket symtomatisk förmaksflimmer. Målet med detta protokoll är att uppnå samma ändpunkter som i ett konventionellt förfarande, det vill säga isolering av alla lungvenerna med bevisad dubbelriktad blocket, och för att minska genomlysning exponering för patienten genom> 90% jämfört med konventionella inställningar via ytterligare användning av den NFCV teknik.
Protocol
Representative Results
Discussion
Exponeringen för interventionella kardiologer och Elektrofysiologer är en underskattad risk på grund av sina oförutsägbara biverkningar. Aktuell litteratur visar en högre förekomst av vänstersidig hjärntumörer bland denna undergrupp av läkare, vilket tyder på att närheten till vänster hjärnhalva till röntgenkällan kan vara en skyldige 12. Latensen mellan strålningsexponering och diagnos av neoplasi har rapporterats vara 20 år eller mer. Därför bör dagens interventionalists använda alla tekniska alternativ för att minska exponeringen för strålning till ett minimum.
Den NFCV systemet kan bidra till att minska genomlysning exponering utan att påverka förfarande tid 14,15 med ett arbetsflöde som anpassades flera gånger under de senaste 3 åren för att minimera strålningsexponering enligt ALARA-principen.
3D karteringssystem kan bidra till att förbättra förståelsen av komplexa 3-dimensionella structures, men den grundläggande inriktningen för operatören genereras med hjälp av konventionell genomlysning.
Den transseptala punktering fortfarande den största bidragande steg (75-80%) av stråldosen under dessa förfaranden, eftersom ingen givare utrustat material för användning med NFCV teknik är för närvarande tillgänglig. Särskilt i oerfarna händer detta representerar den mest kritiska steget i det att procedure- andra avbildningsmetoder (såsom intrakardiella eller transesofagealekot) kan bidra till säker punkteringar och låga komplikationsfrekvens.
Den NFCV används inte bara i ablationsprocedurer men även i komplexa implantationer såsom hjärtresynkronisering terapi (CRT). I dessa förfaranden, tillåter systemet att minska fluoroskopi bördan med 75-80% jämfört med konventionella implantationer 13. En nyare publikation kunde visa att efter en inlärningskurva av 30-40 förfaranden en median genomlysningstid på 1,1 min för 50 patienter i radär möjligt och säkert 14. Detta bekräftades när förlängning av datainsamling till> 500 patienter (se Figur 4).
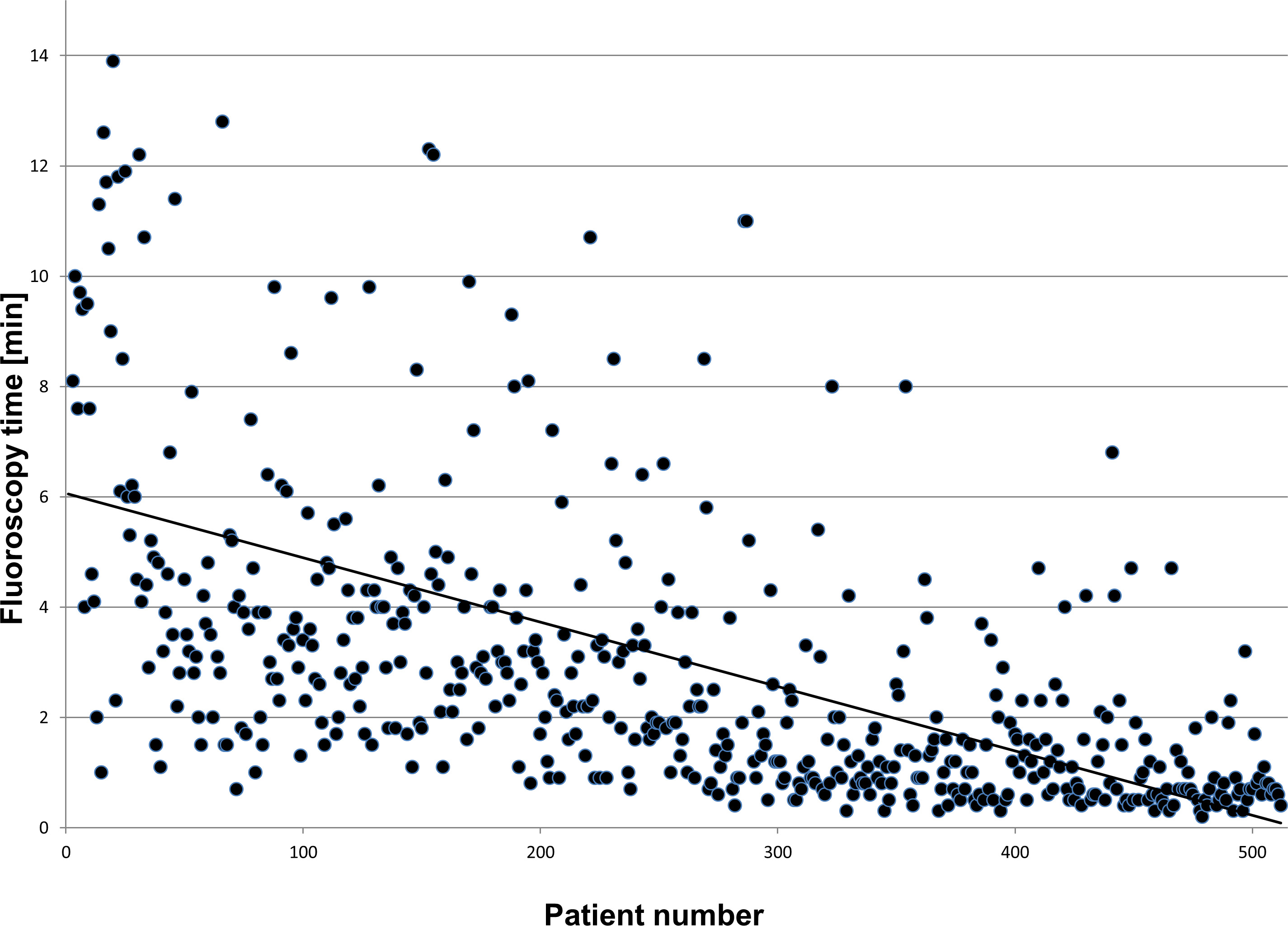
Figur 4: Klicka här för att se en större version av denna siffra.
Begränsningen av den för närvarande tillgängliga system är att endast spetsarna på katetrar visualiseras. Oerfarna operatörer kommer förmodligen inte att kunna interpolera från orienteringen av spetsen för att veta hur läget av kateterskaftet kommer att bli. Dessutom är systemet inte kunna visualisera den transseptala slidan än. Endast ett begränsat urval av katetrar för närvarande tillgängliga-därför endast ett begränsat antal olika procedurer är lämplig att använda NFCV teknik.
I en nära framtidfler enheter och verktyg kommer att finnas tillgängliga som är utrustade med en sensor som ska visualiseras icke-fluoroskopiskt. Systemet fungerar här i princip som en hjärt-plattform för olika förfaranden; elektrofysiologi är bara den första ansökan som har införts.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We acknowledge the funding by SJM.
Materials
| MediGuide System | SJM | MG1000 | Non fluoroscopic mapping system |
| Patient Reference Sensor (PRS) Patch | SJM | H700071 | Reference sensor |
| Livewire™ Diagnostic Catheter MediGuide Enabled™ | SJM | D402058 | diagnostic catheter |
| Agilis Nxt steerable introducers 71cm small curle | SJM | 408309 | steerable sheath |
| BRK transseptal needle and stainless steel stylet | SJM | 408314 | transseptal needle |
| EnSite Velocity patch set | SJM | 100003331 | 3D mapping tools |
| Safire BLU | SJM | A088087 | Ablation catheter |
| Sensitherm | SJM | 26155ST | thermoprobe |
| Siemens Artis | Siemens | x | X Ray biplanar |
| Ensite Velocity v. 2.1 | SJM | x | 3D mapping system |
| Ampere generator | SJM | H700494 | RF generator |
| Ampere Remote control | SJM | H700490 | Remote control for generator |
| Cool point | SJM | IBI-89003 | Irrigation pump |
| Cool point tubing set | SJM | 85785 | Tubing set |
References
- Caponi, D., et al. Ablation of atrial fibrillation: Does the addition of three-dimensional magnetic resonance imaging of the left atrium to electroanatomic mapping improve the clinical outcome?), A randomized comparison of carto-merge vs. Carto-xp three-dimensional mapping ablation in patients with paroxysmal and persistent atrial fibrillation. Europace. 12, 1098-1104 (2010).
- Flugelman, M. Y., et al. Medical positioning system: A technical report. EuroIntervention. 4, 158-160 (2008).
- Jeron, A., et al. First-in-man (fim) experience with the magnetic medical positioning system (mps) for intracoronary navigation. EuroIntervention. 5, 552-557 (2009).
- Sommer, P., Rolf, S., Richter, S., Hindricks, G., Piorkowski, C. non-fluoroscopic catheter tracking: The mediguide system. Herzschrittmacherther Elektrophysiol. 23, 289-295 (2012).
- Sommer, P., et al. Initial experience in ablation of typical atrial flutter using a novel three-dimensional catheter tracking system. Europace. 15, 578-581 (2013).
- Sommer, P., et al. Mediguide in supraventricular tachycardia: Initial experience from a multicentre registry. Europace. 15, 1292-1297 (2013).
- Rolf, S., et al. Catheter ablation of atrial fibrillation supported by novel nonfluoroscopic 4d navigation technology. Heart Rhythm. 10, 1293-1300 (2013).
- Piorkowski, C., et al. Steerable versus nonsteerable sheath technology in atrial fibrillation ablation: A prospective, randomized study. Circ Arrhythm Electrophysiol. 4, 157-165 (2011).
- Eitel, C., et al. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: The pace-and-ablate approach. Heart Rhythm. 7, 157-164 (2010).
- Halm, U., et al. Thermal esophageal lesions after radiofrequency catheter ablation of left atrial arrhythmias. Am J Gastroenterol. 105, 551-556 (2010).
- Vallakati, A., et al. Impact of nonfluoroscopic mediguide tracking system on radiation exposure in radiofrequency ablation procedures (less-rads registry)-an initial experience. J Interv Card Electrophysiol. 38, 95-100 (2013).
- Roguin, A., Goldstein, J., Bar, O., Goldstein, J. A. Brain and neck tumors among physicians performing interventional procedures. Am J Cardiol. 111 (9), 1368-1372 (2013).
- Richter, S., et al. Cardiac resynchronization therapy device implantation using a new sensor-based navigation system: results from the first human use study. Circ Arrhythm Electrophysiol. 6 (5), 917-923 (2013).
- Sommer, P., et al. Non-fluoroscopic catheter visualization in AF ablation: experience from 375 consecutive procedures. Circ Arrhythm Electrophysiol. 7 (5), 869-874 (2014).
- Sommer, P., Richter, S., Hindricks, G., Rolf, S. Non-fluoroscopic catheter visualization using MediGuide technology: experience from the first 600 procedures. J Interv Card Electrophysiol. 40 (3), 209-214 (2014).
- Eitel, C., et al. Circumferential pulmonary vein isolation and linear left atrial ablation as a single-catheter technique to achieve bidirectional conduction block: the pace-and-ablate approach. Heart Rhythm. 7 (2), 157-164 (2010).
- Rolf, S., et al. Tailored Atrial Substrate Modification Based On Low-Voltage Areas in Catheter Ablation of Atrial Fibrillation. Circ Arrythm Electrophysiol. 7, 483-489 (2014).

