Summary
Het doel van dit document en instructie video te beschrijven hoe bloot en verwijder de pig postmortem hersenen en hypofyse in intacte toestand, geschikt voor daaropvolgende macroscopische en histologische analyse.
Abstract
Varkens zijn steeds populairder geworden in grote dieren translationeel neurowetenschappelijk onderzoek als een economisch en ethisch haalbaar alternatief voor niet-menselijke primaten. De grote omvang van de hersenen van het varken maakt het gebruik van conventionele klinische hersenen imagers en de directe gebruik en het testen van neurochirurgische procedures en apparatuur uit de menselijke kliniek. Verdere macroscopische en histologische analyse vereist echter postmortem blootstelling van het varken centrale zenuwstelsel (CZS) en daaropvolgende verwijdering hersenen. Dit is niet eenvoudig, aangezien de pig CNS wordt ingekapseld door een dikke, benige schedel en wervelkolom. Het doel van dit document en instructie video te beschrijven hoe bloot en verwijder de pig postmortem hersenen en de hypofyse in intacte toestand, geschikt voor daaropvolgende macroscopische en histologische analyse.
Introduction
Translationele neurowetenschappen studies in varkens hebben steeds populairder geworden in de afgelopen twee decennia. De grote omvang van de varkenshersenen maakt het gebruik van conventionele klinische hersenen beeldschermen en direct gebruik en testen van neurochirurgische procedures en apparatuur uit de menselijke kliniek 1, 2, 3, 4, 5, 6, 7, 8. In de laatste 20 jaar, varkens, minivarkens bijzonder (bijvoorbeeld minipig Göttingen), zijn gebruikt om neuromodulatory behandelingsmodaliteiten, zoals stamceltransplantatie te onderzoeken; virale vector transfectie; en diepe hersenstimulatie gericht ziekte van Parkinson, obesitas, depressie en ziekte van Alzheimer 2, 6,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Dit werd gevolgd door de ontwikkeling van stereotaxische chirurgische benaderingen van het CNS minipig 3, 18, 19, 20, 21 te manipuleren. De ingestelde CNS wijzigingen zijn geëvalueerd in levende dieren met behulp van brain imaging (PET 10, 13, 22, 24 en 23 MR), cystrometrie 11, 12, 25, gangbeeldanalyse17, neurologisch onderzoek 9, 17 en autopsie basis van histologie en stereologische analyse 14, 15, 17, 26, 27, 31. Echter, postmortem analyse vereist de blootstelling en verwijdering van het varken hersenen, die geen gemakkelijke taak, als dikke, benige schedel en een vezelig durale die rondom de varkenshersenen.
Het doel van dit papier en instructievideo is om te beschrijven hoe de postmortem varken hersenen en de hypofyse kunnen worden blootgesteld en afgevoerd in een intacte toestand in 15-20 min met behulp van niet-gemotoriseerde chirurgische instrumenten. De instructie video en fotografische afbeeldingen tonen mannelijke minipigs (leeftijd: 6 maanden, lichaamsgewicht: 20-25 kg) gebruikt voor een anatomische studie over de minipig hypofyse.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Dierlijke anesthesie en euthanesia werd uitgevoerd volgens "Principles of proefdier care" (NIH publicatie nr 86-23, herzien 1985) en door de Deense Raad voor dierlijke Research Ethics goedgekeurd.
1. Instrumenten
- Verzamel de instrumenten die in de video en in de tabel van Materialen vermeld.
2. Onthoofding
OPMERKING: Anesthesie werd geïnduceerd door een intramusculaire injectie van 5 ml midazolam (5 mg / ml) en 5 ml ketamine (25 mg / ml). 5-10 min later, als het dier diep verdoofd was, een oorader gecannuleerd en een dodelijke overdosis (100 mg / kg lichaamsgewicht) van natriumpentobarbital (200 mg / ml) werd intraveneus toegediend. Opdat het dier volledig was onderworpen aan euthanasie werd de interdigitale pijn reflex getest zoals getoond door Ettrup et al. (2011) 20. Volledige euthanization werd gewaarborgd zoals beschreven inde ethische bovenstaande verklaring gevolgd door een transcardiale perfusie met 5 liter isotonische zoutoplossing, zoals aangetoond door Ettrup et al. (2011) 20. Alle gedemonstreerd procedures worden uitgevoerd postmortem, zich verzet tegen de noodzaak voor het welzijn voorzorgsmaatregelen die nodig zijn voor de lange termijn anesthesie en postprocedurele overleving.
- Onthoofden het varken door een hoge cirkelvormige cervicale incisie via een chirurgische scalpel, net onder de onderkaak hoek (Figuur 1A).
- Nog steeds met de chirurgische scalpel, blijven de incisie voren door het zachte weefsel van de nek, met inbegrip van het strottenhoofd en de slokdarm, tot de benige wervelkolom wordt bereikt, ongeveer ter hoogte van de overgang craniocervicaal.
- Advance het snijden met een chirurgische scalpel uit de voorste zijde van de craniocervicaal knooppunt boven de voorste boog van atlas en door het voorste atlantooccipital membraan, waardoor het wervelkanaal en het ruggenmerg blootstellen (Figuur 1B). Tegelijkertijd vraagt een assistent voor het varken lichaam weg te trekken van het varken hoofd naar de toegang tussen de schedelbasis en de eerste halswervel verlichten.
- Blijven de chirurgische incisie door de durale zak en het ruggenmerg (figuur 1B). Pas goed zodat een volledige dwarsdoorsnede van het ruggenmerg bereikt.
Opmerking: Als de vorige stap kan ongewenste trekkracht op het ruggenmerg en de hersenen tijdens de volgende stappen van de onthoofding uit te voeren. - Krachtig verlengen cranocervical splitsing aan het sectieniveau (figuur 1C). Tegelijkertijd, gebruikt de chirurgische scalpel gedeelte resterende atlantooccipital ligamenten het gewricht los tussen het occipitale condyli en de bovenste scharnierende proces atlas. Scheid de pig kop uit het lichaam.

Figuur 1: minipig onthoofding. (A) nekincisie (pijl kaakhoek). (B) ingesneden atlantooccipital ligamenten en de dura omgeven ruggenmerg (SC) en schedelstructuur knooppunt (C1, anterieure boog van atlas, OC, occipitale condylus). (C) Het achterste deel van de atlantooccipital scharnier wordt vrijgegeven door een krachtige verlenging (pijlen) op sectieniveau. Klik hier om een grotere versie van deze afbeelding te bekijken.
3. Opening Schedel
- Positioneer het varken hoofd op een tafel.
- Voeg een dorsale longitudinale incisie met een chirurgisch scalpel door de huid en het onderliggende zachte weefsel van de rug van de snuit, over de top van het hoofd, en naar beneden door het achterste deel vande occipitale regio.
- Bloot rug- en achterste deel van de schedel door verwijdering van het zachte weefsel zich lateraal van de initiële incisie met een chirurgisch scalpel.
- Laat de temporalis bilateraal van de schedel (Figuur 2A) met een chirurgische scalpel. Zorg ervoor dat de posterieure occipitale bot wordt gereinigd van zacht weefsel.
- Met de achterste ingang van het foramen magnum het schedelbeen verwijderen met een Kerrison botpons en bot rongeurs en bloot-dura bedekte cerebellum (Figuur 2B).
- Keer terug naar de blootgestelde voorste kant van de schedel en selecteer een ingangspunt in de frontale bot, vlak voor de ogen. Op dit moment gebruiken een bot beitel met een hamer om de schedel penetreren en voer de frontale sinus (figuur 2C).
- Met de omvang van de frontale sinus de dorsoposterior verwijderen van de schedel lamina met een bot rongeur of botpons bevorderen en bloot de binnenste dunnebenige schedel lamina die de hersenen (Figuur 2D).
- Open voorzichtig de binnenste benige schedel lamina anterieur met een hamer en een beitel bot op de dura vallen hersenen (figuur 2E) bloot te leggen.
- Blijven de botverwijdering zijdelings via een been beitel en een bot rongeur door de temporale en pariëtale botten om de uiteindelijke dorsoposterior van de schedel, gelegen tussen het reeds belichte delen van de dura bedekte en kleine hersenen (figuur 2F) vrijgeven.
LET OP: Het is vaak mogelijk tijdens de laatste stap van deze procedure, de beitel gebruiken voor het openen van de resterende posterior schedelbot breken van de ene kant, net zoals men een deur opent.
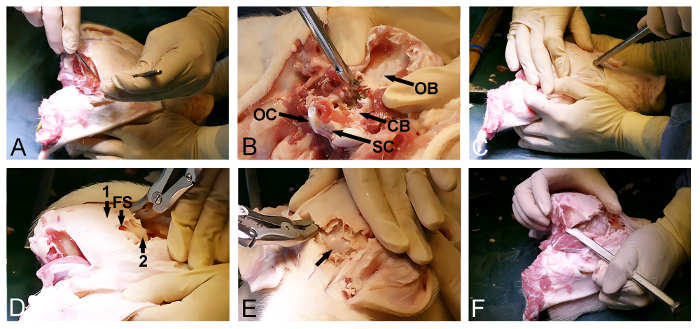
Figuur 2: minipig schedel opening. (A) Blootstelling van de dorsoposterior schedeloppervlak, waaronder het verwijderen van de occipitale en temporale spieren. (B) Het verwijderen van het occipitale bot (CB,-dura bedekte cerebellum, OB, schedelbeen, OC, occipitale condylus en SC, ruggenmerg). (C) Een hamer en een beitel bot worden gebruikt om de schedel voren dringen en de frontale sinus ter hoogte van de ogen te voeren. (D) De mate van de frontale sinus (FS) wordt gebruikt om de buitenste dikke schedelbot (1) te verwijderen, het blootstellen van een binnenste dunne bot plaat (2) die de grote hersenen. (E) Het verwijderen van de dunne lamina bot, waardoor de dura-bedekte hersenen (pijl). (F) Tenslotte werd een hamer en een beitel bot gebruikt zijdelings sluiten de voorste en de achterste schedel openingen. Klik hier om een grotere versie van deze afbeelding te bekijken.
4. Brain removal
- Gebruik chirurgische tang om de dura te tillen en het creëren van een zachte incisie dicht bij de veneuze superieure sagittale sinus met een fijne chirurgische scalpel (Figuur 3A).
- Gebruik micro-schaar of dura-mes om de dura die het dorsale oppervlak van de hersenen verder te openen.
OPMERKING: Speciale voorzichtigheid is geboden bij het verwijderen van de dura overeenkomt met de cerebellaire tentorium (figuur 3B) als het behoud van de durale blad voorkomt daaropvolgende verwijdering hersenen. - Positioneer het varken kop verticaal (figuur 3C).
- Met het bot beitel of dissector de ventroanterior hersenen vrijgeven stompe dissectie van de bulbus olfactorius van de dura bedekte bodem van de schedelholte (Figuur 3D).
- Met een fijne chirurgische scalpel gedeelte blootgestelde optische chiasma (figuur 3E). Bloot te leggen en deel de hypofyse stengel en de oculomotorische zenuwen.
- Maak de ventrale hersenstam door het snijden van de lower craniale zenuwen (figuur 3F) met dunne chirurgische scalpel. Waarborgen dat de durale cerebellaire tentorium volledig ingesneden (figuur 3B), omdat deze durale bladeren anderszins uit de hersenstam snijdt bij de introductie proces.

Figuur 3: minipig hersenen verwijderd. (A) Dural opening chirurgische pincet en een dura mes. (B) Wees voorzichtig volledig insnijden de durale blad (pijl), gelegen tussen de hersenen en de kleine hersenen. (C) Het varken kop verticaal geplaatst voor een betere visualisatie van schedelbasis structuren en zodat de zwaartekracht helpt bij het beoogde verplaatsing van de hersenen. (D) een dissector of bot beitel gebruikt om de olfactorische knobbel verlichten door het stompe gedeelte van de dura-covered schedelbasis. (E) De dissectie wordt voortgezet in een postérieure richting langs de schedelbasis voor belichting en snijden van de optische chiasma (pijl), trechtervormige steel en oculomotorische zenuwen. (F) De hersenen afgifte wordt aangevuld met het gedeelte van de onderste craniale zenuwen deze afwijken van het ventrale oppervlak van de hersenstam (III oculomotor zenuw, IV, trochlear zenuw, V, trigeminale zenuw en VI, nervus abducens). Klik hier om een grotere versie van deze afbeelding te bekijken.
5. Hypofyse Verwijdering
- Identificeer de hypofyse stengel en de omringende durale blad (het diapragma sellae) in de schedel vloer (Figuur 4A).
- Insnijden de durale vel lateraal van de hypofyse steel met een fijne chirurgische scalpel (figuur 4B).
- Gebruik een dissector om de put vrij te gevenuitary en verwijder deze uit de hypofyse fossa (Figuur 4C).

Figuur 4: minipig hypofyse verwijderen. (A) De hypofyse fossa (*) wordt aangegeven in de schedel vloer (1, bulbus olfactorius, 2, optisch chiasma en PF, achterste schedelgroeve). (B) De durale afdekking (sellar diagphragm, (pijl)) zijdelings ingesneden. (C) De hypofyse (pijl) wordt vrijgegeven met een dissector en opgetild uit de hypofyse fossa. Schaalbalk (AC) = 10 mm. Klik hier om een grotere versie van deze afbeelding te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Het weefselmateriaal uitdroging te voorkomen, wordt aanbevolen om de verwijderde hersenen en hypofyse slaan in een pot gevuld met lijm of isotone zoutoplossing onmiddellijk na macroscopische analyse is uitgevoerd. Het weefselmateriaal kan worden opgeslagen in het fixeermiddel jaren, terwijl opslag in isotone zoutoplossing, zelfs in de koelkast, leidt tot weefselverval tijd.
De verwijderde hypofyse kan ook direct worden bevroren door onderdompeling in droogijs gekoelde vloeistof 2-methylbutaan, terwijl de intacte varkenshersenen te groot voor direct invriezen 28. In plaats daarvan wordt aangeraden de varkenshersenen snijden, zoals eerder aangetoond 28 in 9-15 mm dikke coronale parallelle platen weefsel kunnen worden stilgezet in toto en cryostaat-verdeeld in 40 urn dikke secties 5, 18, 26, 28. Als alternatief kunnen specifieke hersengebieden zijn vrij gedissecteerd van de verwijderde intacte hersenen of gesneden hersenen plak en na vibratome snijden 30, paraffine / methacrylaat inbedden en microtoom snijden 6, 17, 27, of invriezen en cryostaat snijden 6 voor verdere histologische verwerking ingediend 14, 15, 25. In onze omgeving, worden de geslachte varkens uiteindelijk geplaatst in gespecificeerde plastic containers en opgeslagen in een speciale koelcel totdat ze worden verzameld en afgevoerd naar een biologische vernederende faciliteit.
Bij het gebruik van niet-gemotoriseerde chirurgische instrumenten (tabel van materialen), de beschreven techniek (figuren 1 g> - 3) mogelijk maakt, in ongeveer 15-20 minuten, het verwijderen van het intacte varkenshersenen (figuur 5AB), terwijl het gescheiden craniale zenuwen en hypofyse blijven verbonden met de schedel vloer (Figuur 4A). Evenzo kan de hypofyse eenvoudig worden verwijderd, intact, na verwijdering van de bovenliggende hersenen en het vrijgeven van de durale sellar membraan (figuur 4 en 5C).
De resulterende hersenen en / of hypofyse (figuur 5) kan vervolgens macroscopische analyse, naast directe visuele inspectie, kunnen de grootte en volumemetingen 31 ingediend. Dit kan worden gevolgd door georiënteerd snijden tot kleinere hersenen platen 28, 29 geschikt voor chemische analyse en / of verdere histologische preparaat, kleuring en microscopisch onderzoek 6,s = "xref"> 14, 15, 17, 25, 26, 27.

Figuur 5: Minipig de hersenen (A en B) en hypofyse (C). (A) Brain, laterodorsal aanzicht (BS, hersenstam, CB, cerebellum en CRB, cerebrum). (B) Brain, ventrale uitzicht (BS, hersenstam, CB, cerebellum en CRB, hersenen). (C) hypofyse, achteraanzicht (AH, adenohypofyse en NH, neurohypofyse). Schaalbalk (A en B) = 10 mm, (C) = 5 mm. Klik hier om een grotere versie van deze afbeelding te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Meest experimentele neurologie studies worden uitgevoerd in kleine diersoorten, zoals muizen en ratten, waarbij toegang tot het CNS wordt vergemakkelijkt door een dunne schedel- en durale dikte. In grote proefdieren als varkens 1, 4, 8, schapen 32 en niet-humane primaten, de aanzienlijke dikte van deze structuren is het gebruik van robuuste instrumenten (tabel van materialen) en goede ingangspunten voor schedelbot verwijderen (fig 2). Kennis beperken durale bladeren (figuren 3 en 4), voordat het CNS kunnen worden benaderd en de hersenen veilig verwijderd.
Het wordt aanbevolen om de dura intact tijdens het schedelbot verwijdering te verlaten, omdat dit de onderliggende hersenen beschermt tegen beschadiging. Previous transcardial fixatie 20 kan eveneens verharden en sliVerpakking goed krimpen de hersenen, waardoor het bot en durale verwijdering uit te voeren met meer gemak en veiligheid. Een bijzonderheid van het varken schedel, in tegenstelling tot de schapen en niet-menselijke primaten, de geleidelijke expansie van de frontale sinus met de leeftijd, wat voordelig in het schedelbot verwijderingsproces (figuur 2) kunnen zijn. De gepresenteerde techniek kan derhalve worden gebruikt op alle grote diersoorten, maar alleen bij varkens, met name die ouder dan 6 maanden, zal de frontale sinus voldoende ontwikkeld om steun in het schedelbot verwijderingsproces te verschaffen. Tenslotte worden volledig snijden van het ruggenmerg in het onthoofding werkwijze (Figuur 1B) en volledig snijden van de durale cerebellaire tentorium (Figuur 3B) voor de laatste versie hersenen absoluut om latere beschadiging van de hersenstam voorkomen vereist.
In sommige studies kan het voordelig zijn om een gedeelte van de rostrale ruggenmerg aan de hersenen.Dit kan worden verkregen door de initiële incisie onthoofding (Figuur 1A) meer caudaal in de hals, waardoor toegang tot het ruggemerg door een tussenwervelschijf cervicale schijf in plaats van de craniocervicaal overgang zoals blijkt in de huidige video. De achterste verwijderen van bot zal dan uit te gaan van de blootgestelde caudale lamina. Afgezien daarvan zal de techniek die vergelijkbaar zijn, dus is het belangrijk om te onthouden dat het ruggenmerg geheel moet worden doorgesneden vóór de onthoofding wordt aangevuld met krachtige uitbreiding op sectieniveau (figuur 1). De huidige procedure is aangetoond gefixeerde dieren, als de werkelijke achtergrondstudie HPLC analyse van de afgeleide hypofyse noodzakelijk. Merk echter op dat exact dezelfde techniek wordt gebruikt bij dieren transcardially gefixeerd met paraformaldehyde 3, 5, 14, 15, 16, 17, 18, 19, 20, 25, 26, 27, 28, 31, alhoewel procedures dergelijk geval moet worden uitgevoerd onder goede ventilatie door een afzuigkap 20. De keuze van natieve versus dissectie in toto -fixation gevolgd dissectie derhalve uitsluitend afhangen van de vereiste post-processing procedure (bijvoorbeeld conventionele histologie, immunohistochemie, HPLC en FISH) 32.
Zoals besproken in de volgende paragrafen, hebben we de voorkeur aan niet-gemotoriseerde chirurgische instrumenten gebruiken. De schedel van varkens boven de 1-2 jaar kan echter zijn zo robuust dat schedel verwijdering met de gedemonstreerde instrmenten niet mogelijk is, in het gebruik van gemotoriseerde instrumenten, zoals craniotomes, oscillerende zagen, boren en elektrische 32. In dat geval is het nog steeds aanbevolen het protocol bovenstaande stappen volgen, aldus profijt trekken van het natuurlijk voorkomende schedel ingangspunten en voorhoofdsholte ontwikkeling. De gepresenteerde anterior toegang tot de schedelbasis is elegant en eenvoudig, maar de beschreven stompe afgifte van de reukkwabben worden uitgevoerd zonder directe visuele geleiding (Figuur 3D), in tegenstelling tot de meer naar achteren afgifte van de hersenen (figuur 3EF). Het ventrale deel van de reukkwabben kan ondergaan daardoor een zekere mate van ongecontroleerde schade die alleen kan worden vermeden, indien nodig, door het boren van de voorste schedelbasis uit ventraal van de bollen voor de afgifte wordt geïnitieerd. Merk op dat de manipulatie, in het bijzonder gefixeerde hersenweefsel tijdens schedel verwijderd, is aangegeven doet ontstaan van histologi cal donker neuron artefact, wat kan leiden tot verkeerde conclusies in neurotoxicologische studies 33.
Het schedelbot verwijderingsproces kan ook worden uitgevoerd met machines, zoals craniotomes, oscillerende zagen, boren en elektrische 32. Deze kunnen het proces versnellen, maar ze zullen ook het risico op beschadiging van de onderliggende neurale structuren. Dergelijke apparatuur kan ook kostbaar zijn en zal waarschijnlijk niet beschikbaar zijn voor de meeste laboratoria. We hebben daarom de voorkeur aan de huidige procedure met gebruik van niet-gemotoriseerde chirurgisch materiaal (Table of Materials), dat is gemakkelijk te bereiken en te gebruiken te tonen.
De beschreven en geïllustreerde techniek zal, bij juist gebruik, mogelijk de belichting en verwijdering van de postmortem varken hersenen, hypofyse en / of cervicale ruggenmerg (figuur 5), waardoor stukken weefsel die zeer geschikt voor verdere analyse macroscopische"xref"> 5, 6, 19, 26, 31, snijden in hersenen platen 28 en daaropvolgende chemische analyse en / of histologische verwerking 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
De auteurs erkennen met dankbaarheid de bekwame hulp van Mrs. Trine W. Mikkelsen, mevrouw Lise M. Fitting, en het personeel in Påskehøjgaard. De Deense Medical Research Council, de Lundbeck Foundation, en de Novo Nordisk Foundation financieel ondersteund de studie.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



