Summary
이 종이와 교육 비디오의 목표는 노출 이후 거시 및 조직 학적 분석에 적합한 손상 상태에 돼지 뇌와 뇌하수체 부검을 제거하는 방법을 설명하는 것입니다.
Abstract
돼지는 인간이 아닌 영장류에 대한 경제적, 윤리적으로 가능한 대안으로 대형 동물 번역의 신경 과학 연구에 점점 더 인기를 끌고있다. 돼지의 큰 뇌의 크기는 기존의 임상 뇌 이미 저와 인간의 병원에서 직접 사용 및 신경 외과 절차 및 장비의 테스트를 사용할 수 있습니다. 또한, 육안 및 조직 학적 분석은, 그러나, 돼지 중추 신경계 (CNS) 및 후속 뇌 제거 사후 노광을 필요로한다. 이것은 CNS는 두께, 뼈 두개골과 척추에 의해 캡슐화 된 돼지로 쉬운 일이 아니다. 이 종이와 교육 비디오의 목표는 노출과 사후 돼지 뇌와 이후의 거시 조직 학적 분석에 적합한 손상 상태에서 뇌하수체를 제거하는 방법을 설명하는 것입니다.
Introduction
돼지 번역 상 신경 과학 연구는 지난 20 년 동안 점점 더 인기를 끌고있다. 돼지 뇌의 크기가 커서 기존의 임상 뇌 이미 저들과 직접 사용하여 인간 임상 1, 2, 3, 4, 5, 6, 7, 8에서 신경 외과 절차 및 장비 테스트의 사용을 가능하게한다. 지난 20 년 동안, 돼지, 특히 minipigs (예를 들어, 괴팅겐 미니 피그) 등 줄기 세포 이식과 같은 neuromodulatory 치료 방법을 검사하는 데 사용되었다; 바이러스 벡터 형질; 파킨슨 질환, 비만, 우울증, 알츠하이머 병 2, 6 향하는 깊은 뇌 자극,= "외부 참조"> 9, 10, 11, 12, 13, 14, 15, 16, 17. 이는 미니 피그 CNS 3, 18, 19, 20, 21을 조작 정위 수술 방법을 개발 하였다되었다. 제정 CNS의 변경 (PET 10, 13, 22, 24, 23 MR), 방광 내압 11, 12, 25 뇌 영상을 이용하여 살아있는 동물에서 평가되어, 보행 분석17, 신경 평가 9, 17, 및 조직학 분석 stereological 14, 15, 17, 26, 27, 31에 기초하여 사후 검사. 그러나 사후 분석은 두께, 뼈 두개골과 돼지 뇌를 둘러싸고 취재 섬유 경막로 노출 쉬운 일이 아니다 돼지 두뇌의 제거가 필요합니다.
이 종이와 교육 비디오의 목표는 사후 돼지 뇌와 뇌하수체 비 전동 수술 도구를 사용하여 15 ~ 20 분에 온전한 상태로 노출을 제거 할 수있는 방법을 설명하는 것입니다. 미니 피그 뇌하수체에 대한 해부학 적 연구에 사용 된 교육 비디오 및 사진 그림은 남성 minipigs (20-25kg : : 6 개월, 체중 세)를 보여줍니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
동물 마취 및 euthanesia은 (NIH 간행물 번호 86-23, 1985 개정) 동물 연구 윤리에 대한 덴마크위원회의 승인을 "실험 동물 관리의 원칙"에 따라 수행되었다.
1. 악기
- 악기 비디오에서 제시 및 재료의 표에 열거를 수집합니다.
2. 목 베기
주 : 마취 미다 졸람 5 ㎖ (5 ㎎ / ㎖) 및 5 mL의 케타민 (25 ㎎ / ㎖)의 근육 내 주사에 의해 유도 하였다. 동물을 깊게 마취 때 50-10 분 후에, 귀 정맥 삽관시키고, 나트륨 펜토 바르 비탈의 과량 치사 (체중 100 밀리그램 / kg)을 (200 ㎎ / ㎖)을 정맥 받았다. Ettrup 등에 의해 도시 된 바와 같이, 동물은 안락사 완전히 것을 보장하기 위해, 인터 통증 플렉스 시험 하였다. (2011) 20. 에 설명 된대로 전체 euthanization 확보했다Ettrup 등에 의해 입증 된 바와 같이하고, 등장 식염수 5 L와 transcardial 관류 하였다 위에 윤리 문. (2011) 20. 모든 입증 절차는 장기 마취 및 postprocedural 생존에 필요한 복지주의가 필요하지 않습니다, 사후을 수행한다.
- 다만 하악 각도 (도 1a) 아래 수술 메스를 사용하여, 높은 원형 자궁 절개하여 돼지 참살.
- 뼈 척추가 약 craniocervical 접합의 수준에 도달 할 때까지 아직도 수술 메스, 후두 및 식도를 포함한 목의 부드러운 조직을 통해 전방 절개를 계속합니다.
- (아틀라스 전치부 호 위의 craniocervical 접합의 전방 측으로부터 외과 용 메스로 절단을 향상하고, 전방 atlantooccipital 막을 통해하여 척추관 척수 노출그림 1B). 동시에 두개골베이스와 첫 번째 경추 사이의 접근을 용이하게하기 위해 돼지 머리에서 멀리 돼지 몸을 끌어 보조를 부탁드립니다.
- 경막 주머니와 척수 (그림 1B)를 통해 수술 절개를 계속합니다. 척수의 전체 횡단면이 달성 될 수 있도록 특별한주의하십시오.
참고 : 잘린 프로세스의 다음 단계 동안 척수와 뇌에 불필요한 마찰이 발생할 수 있습니다 이전 단계를 수행하지 않으면. - 강제 섹션 레벨 (도 1C)에 접합 cranocervical 연장. 동시에, 후두부 관절 구 및 아틀라스의 상부 명료 프로세스 사이의 관절을 해제 섹션에 나머지 atlantooccipital 인대 외과 용 메스를 사용한다. 몸에서 돼지 머리를 분리합니다.

그림 1 : 미니 피그의 참수. (A) 목 절개 (화살표 하악 각도). (; OC, 후두부 외과 C1, 아틀라스 전치부 호)에 atlantooccipital 인대 및 craniocervical 접합부 경질 둘러싸인 척수 (SC) 내지 (B) 절개. (C)가 atlantooccipital 관절의 후방 부분은 부 수준에서 강력한 확장 (화살표)에 의해 방출된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 해골 열기
- 테이블에 돼지 머리를 놓습니다.
- 의 후방 부분을 통해 피부와 머리의 정점에 걸쳐 주둥이의 뒷면에서 기본 부드러운 조직을 통해 수술 메스와 지느러미 세로 절개를, 아래로후두부.
- 외과 용 메스 절개 초기에 측 방향 위치 연조직을 제거하여 두개골의 등쪽과 후방 부분을 노출시킨다.
- 외과 용 메스와 두개골 (도 2A)로부터 임시 좌우 근육을 해제. 후방 뒤통수 뼈는 연부 조직의 청소되어 있는지 확인합니다.
- Kerrison 뼈와 뼈 rongeurs 펀치와 후두부 뼈를 분리하고 경질 피복 소뇌 (도 2b)를 노출시키는 난원 매그넘의 후방 입구를 사용한다.
- 바로 눈 앞에서, 두개골의 노출 전방 측에 돌아가서 정면 뼈의 엔트리 포인트를 선택합니다. 이 시점에서, 두개골을 관통하고 전두엽 부비동 (그림 2C)을 입력 망치로 뼈 조각도를 사용합니다.
- 뼈 또는 뼈 rongeur 펀치 외 두개골 박판 dorsoposterior의 제거를 촉진 할 전두동의 범위를 사용하고, 내부 얇은 노출대뇌 (도 2D)를 덮는 박판 두개골 뼈.
- 부드럽게 경질 피복 뇌 (도 2E)을 노출시키는 해머와 뼈 조각도와 전방 내부 뼈 두개골 박판을 연다.
- 횡 경질 피복 대뇌 및 소뇌 (도 2F)에 이미 노출 된 부분 사이에 두개골의 최종 dorsoposterior 부분을 분리하기 위해 시간적 마루 뼈 통해 뼈 정 및 뼈 rongeur을 사용하여 골 삭제를 계속한다.
참고 :이 절차의 마지막 단계에서, 가능한 한 자주 하나가 문을 열어처럼 한쪽에서 열린 남아있는 후방 두개골 뼈를 파괴하기 위해 끌을 사용합니다.
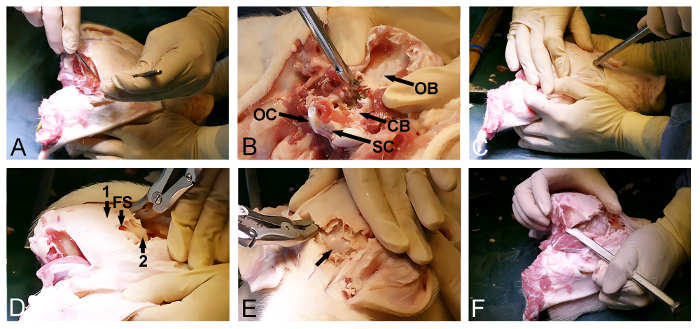
도 2 : 미니 피그 두개골 개구. (A)가 노출되는 dorsoposterio후두 시간적 근육의 제거를 포함하여 R 두개골 표면. 후두골의 (B)를 제거 (CB, 경질 피복 소뇌, OB, 후두골, OC, 후두부 외과 및 SC 척수). (C) 망치 뼈 치즐 전방 두개골을 관통하고 눈의 수준에서 전두동를 입력하기 위해 사용된다. (D) 전방 공동 (FS)의 정도는 내부 얇은 뼈 박판 (2) 뇌를 덮는 노출 (1) 외측 두꺼운 두개골 뼈를 제거하기 위해 사용된다. 경질 피복 대뇌 (화살표)을 노출 얇은 뼈의 박판 (E) 제거. (F)는 마지막으로, 망치와 뼈 시추 좌우 전방 및 후방 두개골 개구를 연결하는 데 사용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 뇌 Remov알
- 경질을 들어 올려 미세 수술 메스 (그림 3A)를 사용하여 정맥 우수한 시상 동에 부드러운 절개 가까이를 만드는 수술 집게를 사용합니다.
- 상기 뇌의 등쪽 표면을 덮는 경질를 열고 마이크로 가위 또는 경질 칼을 사용한다.
참고 : 소뇌 tentorium (그림 3B)에 해당하는 경질을 제거 할 때 특별한주의가 이후의 뇌 제거를 방지 할이 경막 잎의 보존으로,주의해야합니다. - 돼지 머리를 수직으로 (그림 3C)를 배치합니다.
- 뇌 캐비티 (도 3d)의 경질 피복 층에서 후각 망울의 무딘 절개하여 대뇌 ventroanterior를 해제 뼈 정 또는 해부학자 사용.
- 섹션에 노출 광학 chiasm (그림 3E)을 미세 수술 메스를 사용합니다. 뇌하수체 줄기와 안구 운동 신경을 노출하고 섹션을 참조하십시오.
- 소호을 절편하여 복부 뇌간을 해제미세 수술 메스와 WER 뇌신경 (그림 3 층). 경막 소뇌 tentorium 완전히 (그림 3B) 절개 것을이 경막 잎 그렇지 않으면 해제 과정에서 뇌간을 통해 절단하므로, 확인합니다.

그림 3 : 미니 피그 뇌 제거. 수술 집게와 경막 칼 (A) 경막 개방. (B) 관리는 완전히 대뇌 및 소뇌 사이에 경막 리프 (화살표), 절개주의해야한다. (C) 돼지 머리 두개골베이스 구조 나은 시각화 중력 뇌의 의도 용량을 지원하기 위해서는 수직으로 배치된다. (D)는 해부학자 또는 뼈 속이다은 경질 커버 ③에서 평활 수단에 의해 후각 망울을 완화하는 데 사용D 두개골베이스. (E)을 박리는 광학 chiasm (화살표), 줄기 누 두부 및 안구 운동 신경의 노출 단면에 대한 두개골베이스를 따라 후방 방향으로 계속된다. 그들은 뇌간의 복부 표면으로부터 출발로 (F) 뇌 릴리스 하부 뇌신경의 단면 완성된다 (, IV, 활차 신경, III, 눈 돌림 신경 V, 삼차 신경 및 VI를 외전 신경). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 뇌하수체 제거
- 뇌하수체 줄기 두개골 층 (도 4a)의 주변 경막 잎합니다 (diapragma의 sellae)를 식별.
- 미세 수술 용 메스 (도 4b)을 이용하여 뇌하수체 스토킹 경막 리프 횡 절개.
- 구덩이를 해제하는 해부학자를 사용하여uitary 및 뇌하수체 포사 (그림 4C)에서 들어 올립니다.

그림 4 : 미니 피그의 뇌하수체 제거. (A) 뇌하수체 포사 (*)는 두개골 바닥에서 식별된다 (1, 후각 망울 2, 광학 chiasm 및 PF, 사후 뇌 포사 참조). (B) 경막 커버 (sellar diagphragm (화살표)) 측 방향으로 절개되어있다. (C)이 뇌하수체 (화살표)는 해부학자로 방출되어 뇌하수체 포사 밖으로 들어 올려진다. 스케일 바 (AC)는 10mm를 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
마르지 티슈 재료를 방지하기 위해,이 고정 제 또는 거시적 분석이 수행 된 직후에 등장 성 식염수로 채워진 병의 뇌 및 뇌하수체 제거를 저장하도록 권고한다. 조직 재료는, 등장 성 식염수에 보관 반면 년 동안 정착에 저장 될 수있다, 심지어 냉장고에, 시간과 함께 조직의 붕괴로 이어질 것입니다.
본래 돼지 뇌 직접 동결 28 너무 큰 반면 제거는 뇌하수체 직접 드라이 아이스 냉각 액체 -2- 메틸 부탄에 침지하여 고정 될 수있다. 대신, 이전 토토 동결 및 40 μm의 두께 섹션 5, 18에 저온 유지가-구분 될 수있다 9~15mm 두께의 병렬 관상 조직 석판에 28 있듯이, 돼지 뇌를 슬라이스하는 것이 좋습니다, (26), (28). 대안 적으로, 특정 뇌 영역이 될 수있는 제거 손상 뇌에서 자유 해부 뇌 슬래브 슬라이스 및 절편 (30)를 절편에 vibratome 파라핀 / 메타 크릴 매립 및 마이크로톰 절편 6, 17, 27, 또는 동결 저온 유지 장치 (6) 후에 상기 학적 처리에 제출 14, 15, 25. 우리의 설정에서 돼지 사체는 마지막으로 지정된 플라스틱 용기에 배치하고 그들이 수집 및 생물학적 분해 시설로 이송 될 때까지 전용 저온 창고에 저장.
무동력 수술 도구의 사용 (재료의 테이블)에 기재된 기술에 (도 1 g> - 3) 약 15-20 분에있게 그대로 돼지 뇌 (도 5AB)의 제거, 절단 된 뇌신경 뇌하수체가 두개골 바닥에 연결되어있는 동안 (도 4A). 마찬가지로, 뇌하수체 단순히 경막 sellar 다이어프램 (도 4 (c))를 상부의 뇌를 제거하고 해제 후, 그대로 제거 될 수있다.
생성 된 뇌 및 / 또는 뇌하수체 (도 5) 다음에, 따로 직접 육안 검사에서, 크기 및 용적 측정 (31)을 포함 할 수있다 거시적 분석에 제출 될 수있다. 이것은 작은 뇌 석판 (28)으로 배향 하였다 절편 수 화학 분석 및 / 또는 상기 제제 학적 염색 및 현미경 분석에 적합한 6 29S = "외부 참조"> 14, 15, 17, 25, 26, 27.

그림 5 : 미니 피그 뇌 (A 및 B) 및 뇌하수체 (C). (A) 뇌, laterodorsal 뷰 (BS, 뇌간, CB, 소뇌 및 CRB, 대뇌). (B) 뇌, 복부 뷰 (BS, 뇌간, CB, 소뇌 및 CRB, 대뇌). (C) 뇌하수체 후방 뷰 (AH, 샘 뇌하수체 및 NH, neurohypophysis). 스케일 바 (A 및 B)는 10mm, (C) = 5 mm 인 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
대부분의 실험 연구는 신경 같은 CNS에 대한 액세스가 얇은 skull- 및 경막의 두께에 의해 용이하게 마우스 및 래트와 같은 작은 동물 종에서 수행된다. 그러나, 돼지 1, 4, 8, 양 (32) 및 비 - 인간 영장류와 같은 큰 실험 동물에서 이러한 구조의 상당한 두께 두개골 뼈 제거를위한 강력한 도구 (재료의 테이블) 적절한 엔트리 포인트 (도면의 사용을 필요 2). 중추 신경계에 액세스 할 수 있습니다 전에 경막 잎 (그림 3과 4) 제한에 대한 지식이 필요하며 뇌를 안전하게 제거.
이 손상 기본 뇌를 보호하므로 두개골 뼈 제거하는 동안 그대로 두라을두고하는 것이 좋습니다. 이전 transcardial 고정 (20)는 마찬가지로 강화 및 SLI 수 있습니다ghtly 뼈와 경막 제거 프로세스가 더 간편하고 안전하게 수행 할 수 있도록 뇌를 축소. 돼지 두개골의 특징은, 양 및 비인간 영장류 대조적으로 두개골 뼈 제거 공정 (도 2)에서 유리할 수있다 나이와 전두동의 점진적인 확장이다. 제시된 기술은 이에 따라 모든 큰 동물 종에서 사용할 수 있습니다,하지만 돼지, 특히 나이가 6 개월 이상에서 정면 부비동은 두개골 뼈 제거 과정에서 원조를 제공하기 위해 충분히 개발 될 것이다. 마지막으로, 잘린 과정 (그림 1B) 및 최종 뇌 릴리스 전에 경막 소뇌 tentorium (그림 3B)의 완전한 절편 동안 척수의 완전 절편은 절대적으로 뇌간 이후의 손상을 방지하기 위해 필요합니다.
일부 연구에서는 뇌에 부착 주동이의 자궁 경부 척수의 일부를 가지고 유리할 수있다.현재 영상에서 설명한 바와 같이 이것은, 목에 대한 초기 잘린 미부 절개 (도 1a)를 배치하는 대신 craniocervical 접합 추간 경추 디스크 통해 척수에 대한 액세스를 허용함으로써 얻을 수있다. 후방 뼈 제거 후 노출 된 꼬리 얇은에서 시작해야합니다. 이 외에도에서,이 기술은 유사합니다, 그래서 참수이 섹션 수준 (그림 1)에서 강력한 확장자가 완료되기 전에 척수가 완전히 절단해야 함을 기억하는 것이 중요하다. 실제 배경 연구는 파생 뇌하수체의 HPLC 분석을 필요로로 현재의 절차는, 고정되지 않은 동물에 설명된다. , 동일한 기술이로 transcardially 파라 포름 알데히드 3, 5, 14, 15에 집착 동물에 사용된다는 점에 유의하십시오
다음 단락에서 설명하고있는 바와 같이, 우리는 무동력 수술 도구를 사용하는 것이 바람직했다. 1-2년 세 이상 돼지의 두개골은, 그러나, 이렇게 강력 할 수 있음을 입증 INSTR 두개골 제거uments하지 같은 craniotomes, 진동 톱, 전기 드릴 (32)로서 전동기구의 사용을 필요로 가능하다. 이 경우, 여전히하여 자연적으로 발생하는 두개골 진입 점과 정면 공동 개발을 활용, 위에 표시된 프로토콜 단계를 수행하는 것이 좋습니다. 두개골베이스에 제시 전방 접근 우아하고 쉽지만 후각 전구의 설명 무딘 방출 뇌 (도 3EF)의 더 후방 방출 달리, 직접적인 시각적 안내 (도 3D)없이 수행되어야한다. 후각 전구의 복부 부분 따라서 릴리스 프로세스가 시작되기 전에 전구에게 복부 앞쪽 두개골 기반을 시추에 의해, 필요한 경우에만, 피할 수 조절되지 않는 손상이 어느 정도 저하 될 수 있습니다. 특히 두개골을 제거하는 동안 고정되지 않은 뇌 조직의 조작,의 histologi 결과에 표시되어 있습니다 neurotoxicological 공부 (33)에 잘못된 결론으로 이어질 수 CAL 어두운 신경 아티펙트.
두개골 뼈 제거 프로세스는 craniotomes, 진동 톱, 전기 드릴 (32)와 같은 기계를 수행 할 수 있습니다. 이들은 프로세스의 속도가 빨라질 수 있습니다, 그러나 또한 기본 신경 구조 손상의 위험을 증가시킬 것이다. 이러한 장비는 비용이 많이들 수 있으며, 가장 가능성이 가장 실험실에 사용할 수 없습니다. 따라서 우리는 액세스하고 사용하기 쉬운 무동력 수술 장비 (자료 표)를 사용하여 현재 프로 시저를 보여 선호.
적절하게 사용될 때, 설명되고 도시 기술은, 상기 거시 분석에 적합 그 조직편 결과, 노광 및 사후 돼지 뇌, 뇌하수체의 제거 및 / 또는 자궁 척수 (도 5)을 활성화 할뇌 절편 슬라브 (28)에 "외부 참조"> 5, 6, 19, 26, 31 및 이후의 화학 분석 및 / 또는 조직 학적 처리 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자가 공개하는 게 없다.
Acknowledgments
저자는 감사로 부인 트린 W 미켈슨의 숙련 된 지원, 피팅 부인 리자 M. 및 Påskehøjgaard에서 직원을 인정합니다. 덴마크 의학 연구위원회 (Medical Research Council)의 룬드 벡 재단, 그리고 노보 노 디스크 재단은 재정적으로 연구를 지원했다.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



