Summary
Цель данной статьи и обучающего видео, чтобы описать, как выявить и удалить посмертную свинью мозг и гипофиз в интактном состоянии, подходящем для последующего макроскопического и гистологического анализа.
Abstract
Свиньи становятся все более популярными в крупных животных исследования трансляционной нейронауки в качестве экономически и этически возможной замены для приматов. Большой размер мозга свиньи позволяет использовать обычные томографы клинического мозга и прямое использование и тестирование нейрохирургических процедур и оборудования из человеческой клиники. Далее макроскопическое и гистологическое исследование, однако, требует посмертного воздействия на свиной центральную нервной системе (ЦНС) и последующего удаление головного мозга. Это не простая задача, как свиньи ЦНС инкапсулируется толстым, костистым черепом и позвоночником. Цель данной статьи и обучающего видео, чтобы описать, как выявить и удалить посмертный мозг свиньи и гипофиз в интактном состоянии, пригодный для последующего макроскопического и гистологического анализа.
Introduction
Трансляционные исследования неврологии у свинех становятся все более популярными в течение последних двух десятилетий. Большой размер мозга свиньи позволяет использовать обычные томографы клинического мозга и прямого использование и тестирования нейрохирургических процедур и оборудования из человеческой клиники 1, 2, 3, 4, 5, 6, 7, 8. В течение последних 20 лет, свиней, особенно минисвиней (например, Гёттинген minipig), были использованы для изучения neuromodulatory методов лечения, таких как трансплантации стволовых клеток; вирусный вектор трансфекции; и глубокая стимуляция мозга направлены на болезнь Паркинсона, ожирение, депрессии и болезни Альцгеймера 2, 6,= "Xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Это было с последующим развитием стереотаксической и хирургических подходов для манипулирования minipig ЦНС 3, 18, 19, 20, 21. В возбужденные изменения ЦНС были оценены в живых животных с использованием визуализации мозга (ПЭТ 10, 13, 22, 24 и MR 23), цистометрию 11, 12, 25, анализ походки17, неврологическая оценка 9, 17 и вскрытие на основе гистологии и стереологического анализа 14, 15, 17, 26, 27, 31. Однако посмертный анализ требует экспозиции и удаления головного мозга свиньи, которая не является легкой задачей, в виде густым, костистый черепа и волокнистый дюраль, покрывающий окружают головной мозг свиньи.
Цель данной статьи и обучающего видео, чтобы описать, как посмертная свинью мозг и гипофиз, могут быть выявлены и удалены в интактном состоянии в 15-20 мин с использованием безмоторных хирургическими инструментов. Обучающее видео и фотографические иллюстрации показывают мужские минисвиней (возраст: 6 месяцев, вес тела: 20-25 кг), используемые для анатомического исследования на minipig гипофиза.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
анестезии животных и euthanesia проводили в соответствии с «Принципами ухода за лабораторными животными» (NIH публикации № 86-23, пересмотренные 1985) и одобрен Советом Датских животных исследовательской этики.
1. инструменты
- Собирают инструменты , представленные в видео , и перечисленные в таблице материалов.
2. обезглавливание
Примечание: Анестезия индуцировали путем внутримышечной инъекции 5 мл мидазолам (5 мг / мл) и 5 мл кетамина (25 мг / мл). 5-10 мин позже, когда был глубоко седативные животное, ушную вену вводили канюлю и летальный передозировки (100 мг / кг веса тела) пентобарбитала натрия (200 мг / мл) вводили внутривенно. Для того, чтобы гарантировать , что животное было полностью умерщвлены, межпальцевых рефлекс боли тестировали , как показано Ettrup и соавт. (2011) 20. Полная euthanization была обеспечена, как описано вутверждение этики выше и последующая transcardial перфузией 5 л изотонического солевого раствора, как продемонстрировано Ettrup и соавт. (2011) 20. Все продемонстрированные процедуры выполняются вскрытие, исключающей необходимости мер предосторожности обеспечения, необходимой для долгосрочной анестезии и postprocedural выживания.
- Обезглавьте свиньи высокой круговой цервикального разреза, используя хирургический скальпель, чуть ниже угла нижней челюсти (рис 1А).
- Тем не менее с хирургическим скальпелем, продолжает надрез кпереди через мягкие ткани шеи, в том числе гортани и пищевода, пока костное позвоночника не будет достигнуто, примерно на уровне краниоцервикального перехода.
- Предварительный разрез с хирургическим скальпелем от передней стороны краниоцервикального перехода, выше передней дуги атласа, а через переднюю мембрану атлантозатылочной, тем самое подвергая спинномозговой канал и спинной мозг (Фигура 1В). Одновременно попросите помощник, чтобы вытащить тело свиньи от головы свиньи, чтобы облегчить доступ между основанием черепа и первым шейным позвонком.
- Продолжить хирургический разрез через дурального мешка и спинного мозга (Фиг.1В). Соблюдайте особую осторожность, чтобы обеспечить полное поперечное сечение спинного мозга достигается.
ПРИМЕЧАНИЕ: Невыполнение предыдущего шага может привести к нежелательному тяги на спинном и головном мозге в течение следующих этапов процесса обезглавливания. - Насильно продлить cranocervical соединение на уровне раздела (рис 1C). В то же время, использовать хирургический скальпель, чтобы остальные секции атлантозатылочных связки, чтобы освободить сочленение между затылочными мыщелками и верхним суставным процессом атласа. Отделить голову свиньи из организма.

Рисунок 1: Minipig обезглавливание. (А) шейный разрез (стрелка, угол нижней челюсти). (Б) Разрез через атлантозатылочный связок и спинной мозг Dura-окружение (SC) на стыке краниоцервикального (С1, передняя дуга атланта; OC, затылочный мыщелок). (С) Задней частью атлантозатылочного сочленения высвобождаются силовым расширение (стрелка) на уровне секции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
3. Череп Открытие
- Поместите голову свиньи на столе.
- Сделать спинной продольный разрез с хирургическим скальпелем через кожу и подстилающую мягкую ткань из задней части морды, над вершиной головы и вниз по задней частизатылочная область.
- Выставляет спинную и заднюю часть черепа, удаляя мягкие ткани, расположенных сбоку от первоначального разреза с хирургическим скальпелем.
- Выпуск височной мышцы на двусторонней основе из черепа (рис 2A) с хирургическим скальпелем. Убедитесь, что задняя затылочная кость очищается от мягких тканей.
- Используйте вход заднего от затылочного отверстия для удаления затылочной кости с Kerrison костьми пуансонов и костными кусачками и подвергать твердый мозговой покрытый мозжечок (фигура 2В).
- Возврат к открытой передней стороне черепа и выберите точку входа в лобной кости, прямо перед глазами. На этом этапе использует кости долото с молотком , чтобы проникнуть через череп и ввести лобную пазуху (рис 2C).
- Используйте степень лобной пазухи для дальнейшего dorsoposterior удаления внешнего черепа пластинки с костью костных кусачек или костью пуансоном и подвергать внутренние, тонкиекостистые черепа пластинка покрывает головной мозг (рис 2D).
- Аккуратно откройте внутреннюю костистый череп пластинку кпереди с молотком и долотом кости , чтобы выставить Dura-покрытые головной мозг (рис 2E).
- Продолжить удаление кости в боковом направлении с использованием костного долота и костьми костных кусачек через временную и теменную кость , с тем , чтобы выпустить окончательную dorsoposterior части черепа, расположенной между уже открытыми частями твердым мозговым покрытым головным мозгом и мозжечка (рис 2F).
Примечание: Часто это возможно, во время последней стадии этой процедуры, использовать долото, чтобы взломать оставшуюся заднюю череп кости с одной стороны, так же, как один открывает дверь.
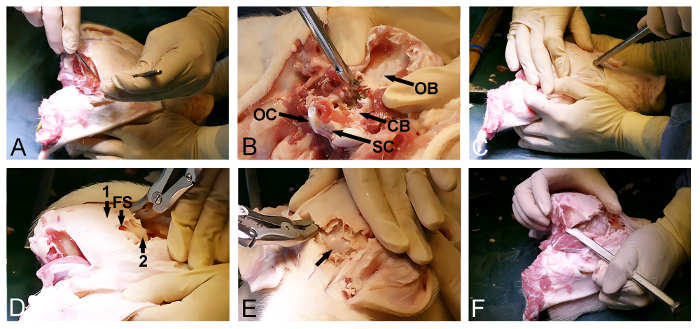
Рисунок 2: Minipig отверстие черепа. (А) Воздействие на dorsoposterioг поверхности черепа, в том числе удаление затылочной и височной мышцы. (Б) Удаление затылочной кости (СВ, Dura покрытого мозжечок; О.Б., затылочная кость; ОС, затылочный мыщелок, и СК, спинной мозг). (C) молоток и долото кости используются , чтобы проникнуть в череп кпереди и войти в лобных пазухах на уровне глаз. (D) Степень лобной пазухи (FS) используется , чтобы удалить наружную толстый череп кости (1), подвергая внутреннюю тонкая кость пластинка (2) , покрывающей головной мозг. (Е) Удаление тонкой костной пластинки, подвергая Dura-покрытые головной мозг (стрелка). (F) И, наконец, молоток и долото кости используются для боков подключения передней и задней отверстия черепа. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Мозг убраль
- Используйте хирургические щипцы , чтобы поднять твердые мозговую оболочку и создать нежный надрез близко к венозному верхнему сагиттальному синусу с помощью тонкого хирургического скальпеля (рис 3А).
- Использование микро-ножницы или Dura-нож, чтобы еще больше открыть твердую мозговую оболочку, покрывающую спинной поверхности мозга.
ПРИМЕЧАНИЕ: Особое внимание должно быть принято при удалении твердой мозговой оболочки, соответствующий мозжечка мозжечка (рис 3B), как сохранение этого дюралевого листа предотвратит последующее удаление мозга. - Поместите свиньи голову вертикально (рис 3C).
- Используйте долото кости или прозектор , чтобы освободить ventroanterior головного мозга с тупым обонятельной луковицей от твердого мозгового покрытого пола черепной полости (рис 3D).
- Используйте тонкий хирургический скальпель раздел обнаженного зрительный перекрест (рис 3E). Expose и раздел гипофиз стебелек и глазодвигательных нервов.
- Отпустите вентральной стволомозговые секционирования ЛОWER черепные нервы (рис 3F) с тонким хирургическим скальпелем. Убедитесь , что дуральный мозжечковой Тенториум был полностью вырезан (фигура 3В), так как это дуральная лист будет иначе прорезать ствол мозга в процессе высвобождения.

Рисунок 3: Minipig удаление мозга. (A) Dural отверстие с хирургическими щипцами и твёрдой ножом. (Б) Необходимо соблюдать осторожность , чтобы полностью надрезать дуральный лист (стрелка), расположенного между головным мозгом и мозжечком. (С) Головка свиньи расположена вертикально для лучшей визуализации черепа базовых структур , а для того , чтобы силы тяжести , чтобы помочь в предполагаемом смещении мозга. (D) прозектор или костное долото используется для облегчения обонятельной луковицы тупого участке от Dura-covereд основания черепа. (Е) Рассечение продолжается в направлении заднего вдоль основания черепа для экспозиции и секционирования зрительных нервов (стрелка), воронкообразного стебла и глазодвигательных нервов. (F) выпуск мозга завершается с секцией нижних черепных нервов , как они отходят от вентральной поверхности ствола мозга (III, глазодвигательного нерва; IV, блоковый нерв; V, тройничного нерва, и VI, отводящий нерв). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
5. гипофиз Удаление
- Определить гипофизарной стебель и его окружающий дурального лист (The diapragma sellae) в череп пола (фиг.4А).
- Надрезать дуральный листьев латеральнее гипофизарной ножку с помощью тонкого хирургического скальпеля (фиг.).
- Используйте прозектор, чтобы освободить ямуuitary и поднять его из гипофиза ямки (рис 4C).

Рисунок 4: Minipig удаление гипофиза. (A) гипофизарной ямки (*) идентифицируется в полу черепа (1, обонятельной луковицы; 2, зрительный перекрест, и PF, задней черепной ямки). (В) Дуральном покрытии (селлярная diagphragm, (стрелка)) разрежут в поперечном направлении . (С) Гипофизом (стрелка) высвобождаются с диссектором и поднял из гипофиза ямки. Шкала бар (АС) = 10 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Чтобы предотвратить материал ткани от высыхания, рекомендуются хранить удаленный мозг и гипофиз в банке, наполненный фиксатором или изотоническим солевой раствор сразу после макроскопического анализ был выполнен. Материал, ткань может быть сохранен в фиксаторе в течение многих лет, в то время как хранение в изотоническом солевом растворе, даже в холодильнике, приведет к разрушению ткани со временем.
Удален гипофиз может также быть непосредственно замораживают путем погружения в сухом охлажденной льдом жидкости 2-метилбутана, тогда как интактный мозг свиньи слишком велик для прямого замораживания 28. Вместо этого, рекомендуется нарезать головного мозга свиньи, как ранее показано , 28, в толстые параллельных плит корональных ткани 9-15 мм , которые могут быть заморожены в Toto и нарезали с применением криостата в 40 мкм толщиной секций 5, 18, 26, 28. Альтернативно, конкретные области мозга , могут быть свободно рассекали от удаленного интактного мозга или нарезанные плиты мозга и представлен дальнейшей гистологической обработки после того, как вибратомы секционирования 30, парафиновым / метакрилата вложения и микротома секционирования 6, 17, 27, или замораживания и криостата секционирования 6, 14, 15, 25. В нашей установке, свинья тушка, наконец, размещена в указанных пластиковых контейнерах и хранила в специальном холодном помещении, пока они не собирают и транспортируют к биологическому унижающему объекта.
С использованием немоторизованных хирургических инструментов (таблица материалов), описанной методикой (фиг.1 г> - 3) позволяет, приблизительно 15-20 мин, удаление интактного мозга свиньи (рисунок 5ab), в то время как отрезанные черепные нервы и гипофиз остаются соединенным с черепом пола (фиг.4А). Аналогично, гипофиз может быть просто удален, неповрежденным, после удаления облегающего мозга и отпускания твердой мозговой оболочки Sellar диафрагмы (рис 4 и 5c).
В результате чего мозг и / или доля гипофиз (рисунок 5) , может впоследствии быть представлена макроскопическим анализ , что, кроме непосредственного визуального осмотра, может включать в себя измерение размера и объем 31. Это может сопровождаться ориентированным на секционирования на более мелкие плиты мозга 28, 29 подходит для химического анализа и / или дальнейшего гистологического препарат, окрашивания и микроскопического анализа 6,s = "Xref"> 14, 15, 17, 25, 26, 27.

Рисунок 5: Minipig мозга (А и В) и гипофиз (С). (А) Мозг, laterodorsal вид (БС, стволовой; CB, мозжечок и ЦРБ, головной мозг). (В) головном мозге, вид снизу (БС, стволовой; CB, мозжечок и ЦРБ, головной мозг). (С) Гипофиз, вид задней (АГ, аденогипофиз и NH, нейрогипофиз). Шкала бар (А и В) = 10 мм, (C) = 5 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Большинство экспериментальных исследований неврологии проводятся в небольших видов животных, таких как мыши и крысы, где доступ к ЦНС облегчается с помощью тонкой skull- и дуральной толщины. Однако в более крупных экспериментальных животных , таких как свиньи 1, 4, 8, овец 32, и отличные от человека приматы, значительная толщина этих структур требует использования надежных инструментов (таблица материалов) и соответствующих точки входа для удаления костей черепа (рис 2). Знание ограничения дуральных листьев (фиг.3 и 4) необходимо до ЦНСА может быть доступен , и мозг безопасно удален.
Рекомендуется, чтобы оставить нетронутыми твердой мозговой оболочки во время удаления костей черепа, так как это будет защитить мозг от лежащей в основе повреждений. Предыдущая transcardial фиксации 20 также может затвердеть и SLIghtly сжать мозг, позволяя кости и процесс удаления твердой мозговой оболочки должны быть выполнены с большей легкостью и безопасностью. Особенность свиньи черепа, в отличии от овец и нечеловеческого примата, является постепенным расширением лобной пазухи с возрастом, что может быть выгодным в процессе удаления костей черепа (рисунок 2). Представленная методика, соответственно, может быть использован на всех крупных видов животных, но только у свиней, особенно те, старше 6 месяцев, будет лобной пазухи быть достаточно развиты, чтобы оказать помощь в процессе удаления костей черепа. И, наконец, полное рассечение спинного мозга во время процесса обезглавливания (Фиг.) и полного секционирование дурального мозжечкового мозжечка (рис 3B) перед окончательным выпуском мозга абсолютно необходимо для того , чтобы избежать последующего повреждения мозга.
В некоторых исследованиях, это может быть выгодно, чтобы иметь часть рострального шейного отдела спинного мозга, прикрепленный к мозгу.Это может быть получено путем размещения первичного обезглавливания разреза (рис 1A) более каудален на шее, обеспечивая доступ к спинному мозгу через межпозвоночный диск шейного вместо краниоцервикального перехода, как показано в текущем видео. Удаление задней кости будет иметь, чтобы начать с открытой каудальной пластинки. Помимо этого, технология будет таким же, поэтому важно помнить , что спинной мозг должен быть полностью разрезал до обезглавливание комплектуется силовым расширение на уровне раздела (рис 1). Текущая процедура демонстрируется на нефиксированных животных, так как реальное исследование фона потребовало анализа ВЭЖХ производного гипофиза. Заметим, однако, что точно такой же метод используется на животных транскардиальную зацикленных с параформальдегидом 3, 5, 14, 15,
Как уже говорилось в следующих параграфах, мы предпочли использовать безмоторные хирургические инструменты. Черепа свиней в возрасте старше 1-2 лет, однако, могут быть настолько надежными, что удаление черепа с демонстрируемой INSTRuments не представляется возможным, что вызывает необходимость использования моторизованных инструментов, такие как craniotomes, осциллирующие пилы, и электрические дрели 32. В этом случае, он по-прежнему рекомендуется следовать инструкциям протокола, указанные выше, таким образом, воспользовавшись естественных точек входа черепа и развитие лобной пазухи. Представлены передний доступ к основанию черепа элегантный и легкий, но описанный тупые выпуск обонятельной луковицы должен быть выполнен без непосредственного визуального наведения (рис 3D), в отличии от дополнительного заднего выпуска головного мозга (рис 3EF). Поэтому вентральная часть обонятельной луковицы может страдать какие-то степени неконтролируемый ущербом, который только можно избежать, если это необходимо, путем бурения переднего основания черепа из брюшной луковицы до того, как процесс выпуска инициируются. Обратите внимание, что манипуляции, особенно нефиксированной ткани головного мозга во время удаления черепа, было показано, приведет к histologi кал темно - нейрон артефакт, что может привести к ошибочным выводам в neurotoxicological исследований 33.
Процесс удаления кости черепа также может быть выполнена с машинами , как craniotomes, осциллирующих пил, и электрические дрели 32. Они могут ускорить этот процесс, но они также увеличивают риск повреждения нижележащих нервных структур. Такое оборудование также может быть дорогостоящим и, скорее всего, будет недоступна для большинства лабораторий. Поэтому мы предпочли продемонстрировать текущую процедуру с использованием немоторизованного хирургического оборудования (таблица материалов), которое легко получить доступ и использовать.
Описан и проиллюстрирован метод будет, при правильном использовании, позволяют экспозиции и удаление посмертных мозга свиньи, гипофиза и / или шейного отдела спинного мозга (рисунок 5), в результате чего куски ткани , которые хорошо подходят для дальнейшего анализа макроскопического"Xref"> 5, 6, 19, 26, 31, секционирование в мозге плиту 28, и последующий химический анализ и / или гистологическая обработка 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы не имеют ничего раскрывать.
Acknowledgments
Авторы с благодарностью искусной помощи миссис Трин W Миккелсен, г-ж Lise М. Место и сотрудники в Påskehøjgaard. Датский Совет по медицинским исследованиям, то Lundbeck фонд и Фонд Novo Nordisk при финансовой поддержке исследования.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



