Summary
O objectivo deste trabalho e vídeo de instruções é descrever como a expor e remover o cérebro de porco e glândula pituitária pós-morte num estado intacto, adequado para análise macroscópica e histológica subsequente.
Abstract
Os porcos têm se tornado cada vez mais popular em grande animal investigação translacional neurociência como um substituto economicamente e eticamente viável para primatas não-humanos. O tamanho grande do cérebro do porco permite o uso de geradores de imagens cerebrais clínica convencionais e a utilização directa e testes de procedimentos e equipamentos neurocirúrgicos de clínica humana. Uma análise mais aprofundada macroscópico e histológico, no entanto, requer exposição post-mortem do sistema de porco nervoso central (SNC) e subsequente remoção do cérebro. Esta não é uma tarefa fácil, como o porco SNC é encapsulado por uma cabeça dura, ósseo e da coluna vertebral. O objectivo deste trabalho e vídeo de instruções é descrever como a expor e remover o cérebro de porco post-mortem e a glândula pituitária num estado intacto, adequado para análise macroscópica e histológica subsequente.
Introduction
estudos de neurociência de translação em suínos têm se tornado cada vez mais popular durante as últimas duas décadas. O grande tamanho do cérebro de porco permite o uso de geradores de imagens cerebrais clínica convencionais e a utilização directa e os ensaios de procedimentos neurocirúrgicos e equipamento de clínica humana 1, 2, 3, 4, 5, 6, 7, 8. Nos últimos 20 anos, porcos, especialmente porcos chineses (por exemplo, Gottingen minipig), foram usadas para examinar as modalidades de tratamento neuromoduladores, tais como transplante de células estaminais; transfecção de vector viral; e estimulação cerebral profunda dirigida para a doença de Parkinson, obesidade, depressão, doença de Alzheimer e 2, 6,= "refex"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Esta foi seguida pelo desenvolvimento de abordagens cirúrgicas estereotáxicas e para manipular o minipig SNC 3, 18, 19, 20, 21. As alterações do sistema nervoso central instituídos foram avaliadas em animais vivos utilizando imagiologia cerebral (PET 10, 13, 22, 24 e 23 MR), cistometria 11, 12, 25, a análise da marcha17, a avaliação neurológica 9, 17, e exame pós-morte com base na histologia e análise estereologia 14, 15, 17, 26, 27, 31. No entanto, a análise post-mortem requer a exposição e a remoção do cérebro de porco, que não é uma tarefa fácil, como uma cabeça dura, ósseo e uma dura-máter fibrosa que cobre rodeiam o cérebro de porco.
O objectivo deste trabalho e vídeo de instruções é descrever como o cérebro de porco post-mortem e na pituitária podem ser expostos e removido em estado intacto em 15-20 min, utilizando instrumentos cirúrgicos não motorizados. O vídeo de instruções e ilustrações fotográficas mostram miniporcos do sexo masculino (idade: 6 meses, peso corporal: 20-25 kg) utilizados para um estudo anatômico na glândula pituitária minipig.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
A anestesia dos animais e euthanesia foi realizada em conformidade com o "Princípios de cuidados de animais de laboratório" (publicação NIH No. 86-23, revista 1985) e aprovado pelo Conselho dinamarquês para animal de Ética.
1. Instrumentos
- Recolher os instrumentos apresentados no vídeo e listadas na Tabela de Materiais.
2. decapitação
NOTA: A anestesia foi induzida através de uma injecção intramuscular de 5 ml de midazolam (5 mg / ml) e 5 ml de cetamina (25 mg / mL). 5-10 minutos mais tarde, quando o animal foi profundamente sedados, uma veia da orelha foi canulada e uma sobredosagem letal (100 mg / kg de peso corporal) com pentobarbital de sódio (200 mg / mL) foi administrada por via intravenosa. Para assegurar que o animal estava completamente sacrificados, o reflexo dor interdigital foi testado como mostrado por Ettrup et al. (2011) 20. eutanásia completa foi assegurada, conforme descrito noa instrução ética acima e seguido por uma perfusão transcardial com 5 L de solução salina isotónica, tal como demonstrado por Ettrup et al. (2011) 20. Todos os procedimentos são realizados demonstraram post-mortem, excluindo a necessidade das precauções necessárias para o bem-estar anestesia longo prazo e sobrevivência pós-procedimento.
- Decapitar o porco por um elevado incisão cervical circular, usando um bisturi cirúrgico, um pouco abaixo do ângulo de mandíbula (Figura 1A).
- Ainda com o bisturi cirúrgico, continuar a incisão anterior através do tecido mole do pescoço, incluindo a laringe e o esago, até que a coluna vertebral óssea é atingido, aproximadamente ao nível da junção crânio-cervical.
- Avançar o corte com um bisturi cirúrgico a partir do lado anterior da junção crânio-cervical, acima do arco anterior do atlas, e através da membrana atlanto anterior, expondo desse modo o canal vertebral e da medula espinhal (A Figura 1B). Simultaneamente pedir um assistente para puxar o corpo de porco longe da cabeça de porco para facilitar o acesso entre a base do crânio ea primeira vértebra cervical.
- Continue a incisão cirúrgica através do saco durai e a medula espinal (Figura 1B). Tomar cuidado especial para assegurar que o corte transversal completo da medula espinal é conseguido.
NOTA: A incapacidade de realizar a etapa anterior pode resultar em tração indesejada sobre a medula espinhal e do cérebro durante as seguintes etapas do processo de decapitação. - Vigorosamente estender a junção cranocervical ao nível da secção (Figura 1C). Ao mesmo tempo, utilizar o bisturi cirúrgico para os restantes secção ligamentos atlanto para soltar a articulação entre os côndilos occipitais e o processo articular superior do atlas. Separar a cabeça do porco do corpo.

Figura 1: Minipig decapitação. Incisão (A) Pescoço (seta, o ângulo da mandíbula). (B) A incisão através dos ligamentos atlanto e da medula espinhal rodeado-dura (SC) na junção craniocervical (C1, arco anterior do atlas; OC, côndilo occipital). (C) A parte posterior da articulação atlanto é libertado por uma extensão vigorosa (setas) ao nível de secção. Por favor clique aqui para ver uma versão maior desta figura.
3. Crânio Abertura
- Posicionar a cabeça de porco em uma mesa.
- Faça uma incisão longitudinal dorsal com um bisturi cirúrgico através da pele e dos tecidos moles subjacente da parte de trás do focinho, sobre o vértice da cabeça, e para baixo através da parte posterior doa região occipital.
- Expor a parte dorsal e posterior do crânio, removendo o tecido macio localizado lateral à incisão inicial com um bisturi cirúrgico.
- Libertar o músculo temporal bilateral a partir do crânio (Figura 2A) com um bisturi cirúrgico. Certifique-se de que o osso occipital posterior é limpo de tecidos moles.
- Utilizar a entrada posterior do forâmen magno para remover o osso occipital com um Kerrison perfurador e osso rongeurs osso e expor o cerebelo coberto-dura (Figura 2B).
- Retornar para o lado anterior exposta do crânio e selecione um ponto de entrada no osso frontal, mesmo em frente dos olhos. Neste ponto, usar um cinzel osso com um martelo para penetrar o crânio e entrar no seio frontal (Figura 2C).
- Utilizar a extensão do seio frontal para promover a remoção da lâmina dorsoposterior crânio exterior com um rongeur óssea ou soco e expor o interior, finalâmina crânio ósseo cobrindo o cérebro (Figura 2D).
- Suavemente abrir o interior lâmina crânio ósseo anteriormente com um martelo e um cinzel osso para expor o cérebro coberto-dura (Figura 2E).
- Continuar a remoção de osso lateralmente utilizando um cinzel osso e um rongeur osso através do osso temporal e parietal, a fim de libertar a parte dorsoposterior final do crânio, localizada entre as partes já expostas do cérebro e cerebelo coberto-dura (Figura 2F).
NOTA: Muitas vezes, é possível, durante a etapa final deste processo, para usar o cinzel de abrir o restante do osso do crânio posterior de um lado, como se abre uma porta.
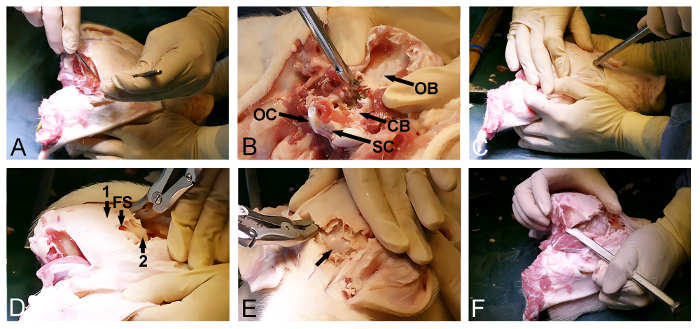
Figura 2: Minipig abertura crânio. (A) Exposição da dorsoposteriosuperfície do crânio r, incluindo a remoção do occipital e temporal do músculo. (B) A remoção do osso occipital (CB, cerebelo coberto-dura; OB, osso occipital; OC, côndilo occipital; e SC, medula espinal). (C) Um martelo e um cinzel osso são utilizadas para penetrar o crânio anteriormente e para introduzir o seio frontal ao nível dos olhos. (D) A extensão do seio frontal (FS) é utilizado para remover o osso do crânio espessa exterior (1), expondo uma lâmina óssea fina interior (2), cobrindo o cérebro. (E) Remoção da lâmina óssea fina, expondo o cérebro coberto-dura (seta). (F) Por fim, um martelo e um cinzel osso são utilizadas para ligar lateralmente o anterior e as aberturas posterior do crânio. Por favor clique aqui para ver uma versão maior desta figura.
4. REMOV Cérebroai
- Use uma pinça cirúrgica para levantar a dura e criar uma incisão perto suave para o seio sagital superior venosa utilizando um bisturi cirúrgico fina (Figura 3A).
- Use micro-tesoura ou uma dura-faca para abrir ainda mais a dura-máter que cobre a superfície dorsal do cérebro.
NOTA: cuidado especial deve ser feita quando a remoção da dura-máter correspondente ao tentorium cerebelo (Figura 3B), com a preservação deste folha dural irá impedir a remoção do cérebro posterior. - Posicionar a cabeça de porco verticalmente (Figura 3C).
- Utilizar o cinzel osso ou um dissecador para libertar o cérebro ventroanterior por dissecção romba do bolbo olfactivo do piso coberto de dura-máter da cavidade craniana (Figura 3D).
- Use um bisturi cirúrgico multa a seção do quiasma exposta (Figura 3E). Expor e secção da haste hipofisária e os nervos oculomotores.
- Solte o tronco cerebral ventral pela secção do lonervos cranianos WER (Figura 3F), com um bisturi cirúrgico fina. Certifique-se de que o tentorium cerebelar durai foi completamente incisão (Figura 3B), como esta folha da dura-máter, de outro modo atravessam o tronco cerebral durante o processo de libertação.

Figura 3: Remoção do cérebro Minipig. Abertura (A) dural com pinça cirúrgica e uma faca de dura-máter. (B) Cuidados devem ser tomados para inciso completamente a folha de dural (seta), localizado entre o cérebro e cerebelo. (C) A cabeça de porco é posicionado verticalmente para melhor visualização das estruturas da base do crânio e em ordem para a gravidade para ajudar no deslocamento pretendida do cérebro. (D) Um de dissecção ou um cinzel osso é usado para aliviar o bolbo olfactivo por secção romba da dura-covered da base do crânio. (E) A dissecção é continuada numa direcção posterior ao longo da base do crânio para exposição e seccionamento do quiasma óptico (seta), haste infundibular, e nervos oculomotores. (F) A libertação do cérebro é completado com a secção dos nervos cranianos inferiores tal como estas se afastem da superfície ventral do tronco cerebral (III, nervo oculomotor; IV, nervo troclear; V, nervo trigeminal; e VI, abducens nervo). Por favor clique aqui para ver uma versão maior desta figura.
5. pituitária Remoção
- Identificar o talo pituitária e a sua folha dural circundante (da sela diapragma) no andar crânio (Figura 4A).
- Incisão lateral da folha da dura-máter com a haste hipofisária usando um bisturi cirúrgico fino (Figura 4B).
- Use um dissector para liberar o poçouitary e levantá-lo para fora da fossa pituitária (Figura 4C).

Figura 4: Minipig remoção da pituitária. (A) A fossa pituitária (*) é identificado no chão crânio (1, bolbo olfactivo; 2, quiasma; e PF, fossa posterior). (B) A cobertura dural (diagphragm selar, (seta)) é incisado lateralmente. (C) A pituitária (seta) é libertado com um dissecador e elevado para fora da fossa pituitária. Escala da barra (AC) = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Para evitar que o material tecido de secar, recomenda-se a armazenar o cérebro removido e pituitária em um frasco cheio com o fixador ou solução salina isotónica imediatamente após análise macroscópica foi realizada. O material de tecido pode ser armazenado no fixador por ano, ao passo que o armazenamento em solução salina isotónica, mesmo no frigorífico, irá conduzir à deterioração do tecido com o tempo.
A pituitária removida podem também ser congeladas directamente por imersão em líquido seco 2-metilbutano, arrefecida com gelo, ao passo que o cérebro de porco intacta é demasiado grande para congelamento directo 28. Em vez disso, recomenda-se a fatia de cérebro de porco, tal como anteriormente demonstrado 28, em lajes espessas de tecido 9-15 mm paralelas coronal que podem ser congeladas em criostato e toto-seccionados em secções de 40 um de espessura 5, 18, 26, 28. Alternativamente, áreas específicas do cérebro pode ser livre de dissecado do cérebro intacto removida ou cortada laje cérebro e submetido a mais processamento histológico após vibratome seccionamento 30, parafina / incorporação de metacrilato e micrótomo seccionamento 6, 17, 27, ou congelamento e criostato seccionamento 6, 14, 15, 25. Na nossa configuração, as carcaças de porco são finalmente colocados em recipientes de plástico especificados e armazenadas numa sala de armazenamento a frio dedicado até que eles são recolhidos e transportados para uma instalação de degradação biológica.
Com a utilização de instrumentos cirúrgicos não motorizados (tabela de materiais), a técnica descrita (Figuras 1 g> - 3) permite que, em cerca de 15-20 min, a remoção do cérebro de porco intacta (Figura 5AB), enquanto os nervos cranianos cortadas e pituitária permanecer ligado ao chão crânio (Figura 4A). Da mesma forma, a pituitária pode ser simplesmente removida, intacto, após a remoção do cérebro sobrejacente e libertando o diafragma selar dural (Figura 4 e 5C).
O cérebro e / ou pituitária resultante (Figura 5) pode, subsequentemente, ser submetido a análise macroscópica, que, para além de inspecção visual directo, podem incluir medições de tamanho e volume 31. Isto pode ser seguido por seccionamento orientada em pequenas placas cerebrais 28, 29 adequados para análises químicas e / ou posterior preparação histológica, coloração, e análise microscópica 6,s = "refex"> 14, 15, 17, 25, 26, 27.

Figura 5: O cérebro minipig (A e B) e da pituitária (C). (A) do cérebro, vista laterodorsal (BS, tronco cerebral; CB, cerebelo; e CRB, cérebro). (B) Cérebro, vista ventral (BS, tronco cerebral; CB, cerebelo; e CRB, cérebro). (C) pituitária, vista posterior (AH, adenohipófise e NH, neurohypophysis). Barra de escala (A e B) = 10 mm, (C) = 5 mm. Por favor clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
A maior parte dos estudos experimentais neuroscience são realizados em espécies animais pequenos, tais como ratinhos e ratos, em que o acesso ao SNC é facilitado por um de espessura da dura-máter e o crânio fina. No entanto, em animais experimentais maiores, como porcos 1, 4, 8, ovinos 32, e primatas não-humanos, a espessura considerável destas estruturas que requer a utilização de instrumentos robustos (tabela de materiais) e os pontos de entrada apropriados para a remoção do osso do crânio (Figura 2). Conhecimento de restrição folhas durais (Figuras 3 e 4) é necessária antes que o sistema nervoso central pode ser acedido e o cérebro removido com segurança.
Recomenda-se a deixar a dura-máter intacta durante a remoção do osso do crânio, pois isso irá proteger o cérebro subjacente de danos. Fixação transcardial Anterior 20 pode também endurecer e SLIghtly encolher o cérebro, permitindo que o osso e o processo de remoção da dura-máter para ser executada com mais facilidade e segurança. Uma característica especial do crânio porco, em contraste com as ovelhas e primatas não humanos, é a expansão progressiva do seio frontal com a idade, que pode ser vantajosa no processo de remoção do osso do crânio (Figura 2). A técnica apresentada pode, portanto, ser utilizado em todas as espécies de animais de grande porte, mas apenas em suínos, em especial aqueles com mais de 6 meses, será o seio frontal ser desenvolvido o suficiente para fornecer uma ajuda no processo de remoção do osso do crânio. Finalmente, secção completa da medula espinhal durante o processo de decapitação (Figura 1B) e secção completa da tentorium cerebelar dural (Figura 3B) antes do lançamento final cérebro são absolutamente necessários, a fim de evitar danos posteriores para o tronco cerebral.
Em alguns estudos, pode ser vantajoso dispor de uma parte da medula espinhal cervical rostral ligado ao cérebro.Isto pode ser obtido colocando-se a incisão decapitação inicial (Figura 1A) mais caudalmente no gargalo, permitindo o acesso para a medula espinal por meio de um disco intervertebral do colo do útero, em vez da junção crânio-cervical, como demonstrado no vídeo actual. A remoção óssea posterior terá, então, começar a partir da lâmina caudal exposta. Para além disto, a técnica será semelhante, por isso, é importante lembrar que a medula espinhal deve ser completamente seccionados antes da decapitação é completada com extensão forte ao nível da secção (Figura 1). O processo actual é demonstrada em animais não fixadas, como o estudo de fundo real exigiu a análise por HPLC da pituitária derivado. Note-se, no entanto, que a mesma técnica é utilizada em animais transcardialmente fixadas com paraformaldeído a 3, 5, 14, 15,
Como discutido nos próximos parágrafos, nós preferimos usar instrumentos cirúrgicos não-motorizados. O crânio de porcos com idade acima de 1-2 anos podem, no entanto, ser tão robusto que a remoção do crânio com a instr demonstradouments não é possível, necessitando do uso de instrumentos motorizados, tais como craniotomes, serras oscilantes, e brocas eléctricas 32. Neste caso, recomenda-se ainda a seguir os passos do protocolo acima indicados, tomando desse modo vantagem dos que ocorrem naturalmente e os pontos de entrada crânio desenvolvimento do seio frontal. O acesso anterior apresentada à base do crânio é elegante e fácil, mas a libertação romba descrita dos bulbos olfactivos devem ser realizados sem orientação visual directa (Figura 3D), em contraste com a libertação mais posterior do cérebro (Figura 3EF). A parte ventral dos bulbos olfactivos pode, por conseguinte, sofrem de algum grau de danos descontrolada que só pode ser evitado, se necessário, através da perfuração da base do crânio anterior ventral para fora para as lâmpadas antes do processo de libertação é iniciada. Note-se que a manipulação, especialmente de tecido cerebral não fixadas durante a remoção do crânio, foi indicado para resultar no histologi cal escuro neurônio artefato, o que pode levar a conclusões errôneas em estudos neurotoxicológicos 33.
O processo de remoção do osso do crânio também pode ser realizado com máquinas como craniotomes, serras oscilantes, e brocas eléctricas 32. Estes podem acelerar o processo, mas que também irá aumentar o risco de danos para as estruturas neurais subjacentes. Esses equipamentos também pode ser caro e, provavelmente, não estará disponível para a maioria dos laboratórios. Temos, portanto, preferiu demonstrar o procedimento atual usando equipamento cirúrgico não motorizado (Tabela de Materiais) que é fácil de acessar e usar.
A técnica descrita e ilustrada irá, quando utilizados de forma adequada, permitir a exposição e a remoção do cérebro de porco post-mortem, pituitária, e / ou da medula espinhal cervical (Figura 5), resultando em pedaços de tecido que são bem adequados para posterior análise macroscópica"refex"> 5, 6, 19, 26, 31, o corte em placas cerebrais 28, e análise química subsequente e / ou processamento histológico 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada a revelar.
Acknowledgments
Os autores reconhecem com gratidão a ajuda hábil de Sra Trine W. Mikkelsen, Sra Lise M. Fitting, e os funcionários da Påskehøjgaard. O Medical Conselho Dinamarquês de Pesquisas, a Fundação Lundbeck, ea Nordisk Fundação Novo suportado financeiramente o estudo.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



