Summary
מטרת נייר זה סרט הדרכה היא לתאר כיצד לחשוף ולהסיר את מוח חזיר לאחר המוות ואת בלוטת יותרת מוח במצב שלם, מתאים לניתוח מקרוסקופית היסטולוגית עוקב.
Abstract
חזירים הפכו פופולריים יותר ויותר מחקרים במדעי translational גדול חיה כתחליף מבחינה כלכלית והן מבחינה מוסרית כדי פרימטים לא אנושיים. גודל המוח הגדול של החזיר מאפשר שימוש הדמיה מוחית קליני קונבנציונלית והשימוש הישיר והבדיקה של נהלים נוירוכירורגיים וציוד מהמרפאה האנושית. ניתוח מקרוסקופית היסטולוגית בהמשך, לעומת זאת, דורש חשיפה שלאחר המוות של מערכת העצבים המרכזית חזיר (CNS) והסרת המוח עוקבות. זו אינה משימה קלה, כמו החזיר CNS הוא כמוסה על ידי גולגולת עבה, גרומה עמוד שדרה. מטרת נייר זה סרט הדרכה היא לתאר כיצד לחשוף ולהסיר את מוח החזיר לאחר מוות ואת בלוטת יותרת המוח במצב שלם, מתאימה לניתוח מקרוסקופית היסטולוגית עוקב.
Introduction
מחקרים במדעי המוח Translational בחזירים הפכו פופולריים יותר ויותר במהלך שני העשורים האחרונים. גודלו של מוח החזיר מאפשר את שימוש הדמיה מוחית קליני קונבנציונלית והשימוש הישיר ובדיקה של נהלים נוירוכירורגיים וציוד מהמרפאה האנושית 1, 2, 3, 4, 5, 6, 7, 8. בשנות ה 20 השנים האחרונות, חזירים, במיוחד minipigs (למשל, גטינגן Minipig), שימשו לבחון שיטות טיפול neuromodulatory, כגון השתלת תאי גזע; transfection וקטור ויראלי; גירוי מוחי עמוק מכוון מחלת פרקינסון, השמנה, דיכאון, אלצהיימר ומחלות 2, 6,= "Xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. זה כבר ואחריו בפיתוח גישות stereotaxic וכירורגים לתפעל את Minipig 3 CNS, 18, 19, 20, 21. השינויים CNS הנהיג הוערכו בבעלי חיים באמצעות דימות המוח (10 PET, 13, 22, 24 ו MR 23), cystometry 11, 12, 25, ניתוח הליכה17, נוירולוגיות הערכה 9, 17, ו לבדיקה שלאחר המוות מבוסס על היסטולוגיה וניתוח stereological 14, 15, 17, 26, 27, 31. עם זאת, ניתוח שלאחר המוות מחייב חשיפה וסרה של מוח החזיר, אשר אינה משימה קלה, כמו גולגולת עבה, גרמית ו dural סיבי מכסים המקיפים את מוח החזיר.
מטרת נייר זה סרט הדרכה היא לתאר כיצד מוח החזיר לאחר המוות ובלוטת יותרת המוח עלול להיחשף והוסרו במצב שלם ב 15-20 דקות באמצעות כלי כירורגיים הלא ממונע. וידאו ההדרכה ואיורי צילום להראות minipigs זכר (גיל: 6 חודשים, משקל גוף: 20-25 קילו) המשמש במחקר אנטומי על בלוטת יותרת מוח Minipig.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
הרדמת euthanesia Animal בוצעה בהתאם "עקרונות של טיפול בבעלי חיים במעבדה" (מס 'פרסום NIH 86-23, מתוקן 1985) ואושר על ידי המועצה הדנית לאתיקת מחקר בבעלי החיים.
1. מכשירים
- אסוף המכשירים שהוצגו וידאו נזכרים בטבלה של חומרים.
עריפת ראש 2.
הערה: הרדמה הושרה על ידי זריקה תוך שרירית של 5 מ"ל של midazolam (5 מ"ג / מ"ל) ו 5 מ"ל של קטמין (25 מ"ג / מ"ל). 5-10 דקות מאוחר יותר, כאשר החיה היה מורדמת, וריד האוזן היה cannulated ו ממנת יתר קטלנית (100 מ"ג / ק"ג ממשקל הגוף) של נתרן pentobarbital (200 מ"ג / מ"ל) ניתנה לווריד. כדי להבטיח כי בעל החיים מורדמים לגמרי, רפלקס הכאב interdigital נבדק כפי שמוצג על ידי Ettrup ואח. (2011) 20. euthanization Complete היה מובטח כמתוארהצהרת האתיקה מעל ואחריו זלוף transcardial עם 5 L של סליין איזוטוני, כפי שהוכח על ידי Ettrup ואח. (2011) 20. כל הנהלים הפגינו מבוצעות לאחר המוות, מניעת הצורך באמצעי הזהירות הדרושים הרווחה הרדמה לטווח ארוך הישרדות postprocedural.
- לערוף את חזיר ידי חתך צוואר הרחם עגול גבוה, באמצעות אזמל כירורגי, ממש מתחת זווית בלסת התחתונה, (איור 1A).
- ובכל זאת עם האזמל כירורגי, להמשיך את החתך anteriorly דרך הרקמות הרכות של הצוואר, כולל הגרון והוושט, עד עמוד השדרה הגרמי היא הגיעה, כ ברמה של צומת craniocervical.
- Advance לחתוך באיזמל מנתחים מהצד הקדמי של צומת craniocervical, מעל הקשת הקדמית של אטלס, ואת דרך הממברנה atlantooccipital הקדמית, ובכך לחשוף את תעלת שדרה ואת חוט השדרה (איור 1B). במקביל לשאול עוזרים למשוך את גוף החזיר הרחק בראש החזיר כדי להקל על הגישה בין בסיס הגולגולת ואת החוליה הצווארית הראשונה.
- המשך חתך ניתוחי דרך שק dural ואת חוט השדרה (איור 1B). קח טיפול מיוחד על מנת להבטיח כי קטע רוחבי מלא של חוט השדרה מושג.
הערה: אי ביצוע השלב הקודם עלולים לגרום מתיחה רצויה על חוט השדרה והמוח במהלך השלבים הבאים בתהליך עריפת הראש. - בכוח להאריך את צומת cranocervical ברמה סעיף (איור 1C). במקביל, השתמש באזמל כירורגי סעיף רצועות atlantooccipital הנותרים כדי לשחרר את הארטיקולציה בין condyles העורפית ואת התהליך הרהוט העליון של אטלס. הפרד את ראש החזיר מהגוף.

איור 1: עריפת ראש Minipig. (א) צוואר חתך (חץ, זווית בלסת תחתונה,). (ב) חתך דרך רצועות atlantooccipital ואת חוט שדרה-מוקף ההדור (SC) בצומת craniocervical (C1, קשת קדמית של אטלס; OC, condyle העורפית). (ג) החלק האחורי של ארטיקולצית atlantooccipital הוא שוחרר על ידי רחבה כוחנית (חיצים) ברמת הסעיף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
3. פתיחת גולגולת
- מקם את ראש החזיר על שולחן.
- ביצוע חתך אורכי הגב באיזמל מנתחים דרך העור ואת רקמות רכות הבסיסית מהחלק האחורי של חוטם, על הקודקוד של הראש, ולמטה דרך החלק האחורי שלהאזור העורפי.
- לחשוף את החלק הגבה ואת אחורי של הגולגולת על ידי הסרת הרקמות הרכות הממוקמות לרוחב החתך הראשוני באיזמל מנתחים.
- שחרר את השריר הזמני בילטרלי מהגולגולת (איור 2 א) באיזמל מנתחים. ודא כי עצם העורף האחורי הוא ניקה של רקמות רכות.
- השתמש הכניסה האחורית של מגנום foramen להסיר את עצם העורף עם אגרוף העצם Kerrison ו rongeurs העצם ולחשוף המוחון מכוסי הדורה (איור 2B).
- חזור אל הצד הקדמי החשוף של הגולגולת ובחר נקודת כניסה של העצם הפרונטלית, ממש מול העיניים. בשלב זה, להשתמש באיזמל העצם עם פטיש לחדור הגולגולת להיכנס סינוס פרונטלי (איור 2C).
- השתמש היקף סינוס פרונטלי כדי לקדם את הסרת dorsoposterior של lamina הגולגולת החיצוני באגרוף rongeur או עצם עצם ולחשוף את הפנימיות, רזהlamina פדחת גרמית המכסה את המוח הגדול (2D איור).
- בעדינות לפתוח את lamina הגולגולת הגרמי הפנימי קדמי עם פטיש ואזמל עצם לחשוף את המוח הגדול מכוסה-דורא (האיור 2E).
- המשך הסרת עצם רוחבית בעזרת אזמל עצם ועצם rongeur דרך העצם הטמפורלית הקודקודית כדי לשחרר את החלק dorsoposterior הסופי של הגולגולת, הממוקם בין החלקים החשופים כבר פעולת המוח מכוסה הדורה המוחון (איור 2F).
הערה: זה בדרך כלל אפשרי, במהלך השלב הסופי של הליך זה, להשתמש המפסלת לפרוץ את עצם הגולגולת האחורית הנותרים מצד אחד, בדיוק כמו אחד פותח דלת.
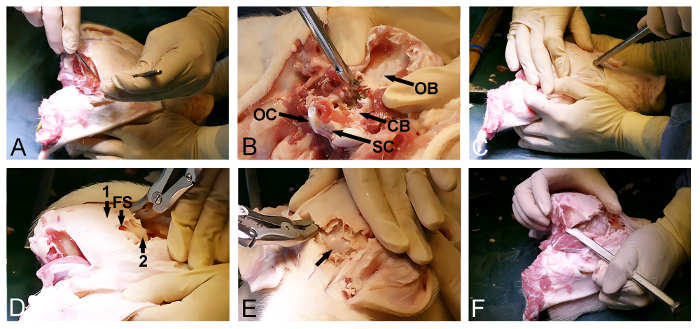
איור 2: פתיחת גולגולת Minipig. (א) חשיפה של dorsoposterioפני גולגולת R, כולל ההסרה העורפית ואת השרירים זמניים. הסרת (B) של עצם העורף (CB, המוחון מכוסי דורא; OB, עצם העורף; OC, condyle העורפית; ו SC, חוט השדרה). (ג) פטיש ואזמל עצם משמשים לחדור הגולגולת קדמית ו להיכנס סינוס פרונטלי ברמה של העיניים. (ד) היקף סינוס פרונטלי (FS) משמש כדי להסיר את עצם הגולגולת העבה החיצוני (1), וחשף lamina עצם דק פנימי (2) המכסה את המוח הגדול. הסרה (E) של lamina העצם הדק, חשיפת המוח גדול מכוסי הדורה (חץ). (F) לבסוף, פטיש ואזמל עצם משמשים רוחבי לחבר את הקדמי ואת פתחי הגולגולת האחורית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
4. המוח removאל
- שימוש במלקחיים כירורגיים להרים את הדורה וליצור קרוב חתך עדין אל סינוס sagittal מעולה ורידי באמצעות אזמל כירורגי קנס (איור 3A).
- השתמשו-מספריים מיקרו או א-דורא סכין נוספת כדי לפתוח את הדורה המכסה את פני השטח הגבי של המוח.
הערה: טיפול מיוחד יש לנקוט בעת הסרת הדורה המתאים אוֹהֶל המוח הקטן (איור 3B), כמו שימור עלים dural זה ימנע הסרת המוח עוקבות. - מקם את ראש החזיר אנכי (איור 3 ג).
- השתמש אזמל העצם או מבתר לשחרר את המוח הגדול ventroanterior ידי לנתיחה בוטה של הנורה הריח מן הרצפה המכוסה הדורה של חלל הגולגולת (איור 3D).
- השתמש אזמל כירורגים בסדר סעיף תצלובת הראייה החשופה (האיור 3E). לחשוף קטע גבעול ההיפופיזה ואת העצבים האוקולומוטורי.
- שחרר את המוח הגחון על ידי חתך את loעצבי גולגולת wer (איור 3F) באיזמל מנתחים דק. ודא כי אוֹהֶל cerebellar dural היה חרוט לחלוטין (איור 3B), כמו עלה dural זה יקצץ אחרת דרך גזע המוח במהלך תהליך השחרור.

איור 3: הסרת המוח Minipig. (א) פתיחת Dural עם מלקחיים כירורגיים וסכין הדור. (ב) יש להקפיד על מנת לחתוך את עלי dural לחלוטין (חץ), הממוקמים בין המוח הגדול לבין המוח הקטן. (ג) ראש החזיר ממוקם אנכי עבור ויזואליזציה טובה יותר של מבנים בבסיס גולגולת כדי כובד לסייע עקירה המיועדת של המוח. (ד) מבתר או אזמל עצם משמש כדי להקל את נורת חוש הריח על ידי סעיף בוטה מן דורא-covereבסיס גולגולת ד. (E) דיסקציה היא המשיכה בכיוון אחורי לאורך בסיס הגולגולת לחשיפת חתך של תצלובת הראייה (חץ), גבעול infundibular, ועצבים האוקולומוטורי. (F) שחרור המוח יושלם עם הסעיף של עצבי גולגולת הנמוכים כפי שהם יוצאים מן שטח הגחון של גזע המוח (III, עצב האוקולומוטורי; IV, עצב סליל; V, עצב trigeminal; ו- VI, עצב המצדיד). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
5. הסרת יותרת המוח
- זהה את גבעול יותרת עלה dural המקיפים שלה (sellae diapragma) ב (איור 4 א) רצפת הגולגולת.
- לחתוך את רוחבי עלה dural לגבעול יותרת המוח באמצעות אזמל כירורגי קנס (איור 4 ב).
- השתמש מבתר לשחרר את בורuitary ולהרים אותו אל מחוץ הפוסה יותרת המוח (איור 4C).

איור 4: הסרת יותרת המוח Minipig. (א) הפוסה יותרת המוח (*) מזוהה רצפת הגולגולת (1, נורת ריח; 2, תצלובת ראייה; ו PF, הפוסה גולגולתי אחורית). (ב) כיסוי dural (diagphragm sellar, (החץ)) הוא חרות רוחבי. (ג) בלוטת יותרת המוח (חץ) הוא שוחרר עם מבתר והרים מתוך הפוסה יותרת המוח. בר סולם (AC) = 10 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
כדי למנוע את חומר רקמות מהתייבשות, מומלץ לאחסן את המוח הוסר יותרת בצנצנת מלאה מקבע או סליין איזוטוני מייד לאחר ניתוח מקרוסקופי שבוצע. חומר הרקמות ניתן לאחסן מקבע במשך שנים, ואילו אחסון סליין איזוטוני, אפילו במקרר, יוביל ריקבון רקמה עם זמן.
בלוטת יותרת מוח הסיר עשוי גם להיות קפוא ישירות על ידי טבילה לתוך נוזל 2-methylbutane קרח מקורר יבש, ואילו מוח החזיר השלם הוא גדול מדי עבור מקפיא ישיר 28. במקום זאת, מומלץ לחתוך את המוח חזיר, כפי שמודגם בעבר 28, לתוך 9-15 מ"מ לוחות רקמות העטרה במקביל עבה שיכול להיות קפוא טוטו cryostat-מחולק לתוך 40 מיקרומטר בעובי חלקים 5, 18, 26, 28. לחלופין, אזורים ספציפיים במוח יכולים להיות חופשיים-גזור מן המוח השלם סיר או פרוס לוח המוח שהוגש עיבוד היסטולוגית נוסף לאחר חתך vibratome 30, פרפין / methacrylate הטבעה ו microtome חתך 6, 17, 27, או מקפיא cryostat חתך 6, 14, 15, 25. בהגדרה שלנו, על פגרי החזירים ממוקמים ולבסוף במכלי פלסטיק שצוינו ומאוחסני חדר קירור ייעודי עד שהם נאספים ומובלים למתקן משפיל ביולוגי.
עם השימוש בכלי כירורגיים הלא ממונע (טבלה של חומרים), הטכניקה המתוארת (איורים 1 g> - 3) מאפשר, ב כ 15-20 דקות, הסרת המוח חזיר שלם (איור 5AB), בעוד העצבים ובלוטת יותרת המוח גולגולתי הכרות נשארים מחוברים לרצפה הגולגולת (איור 4A). כמו כן, יותרת המוח ניתן להסיר פשוט, ללא פגע, לאחר הסרת המוח שמעליה ושחרור לסרעפת sellar dural (איור 4 ו -5 ג).
המוח וכתוצאה מכך ו / או יותרת המוח (איור 5) ייתכן כי בהמשך יוגשו ניתוח מקרוסקופי כי, מלבד בדיקה ויזואלית ישירה, עשויים לכלול מדידות גודל ונפח 31. זה יכול להיות מלווה על ידי אוריינטציה חתך לתוך לוחות המוח קטן 28, 29 מתאים ניתוח כימי ו / או הכנה היסטולוגית נוספת, מכתים, ניתוח מיקרוסקופי 6,s = "Xref"> 14, 15, 17, 25, 26, 27.

איור 5: מוח Minipig (A ו- B) ובלוטת יותרת המוח (C). (א) מוח, נוף laterodorsal (BS, גזע מוח; CB, מוח קטן; ו CRB, מוח גדול). (B) מוח, נוף גחון (BS, גזע מוח; CB, מוח קטן; ו CRB, מוח גדול). (ג) יותרת המוח, נוף האחורי (AH, adenohypophysis ו NH, neurohypophysis). בר סולם (A ו- B) = 10 מ"מ, (C) = 5 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
רוב המחקרים במדעי מוח הניסיונות מבוצעים מינים של בעלי חיים קטנים, כגון עכברים וחולדות, שבו גישת CNS בהנחייתם א-עובי dural skull- ורזה. עם זאת, בחיות מעבדה גדולות כמו חזירים 1, 4, 8, כבשת 32, ו פרימטים לא אנושי, העובי הניכר של מבנים אלה מחייב שימוש בכלים חזקים (טבלה של חומרים) וכן בנקודות כניסה נכונות להסרת עצם גולגולת (איור 2). ידיעת הגבלת עלי dural (איורים 3 ו 4) נדרשה לפני CNS ניתן לגשת ואת המוח להסיר בבטחה.
מומלץ להשאיר את הדורה ללא פגע במהלך הסרת עצם הגולגולת, כמו זה יהיה להגן על המוח מפני נזק הבסיסית. קיבוע transcardial הקודם 20 עלול להקשות כן ו SLIghtly לכווץ את המוח, מה שמאפשר את עצם תהליך הסרת dural להתבצע בקלות יותר ובטיחות. תכונה מיוחדת של הגולגולת חזיר, בניגוד כבשים הפרימטים הלא-אנושית, היא התרחבות הדרגתית של סינוס פרונטלי עם הגיל, אשר עשוי להיות יתרון בתהליך הסרת עצם הגולגולת (איור 2). הטכניקה המוצגת עשויה לשמש בהתאם על כל מיני בעלי חיים גדולים, אלא רק בחזירים, במיוחד אלו מעל גיל 6 חודשים, יהיה הסינוס הפרונטלי יפותח מספיק כדי לספק סיוע בתהליך הסרת עצם הגולגולת. לבסוף, חתך שלם של חוט השדרה במהלך תהליך עריפת (איור 1B) חתך שלם של אוֹהֶל cerebellar dural (איור 3B) לפני שחרור המוח הסופי נדרשים לחלוטין על מנת למנוע נזק לאחר בגזע המוח.
בחלק ממחקרים, זה עשוי להיות יתרון להיות חלק חוט השדרה הצווארי המקורי מצורף המוח.זה ניתן להשיג על ידי צבת חתך העריפה הראשוני (איור 1A) יותר caudally על הצוואר, המאפשר גישה אל חוט השדרה באמצעות דיסק צוואר רחם חולייתי במקום לצומת craniocervical, כפי שמודגם בסרטון הנוכחי. הסרת העצם האחורי יהיה אז צריך להתחיל מן lamina הזנב חשוף. מלבד זאת, הטכניקה תהיה דומה, ולכן חשוב לזכור כי חוט השדרה חייב להיות מחולק לחלוטין לפני העריפה תושלם עם סיומת חזקה ברמת הסעיף (איור 1). ההליך הנוכחי מודגם על חיות מבולבלות, כמו המחקר רקע בפועל חייב ניתוח HPLC של בלוטת יותרת המוח נגזר. הערה, עם זאת, כי הטכניקה הזהה משמשת על חיות מקובעות transcardially עם paraformaldehyde 3, 5, 14, 15,
כפי שנאמר בפסקאות הבאה, העדפנו להשתמש בכלי כירורגיים הלא ממונע. הגולגולת של חזירים בגילאים מעל 1-2 שנים עשויה, עם זאת, להיות כל כך חזקה כי הסרת גולגולת עם Instr הפגיןuments לא אפשרי, יש צורך בהפעלת מכשירים ממונעים, כגון craniotomes, מסורי נדנוד, מקדחות חשמליות 32. במקרה כזה, הוא עדיין מומלץ לבצע את שלבי הפרוטוקול שצוינו לעיל, ובכך מנצל את נקודות כניסת גולגולת הטבעיות ופיתוח סינוס פרונטלי. הגישה הקדמית הציגה לבסיס הגולגולת היא אלגנטית וקלה, אך שחרורו הבוטה תאר של נורות ההרחה חייבת להתבצע ללא הדרכה ויזואלית ישירה (איור 3D), בניגוד שחרורו האחורי יותר של המוח (האיור 3EF). חלק הגחון של נורות הרחה עשוי אפוא סובל במידה מסוימת של ניזק בלתי מבוקר שרק ניתן להימנע, במידת הצורך, על ידי קידוח בבסיס הגולגולת הקדמי החוצה הגחון נורה לפני תהליך השחרור הוא יזם. שים לב המניפולציה, במיוחד של רקמת מוח מבולבלת במהלך הסרת גולגולת, כבר הצביעה כדי לגרום histologi חפץ נוירון כהה קאל, אשר עלול להוביל למסקנות שגויות במחקרים neurotoxicological 33.
תהליך הסרת עצם הגולגולת יכול גם להתבצע עם מכונות כמו craniotomes, מסורי נדנוד, מקדחות חשמליות 32. אלה עשויים לזרז את התהליך, אבל הם גם יגדילו את הסיכון של פגיעת המבנים העצביים הבסיסיים. ציוד כזה גם יכול להיות יקר יהיה זמין ככל הנראה למרבית המעבדות. לפיכך, אנו מעדיפים להפגין את ההליך הנוכחי באמצעות ציוד כירורגים הלא ממונע (לוח של חומרים) כי הוא קל לגשת ולהשתמש.
הטכניקה המתוארת ואייר יהיה, כאשר משתמשים בו כראוי, לאפשר חשיפה והסרה של המוח חזיר לאחר המוות, יותרת המוח, ו / או בחוט השדרה הצווארי (איור 5), וכתוצאה מכך חתיכות רקמה שמתאימים היטב לניתוח מקרוסקופית נוספת"Xref"> 5, 6, 19, 26, 31, חתך לתוך לוחות מוח 28, וניתוח כימי עוקב ו / או עיבוד היסטולוגית 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
החוקרים אין לחשוף.
Acknowledgments
המחברים מודים בהכרת תודה את הסיוע מיומן של גב 'Trine וו מיקלסן, גב' ליזה M. התאמה, וכך גם הצוות Påskehøjgaard. המועצה למחקר הרפואית הדנית, הקרן לונדבק, וקרן נובו נורדיסק כלכלית נתמכת במחקר.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



