Summary
Le but de cet article et vidéo d'instruction est de décrire comment exposer et enlever le cerveau de porc post-mortem et hypophyse dans un état intact, adapté à l'analyse macroscopique et histologique.
Abstract
Les porcs sont devenus de plus en plus populaire dans la recherche en neurosciences translationnelle grand animal comme sur le plan économique et sur le plan éthique substitut possible aux primates non humains. La grande taille du cerveau du porc permet l'utilisation des imageurs du cerveau clinique classique et l'utilisation directe et le contrôle des procédures et de l'équipement neurochirurgicales de la clinique humaine. Une analyse plus poussée macroscopique et histologique, cependant, exige une exposition post-mortem du système nerveux central de porc (CNS) et l'élimination ultérieure du cerveau. Ce n'est pas une tâche facile, comme le porc du système nerveux central est encapsulé par un crâne épais, osseux et de la colonne vertébrale. Le but de cet article et vidéo d'instruction est de décrire comment exposer et enlever le cerveau de porc post-mortem et l'hypophyse dans un état intact, adapté à l'analyse macroscopique et histologique.
Introduction
Des études en neurosciences translationnelles chez les porcs sont devenus de plus en plus populaires au cours des deux dernières décennies. La grande taille du cerveau de porc permet l'utilisation d'imageurs du cerveau clinique classiques et l'utilisation directe et les tests des procédures neurochirurgicales et de l' équipement de la clinique humaine 1, 2, 3, 4, 5, 6, 7, 8. Au cours des 20 dernières années, les porcs, en particulier miniporcs (par exemple, Göttingen minipig), ont été utilisées pour examiner les modalités de traitement neuromodulateurs, comme la transplantation de cellules souches; transfection de vecteur viral; et la stimulation cérébrale profonde dirigée vers la maladie de Parkinson, l' obésité, la dépression, la maladie d' Alzheimer et 2, 6,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Cela a été suivi par le développement d'approches chirurgicales stéréotaxiques et de manipuler le système nerveux central minipig 3, 18, 19, 20, 21. Les modifications du SNC instituées ont été évaluées chez des animaux vivants en utilisant l' imagerie du cerveau (PET 10, 13, 22, 24 et 23 MR), cystometry 11, 12, 25, analyse de la marche17, l' évaluation neurologique 9, 17, et examen post - mortem sur la base de l' histologie et analyse stéréologique 14, 15, 17, 26, 27, 31. Cependant, l'analyse post-mortem nécessite l'exposition et l'élimination du cerveau de porc, ce qui est pas une tâche facile, comme un crâne épais, osseux et un dural fibreux couvrant entourent le cerveau de porc.
Le but de cet article et vidéo d'instruction est de décrire comment le cerveau de porc post-mortem et hypophyse peuvent être exposés et éliminés dans un état intact 15-20 min à l'aide des outils chirurgicaux non motorisés. La vidéo pédagogique et illustrations photographiques montrent miniporcs mâles (âge: 6 mois, poids vif: 20-25 kg) utilisés pour une étude anatomique sur l'hypophyse minipig.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
anesthésie animale et euthanesia a été réalisée conformément aux « Principes de protection des animaux de laboratoire » (publication NIH n ° 86-23, révisé 1985) et approuvé par le Conseil danois pour l'éthique de la recherche animale.
1. Instruments
- Recueillir les instruments présentés dans la vidéo et figurant dans la table des matières.
2. Décapitation
NOTE: L'anesthésie a été induite par une injection intramusculaire de 5 mL de midazolam (5 mg / ml) et 5 ml de kétamine (25 mg / ml). 5-10 min plus tard, quand l'animal a été profondément sous sédation, une veine de l'oreille a été canulée et une surdose létale (100 mg / kg de poids corporel) de pentobarbital de sodium (200 mg / ml) a été administré par voie intraveineuse. Pour veiller à ce que l'animal a été complètement euthanasié, le réflexe de la douleur interdigital a été testé comme indiqué par Ettrup et al. (2011) 20. Complète euthanasier a été assurée comme décrit dansla déclaration d'éthique ci - dessus et suivie par une perfusion transcardial avec 5 L d' une solution saline isotonique, tel que démontré par Ettrup et al. (2011) 20. Toutes les procédures démontrées sont effectuées post-mortem, ce qui exclut la nécessité pour les mesures de protection nécessaires à l'anesthésie à long terme et la survie postprocedural.
- Décapitez le porc par une incision cervicale haute circulaire, à l' aide d' un scalpel chirurgical, juste en dessous de l'angle mandibulaire (figure 1A).
- Toujours avec le scalpel chirurgical, poursuivre l'incision antérieure à travers le tissu mou du cou, y compris le larynx et l'oesophage, jusqu'à ce que la colonne vertébrale osseuse est atteint, à peu près au niveau de la jonction cranio.
- Faire avancer la coupe avec un scalpel chirurgical à partir de la face antérieure de la jonction cranio-cervicale, au-dessus de l'arc antérieur de l'atlas, et à travers la membrane atlanto-occipitale antérieure, exposant ainsi le canal médullaire et la moelle épinière (Figure 1B). Dans le même temps demander à un assistant de tirer le corps de porc loin de la tête de porc pour faciliter l'accès entre la base du crâne et la première vertèbre cervicale.
- Continuer l'incision chirurgicale à travers le sac durai et la moelle épinière (figure 1B). Faites attention à veiller à ce qu'une section transversale complète de la moelle épinière est atteint.
REMARQUE: Le défaut d'effectuer l'étape précédente peut entraîner une traction indésirable sur la moelle épinière et le cerveau au cours des étapes suivantes du processus de décapitation. - Étendre la jonction avec force cranocervical au niveau de la section (Figure 1C). Dans le même temps, utiliser le scalpel chirurgical à la section des ligaments restants atlanto-occipitale pour libérer l'articulation entre les condyles occipitaux et le processus articulé supérieur de l'atlas. Séparer la tête de porc de l'organisme.

Figure 1: Minipig décapitation. (A) incision du cou (flèche, l' angle de la mandibule). (B) à travers l' incision des ligaments atlanto - occipitale et la dure - mère de la moelle épinière, entouré (SC) à la jonction cranio - cervicale (C1, arc antérieur de l' atlas; OC, occipital condyle). (C) La partie postérieure de l'articulation atlanto - occipitale est libéré par une extension forcée (flèches) au niveau de la section. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
3. Ouverture de crâne
- Placez la tête de porc sur une table.
- Faire une incision longitudinale dorsale avec un scalpel chirurgical à travers la peau et les tissus mous sous-jacente à l'arrière du museau, sur le sommet de la tête, et vers le bas par la partie postérieure dela région occipitale.
- Exposer la partie dorsale et postérieure du crâne en enlevant le tissu mou situé latéralement à l'incision initiale avec un scalpel chirurgical.
- Libérer le muscle temporal bilatéral du crâne (figure 2A) avec un scalpel chirurgical. Assurez-vous que l'os occipital postérieur est nettoyé des tissus mous.
- Utilisez l'entrée postérieure du trou occipital pour enlever l'os occipital avec un poinçon os Kerrison et rongeurs os et exposer le cervelet couvert dura-(figure 2B).
- Retour à la face antérieure du crâne exposé et sélectionnez un point d'entrée dans l'os frontal, juste devant les yeux. À ce stade, utiliser un ciseau à os avec un marteau pour pénétrer dans le crâne et entrer dans le sinus frontal (figure 2C).
- Utiliser la mesure du sinus frontal pour favoriser le retrait de la lame dorsoposterior du crâne externe avec une pince-gouge d'os ou l'os poinçon et d'exposer la intérieure mincelamina osseuse du crâne recouvrant le cerveau (figure 2D).
- Ouvrir doucement le crâne osseux interne lame avant avec un marteau et d' un ciseau à os pour exposer le cerveau-mère recouvert (figure 2E).
- Poursuivre le retrait d'os en utilisant latéralement un ciseau à os et une pince - gouge osseuse à travers l'os temporal et pariétal afin de libérer la partie dorsoposterior finale du crâne, situé entre les parties déjà exposées du cerveau-mère recouvert et le cervelet (Figure 2F).
NOTE: Il est souvent possible, au cours de la dernière étape de cette procédure, d'utiliser le ciseau pour briser l'os ouvert le crâne postérieur restant d'un côté, comme on ouvre une porte.
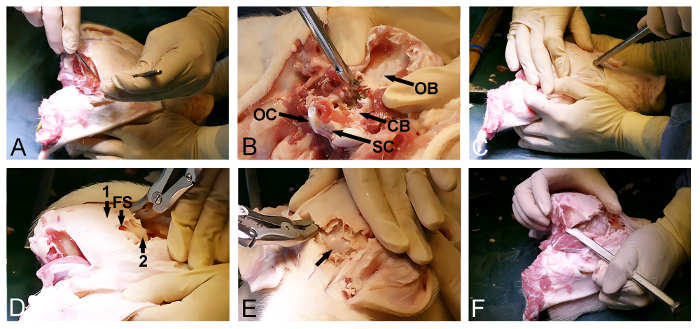
Figure 2: ouverture du crâne Minipig. (A) L' exposition de la dorsoposterior surface du crâne, y compris le retrait de l'occipital et les muscles temporaux. (B) enlèvement de l'os occipital (CB, cervelet-mère recouvert; OB, os occipital; OC, condyle occipital, et SC, la moelle épinière). (C) un marteau et d' un ciseau à os sont utilisés pour pénétrer dans le crâne en avant et pour entrer dans le sinus frontal au niveau des yeux. (D) la mesure du sinus frontal (FS) est utilisé pour enlever l'os du crâne épais extérieur (1), l' exposition d' une feuille mince de l' os intérieur (2) recouvrant le cerveau. (E) enlèvement de la lame mince de l' os, ce qui expose le cerveau-mère recouvert (flèche). (F) Enfin, un marteau et d' un ciseau à os sont utilisés pour relier latéralement la partie antérieure et les ouvertures du crâne postérieur. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
4. Cerveau RemovAl
- Utiliser des pinces chirurgicales pour soulever la dure - mère et de créer une légère incision à proximité du sinus veineux sagittal supérieur au moyen d' un fin scalpel chirurgical (Figure 3A).
- Utilisation des micro-ciseaux ou un couteau-mère à ouvrir davantage la dure-mère recouvrant la surface dorsale du cerveau.
REMARQUE: Des précautions particulières doivent être prises lors du retrait du correspondant à la dure-mère cérébelleuse tentorium (figure 3B), comme la préservation de cette feuille dural empêchera l'élimination ultérieure du cerveau. - Positionner la tête de porc verticalement (figure 3C).
- Utiliser le ciseau à os ou un dissecteur pour libérer le cerveau ventroanterior par dissection du bulbe olfactif du sol recouvert de dure-la cavité crânienne (figure 3D).
- Utiliser une amende scalpel chirurgical de section du chiasma optique exposée (Figure 3E). Exposer et section de la tige pituitaire et les nerfs oculomoteurs.
- Relâchez le tronc cérébral ventrale en sectionnant le lonerfs crâniens wer (Figure 3F) avec un fin scalpel chirurgical. Assurez -vous que le tentorium dural cérébelleuse a été complètement incisé (figure 3B), comme cette feuille dural va autrement couper à travers le tronc cérébral au cours du processus de libération.

Figure 3: Minipig élimination du cerveau. (A) avec ouverture Dural pince chirurgicale et un couteau-mère. (B) Il faut veiller à inciser complètement la feuille dural (flèche), situé entre le cerveau et le cervelet. (C) La tête de porc est positionné verticalement pour une meilleure visualisation des structures de base du crâne et pour que la gravité pour aider au déplacement voulu du cerveau. (D) un dissecteur ou un ciseau à os est utilisé pour soulager le bulbe olfactif par section émoussée de la dure-remd la base du crâne. (E) La dissection se poursuit dans une direction postérieure le long de la base du crâne pour l' exposition et la coupe du chiasma optique (flèche), tige infundibulaire, et les nerfs oculomoteurs. (F) La libération du cerveau est complétée par la section des nerfs crâniens inférieurs tels qu'ils partent de la surface ventrale du tronc cérébral (III, nerf oculomoteur, IV, nerf trochléaire; V, nerf trijumeau, et VI, abducens nerf). S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
5. Suppression pituitaire
- Identifier la tige pituitaire et ses environs feuille dural (la sellae de diapragma) dans le plancher du crâne (figure 4A).
- Inciser la feuille latérale de la dure - mère à la tige pituitaire au moyen d' un fin scalpel chirurgical (figure 4B).
- Utilisez un dissecteur pour libérer la fosseuitary et le sortir de la fosse hypophysaire (Figure 4C).

Figure 4: Minipig élimination de l' hypophyse. (A) La fosse pituitaire (*) est identifié dans le plancher du crâne (1, bulbe olfactif, 2, chiasma optique, et PF, postérieure fosse crânienne). (B) Le revêtement dural (sellar de diagphragm, (flèche)) est incisée latéralement. (C) L'hypophyse (flèche) est libéré avec un dissecteur et sorti de la fosse pituitaire. Barre d'échelle (AC) = 10 mm. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Pour éviter que le matériau de tissu de sécher, il est recommandé de stocker le cerveau enlevé et pituitaire dans un bocal rempli de fixatif ou une solution saline isotonique immédiatement après l'analyse macroscopique a été réalisée. Le matériau de tissu peut être stocké dans le fixatif pendant des années, alors que le stockage dans une solution saline isotonique, même dans un réfrigérateur, conduira à la désintégration du tissu avec le temps.
L'hypophyse peut également être retiré directement congelé par immersion dans 2-méthylbutane liquide refroidi à la glace carbonique, alors que le cerveau de porc intacte est trop grande pour la congélation directe 28. Au lieu de cela, il est recommandé de découper le cerveau de porc, comme précédemment démontré 28, en tranches coronales de tissu parallèles d' épaisseur 9-15 mm qui peuvent être congelés et sectionnés in toto-cryostat en 40 sections pm d'épaisseur 5, 18, 26, 28. En variante, des zones spécifiques du cerveau peut être libre-disséqués à partir du cerveau intact enlevé ou dalle de cerveau en tranches et soumis à un traitement ultérieur histologique après vibratome sectionnement 30, de la paraffine / enrobage méthacrylate et microtome sectionner 6, 17, 27, ou la congélation et cryostat sectionner 6, 14, 15, 25. Dans notre contexte, les carcasses de porcs sont finalement placés dans des contenants en plastique spécifiés et entreposés dans un local de stockage à froid dédié jusqu'à ce qu'ils soient collectés et transportés vers une installation dégradante biologique.
Avec l'utilisation d'outils chirurgicaux non motorisés (table des matières), la technique décrite (figures 1 g> - 3) permet, en environ 15 à 20 min, l'élimination du cerveau de porc intacte (figure 5AB), tandis que les nerfs crâniens coupées et pituitaire restent reliés au plancher du crâne (figure 4A). De même, l'hypophyse peut être simplement retiré, intact, après avoir enlevé le cerveau sus - jacente et à libérer la membrane sellar dural (figure 4 et 5C).
Le cerveau résultant et / ou hypophysaire (Figure 5) peuvent ensuite être soumis à une analyse macroscopique que, en dehors de l' inspection visuelle directe, peuvent comprendre les dimensions et les mesures de volume 31. Ceci peut être suivi par sectionnement orienté en plus petites plaques cérébrales 28, 29 approprié pour l' analyse chimique et / ou autre préparation histologique, la coloration, et une analyse microscopique 6,s = "xref"> 14, 15, 17, 25, 26, 27.

Figure 5: Le cerveau de porc miniature (A et B) et de l' hypophyse (C). (A) du cerveau, vue latéro (BS, tronc cérébral, CB, cervelet et CRB, encéphale). (B) du cerveau, vue ventrale (BS, tronc cérébral, CB, cervelet et CRB, encéphale). (C) hypophysaire, vue postérieure (AH, adénohypophyse et NH, neurohypophyse). La barre d'échelle (A et B) = 10 mm, (C) = 5 mm. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
La plupart des études de neuroscience expérimentales sont réalisées en petites espèces d'animaux, comme les souris et les rats, où l'accès au SNC est facilitée par une fine épaisseur dural et skull-. Cependant, chez les animaux expérimentaux plus grands comme les porcs 1, 4, 8, les moutons 32 et les primates non humains, l'épaisseur considérable de ces structures nécessite l'utilisation d'instruments robustes (table des matières) et les points d'entrée appropriés pour l' enlèvement de l' os du crâne (Figure 2). Connaissance de restreindre les feuilles duraux (figures 3 et 4) est nécessaire avant que le système nerveux central est accessible et le cerveau retiré en toute sécurité.
Il est recommandé de laisser intacte la dure-mère lors de l'enlèvement des os du crâne, car cela protège le cerveau contre les dommages sous-jacents. Fixation précédente transcardial 20 peut également durcir et sliréduire ghtly le cerveau, ce qui permet le processus de suppression des os et durale à réaliser avec plus de facilité et de sécurité. Une caractéristique particulière du crâne de porc, en contraste avec les moutons et les primates non humains, est l'expansion progressive du sinus frontal avec l' âge, ce qui peut être avantageux dans le processus de retrait d'os du crâne (Figure 2). La technique présentée peut donc être utilisé sur toutes les grandes espèces animales, mais seulement chez les porcs, en particulier ceux de plus de 6 mois, sera le sinus frontal soit suffisamment développé pour fournir une aide dans le processus d'élimination des os du crâne. Enfin, complet du sectionnement de la moelle épinière au cours du processus de décapitation (figure 1B) et la coupe complète du dural cérébelleuse tentorium (figure 3B) avant la sortie du cerveau finale sont absolument nécessaires afin d'éviter les dommages consécutifs au tronc cérébral.
Dans certaines études, il peut être avantageux d'avoir une partie de la moelle épinière cervicale rostrale attachée au cerveau.Ceci peut être obtenu en plaçant l'incision de la décapitation initiale (figure 1A) plus caudale sur le col, ce qui permet l' accès à la moelle épinière par l' intermédiaire d' un disque intervertébral cervical à la place de la jonction cranio - cervicale, comme démontré dans la vidéo en cours. L'enlèvement de l'os postérieur devra alors commencer à partir de la lame caudale exposée. En dehors de cela, la technique sera similaire, il est donc important de se rappeler que la moelle épinière doit être complètement sectionné avant la décapitation est complétée par l' extension de force au niveau de la section (Figure 1). La procédure actuelle est démontrée sur des animaux non fixés, comme l'étude de fond réelle a nécessité une analyse par HPLC de l'hypophyse dérivée. Notez toutefois que la même technique exacte est utilisée sur les animaux transcardiaque obsédés avec paraformaldéhyde 3, 5, 14, 15, 16, 17, 18, 19, 20, 25, 26, 27, 28, 31, bien que toutes les procédures dans ce cas doivent être effectuées sous une bonne ventilation fournie par une hotte 20. Le choix de la dissection native par rapport à toto -fixation et la dissection ultérieure devrait donc dépendre uniquement sur la procédure de post-traitement nécessaire (par exemple, histologie conventionnelle, immunohistochimie, HPLC et FISH) 32.
Comme indiqué dans les prochains paragraphes, nous avons préféré utiliser des outils chirurgicaux non motorisés. Le crâne des porcs âgés de plus de 1-2 ans peut, toutefois, être aussi robuste que l'enlèvement du crâne avec le instr démontréuments pas est possible, ce qui nécessite l'utilisation d'instruments motorisés, tels que craniotomes, scies oscillantes et les exercices électriques 32. Dans ce cas, il est toujours recommandé de suivre les étapes du protocole indiquées ci-dessus, tirant ainsi parti des points d'entrée du crâne d'origine naturelle et le développement du sinus frontal. L'accès antérieur présenté à la base du crâne est élégant et facile, mais la libération contondant décrit des bulbes olfactifs doit être effectuée sans guidage visuel direct (figure 3D), contrairement à la version plus postérieure du cerveau (Figure 3EF). La partie ventrale des bulbes olfactifs peut donc souffrir d'un certain degré de dommages non contrôlé qui ne peut être évité, si nécessaire, en perçant la base antérieure du crâne sur ventral aux ampoules avant que le processus de libération est lancé. Notez que la manipulation, en particulier du tissu cérébral non fixé lors de l'enlèvement du crâne, a été indiqué dans le résultat histologi artefact neurone cal noir, ce qui peut conduire à des conclusions erronées dans les études neurotoxicologiques 33.
Le processus de retrait d'os du crâne peut également être effectuée avec des machines comme craniotomes, scies oscillantes et les exercices électriques 32. Ceux-ci peuvent accélérer le processus, mais ils augmenteront également le risque de dommages aux structures nerveuses sous-jacentes. Un tel équipement peut aussi être coûteux et sera probablement disponible pour la plupart des laboratoires. Nous avons donc préféré démontrer la procédure actuelle à l' aide du matériel chirurgical non motorisé (Table des matières) qui est facile d'accès et d' utilisation.
La technique décrit et illustré sera, lorsqu'il est correctement utilisé, permettre l'exposition et l' élimination du cerveau post - mortem de porc, de l' hypophyse et / ou la moelle épinière cervicale (Figure 5), résultant en morceaux de tissu qui sont bien adaptées pour d' autres analyses macroscopiques"xref"> 5, 6, 19, 26, 31, sectionner en plaques cérébrales 28, et l' analyse chimique ultérieure et / ou le traitement histologique 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n'ont rien à dévoiler.
Acknowledgments
Les auteurs reconnaissent avec gratitude l'aide habile de Mme Trine W. Mikkelsen, Mme Lise M. Fitting, et le personnel Påskehøjgaard. Le Conseil de recherches médicales du Danemark, la Fondation Lundbeck et la Novo Nordisk Fondation a soutenu financièrement l'étude.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



