Summary
Protokollen beskriver intubere voksen sebrafisk med en biologisk; deretter dissekere og forbereder tarmen cytometri, AC confocal mikroskopi og qPCR. Denne metoden tillater administrasjon av bioaktive forbindelser å overvåke intestinal opptak og lokale immunforsvaret stimulans fremkalt. Det er relevant for testing intestinal dynamikken i muntlig profylaktiske ordninger.
Abstract
De fleste patogener invadere organismer gjennom deres mucosa. Dette gjelder særlig i fisk som de kontinuerlig utsatt for en mikrobiell-rik vann miljøet. Utvikle effektive metoder for muntlig levering av immunostimulants eller vaksiner, som aktiverer immunforsvaret mot smittsomme sykdommer, er svært ettertraktet. I utarbeide forebyggende verktøy, for god eksperimentelle modeller å teste resultatene. Her viser vi en metode for muntlig intubasjon av voksen sebrafisk og et sett av prosedyrer for å analysere og forberede tarmen cytometri, AC confocal mikroskopi og kvantitative polymerase kjedereaksjon (qPCR) analyse. Med denne protokollen, kan vi nettopp administrere volumer opptil 50 µL fiske veier ca 1 g enkelt og raskt, uten å skade dyr. Denne metoden tillater oss å utforske direkte i vivo opptaket av fluorescently merket forbindelser med tarmen og immunmodulerende kapasitet av slike biologiske på det lokale området etter intubasjon. Ved å kombinere nedstrøms metoder som flowcytometri, histology, qPCR og AC confocal mikroskopi av intestinal vev, kan vi forstå hvordan immunostimulants eller vaksiner er kunne krysse intestinal slimhinnene barrierer, passerer gjennom lamina propria, og nå muskler, øve en effekt på intestinal mucosal immunsystem. Modellen kan brukes til å teste kandidat muntlig profylaktiske ordninger og leveringssystemer eller lokale effekten av en muntlig-administrert bioaktive sammensatte.
Introduction
Målet med denne artikkelen er å beskrive i dybden en grei metode for muntlig intubasjon av sebrafisk, sammen med nyttige tilknyttede nedstrøms prosedyrer. Muntlig intubasjon bruker sebrafisk blitt en praktisk modell i studiet av infeksjonssykdommer dynamics, oral vaksine/immunostimulant, narkotika/hydrogenion opptak og effekt og intestinal slimhinnene immunitet. For eksempel har sebrafisk muntlig intubasjon blitt brukt i studiet av Mycobacterium marinum og Mycobacterium peregrinum infeksjon1. Lovmo et al. også brukt denne modellen til å levere nanopartikler og M. marinum til mage-tarmkanalen voksen sebrafisk2. I tillegg Chen et al. brukt sebrafisk muntlig intubasjon vise at narkotika innkapslet av nanopartikler, når administrert via mage-tarmkanalen, ble fraktet over blod hjernen barriere3. Disse forfatterne utført intubasjon basert på gauvage metoden beskrevet av Collymore et al. 4 med noen modifikasjoner. Men gir de ikke en svært detaljerte protokoll som beskriver muntlig intubasjon prosedyren. Her presenterer vi en metode for muntlig intubasjon av voksen sebrafisk bygger på Collymore et al. 4 vi videre inkluderer utarbeidelse av tarmen for relevante nedstrøms analyse av cytometri, AC confocal mikroskopi og qPCR.
Tarmen og spesielt dens mucosa er den første linjen i forsvaret mot infeksjon og hovedwebområdet av nærings-opptak5. Når de epitelceller og antigen-presentasjon innen mucosal barrierer oppfatter fare signaler, utløses en umiddelbar medfødte immunforsvaret. Neste, svært spesifikke adaptive immunforsvaret er etablert av T- og B-lymfocytter6,7. Utvikling av muntlig vaksiner er en gjeldende fokusområde i vaccinology. Slike vaksiner vil være et effektivt verktøy for å beskytte organismen utsatte områder på grunn av bestemte svaret av immunceller i mucosa-assosiert lymfoid vev (MALT)8,9. I akvakultur har mucosal vaksiner åpenbare fordeler sammenlignet med injiserbare vaksiner. De er praktisk for masse vaksinasjon, mindre arbeidskrevende, er mindre stressende for fisken, og kan administreres til unge fisken. Likevel må mucosal vaksine kandidater nå andre gut segmentet uten å bli denaturert i muntlig miljø. De må også krysse mucosal barrierer for å få tilgang til antigen presentere celler (APCs) å indusere lokale og/eller systemisk svar10. Derfor er testing av slimhinnene opptaket av kandidaten muntlig antigener og deres leveringsmidler, samt immunrespons fremkalt, viktig i utviklingen av muntlig vaksiner.
Utvikle en modell for å teste biologiske effekter av forbindelser etter muntlig intubasjon er økende interesse i biomedisinsk sammenheng. Mange av de anatomiske og fysiologiske funksjonene i tarmen er bevart mellom bilaterian linjene, pattedyr og bony fisker11. Denne muntlig intubasjon modellen koblet til nedstrøms kan være et verktøy for å gi innsikt i menneskets biologi, samt et prøvefelt for biologiske eller andre forbindelser i vivo.
Muntlig intubasjon protokollen kan utføres av en operatør, f.eksvellykket administrere opptil 50 µL av protein hydrogenion suspensjon fiske veiing 1 g, med en høy overlevelse. Fremgangsmåten er enkel å sette opp og rask; 30 fisk kan være intubated i 1 time. Protokollen for tarmen forberedelser er nøkkelen til å gi kvalitet celler og vev eksempler for senere analyse. Eksempler på nedstrømsresultater gis som viser protokollen nytte å skaffe data relatert til intestinal opptak og isolere kvalitet RNA for qPCR. Protokollen ville være for de som trenger en passende modell å teste dynamikken i muntlig profylaktiske ordninger eller andre forbindelser i tarmen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle eksperimentelle prosedyrer som involverer sebrafisk (Danio rerio) ble godkjent av den etiske komiteen av Universitat Autònoma de Barcelona (CEEH nummer 1582) med det internasjonale styrende prinsippet for forskning som involverer dyr ( EU 2010/63). Alle eksperimenter med live sebrafisk ble utført på 26-28 ° C.
1. forbereder utstyret muntlig intubasjon
- Legg ca 1 cm av en fin silikon rør på en 31 G Luer lås nål å dekke pinne-spissen.
- Kuttet en 10 µL sterilt filter pipette tips (ca 2 cm), ta finere enden og sovrapponetelo silikon røret som en kappe. Kontroller at pipette strekker seg utover spissen av nålen å unngå å skade dyr.
- Fest nålen 100 µL Luer lås sprøyte.
Merk: Alltid skyll med etanol og deretter fosfat bufret saltvann (PBS, se materialer) grundig mellom behandlingene.
2. lobbyer
- Forberede 150 mg/L (for anestesi) eller 300 mg/L (for euthanasia) ethyl 3-aminobenzoate methanesulfonate (MS-222) løsning med vann fra akvariet der sebrafisk vedlikeholdes. Fylle en liten tank med 1 L bedøvende løsning og holde den karbonisert.
- Fylle en annen liten tank med 1 L akvariet vann uten MS-222 for fisk utvinning og holde den karbonisert.
- Gjøre 50 mL 1 x PBS fra en 10 x sterilt lagerløsning.
- Cytometri analyse/intestinal celle isolering, forberede nok frisk 0,15% collagenase Type IV løsning 1 mL per fisk fra en lagerløsning eller pulver i Dulbeccos endret eagle medium (DMEM) med 1% v/v penicillin og streptomycin (se materialer). Må dele (1 per fisk) 1 mL i 2 mL sentrifuge rør. Hold på 4 ° C til 30 min før disseksjon trinn.
- AC confocal mikroskopi/sample fiksering, forberede 50 mL av frisk 4% paraformaldehyde (PFA) løsning i PBS eller tine en lagerløsning fra 20 ° C fryseren i avtrekksvifte.
FORSIKTIG: PFA er giftig. Les sikkerhetsdatabladet før du arbeider med den. Vernehansker og vernebriller bør brukes, og alltid la løsninger innenfor avtrekksvifte.
3. forberedelser fluorescerende Nanoparticle suspensjon
- Etiketten protein hydrogenion med Atto-488 NHS ester (se Tabell for materiale) eller en passende fluorescerende farge i henhold til produsentens instruksjoner.
- Resuspend nanopartikler inne 0.1 M natriumbikarbonat buffer på konsentrasjonen av 2 mg/mL.
- Oppløse Atto 488 NHS ester i Amin-fri dimethyl sulfoxide (DMSO) på 2 mg/mL. Holde en aliquot av 10 µL sjekke merking effektivitet (trinn 3.7-3.8).
- Bland nanopartikler og Atto 488 NHS ester i molar forholdet 1:2 (protein: fargestoff) ved røring i mørket.
- Nedspinning merket nanopartikler med sentrifugering 8000 x g i 10 min ved romtemperatur, Fjern nedbryting og holde det for å kontrollere merking effektivitet (trinn 3.7-3.8).
- Vask den merket nanopartikler av resuspending i 1 mL av 0.1 M natriumbikarbonat buffer av vortexing og pipettering opp og ned. Deretter forkaste nedbryting av sentrifugering 8000 x g i 10 min ved romtemperatur. Gjenta trinn 3.6 for 5 ganger.
- Resuspend pellet i 5 mL 0.1 M natriumbikarbonat bufferen i et 15 mL sentrifuge rør og gjøre dele fluorescerende hydrogenion i 1,5 mL sentrifuge rør (30 dele). Nedspinning 8000 x g i 10 min ved romtemperatur, forkaste nedbryting og lagre-80 ° c beskyttet mot lyset.
-
Måle merking effektiviteten ved hjelp av et microvolume spektrofotometer.
- Ta 1 µL av opprinnelige Atto 488 løsningen holdt fra trinn 3.3 og ytterligere fortynne den i DMSO (f.eks1:20 etter Volumforholdet). Dette er bind pleide få molar forholdet av protein hydrogenion og Atto 488 blanding på trinn 3.4.
- Ta 1 µL av lagrede nedbryting merking reaksjonen i trinn 3.5. Måle absorpsjon (abs) på = 501 nm. Prosentandelen av merking er:
(
- Forberede hydrogenion suspensjon på ønsket konsentrasjonen med 1 x PBS løsning før eksperimentet.
4. sebrafisk Anesthetization og muntlig intubasjon
- Rask fisken (> 0,5 g) minst 48 timer før forsøket å tømme tarmen.
- Flytte fisk (12 fisk) til eksperimentelle tankene (6 L) en natt før forsøket å tillate Akklimatisering12.
- Vortex hydrogenion løsningen godt (f.eks 2500 rpm og 30 s) og tegne opp det ønskede volumet av hydrogenion suspensjon (f.eks 20-50 µL) i sprøyten festet til beskyttet nålen.
- Legg fisken i karbonisert 150 mg/L MS-222 løsning (se avsnitt 2) før de synke å bunnen av akvariet og ikke svarer halefinnen knipe; prosessen tar mindre enn 5 minutter.
- Raskt overføre bedøvet fisken net til en våt plast brett, orientere dyret vannrett for å møte nålen og umiddelbart begynne den muntlige intubasjon.
- Nøye støtte fisken med en hånd og åpne munnen med den andre hånden bruke beskyttet nålen. Forsiktig inn nålen ned spiserøret ca 1 cm fra munnen åpning.
Merk: Operatøren kan føle en liten motstand når slutten av pipette spissen gått gill. Ta vare ikke for å vinkle oppføringen p mye som kanskje perforere gill. - Sakte injisere hydrogenion suspensjon til fisken. Kontroller at suspensjon ikke strømmer utover gjennom gjellene eller munn.
- Forsiktig fjerne nålen og legg fisken i utvinning tanken (se avsnitt 2). Systemgjenoppretting tar vanligvis innen 1 min.
- Når fisken nøye for alle abnormiteten (f.eksblødninger på gjellene er et tegn på perforering).
- Når fisken har gjenopprettet, returnere dem til eksperimentelle tankene.
5. sebrafisk tarmen disseksjon
- Etter en angitt tidsperiode legge intubasjon (f.eks 5 h og/eller 24 timer), legg fisken bruker nettet til 300 mg/L MS-222 løsning for euthanasia (se avsnitt 2). Kontroller at bløtdyr stopper flytter og det er ingen hale knipe refleks. Fem minutter er vanligvis nok.
- Plukk opp euthanized dyret net og plassere den på et filter papir.
Merk: Filter papiret er svært nyttig for å fjerne selvklebende vevet langs tarmen. - Bruke skarp disseksjon saks, lage en semi-sirkulære snitt fra anus til bløtdyr og åpne snitt ved hjelp av fine pinsett. Kutte begge ender av tarmen, ta ut alle de indre organene og plassere dem på filter papir.
FORSIKTIG: Arbeide raskt for å redusere celle metabolisme og død.
Merk: Fjern eventuelt selvklebende vevet i PBS og på isen. - Skille tarmen fra indre organer og pass på å holde retningen (anterior bakre intestinal segment) og strekke det ut. Vanligvis er anterior segment av tarmen bredere enn bakre segmentet. Pass på å få alle tarmen når dissekere.
Merk: Den bakre enden er ganske fin og skjøre i liten fisk og kan bryte, spesielt i dyr < 0,7 g. - Kast tarmen på filter papir med pinsett for å løsne den selvklebende vev fra tarmen.
- Fortsette å forberede tarmen ulike nedstrøms analyser (seksjoner 6, 7 og 8).
6. forberedelser Intestinal celler for cytometri
- Forberede seg på forhånd dele 0,15% collagenase løsning (se avsnitt 2.4).
Merk: Dele skal ved romtemperatur før du fortsetter. - Valgfritt: Fortsetter fra trinn 5.5, kuttet åpne tarmen langs og vaskes med 1 x PBS.
- Ved hjelp av pinsett, plassere tarmen i 2 mL sentrifuge røret fylt med 0,15% collagenase løsning.
- Plass rør på et loddrett laboratorium rotator 1t ved romtemperatur i mørket.
- Plass tarmen på en 100 µm celle sil støttes over en 50 mL sentrifuge rør. Bryte opp tarmen med en 5 mL sprøytestempelet, vaske 3 ganger med 1 x PBS, samle flyten gjennom eksempel i 50 mL sentrifuge røret.
- Sentrifuge 50 mL sentrifuge røret på 400 x g for 10 min, på 4 ° C.
- Pipetter forsiktig av de fleste nedbryting av mens ikke miste celler, noe som kan være tilknyttet slim.
- Resuspend tarmen cellene nederst på sentrifuge røret med 500 µL av 1 x PBS og holde på is inntil cytometri analyse
- Filteret prøver gjennom et 30 µm celle filter i 5 mL rundt bunnen rør for cytometri.
- Angi parametere (f.eks antall celler for analyse, regionen interesse, spenning og kompensasjon, utvalg av detektorer) på en cytometer utstyr (se materialer).
- Umiddelbart analysere cellene i en cytometer, følge instruksjonene Bruk13.
7. forbereder tarmen Cryosections AC Confocal mikroskopi
- Fylle plast mold (se Tabell of Materials) til halv volum med optimal kutte temperatur (O.C.T.) sammensatte.
- Fortsetter fra trinn 5.5 og umiddelbart etter dissection, forsiktig plassere tarmen i plast mold. Kontroller tarmen er helt innebygd i den O.C.T. sammensatt. Om nødvendig kan du legge til flere O.C.T. sammensatte i plast mold.
Merk: Det anbefales å plassere tarmen med en "Z" figur i O.C.T. sammensatte lett følge naturlige retningen. - Plass plast mold på tørris til den går ugjennomsiktig (mindre enn et minutt).
- Lagre plast mold ved-80 ° C for langvarig bruk eller prosessen umiddelbart ved hjelp av følgende fremgangsmåte.
Merk: Protokollen kan pauses her. - Skjær frosne tarmen i 10 µm deler eller passende tykkelse ved hjelp av en kryostaten på 20 ° C.
- Samle delen tarmen med en fin børste på et lysbilde.
- Fordype lysbildet i 4% PFA i 15 min ved romtemperatur å fikse prøven.
FORSIKTIG: PFA er giftig. Les sikkerhetsdatabladet før du arbeider med den. Vernehansker og vernebriller bør brukes, og alltid la løsninger innenfor avtrekksvifte. - Vask lysbildet 3 ganger med 1 x PBS, 10 min.
- Legg en dråpe montering medium og plassere en dekkglassvæske over prøven.
Merk: Protokollen kan pauses her. - Se eksemplet under AC confocal mikroskop ved passende forstørrelse.
8. forbereder tarmen sanntid qPCR (RT-qPCR)
- Fortsetter fra trinn 5.5, sette tarmen i Kryogenisk ampuller og raskt fryse tarmen i flytende nitrogen og store-80 ° c før bruk.
Merk: Protokollen kan pauses her. - Homogenisering legge 200 µL på 2% (v/v) kjølt 1-Thioglycerol/homogenisering løsning (se Tabell for materiale) eller alternativ homogenisering løsning til tarmen prøven.
- Arbeide raskt, homogenize tarmen prøven på is en laboratorium homogenizer i høy hastighet (satt på 25-30 000 rpm) til ingen synlige vev fragmenter igjen. 3 ganger for 5 s er vanligvis tilstrekkelig.
- Isolere RNA bruker en kommersiell kit (se Tabell for materiale) i henhold til produsentens instruksjoner14 eller en egnet alternativ metode. Etter behov, lagre RNA ved-80 ° C for langsiktig bruk.
Merk: Protokollen kan pauses her. - Kvantifisere RNA konsentrasjonen bruker et spektrofotometer15 og vurdere kvaliteten med en RNA analyzer16.
- Forberede 1 µg eller en passende mengde cDNA bruker en cDNA syntese kit i henhold til produsentens instruksjoner.
Merk: Protokollen kan pauses her. For qPCR analyse, vennligst Følg de MIQE retningslinjer17. - Utforme riktig primer par for genet/s av interesse.
- Velg en passende referanse genet og analysere uttrykk for hver genet av en RT-qPCR oppdagelsen system ved hjelp av en kommersiell kit (se materialer).
Merk: For eksempel legge 5 µL av SYBR grønne supermix, 0,5 µM primere, 2,5 µL av fortynnet cDNA og 1,5 µL av vann i en endelig mengde 10 µL for hver brønn av qPCR plate.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Sebrafisk (gjennomsnittlig vekt: 1,03 ± 0,16 g) av blandet sex var lykkes intubated med forskjellige rekombinante proteiner nanopartikler (bakteriell inkludering organer) ved hjelp av vårt hjemmelagde muntlig intubasjon enhet (figur 1). Vi har utført den muntlige intubasjon og oppnådde en lav gjennomsnittlig prosentandel dødelighet (6,8%) (Tabell 1). Sebrafisk var enten intubated med 30 µL eller 50 µL av hydrogenion suspensjoner og dødeligheten ble beregnet innen 24 timer innlegget intubasjon. Forsøkene ble utført av to operatører, R hadde mindre erfaring med sebrafisk muntlig intubasjon enn J. Resultatene viste at selv en ny operatør uavhengig kan utføre den muntlige intubasjon eksperimenter og oppnå enkelt en høy overlevelse ved denne protokollen. Fra vår erfaring, optimal fisk er 1 g, men vi har med hell intubated fisk så liten som 0,5 g.
For bedre å forstå om de fluorescerende nanopartikler IBsTNFα (en rekombinant cytokin protein nanostructured som inkludering organer) ble levert til sebrafisk av vår metode og tatt opp av sebrafisk tarmen eller ikke, vi utført cytometri analyse. Nanopartikler (100 µg/fisk, 50 µL) PBS (kontroll) var muntlig administrert (ved intubasjon) til sebrafisk og tarmen var dissekert 5 h og 24 h innlegget intubasjon. Totalt intestinal celler ble utarbeidet av trinn 6 og analyseres av registrerer fluorescens utslipp signaler. Representant histogrammer fluorescens intensitet og dot tomter av fluorescerende cellen vises i figur 2. Tettheten av fluorescerende celler er klart høyere hydrogenion intubated gruppen sammenlignet med kontrollgruppen både 5 h og 24 h (figur 2A). Prosentandelene av fluorescerende celler er betydelig høyere i både 5t (46.3%) og 24 timer (43.0%) av hydrogenion intubated (figur 2B).
Videre studie som en del av intestinal laget er involvert i hydrogenion opptaket, utført vi AC confocal mikroskopi analyse. Nanopartikler (20 µg/fisk, 50 µL) PBS (kontroll) var muntlig intubated til sebrafisk og tarmen var dissekert på 5t innlegget intubasjon. Tarmen delene ble utarbeidet av frossent metode etter trinn 7 (Figur 3A). AC confocal bilder av fluorescerende nanopartikler i tarmen er vist i Figur 3B. De fluoriserende nanopartikler ble funnet i sebrafisk tarmen. Vi observerte fluorescens i epitelceller, lamina propria og muskelceller.
For å kontrollere om vi kan trekke ut høykvalitets RNA av våre protokollen, analyserte vi RNA utdraget fra tarmen med en bioanalyzer (også referert til som RNA analysator her). Sebrafisk var intubated muntlig med PBS (50 µL) eller nanopartikler (20 µg/fisk, 50 µL). Tarmen ble dissekert for RNA utvinning på 24 h innlegget intubasjon. Vi valgte syv RNA prøver å teste med analyserer. Vi fant at alle testet RNA prøvene har høye RNA integritet tall mellom 7.9 8,9 (Figur 4).
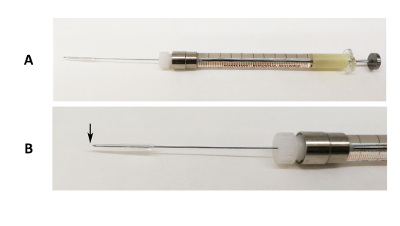
Figur 1 : Muntlig intubasjon enheten. (A) bilde av en 31 G Luer lås nål fast på 100 µL sprøyte med silisium rør og pipette tips slutten dekker tuppen av nålen. (B) et forstørret bilde av p. Svarte pilen viser hvor pipette tips slutten overskrider spissen av nålen. Klikk her for å se en større versjon av dette tallet.

Figur 2 : Flow cytometri analyse av fluorescerende nanopartikler i sebrafisk tarmen via muntlig intubasjon. Sebrafisk ble behandlet med PBS eller fluorescerende IBsTNFα (100 µg) for 5 h og 24 h, henholdsvis. (A) representant histogrammer fluorescens intensitet. (B) Dot tomter grafen av fluorescerende celler. Hver grønn prikk representerer prosentdelen av fluorescerende celler i én enkelt, n ≥4. Dataene representerer gjennomsnittlig ± standardfeil av gjsnitt (SEM). Forskjellene ble analysert bruker veis VARIANSANALYSE. Betydelige forskjeller når det gjelder kontroll (**, p < 0,01) Klikk her for å se en større versjon av dette tallet.

Figur 3 : Bilder AC confocal mikroskopi analyse. Fisk var muntlig intubated med PBS eller 20 µg/fisk fluorescerende nanopartikler. Tarmen ble dissekert på 5t innlegget intubasjon. (A) sebrafisk tarmen innebygd i OCT forbindelser. Tarmen ble plassert med naturlige retningen på en "Z" figur (a: fremre delen, p: bakre ende). (B) AC Confocal mikroskopi bilder av sebrafisk tarmen. Hvite pilene viser at de fluorescerende nanopartikler blir tatt opp i tarmen. Klikk her for å se en større versjon av dette tallet.

Figur 4 : RNA analyzer virtuelle gel bildet viser RNA utvunnet fra 7 sebrafisk tarmen samplet innlegget intubasjon. Eksempel nummer 1 og 2 er PBS intubated grupper og utvalg nummer 3 til 7 er hydrogenion intubated grupper. RNA integritet tall (RIN) er gitt nederst mellom 7.9 8,9. Klikk her for å se en større versjon av dette tallet.
| Operatør | Volum | # fisk intubated | Gjennomsnittlig vekt (g ± SD) |
# dødsfall | Dødelighet (%) |
| R | 30 ΜL | 22 | 0,88 ± 0.14 | 3 | 13,6 |
| R | 30 ΜL | 17 | 0.93 ± 0,19 | 0 | 0 |
| J | 50 ΜL | 19 | 1,23 ± 0.31 | 1 | 5.2 |
| J | 50 ΜL | 30 | 1,08 ± 0.40 | 2 | 6.6 |
| Totalt | 88 | 1,03 ± 0,16 | 6 | 6.8 | |
| SD: standardavvik for gjennomsnittet | |||||
Tabell 1: Sammenligning av sebrafisk dødelighet forårsaket av to operatører bruker protokollen. Identifikasjonskoden operatør, intubated volumet, hvor fisken og fisk gjennomsnittlige vekten i gram (g) vises.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne protokollen er en forbedring av den tidligere beskrevet teknikken for muntlig intubasjon ved Collymore et al. 4 vår beskriver i detalj metoden muntlig intubasjon og inkluderer utarbeidelse av tarmen for nedstrøms analyser. Vår metode forbedrer fisk manipulasjon fart slik at en person til å utføre hele protokollen raskt, uten mye variasjon mellom operatørene. Største forskjellen av våre protokollen med forrige er at vi evaluere hvor vellykket et muntlig intubasjon eksperiment ikke bare ved observasjon av dyret for velvære (f.eks ingen blødninger) og uten lekkasje av væsken administrert, men også ved å kontrollere opptaket av en bioaktive hydrogenion i tarmen nedstrøms analyse (cytometri, AC confocal mikroskopi og qPCR). Vi viser at intubated fluorescently merket nanopartikler ble funnet i tarmen.
På den praktiske siden intubasjon utstyret er billig, presis og gjenbrukbare: grunnleggende enheten er laget av en gjenbrukbare 100 µL glass (f.eksHamilton) sprøyte koplet til en 31 G nål med et stykke av silisium øverst. Et kutt sterilt tips er plassert over silisium røret og kan endres for hver individuelle administrasjon. Sprøyten er gjenbrukbare tynn nålen lar intubere liten fisk med en stor mulighet for suksess. Videre kunne kuttet sterilt spissen plasseres direkte over nålen uten silisium rør som lar intubasjon utstyret lettere å være laget i et laboratorium. Administrert bioaktive sammensatte er godt synlig, og en riktig administrasjon kan overvåkes lett. En kritisk trinn under intubasjon prosedyren er nålen oppføringen. Det er viktig at nålen ikke vippet eller satt inn for mye for å unngå perforating gjellene. Dødeligheten observert med denne metoden er svært lav (ca 7%) og avhenger av størrelsen på fisken. Gill perforering er den vanligste årsaken fisk død, og når det skjer fisk dør i den første timen. Selv om fisken 0,5 g kan være lett intubated er optimal fisk rundt 1 g. En annen forskjell med metoden utviklet av Collymore et al. er at fisken er fastet 48 h å være sikker på at fordøyelsessystemet er tom. Hele intubasjon prosedyren kan gjøres veldig raskt (30 dyr/h) av en operatør og viktigst, metoden er konsekvent mellom forskjellige operatører4. Metoden intubasjon er lett å lære og krever ikke mye øvelse å mestre.
Tarmen disseksjon prosedyren må utføres riktig for å få god kvalitet prøver for cytometri, AC confocal og qPCR analyser. Det kritiske trinnet er på dette punktet Disseksjon av hele tarmen; den bakre delen er skjøre og lett å miste. Når tarmen er dissekert, kan det behandles videre til cytometri (2t protocol), qPCR analyse (2t protokollen til total RNA isolasjon) eller AC confocal mikroskopi (1 h å ha prøver klar for cryosection). Det er svært viktig å holde styr på retningen på tarmen, særlig for AC confocal mikroskopi. Cytometri analyse krever rask behandling og prosedyren kan ikke stoppes før ferdigstillelse. Mens, RNA isolasjon og prøver forberedt på cryosection kan bli lagret og behandlet til enhver tid. For cytometri, god kvalitet prøver uten rusk clumping maskinen kan isoleres med denne metoden og rask analyse etter fluorescerende celler kan utføres enkelt personer. Overvåking av kvaliteten på RNA viste at høy kvalitet RNA kan være isolert fra tarmen tillater analyse av fisk av qPCR. Til slutt gir cryosection forberedelsene til AC confocal mikroskopi viktig strukturelle informasjon om protein hydrogenion opptaket. Våre metoder dermed gir en modell for å teste dynamikken i muntlig profylaktiske ordninger eller andre forbindelser i tarmen.
Begrensningene i vår studie er størrelsen på fisken siden vi ikke teste administrasjon i fisk mindre enn 0,5 g og bruk av en kjemisk bedøvelse å sedate dyrene. Noen forfattere bruker kaldt vann (0-4 ° C) til å bedøve sebrafisk18 men i sammenheng med dyrevelferd og europeiske juridiske begrensninger vi besluttet at MS-222 var metoden for valg.
Sebrafisk gir mange fordeler over andre modellsystemer inkludert Komplettsett genet og tilgjengelig transgene linjene. For immunologists angi transgene linjene (f.eks vs mpx:GFP og vs mpeg1:GFP) en scene for i vivo observasjon av immunceller som makrofager og nøytrofile19,20. Kombinere våre muntlig intubasjon og nedstrøms med transgene linjer, kan være ideell for å identifisere de celletyper som involverer opptak, transport og behandling av muntlig vaksiner, nanopartikler og patogener i fisk.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer at det finnes ingen konkurrerende interesser.
Acknowledgments
Dette arbeidet ble støttet av tilskudd fra det spanske departementet for vitenskap, Europakommisjonen og AGAUR midler til NR (AGL2015-65129-R MINECO/FEDER og 2014SGR-345 AGAUR). RT har pre stipend fra AGAUR (Spania), JJ ble støttet av en PhD fellowship fra Kina stipend Council (Kina) og NR støttes av programmet Ramón y Cajal (RYC-2010-06210, 2010, MINECO). Vi takker Dr. Torrealba for ekspertråd i protein produksjon, N. Barba fra "Servei de Microscopia" og Dr. M. Costa fra "Servei de Citometria" av Universitat Autònoma de Barcelona for nyttig teknisk assistanse.
Materials
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
References
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).




