Summary
لاختبار تأثير chemokine على تجنيد الضامة في الجسم الحي، تم استخدام جبل كامل في الموقع التهجين للكشف عن التعبير خارج الرحم من chemokine، واستخدمت تلطيخ المناعة لتسمية الضامة. تم استخدام التصوير الحي للمراقبة في الوقت الحقيقي لهجرة الضامة.
Abstract
وتستخدم على نطاق واسع حمار وحشي في البحوث الأساسية والطبية الحيوية. العديد من خطوط حمار وحشي المعدلة وراثيا متاحة حاليا لتسمية أنواع مختلفة من الخلايا. بسبب الجسم الجنيني الشفاف من سمك الحمار الوحشي ، فمن المناسب بالنسبة لنا لدراسة تأثير واحد chemokine على سلوك نوع معين من الخلايا في الجسم الحي. هنا قدمنا سير العمل للتحقيق في وظيفة chemokine على هجرة الضامة في الجسم الحي. قمنا ببناء بلازميد الإفراط في التعبير الأنسجة الخاصة لالإفراط في التعبير IL-34 وحقن بلازميد في مرحلة خلية واحدة أجنة الأسماك المعدلة وراثيا التي وصفت الضامة على وجه التحديد من قبل بروتين الفلورسنت. ثم استخدمنا جبل كامل الفلورسنت في الموقع التهجين والمناعية للكشف عن نمط التعبير chemokine وعدد أو موقع الضامة. تم رفع الأجنة WT حقن لتوليد خط مستقر المعدلة وراثيا. وأخيرا، استخدمنا التصوير الحي البؤري لمراقبة سلوك الضامة مباشرة في الأسماك المعدلة وراثيا مستقرة لدراسة وظيفة IL-34 على الضامة في الجسم الحي.
Introduction
سمك الحمار الوحشي هو صغير الاستوائية الصلبة العظام أسماك المياه العذبة نشأت في الهند. وفيما يتعلق بحفظ الجينات، حمار وحشي لديها تشابه من 87٪ إلى الإنسان1. يمكن أن توفر لنا رؤى حول المواضيع ذات الصلة من الإنسان من خلال دراسة تنظيم الجينات، وظيفة البروتين وسلوك الخلية مثل الهجرة، et.al الانتشار في حمار وحشي. يمكن استخدام جنين سمك الحمار الوحشي لمراقبة تطور الأجنة المبكرة في مراحل مختلفة بعد تثبيط الصباغ. وفي الوقت نفسه، فإنه يأخذ ثلاثة أشهر فقط لحمار وحشي لتطوير إلى النضج الجنسي، ثم حمار وحشي يمكن أن تنتج مئات من البيض كل 4 أيام. صغيرة الحجم، وتربية بسيطة، والقدرة الإنجابية القوية، وهذه المزايا تجعل ثقافة حمار وحشي جدا توفير الفضاء، مما يؤدي إلى ثقافة واسعة النطاق. الماوس نموذج الثدييات التقليدية لديها تكاليف صيانة أعلى من حمار وحشي، وبالتالي الحد من حجم رفع الماوس. في جانب نمو الجنين المبكر ، من الصعب ملاحظة جنين الفأر في حالة حية بسبب خصائص نمو جنين الفئران في رحم الأم. على العكس من ذلك، تتطور أجنة حمار وحشي خارجيا ً وتتسم بالشفافية، وبالتالي يسهل ملاحظتها تحت المجهر. وعلاوة على ذلك، من السهل جدا بناء مجموعة متنوعة من الخطوط المعدلة وراثيا للبحوث ذات الصلة وظيفة الجينات. حاليا، تتوفر خطوط مختلفة من أسماك الحمار الوحشي المعدلة وراثيا لتسمية أنواع مختلفة من الخلايا. فمن المريح جدا الآن لبناء خطوط المعدلة وراثيا لالإفراط في التعبير عن العلاج الكيميائي في مواقع محددة ودراسة وظيفة chemokines على سلوك الخلية في حمار وحشي.
هنا، قدمنا سير العمل لاستخدام حمار وحشي خط المعدلة وراثيا للتحقيق في وظيفة IL-34 على سلوك الضامة في الجسم الحي2،3،4،5،6،7. أولا، قمنا ببناء بلازميد الإفراط في التعبير عن الكبد محددة من الجينات il34 وحقن بلازميد في مرحلة خلية واحدة TG (mpeg1: GFP) أجنة الأسماك التي وصفت على وجه التحديد الضامة من قبل GFP البروتين الفلورسنت. ثم، استخدمنا جبل كامل الفلورسنت في الموقع التهجين وتلطيخ المناعة للكشف عن نمط التعبير il34 وعدد أو موقع الضامة. تم رفع الأجنة WT حقن لتوليد خط مستقر المعدلة وراثيا. في هذه الخطوات، أنشأنا والتحقق من صحة خط إنتاج السيتوكين وتقييم بصريا الآثار التي يمكن رؤيتها على توزيع الضامة. وأخيرا، للتحقيق في سلوك الضامة ردا على السيتوكين، استخدمنا التصوير الحي البؤري لمراقبة مباشرة هجرة الضامة لتأكيد وظيفة il34 على هجرة الضامة في الجسم الحي.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
ملاحظة: تم علاج جميع العينات بواسطة فينيلثيويوريا (PTU) ماء البيض لمنع الصباغ.
1. توليد TG (fabp10a: il34)المنشآت المعدلة وراثيا وحقن الأسماك
- استنساخ 2.8 كيلو بايت fabp10a المروج8 ومناطق الترميز IL-34 (ENSDART00000126460.3) من حمار وحشي في ناقلات pTol2 لتوليد بناء fabp10a-il34. حقن المنشآت في مرحلة خلية واحدة TG (mpeg1: GFP)وWT أجنة الأسماك جنبا إلى جنب مع mRNA transposase. رفع fabp10a-il34 حقن الأجنة WT إلى الكبار9 وتحديد مؤسس المعدلة وراثيا عن طريق التهجين في الموقع.
ملاحظة: حقن بناء Tol2 مباشرة في آخر المعدلة وراثيا يمكن أن تكون إشكالية إذا تم إجراء خط المعدلة وراثيا الأخرى مع نفس نظام transposon. وتتوّه الممارسة العامة هي وضع خط مستقل وراثياً ثم تجاوز الخط الجديد بسطر مراسل آخر. وهذا يضمن أنه لن تكون هناك آثار للجينات الجديدة على ترانسجين تم إدراجه سابقاً.
2. الفلورسنت جبل كامل في الموقع التهجين (WISH) الجمع بين مع تلطيخ المناعة
- تثبيت العينة
- جمع الأجنة من الحقن العابر أو مستقرة IL-34 خط المعدلة وراثيا التي عبرت مع TG (mpeg1: GFP) في المراحل المطلوبة.
ملاحظة: لهذه الحالة، تم جمع الأجنة في 4 د بعد الإخصاب (dpf). (إذا لزم الأمر) إزالة الشيوريون عن طريق الحقنة. - إصلاح الأجنة مع 4٪ بارافورمالدهايد (PFA) بين عشية وضحاها في 4 درجة مئوية أو 2 ساعة في درجة حرارة الغرفة (RT) (حوالي 25 درجة مئوية).
- غسل الأجنة مع الفوسفات المخزنة المالحة بالإضافة إلى توين 20 (PBST) 3X 5 دقيقة.
- تجفيف الأجنة بشكل منفصل مع 50٪ الميثانول في PBST (50٪ الميثانول / PBST) و 100٪ الميثانول، 1X 5 دقيقة لكل منهما. ثم، تغيير إلى الميثانول الطازجة 100٪ وتخزينها في -20 درجة مئوية (على الأقل 2 ح).
ملاحظة: يمكن إيقاف البروتوكول مؤقتاً هنا.
- جمع الأجنة من الحقن العابر أو مستقرة IL-34 خط المعدلة وراثيا التي عبرت مع TG (mpeg1: GFP) في المراحل المطلوبة.
- التهجين التحقيق (اليوم الأول)
- إعادة ترطيب الأجنة في الخطوات السابقة مع الميثانول 50٪ في PBST (50٪ الميثانول / PBST)، ثم يغسل مع PBST 3X 5 دقيقة.
- هضم الأجنة مع proteinase K في PBST في RT (التركيز النهائي: 10 ميكروغرام / مل؛ 1:2000 في PBST).
ملاحظة: وقت الهضم يعتمد على مرحلة الأجنة: أقل من 36 ساعة بعد الإخصاب (hpf)، لا حاجة. 36 هبف-2 dpf الجنين، 3-5 دقيقة؛ 2-3 dpf الجنين، 10 دقيقة؛ 3-4 dpf الجنين، 15 دقيقة؛ 4-5 dpf الجنين، 15-20 دقيقة؛ 5-6 dpf الجنين، 20-27 دقيقة؛ > 6 ديسيبل الجنين، 25-30 دقيقة في RT (حوالي 25 درجة مئوية). - تجاهل محلول الهضم وتنفيذ التثبيت مرة أخرى مع 4٪ PFA، لمدة 20 دقيقة في RT.
- غسل الأجنة مع PBST 2X 10 دقيقة.
- تجاهل PBST، تنفيذ التهجين المسبق مع المخزن المؤقت التهجين ساخنة (HB المخزن المؤقت) في 65 درجة مئوية لمدة 5 دقائق، إعادة تدوير المخزن المؤقت HB في الأنبوب الأصلي.
- قم بإجراء التهجين قبل التهجين باستخدام المخزن المؤقت الجديد للHB الساخن عند 65 درجة مئوية على الأقل 1 ساعة.
- قبل تسخين التحقيق9 (لهذه الحالة كان التحقيق il34، 1 نانوغرام / مل) في 65 درجة مئوية على الأقل 10 دقيقة. ثم إعادة تدوير المخزن المؤقت HB في الأنبوب الأصلي. قم بإجراء التهجين مع المسبار المدفأ مسبقًا عند 65 درجة مئوية بين عشية وضحاها.
- علاج الأجسام المضادة (اليوم الثاني)
- قبل تسخين 50٪ formamide / 2X سيترات الصوديوم المالحة بالإضافة إلى توين 20 (SSCT)، 2X SSCT، 0.2X SSCT في 65 درجة مئوية.
- إعادة تدوير التحقيق في الأنبوب الأصلي وتخزين التحقيق في -20 درجة مئوية.
- غسل الأجنة بشكل منفصل مع 50٪ فورماميد / 2X SSCT. 2x SSCT؛ 0.2x SSCT، 3X 20 دقيقة أو 2X 30 دقيقة لكل منهما عند 65 درجة مئوية.
- غسل الأجنة مع PBST 3X 5 دقيقة.
- منع العينات مع 600 درجة مئوية من العازلة حجب (5٪ تصفية مصل البقر الجنيني (FBS) في PBST) لمدة 1 ساعة في RT.
- إضافة 400 درجة مئوية من المضادة للديجوكجينين-HRP حل الأجسام المضادة (1:1,000-1:2,000 في حظر العازلة) واحتضان الأجنة في 4 درجة مئوية بين عشية وضحاها. إذا كانت الإشارات ضعيفة، استخدم 1:500 تخفيف الأجسام المضادة.
- تلوين واحتضان الأجسام المضادة الأولية (اليوم الثالث)
- إزالة الجسم المضاد. غسل الأجنة مع PBST، 6X 20 دقيقة في RT.
- شطف العينة مع 30 درجة مئوية من 1X زائد تضخيم مخفف لمدة 5 دقائق في RT.
- تجاهل تخفيف عن طريق الأنابيب خارج; تمييع Fluorophore Tyramide الأوراق المالية الحل (سيانين 3 زائد التضخيم كاشف (Cy3) أو السيانين 5 زائد تضخيم كاشف (Cy5)، لهذه الحالة تم استخدام Cy3) 1:50 في 1X زائد تضخيم مخفف لجعل الفلوروفور التيرامي حل العمل. إعداد 50-100 درجة مئوية من حل العمل لكل عينة.
- احتضان العينة في حل العمل الفلوروفور ييراميد لمدة 5-15 دقيقة في الظلام في RT. إذا كانت الإشارات ضعيفة، قم بتمديد وقت الحضانة إلى 30 دقيقة.
- وقف رد الفعل عن طريق تغيير حل العمل مع PBST وفحص الإشارات.
- غسل الأجنة مع PBST 3X 10 دقيقة في RT.
- احتضان العينة مع الأجسام المضادة الأولية في 4 درجة مئوية بين عشية وضحاها. لهذه الحالة، استخدم الجسم المضاد لمكافحة الماعز-GFP كجسم مضاد أساسي.
- تلطيخ الأجسام المضادة الثانوية (اليوم الرابع)
- اغسل الأجنة بـ PBST لمدة 4×30 دقيقة.
- احتضان الأجنة مع الأجسام المضادة الثانوية في 4 درجة مئوية بين عشية وضحاها. لهذه الحالة، استخدم أليكسا 488-المضادة للماعز الأجسام المضادة كجسم مضاد الثانوية.
- التقاط الصور (اليوم الخامس)
- غسل الأجنة مع PBST 3X 10 دقيقة في RT.
- تخزين الأجنة في 70٪ الجلسرين في الظلام في 4 درجة مئوية بين عشية وضحاها أو -20 درجة مئوية لفترة أطول.
3. التصوير الحي
-
تحديد العينة
ملاحظة: استخدام الصورة الحية لمراقبة مباشرة ما إذا كان الضامة من Tg (fabp10a: il34؛ fabp10a: DsRed؛ mpeg1: GFP)الأسماك سوف تهاجر إلى الكبد تحت IL-34 التعريفي خلال 3-3.5 ديسيبل. هنا يتم استخدام خط Tg (fabp10a-DsRed)المعدلة وراثيا لتسمية منطقة الكبد وجعلها مرئية، لتسهيل توطين الكبد وتحديد ما إذا كانت الضامة تهاجر إلى الكبد. قبل التصوير، استخدم مجهر الفلورة لتحديد الأجنة الإيجابية المزدوجة DsRed وGFP. -
الأسماك تصاعد
- استخدام حمام معدني لتسخين 1 مل من 1٪ منخفضة ذوبان أغاروز إلى أعلى من 90 درجة مئوية لإذابة تماما.
- بعد تبريد الأجاروز ذوبان منخفضة إلى درجة حرارة الجسم، إضافة 50 درجة مئوية من 0.2٪ ثلاثي الكوكايين، ومزيج موحد tricaine مع أغاروز.
- نقل الأجنة التخدير إلى طبق صغير شنت مع شريحة غطاء على الجزء السفلي، وإزالة المياه المحيطة بها، وإسقاط ببطء الأجاروز ذوبان منخفضة على الأجنة، تعيين بعناية موقف الأسماك قبل أن توطد أغاروز، والحفاظ على منطقة الكبد قريبة من الشريحة غطاء على الجزء السفلي من الطبق.
- بعد أن يتعزز الأجاروز الذوبان المنخفض، قم بتغطيتها بعناية بطبقة أخرى من الأجاروز لتعزيزها.
- وضع الطبق على طاولة الناقل المجهر البؤري، وتغطية الأسماك مع الحل E210 مع tricaine والبدء في التصوير.
-
تشغيل البرمجيات من المجهر البؤري
- فتح برنامج ZEN الأسود 2.3، تثبيت منضدة الخلية الحية على طاولة الناقل المجهر.
- انقر فوق تحديد الموقع | الحضانة | درجة الحرارة لتعيين درجة الحرارة إلى 29 درجة مئوية.
- وضع الطبق في وسط منضدة الخلية الحية، وتغطي الأسماك مع الحل E210 مع tricaine.
- انقر فوق القائمة اكتساب ، حدد وضع المسح الضوئي المطلوب والليزر في القائمة إعداد الذكية ، ثم حدد Z-المكدس والموضع.
- انقر فوق القائمة مصمم التجربة، حدد تمكين تجربة كتلة متعددة، في الكتلة الأولى، للعثور على العينة تحت التكبير المنخفض، ثم التبديل إلى التكبير عالية، والسماح للمنطقة التي لوحظت في وسط الحقل المرئي.
- قم بتعيين الموضع ومعلومات Z-Stack، وحدد كثافة الليزر المناسبة، وطبقات المسح الضوئي، وسرعة التصوير.
- إنشاء كتلة جديدة وكرر الخطوات المذكورة أعلاه. بعد إعداد جميع الكتل، تعيين العدد المناسب من الحلقات وبدء التسجيل(الشكل 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ويبين الشكل 2الخطوات التي ينطوي عليها بروتوكول سمك الحمار الوحشي. أولا، قمنا بإنشاء pBLK-fabp10a-il34-sv40 الذي كان يقودها il34 من قبل المروج fabp10a (الشكل 2). تم حقن البناء ميكروين في مرحلة خلية واحدة Tg (mpeg1: GFP)أجنة حمار وحشي التي يمكن تسمية الضامة مع جنين GFP وWT التي أثيرت للبالغين لتوليد خط مستقر المعدلة وراثيا(الشكل 2). تم تحليل التعبير عن il34 من قبل الفلورة جبل كامل في الموقع التهجين(الشكل 2 والشكل 3). تم تحليل الضامة التي تحمل اسم GFP عن طريق تلطيخ المناعة(الشكل 2 والشكل 3). استخدمنا التصوير الحي لمراقبة ما إذا كانت الضامة سوف تهاجر إلى الكبد تحت الحث il34 خلال 3-3.5 ديسيبل (الشكل 2، الشكل 4، الفيلم التكميلي 1 والفيلم التكميلي 2) .
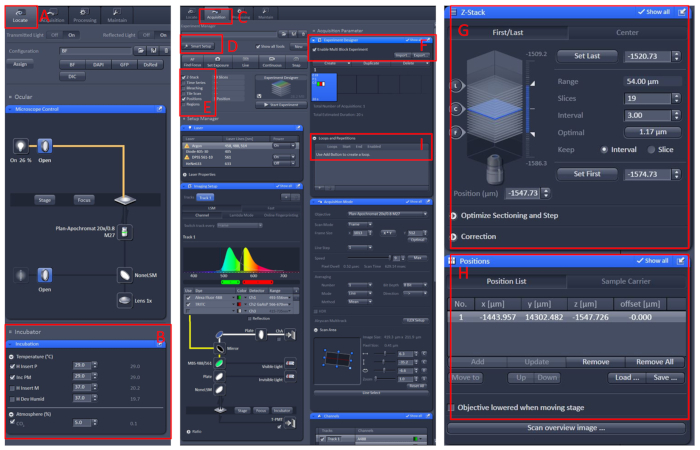
الشكل 1: تشغيل البرمجيات من المجهر البؤري التصوير الحي. افتح برنامج ZEN black 2.3، قم بتثبيت منضدة الخلية الحية على طاولة حامل ة المجهر، ثم انقر على تحديد الموقع (A) | الحضانة | درجة الحرارة (B)لتعيين درجة الحرارة إلى 29 درجة مئوية. وضع الطبق في وسط منضدة الخلية الحية، وتغطي الأسماك مع الحل E210 مع tricaine. بعد كل هذه، انقر فوق الحصول على (C) القائمة ، حدد وضع المسح الضوئي المطلوبة والليزر في القائمة الإعداد الذكي (D) ، ثم حدد Z-المكدس والموضع (E). وأخيراً، انقر فوق القائمة مصمم التجربة (F)،حدد تمكين تجربة كتلة متعددة، في الكتلة الأولى، للعثور على العينة تحت التكبير المنخفض، ثم التبديل إلى التكبير عالية، والسماح للمنطقة التي لوحظت في مركز المجال البصري، وتعيين موقف وZ-المكدس(G و H)المعلومات، حدد كثافة الليزر المناسبة، وطبقات المسح الضوئي وسرعة التصوير. إنشاء كتلة جديدة ثم كرر الخطوات المذكورة أعلاه. بعد إعداد جميع الكتل، تعيين العدد المناسب من الحلقات(I)وبدء التسجيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: سير عمل للتحقيق في وظيفة chemokine على هجرة الضامة في الجسم الحي. قمنا ببناء بلازميد الإفراط في التعبير عن الأنسجة (الكبد) إلى الإفراط في التعبير IL-34 وحقن بلازميد في مرحلة خلية واحدة أجنة الأسماك المعدلة وراثيا التي وصفت على وجه التحديد الضامة من قبل بروتين الفلورسنت (TG: mpeg1: GFP )). تم رفع الأجنة WT حقن لتوليد خط مستقر المعدلة وراثيا. ثم استخدمنا كامل جبل الفلورسنت التهجين في الموقع وتلطيخ المناعة للكشف عن نمط التعبير الجيني وعدد أو موقع الضامة من الأجنة عن طريق الحقن العابر أو الأجنة خط مستقرة (4 ديسيبل). وأخيرا، استخدمنا التصوير الحي البؤري لمراقبة سلوك الضامة مباشرة في الأسماك المعدلة وراثيا مستقرة (3-3.5 ديسيبل) لدراسة وظيفة IL-34 على الضامة في الجسم الحي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الفلورسنت WISH الجمع بين مع تلطيخ المناعة. تم تعديل هذا الرقم من جيانغ وآخرون11. تم حقن ما مجموعه 1.8 نانولتر (30 نانوغرام/ميكرولتر) من بناء pBLK-fabp10a-il34-sv40 بصورة دقيقة في مرحلة الخلية الواحدة Tg (mpeg1: GFP) أجنة حمار وحشي. (أ)الرغبة في التعبير il34 (الأحمر) وكامل جبل تلطيخ الأجسام المضادة من التعبير GFP (الأخضر) في 4 dpf الجنين (6X). تتكون صورة الجسم كله من الأسماك من صورتين منفصلتين التقطتها البؤرة ومخيط معا في فوتوشوب. Insets هي التكبير عالية (20x) من المناطق العلبة المقابلة (المناطق البرتقالية المنقطة). (ب)التحليل الكمي لأرقام خلايا الضامة في غير حقن وبناء الكبد حقن الأجنة (كما هو موضح في المنطقة البيضاء المنقطة) ومنطقة الذيل (تقريبا بين 13 و 17 somite، كما هو مبين بين خطين منقط أبيض). تم تحليل البيانات من قبل مان ويتني يو اختبار، ** p < 0.01 مقارنة مع السيطرة. ن = 5، 5 ل4 dpf حقن والسيطرة على الأسماك. القضبان: 200 ميكرومتر (الخط الأبيض)؛ 50 ميكرومتر (خط أصفر). (C)الرغبة في التعبير il34 وكامل جبل تلطيخ الأجسام المضادة للتعبير GFP في 4 ديسيبل الجنين خط مستقر (6X). تتكون صورة الجسم كله من الأسماك من صورتين منفصلتين التقطتها البؤرة ومخيط معا في فوتوشوب. Insets هي التكبير عالية (20x) من المناطق العلبة المقابلة (المناطق البرتقالية المنقطة). (د)التحليل الكمي لأرقام خلايا الضامة في Tg (mpeg1: GFP)و TG (fabp10a: il34; mpeg1: GFP)كبد الأجنة (كما هو موضح في المنطقة البيضاء المنقطة) ومنطقة الذيل (تقريبا بين 13 وsomite 17، كما هو مبين بين اثنين من خطوط بيضاء منقط). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التصوير الحي البؤري لمراقبة سلوك الضامة مباشرة في الأسماك المعدلة وراثيا مستقرة. تم تعديل هذا الرقم من جيانغ وآخرون11. تظهر الصور المجهرية للتصوير الحي عملية الضامة (الأخضر، المسمى بالسهام البيضاء) التي تمر من قبل الكبد (الأحمر) في غضون 28 دقيقة في الأسماك السيطرة(أ)وعملية الضامة (الأخضر، المسمى بالسهام البيضاء) الهجرة إلى الكبد (الأحمر) في غضون 28 دقيقة في IL-34 الإفراط في التعبير عن الأسماك (B). قضبان مقياس = 40 ميكرومتر (خط أبيض). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الفيلم التكميلي 1: التصوير الحي الذي يظهر عملية الضامة (الأخضر، المسمى بالسهام البيضاء) الهجرة إلى الكبد (الأحمر) في غضون 2 ساعة في IL-34 الإفراط في التعبير عن الأسماك. قضبان مقياس = 20 ميكرومتر (خط أبيض). تم إعادة نشر هذا الفيلم من جيانغ وآخرون11. الرجاء النقر هنا لمشاهدة هذا الفيديو. (انقر بزر الماوس الأيمن للتنزيل.)

الفيلم التكميلي 2: التصوير الحي الذي يظهر عملية الضامة (الأخضر، المسمى بالسهام البيضاء) يتجول حول الكبد (الأحمر) في غضون 2 ح في الأسماك السيطرة. قضبان مقياس = 20 ميكرومتر (خط أبيض). تم إعادة نشر هذا الفيلم من جيانغ وآخرون11. الرجاء النقر هنا لمشاهدة هذا الفيديو. (انقر بزر الماوس الأيمن للتنزيل.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
البروتوكول الموضح هنا يسمح لنا للتحقيق في وظيفة chemokine على سلوك الجسم الحي الضامة والإجراء يتطلب بعض الخبرة التقنية. وباختصار، هناك عدة خطوات حاسمة لتجنب المضاعفات في البروتوكول: 1) اختيار خط مناسب وراثيا الذي يظهر إشارة محددة وقوية المعدلة وراثيا لتسمية الخلية ذات الأهمية؛ (2) اختيار خط مناسب وراثيا يبين إشارة محددة وقوية من الجينات إلى تسمية الخلية ذات الأهمية؛ (2) اختيار خط مناسب وراثيا يبين إشارة محددة وقوية من الجينات المعدلة وراثيا لتسمية الخلية ذات الأهمية؛ (2) اختيار خط مناسب وراثيا يبين إشارة محددة وقوية من الجينات إلى الخلية ذات الأهمية؛ (2) اختيار خط مناسب وراثيا يبين إشارة محددة وقوية من الجينات وراثيا لتسمية الخلية ذات الأهمية؛ (2 2) حدد الأنسجة المناسبة التي يمكن الوصول إليها للتصوير والتعبير المفرط الجينات المعدلة وراثيا؛ 3) جعل التحقيق RNA حساسة ومحددة؛ 4) حدد نافذة وقت المراقبة المناسبة لالتقاط سلوك الخلية بدقة.
في إجراء الفلورة جبل كامل في الموقع التهجين جنبا إلى جنب مع تلطيخ المناعة، ينبغي أن يكون التحقيق RNA المستخدمة للكشف عن التعبير الجيني حساسة والإشارة تحتاج إلى أن تكون قوية بما فيه الكفاية. من أجل التقاط وظيفة الجينات على سلوك الخلية، ينبغي اختبار سلسلة من النقاط الزمنية. على سبيل المثال، في مراقبة تأثير il34 على هجرة الضامة، على الرغم من أن المروج fabp10a بدأت في التعبير عن 2-3 dpf، تراكم الضامة في الكبد لم يكن واضحا في ذلك الوقت. هو فقط ب 4 [دبف] أنّ يصبح الإثراء من [ماكروفج] في الكبدة واضحة. وبالإضافة إلى ذلك، وبعد التهجين في الموقع، ستتأثر شدة الإشارة للبقع المناعية اللاحقة. على سبيل المثال، مقارنة مع GFP، DsRed من الصعب أن لون في تلطيخ الفلورة المناعية بعد التهجين في الموقع، وربما بسبب هياكل البروتين المختلفة. وبصفة عامة، فإن شدة الإشارة للتلطيخ المناعي بعد الفلورة في الموقع كله ستكون أقل من تلك التي تُحتسان المناعة الواحدة.
في خطوة التصوير الحي مع المجهر البؤري، فمن الضروري للحفاظ على العينة قريبة من الجزء السفلي من الطبق. عندما تطفو الأجنة في أغاروز، قد تكون مسافة العمل من الهدف غير كافية، أيضا، فإن الأجاروز بين الهدف والعينة تؤثر على نوعية التصوير. إلى جانب ذلك، يجب تعيين عدد العينات للتصوير في كل مرة بشكل صحيح. يجب على المرء التأكد من أن الفترة الزمنية بين اثنين من المسح الضوئي لكل سمكة لن تكون طويلة جدا لتفقد تفاصيل سلوك الخلية. لذلك هذا الأسلوب ليست مناسبة لتتبع الخلايا التي تتحرك بسرعة في الأنسجة السميكة.
في الختام، يمكن استخدام هذا البروتوكول لمراقبة وظيفة chemokines على سلوك مجموعة متنوعة من الخلايا مثل الضامة، العدلات، والخلايا T. هنا، استخدمنا IL-34، وهو ربط تم تحديده مؤخرًا من وظيفة CSF-1R في chemotaxis6،7، كما أعرب العلاج الكيميائي خارج الرحم للحث على هجرة الضامة. وتستند معظم النماذج التجريبية القائمة من chemotaxis الخلية على تجارب الخلايا في المختبر، ولكن التجارب في المختبر في بعض الأحيان بسيطة جدا لنمذجة البيئة المعقدة في الجسم الحي. أيضا، فإنه من الصعب أن تصور القدرة على الجذب الكيميائيفي الجسم الحي عندما ننظر ببساطة في حالة في المختبر. استخدم هذا الأسلوب المزايا المحددة لحمار وحشي لمراقبة سلوك الخلية المباشرة التي من الصعب على الفئران. الطريقة الحالية سمحت لنا لاختبار بسرعة وظائف chemokine على سلوكيات الخلايا في غضون عدة أيام وجعل حمار وحشي نموذجا قويا لدراسة البيولوجيا الجزيئية والخلية.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgments
نشكر الدكتور جينغرونغ بنغ لتقاسم Tg (fabp10a: DsRed) خط المعدلة وراثيا; الدكتور زيلونغ ون لتقاسم TG (mpeg1: GFP) خطوط المعدلة وراثيا؛ د. كويتشي كاواكامي لتوفير متجه pTol2. وقد تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (31771594)، ومشاريع خطة قوانغدونغ للعلوم والتكنولوجيا (2019A030317001) وصناديق البحوث الأساسية للجامعات المركزية (D2191450).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



