Summary
생체 내에서 대식세포 모집에 대한 케모카인의 효과를 시험하기 위해, 시투 혼성화에서 전체 마운트를 사용하여 케모카인의 자궁외 발현을 검출하고, 면역염색을 사용하여 대식세포에 라벨을 붙이도록 하였습니다. 라이브 이미징은 대식세포 이동의 실시간 관찰에 사용되었다.
Abstract
제브라피쉬는 기초 및 생물의학 연구에 널리 사용됩니다. 많은 제브라피쉬 형질전환 선은 현재 다양한 유형의 세포에 라벨을 붙일 수 있습니다. 제브라피시의 투명한 배아 몸으로 인해 생체 내에서 특정 유형의 세포의 행동에 대한 하나의 케모카인의 효과를 연구하는 것이 편리합니다. 여기서 우리는 생체 내에서 대식세포 마이그레이션에 대한 케모카인의 기능을 조사하는 워크플로우를 제공했습니다. 우리는 IL-34를 과발현하기 위하여 조직 특정 과발현 플라스미드를 건설하고 그의 대식세포가 형광 성 단백질에 의해 특별히 표지된 1 세포 단계 형질전환 물고기 태아로 플라스미드를 주입했습니다. 그런 다음 전체 마운트 형광을 계면 혼성화 및 면역 염색을 사용하여 케모카인 발현의 패턴과 대식세포의 수 또는 위치를 감지했습니다. 주입된 WT 배아는 안정적인 형질전환 라인을 생성하도록 제기되었다. 마지막으로, 우리는 생체 내에서 대식세포에 대한 IL-34의 기능을 연구하기 위해 안정적인 형질전환 어류에서 대식세포 거동을 직접 관찰하기 위해 공초점 라이브 이미징을 사용했습니다.
Introduction
제브라피쉬는 인도에서 유래한 작은 열대성 경뼈 민물고기입니다. 유전자 보존에 관해서는, 제브라피쉬는 인간1과87%의 유사성을 갖는다. 그것은 저희에게 유전자 조절, 단백질 기능 및 제브라피시에 있는 et.al 이동과 같은 세포 행동을 공부하여 인간의 관련 주제에 대한 통찰력을 제공할 수 있습니다. Zebrafish 배아는 안료를 억제한 후 다른 단계에서 초기 배아의 발달을 관찰하는 데 사용할 수 있습니다. 한편, 제브라피쉬가 성숙해지면 3개월밖에 걸리지 만, 제브라피쉬는 4일마다 수백 개의 알을 생산할 수 있습니다. 미니 크기, 간단한 번식, 강한 생식 능력, 이러한 장점은 제브라피시 문화를 매우 공간 절약, 대규모 문화에 도움이됩니다. 전통적인 포유류 모델 마우스는 제브라피시보다 유지 보수 비용이 높기 때문에 마우스 기르기의 규모를 제한합니다. 초기 배아 발달의 양태에서, 마우스 배아는 모체 자궁에서 마우스 배아 발달의 특성으로 인해 살아있는 상태에서 관찰하기 어렵다. 반대로, 제브라피시 배아는 외부에서 발달하고 투명하기 때문에 현미경으로 관찰하기 쉽습니다. 더욱이, 제브라피쉬는 관련 유전자 기능 연구를 위한 다양한 형질전환라인을 구성하기가 매우 용이하다. 현재 다양한 제브라피쉬 형질전환 라인을 사용하여 다양한 유형의 세포에 라벨을 부착할 수 있습니다. 특정 위치에서 화학모카인을 과도하게 표현하고 제브라피시의 세포 행동에 대한 케모카인 기능을 연구하기 위해 형질전환 선을 구성하는 것이 매우 편리합니다.
여기서, 우리는 생체2, 3,4,5,6,7에서대식세포 행동에 IL-34의 기능을 조사하기 위해 제브라피시 형질전환 라인을 사용하는 워크플로우를 제공했다. 첫째, 우리는 유전자 il34의 간 특이적 과발현 플라스미드를 구성하고 형광 단백질 GFP에 의해 대식세포를 특이적으로 표지한 1세포 단계 Tg(mpeg1: GFP) 물고기 배아에 플라스미드를 주입하였다. 이어서, 우리는 il34 발현의 패턴 및 대식세포의 수 또는 위치를 검출하기 위해 전체 마운트 형광을 실재화 및 면역 염색을 사용했다. 주입된 WT 배아는 안정적인 형질전환 라인을 생성하도록 제기되었다. 이 단계에서, 우리는 사이토카인 생산 라인을 설치하고 검증하고 대식세포 분포에서 볼 수 있는 효력을 시각적으로 평가했습니다. 마지막으로, 사이토카인에 반응하여 대식세포 거동을 조사하기 위해, 우리는 생체 내에서 대식세포 이동에 대한 il34의 기능을 확인하기 위해 대식세포 이동을 직접 관찰하기 위해 공초점 라이브 이미징을 사용했다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
참고: 모든 시료를 페닐티우레아(PTU) 난자물에 의해 처리하여 안료를 억제하였다.
1. Tg의 생성(fabp10a:il34)형질전환 구성 및 물고기 주입
- 2.8 kb fabp10a 프로모터8 및 IL-34 코딩 영역(ENSDART0000000126460.3)을 pTol2 벡터내로 복제하여 fabp10a-il34 구획을 생성한다. 생성을 트랜스포사제 mRNA와 함께 1세포 단계Tg(mpeg1: GFP)및 WT 어항 배아에 주입한다. fabp10a-il34를 성인9에 WT 배아를 주입하고 섭식 창시자를 섭식 형질전환에 의해 식별한다.
참고: 다른 트랜스제닉 라인이 동일한 트랜스포전 시스템으로 만들어지면 Tol2 구성을 다른 형질전환에 직접 주입하는 것이 문제가 될 수 있습니다. 일반적인 관행은 독립적 인 형질 전환 라인을 만들고 이후에 다른 기자 라인과 새 선을 교차하는 것입니다. 이것은 이전에 삽입된 이식 유전자에 새로운 transgenesis의 효력이 없을 것이라는 점을 확인합니다.
2. 형광 전체 마운트 인 시투 혼성화 (WISH) 면역 염색과 결합
- 샘플 고정
- 원하는 단계에서 Tg (mpeg1: GFP)와 교차 하는 일시적인 주입 또는 안정 한 IL-34 형질 전환 라인의 배아를 수집 합니다.
참고: 이 경우, 배아를 4d 후 수정(dpf)에서 수집하였다. (필요한 경우) 주사기로 코리온을 제거합니다. - 4% 파라포름알데히드(PFA)로 배아를 실온(RT)에서 4°C 또는 2시간(약 25°C)에서 밤새 고정시다.
- 배아를 인산완충식염수와 트웬 20(PBST) 3x 5분으로 세척한다.
- 배아를 PBST(50% 메탄올/PBST)에서 50% 메탄올과 100% 메탄올, 1x 5분 각각으로 별도로 탈신시다. 그런 다음 신선한 100% 메탄올로 변경하고 -20°C(적어도 2시간)에 보관합니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
- 원하는 단계에서 Tg (mpeg1: GFP)와 교차 하는 일시적인 주입 또는 안정 한 IL-34 형질 전환 라인의 배아를 수집 합니다.
- 프로브 혼성화 (1일차)
- PBST에서 50 % 메탄올 (50 % 메탄올 / PBST)으로 이전 단계에서 배아를 재수화 한 다음 PBST 3x 5 분으로 씻으하십시오.
- RT에서 PBST에서 단백질 분해제 K로 배아를 소화하십시오 (최종 농도 : 10 μg / mL; PBST에서 1 :2000).
참고: 소화 시간은 배아 단계에 따라 달라집니다 : 36 시간 미만의 후 수정 (hpf), 필요 없음; 36 hpf-2 dpf 배아, 3-5 분; 2-3 dpf 배아, 10 분; 3-4 dpf 배아, 15분; 4-5 dpf 배아, 15-20 분; 5-6 dpf 배아, 20-27 분; >6 dpf 배아, RT에서 25-30분 (약 25°C). - 소화 용액을 버리고 RT에서 20 분 동안 4 % PFA로 다시 고정을 수행하십시오.
- 배아를 PBST 2x 10분으로 씻으소서.
- PBST를 폐기하고, 65°C에서 65°C에서 가열된 혼성화 버퍼(HB 버퍼)로 사전 혼성화를 수행하고, HB 버퍼를 원래 튜브로 재활용합니다.
- 65°C에서 새로운 가열 된 HB 버퍼로 사전 혼성화를 수행하여 적어도 1 시간.
- 프로브9를 예열(이 경우 il34 프로브, 1 ng/mL)을 65°C에서 10분 이상 가열하였다. 그런 다음 HB 버퍼를 원래 튜브로 재활용합니다. 65°C에서 하룻밤 동안 예열된 프로브로 혼성화를 수행합니다.
- 항체 치료 (일 II)
- 50% 포름아미드/2x 식염수 구연산나트륨과 트웬 20(SSCT), 2x SSCT, 65°C에서 0.2x SSCT를 예열합니다.
- 프로브를 원래 튜브에 재활용하고 프로브를 -20°C에 저장합니다.
- 배아를 50% 포름아미드/2x SSCT로 따로 세척; 2x SSCT; 0.2x SSCT, 3x 20 분 또는 2x 30 분 각각 65 °C에서.
- 배아를 PBST 3x 5분으로 씻으소서.
- RT에서 1 시간 동안 차단 버퍼 (PBST에서 5 % 여과 된 태아 소 혈청 (FBS)로 샘플을 차단하십시오.
- 안티 디곡시겐-HRP 항체 용액 400 μL(차단 완충액1:1,000-1:2,000)을 추가하고 배아를 밤새 4°C에서 배양합니다. 신호가 약한 경우 항체의 1:500 희석을 사용하십시오.
- 착색 및 1 차 항체 배양 (일 III)
- 항체를 제거; PBST로 배아를 씻고 RT에서 6 x 20 분.
- RT에서 5분 동안 1x 플러스 증폭 희석액의 30 μL로 시료를 헹구고 있습니다.
- 파이펫팅하여 희석제를 폐기; 희석 플루오로폴레 티라미드 스톡 솔루션(사이아닌 3 플러스 증폭 시약(Cy3) 또는 시안 5 플러스 증폭 시약(Cy5)을 사용하였고, 이 경우 Cy3가 사용되었고, 1:50에 1x 플러스 증폭 희석제는 플루오로폴레 티라미드 작업 용액을 만들었다. 각 샘플에 대해 50-100 μL의 작업 용액을 준비합니다.
- RT에서 어두운 5-15 분 동안 플루오로포어 티라미드 작업 솔루션에서 샘플을 배양. 신호가 약한 경우 인큐베이션 시간을 30분으로 연장합니다.
- PBST로 작동 용액을 변경하여 반응을 중지하고 신호를 검사합니다.
- RT에서 PBST 3x 10 분으로 배아를 씻으소서.
- 1차 항체로 샘플을 밤새 4°C에서 배양한다. 이 경우 염소-항-GFP 항체를 1차 항체로 사용한다.
- 이차 항체 염색 (일 IV)
- 배아를 PBST로 4x 30 분 동안 씻으소서.
- 배아를 하룻밤 동안 4°C에서 이차 항체로 배양합니다. 이 경우, Alexa 488-항염소 항체를 이차 항체로 사용한다.
- 사진 찍기 (데이 V)
- RT에서 PBST 3x 10 분으로 배아를 씻으소서.
- 배아를 70% 글리세롤을 밤새 4°C 또는 -20°C에서 어두운 형태로 보관하십시오.
3. 라이브 이미징
-
샘플 선택
참고 : 직접 Tg의 대식 세포 여부를 관찰하기 위해 라이브 이미지를 사용하여(fabp10a: il34; fabp10a: DsRed; mpeg1: GFP)물고기는 3-3.5 dpf 동안 IL-34 유도하에 간으로 마이그레이션할 것입니다. 여기에서 Tg (fabp10a-DsRed)형질전환 선은 간 영역을 표시하고 보이게하는 데 사용되며, 간 국소화를 용이하게하고 대식세포가 간으로 이동하는지 여부를 결정합니다. 화상 진찰의 앞에, DsRed와 GFP 이중 양성 태아를 선택하기 위하여 형광 현미경을 이용하십시오. -
생선 마운팅
- 금속 욕조를 사용하여 1 mL의 1% 낮은 용융 아가로스를 90 °C 이상으로 가열하여 완전히 녹입니다.
- 낮은 용융 아가로스가 체온으로 냉각 된 후, 0.2 % 트리카인 50 μL을 추가하고 아가로스와 트리카인을 균일하게 혼합합니다.
- 마취 된 배아를 바닥에 커버 슬라이드가 장착 된 작은 접시로 옮기고, 주변 물을 제거하고, 배아에 낮은 녹는 아가로스를 천천히 떨어 뜨리고, 아가로스가 고화되기 전에 물고기의 위치를 조심스럽게 설정하고 간 부위를 가까이 유지하십시오. 커버 슬라이드를 접시 바닥에 밀어 넣을 수 있습니다.
- 낮은 용융 아가로스가 고형화 된 후 조심스럽게 아가로즈의 다른 층으로 덮어 강화합니다.
- 공초점 현미경 담체 테이블에 접시를 놓고, 트리카인으로 E2 용액10으로 물고기를 덮고 이미징을 시작합니다.
-
공초점 현미경의 소프트웨어 작동
- ZEN Black 2.3 소프트웨어를 열고 살아있는 셀 워크벤치를 현미경 캐리어 테이블에 설치합니다.
- 찾기를 클릭합니다. 인큐베이션 | 온도를 29°C로 설정한다.
- 접시를 살아있는 세포 작업대 의 중앙에 놓고, 트리카인으로 E2 용액10으로 물고기를 덮습니다.
- 수집 메뉴를 클릭하고 스마트 설정 메뉴에서 필요한 스캔 모드와 레이저를 선택한 다음 Z 스택 및 위치를선택합니다.
- 실험 디자이너 메뉴를 클릭하고 첫 번째 블록에서 다중 블록 실험 활성화를선택하여 낮은 배율 아래의 샘플을 찾은 다음 높은 배율로 전환한 다음 시야 중앙에 있는 관찰된 영역을 허용합니다.
- 위치 및 Z 스택 정보를 설정하고 적절한 레이저 강도, 스캐닝 레이어 및 이미징 속도를 선택합니다.
- 새 블록을 만들고 위의 단계를 반복합니다. 모든 블록을 설정한 후 적절한 수의 루프를 설정하고 녹화를시작합니다(그림 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
제브라피시 프로토콜에 관련된 단계는 그림 2에나와 있습니다. 먼저, 우리는 il34가 fabp10a 프로모터에 의해 구동된 pBLK-fabp10a-il34-sv40 구문(그림2)을생성하였다. 이 구획은 1세포 단계 Tg(mpeg1:GFP)로미세주입하였으며, 이는 성인용으로 사육된 GFP 및 WT 배아로 대식세포를 라벨링할 수 있는 제브라피시 배아를 형질전환 안정라인을 생성하였다(도2). il34의 발현은 전체 마운트 형광에 의해 계면 혼성화(도2 및 도 3)로분석하였다. GFP에 의해 표지된 대식세포는 면역염색에 의해 분석되었다(도2 및 도 3). 우리는 3-3.5 dpf 도중 il34 유도의 밑에 대식세포가 간으로 이동할 지 여부를 직접 관찰하기 위하여 살아있는 화상 진찰을 이용했습니다(그림 2, 그림 4, 보충 영화 1 및 보충 영화 2) .
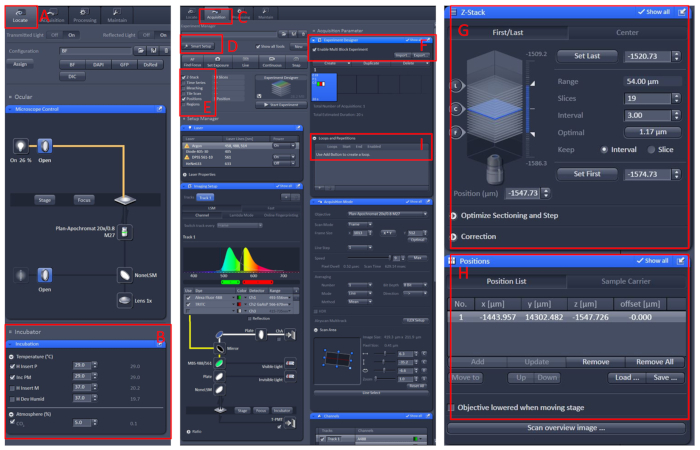
그림 1: 공초점 현미경 라이브 이미징의 소프트웨어 작동. ZEN Black 2.3 소프트웨어를 열고 살아있는 셀 워크벤치를 현미경 캐리어 테이블에 설치한 다음 찾기 (A)를클릭합니다 | 인큐베이션 | 온도 (온도) (B)온도를 29°C로 설정한다. 접시를 살아있는 세포 작업대 의 중앙에 놓고, 트리카인으로 E2 용액10으로 물고기를 덮습니다. 이 모든 후, 수집 (C)메뉴를 클릭, 스마트 설정 (D)메뉴에서 필요한 스캔 모드와 레이저를 선택, 다음 Z 스택 및 위치 (E)를선택합니다. 마지막으로 실험 디자이너 (F)메뉴를 클릭하고 첫 번째 블록에서 다중 블록 실험 활성화를선택하고 낮은 배율 에서 샘플을 찾은 다음 높은 배율로 전환한 다음 관찰 된 영역을 시야의 중심, 위치 및 Z 스택(G 및 H)정보를 설정, 적절한 레이저 강도, 스캐닝 레이어 및 이미징 속도를 선택합니다. 새 블록을 만들고 위의 단계를 반복합니다. 모든 블록을 설정 한 후, 루프(I)의적절한 수를 설정하고 녹음을 시작합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 생체 내 대식세포 이동에 대한 케모카인의 기능을 조사하는 워크플로우. 우리는 조직 특이적 (간) 과발현 플라스미드를 과발현 IL-34로 구성하고 대식세포가 형광 단백질(Tg: (mpeg1: GFP)에 의해 특별히 표지된 1세포 단계 형질전환 물고기 배아에 플라스미드를 주입했습니다. )). 주입된 WT 배아는 안정적인 형질전환 라인을 생성하도록 제기되었다. 그런 다음 전체 마운트 형광을 실재화 및 면역 염색에 사용하여 유전자 발현 패턴및 일시적인 주입 배아 또는 안정된 라인 배아(4 dpf)의 대식세포수 또는 위치를 검출하였다. 마지막으로, 우리는 생체 내에서 대식세포에 대한 IL-34의 기능을 연구하기 위해 안정된 형질전환 어류(3-3.5 dpf)에서 대식세포 거동을 직접 관찰하기 위해 공초점 라이브 이미징을 사용했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 형광 위시면역염색과 결합. 이 그림은 Jiang 외11에서수정되었습니다. pBLK-fabp10a-il34-sv40 구성물의 총 1.8 nL(30 ng/μL)을 1세포 단계 Tg(mpeg1: GFP) 제브라피쉬 배아로 미세주입하였다. (A)4 dpf 배아(6x)에서 GFP 발현(녹색)의 il34 발현(적색) 및 전체 마운트 항체 염색의 소원. 물고기의 몸 전체 사진은 공초점으로 촬영하고 포토샵에서 함께 바느질 두 개의 별도 이미지로 구성되어 있습니다. 인세트는 해당 박스 영역(주황색 점선 영역)의 높은 배율(20x)입니다. (B)주사되지 않은 배아의 간(흰색 점선 영역으로 표시됨) 및 꼬리 영역(대략 13일과 17일 사이, 두 개의 흰색 점선 사이에 표시됨)에서 대식세포 세포 수의 정량적 분석. 데이터는 Mann Whitney U 테스트, ** p < 0.01에 의해 대조군으로 분석되었다. n = 5, 5를 주입하고 물고기를 대조하는 4 dpf에 대해. 바: 200 μm (흰색 선); 50 μm (노란색 선). (C)4 dpf 안정선 배아(6x)에서 GFP 발현의 il34 발현 및 전체 마운트 항체 염색의 소원. 물고기의 몸 전체 사진은 공초점으로 촬영하고 포토샵에서 함께 바느질 두 개의 별도 이미지로 구성되어 있습니다. 인세트는 해당 박스 영역(주황색 점선 영역)의 높은 배율(20x)입니다. (D) Tg (mpeg1 : GFP)및 Tg (fabp10a : il34; mpeg1 : GFP)배아의 간 (흰색 점선 영역으로 표시) 및 꼬리 영역 (약 13 일 사이)의 대식세포 세포 수의 정량 분석 두 개의 흰색 점선 사이에 표시) 및 17 somite. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 안정된 형질전환어에서 대식세포 거동을 직접 관찰하는 공초점 라이브 이미징. 이 그림은 Jiang 외11에서수정되었습니다. 생생한 이미징의 현미경 사진은 대조군 물고기(A)에서28 분 이내에 간 (빨간색)에 의해 통과하는 대식세포 (녹색, 흰색 화살표로 표시)의 과정을 보여주고 대식세포 (녹색, 흰색 화살표로 표시) 28 내에서 간 (빨간색)으로 이동하는 과정 IL-34 과다 표현 물고기 (B)에서 분. 배율 막대 = 40 μm(흰색 선). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

보충 영화 1: IL-34 과발현 물고기에서 2 시간 이내 간 (빨간색)으로 마이그레이션 대식 세포 (녹색, 흰색 화살표로 표시)의 과정을 보여주는 라이브 이미징. 배율 막대 = 20 μm(흰색 선). 이 영화는 Jiang et al.11에서다시 출판되었습니다. 이 비디오를 보려면 여기를 클릭하십시오. (다운로드하려면 마우스 오른쪽 단추로 클릭합니다.)

보충 영화 2: 대식 세포의 과정을 보여주는 라이브 이미징 (녹색, 흰색 화살표에 의해 표시) 간 주위 방황 (빨강) 내 2 제어 물고기. 배율 막대 = 20 μm(흰색 선). 이 영화는 Jiang et al.11에서다시 출판되었습니다. 이 비디오를 보려면 여기를 클릭하십시오. (다운로드하려면 마우스 오른쪽 단추로 클릭합니다.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
여기에 설명된 프로토콜은 우리가 대식세포 생체의 행동에 대한 케모카인의 기능을 조사할 수 있게 해주며, 절차는 몇 가지 기술적 전문 지식이 필요합니다. 요약하면, 프로토콜내의 합병증을 피하기 위한 몇 가지 중요한 단계가 있다: 1) 관심 있는 세포를 라벨화하는 특이적이고 강한 형질전환 신호를 보여주는 적합한 형질전환 라인을 선택; 2) 이미징 및 형질전환 유전자 과발현에 접근할 수 있는 적절한 조직을 선택; 3) 민감하고 특정 RNA 프로브를 만드는; 4) 세포 거동을 정확하게 포착하기 위해 적절한 관찰 시간 창을 선택한다.
면역 염색과 결합된 계면 혼성화에서 전체 마운트 형광의 절차에서, 유전자 발현을 검출하는 데 사용되는 RNA 프로브는 민감해야 하며 신호는 충분히 강해야 한다. 세포 행동에 유전자 기능을 포착하기 위하여는, 일련의 시간 점을 시험되어야 합니다. 예를 들어, 대식세포 이동에 대한 il34의 효과를 관찰할 때, fabp10a 프로모터가 2-3 dpf에서 발현되기 시작했음에도 불구하고, 간에서 대식세포 축적은 그 당시 명확하지 않았다. 그것은 단지 4 dpf에 의해 간에서 대 식 세포의 농축이 명백해진다. 또한, 시투 혼성화 후, 후속 면역 염색의 신호 강도가 영향을 받을 것이다. 예를 들어, GFP와 비교하여, DsRed는 상이한 단백질 구조 때문에 아마도 상이한 단백질 구조 때문에, 아마도 상이한 단백질 구조때문에, 현재 의 혼성화에서 후 면역형광 염색에서 염색하기 어렵다. 일반적으로 말하자면, 계종 혼성화에서 전체 마운트 형광 후 면역 염색의 신호 강도는 단일 면역 염색보다 적을 것이다.
공초점 현미경을 가진 살아있는 화상 진찰 단계에서, 접시의 바닥에 가까운 견본을 유지하는 것이 필요합니다. 배아가로즈에 떠있을 때, 목표의 작동 거리가 불충분할 수 있고, 또한, 목표와 견본 사이 아가로스는 화상 진찰의 질에 영향을 미칠 것입니다. 게다가, 매번 화상 진찰을 위한 견본의 수는 제대로 설정되어야 합니다. 하나는 각 물고기의 두 스캔 사이의 시간 범위가 세포 행동의 세부 사항을 잃고 너무 오래되지 않을 것이라는 점을 확인해야합니다. 따라서이 방법은 두꺼운 조직에서 빠르게 움직이는 세포를 추적하는 데 적합하지 않습니다.
결론적으로,이 프로토콜은 대식세포, 호중구 및 T 세포와 같은 다양한 세포의 거동에 대한 케모카인의 기능을 관찰하는 데 사용될 수 있다. 여기서, 우리는 화학탁증6,7에서CSF-1R 기능의 최근 확인된 리간드인 IL-34를 사용하였으며, 이소성 발현 된 케모카인으로서 대식세포 이동을 유도한다. 세포 화학요법의 기존 실험 모델의 대부분은 시험관내 세포 내 실험을 기반으로 하지만, 시험관내 실험은 때때로 생체 내에서 복잡한 환경을 모델링하기에는 너무 간단하다. 또한, 체외 상황을 단순히 살펴보면 화학적 매력 능력을 상정하기 어렵다. 이 방법은 마우스에게 어려운 직접적인 세포 행동 관찰을 위해 제브라피시의 특정 장점을 활용하였다. 현재 의 방법을 통해 며칠 내에 세포 행동에 대한 케모카인 기능을 신속하게 테스트하고 zebrafish를 분자 및 세포 생물학을 연구하는 강력한 모델로 만들 수 있었습니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 할 것이 없다.
Acknowledgments
Tg (fabp10a: DsRed) 형질전환 라인을 공유해 주신 징롱 펑 박사에게 감사드립니다. Tg (mpeg1: GFP) 형질전환 선을 공유하기 위한 지롱 웬 박사; pTol2 벡터를 제공하는 가와카미 고이치 박사. 이 사업은 중국 국립자연과학재단(31771594), 광동과학기술계획사업(2019A030317001), 중앙대학교 기초연구기금(D2191450)의 지원을 받았다.
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



