Summary
För att testa effekten av en Chemokine på makrofag rekrytering in vivo, var hela Mount in situ hybridisering används för att upptäcka ektopisk uttryck för Chemokine, och immunofärgning användes för att märka makrofager. Live Imaging användes för realtids observation av makrofagmigrering.
Abstract
Zebrafish används ofta i grundläggande och biomedicinsk forskning. Många zebrafiskar transgena linjer är för närvarande tillgängliga för att märka olika typer av celler. På grund av den genomskinliga embryonala kroppen av zebrafisk, det är bekvämt för oss att studera effekten av en Chemokine på beteendet hos en viss typ av celler in vivo. Här har vi tillhandahållit ett arbetsflöde för att undersöka funktionen hos en Chemokine på makrofagmigrering in vivo. Vi konstruerade en vävnad-specifika överuttryck plasmid att överuttrycka Il-34 och injiceras plasmiden i en cell skede transgena fisk embryon vars makrofager var särskilt märkta med ett fluorescerande protein. Vi använde sedan hela montera fluorescerande in situ hybridisering och immunofärgning att upptäcka mönstret av Chemokine uttryck och antalet eller lokalisering av makrofager. De injicerade WT-embryona höjdes för att generera en stabil transgen linje. Slutligen använde vi konfokalmikroskopi Live Imaging att direkt observera makrofag beteende i den stabila transgena fisken att studera funktionen av Il-34 på makrofager in vivo.
Introduction
Zebrafish är en liten tropisk hårda ben sötvattenfisk har sitt ursprung i Indien. Angående gen beskydd har zebrafiskar en likhet av 87% till människan1. Det kan ge oss insikter om relaterade ämnen av människan genom att studera genreglering, proteinfunktion och cell beteende såsom migration, proliferation et.al i zebrafisk. Zebrafish embryo kan användas för att observera utvecklingen av tidiga embryon i olika stadier efter att hämma pigment. Under tiden tar det bara tre månader för zebrafiskar att utvecklas till sexuell mognad, då zebrafisken kan producera hundratals ägg var 4 dagar. Mini-storlek, enkel avel, stark fortplantningsförmåga, dessa fördelar gör zebrafiskar kultur mycket utrymmesbesparande, bidrar till storskalig kultur. Den traditionella däggdjurs modellen mus har en högre underhållskostnader än Zebrafish, därför begränsa omfattningen av mus höjning. I aspekten av tidig embryonal utveckling, mus embryo är svårt att Observera i levande tillstånd på grund av egenskaperna hos mus embryots utveckling i moderlivmodern. Tvärtom, zebrafiskar embryon utvecklas externt och är transparenta, därför är de lätta att observera under ett mikroskop. Dessutom är zebrafiskar mycket lätt att konstruera en mängd transgena linjer för relaterad genfunktion forskning. För närvarande, olika zebrafiskar transgena linjer är tillgängliga för att märka olika typer av celler. Det är mycket bekvämt nu att konstruera transgena linjer för att överuttrycka chemokines på specifika platser och studera chemokines funktion på cell beteende i zebrafisk.
Här, vi tillhandahöll ett arbetsflöde för att använda zebrafiskar transgena linje för att undersöka funktionen av Il-34 på makrofage beteende in vivo2,3,4,5,6,7. För det första konstruerade vi en leverspecifik överuttryck plasmid av genen il34 och injiceras plasmiden i en-cells skede TG (MPEG1: GFP) fisk embryon som specifikt märkt makrofager av fluorescerande protein GFP. Sedan använde vi hela montera fluorescerande in situ hybridisering och immunofärgning att upptäcka mönstret av il34 uttrycket och antalet eller lokalisering av makrofager. De injicerade WT-embryona höjdes för att generera en stabil transgen linje. I dessa steg, vi etablerade och validerade cytokin-producerande linje och visuellt bedömas de effekter som kan ses på makrofagdistribution. Slutligen, för att undersöka makrofagbeteende som svar på cytokin, vi använde konfokalmikroskopi Live Imaging att direkt observera makrofagmigrering för att bekräfta funktionen av il34 på makrofagmigrering in vivo.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Anmärkning: Alla prover behandlades med fenylthiourea (PTU) ägg vatten för att hämma pigment.
1. generering av TG (fabp10a: il34) transgena konstruktioner och fisk injektion
- Klona 2,8 KB fabp10a promotor8 och Il-34 kodning regioner (ensdart 00000126460.3) av zebrafiskar i pTol2 vektor för att generera fabp10a-il34 konstruera. Injicera konstrukterna i encellsstadiet TG (MPEG1: GFP) och WT-fiskembryon tillsammans med Transposase mRNA. Höj fabp10a-il34 injiceras WT embryon till vuxna9 och identifiera transgena grundaren av in situ hybridisering.
Anmärkning: Injektion av Tol2 konstruera direkt i en annan transgena kan vara problematiskt om den andra transgena linjen görs med samma transposon system. En allmän praxis skulle vara att göra en oberoende transgen linje och därefter korsa den nya linjen med en annan reporter linje. Detta säkerställer att det inte kommer att finnas några effekter av den nya transgenetik på en tidigare insatt Transgene.
2. fluorescerande hela Mount in situ hybridisering (WISH) kombinera med immunofärgning
- Provfixering
- Samla embryon av övergående injektion eller stabil IL-34 transgena linje som korsade med TG (MPEG1: GFP) vid önskade stadier.
Anmärkning: För detta fall, embryona samlades vid 4 d post fertilisering (DPF). (Vid behov) ta bort chorion med spruta. - Fixera embryona med 4% PARAFORMALDEHYD (PFA) över natten vid 4 ° c eller 2 h vid rumstemperatur (RT) (ca 25 ° c).
- Tvätta embryona med fosfatbuffrad saltlösning plus Tween 20 (PBST) 3x 5 min.
- Torka av embryona separat med 50% metanol i PBST (50% metanol/PBST) och 100% metanol, 1x 5 min vardera. Byt sedan till färsk 100% metanol och förvara vid-20 ° c (minst 2 h).
Anmärkning: Protokollet kan pausas här.
- Samla embryon av övergående injektion eller stabil IL-34 transgena linje som korsade med TG (MPEG1: GFP) vid önskade stadier.
- Sond hybridisering (dag I)
- Rehydrera embryona i föregående steg med 50% metanol i PBST (50% metanol/PBST), tvätta sedan med PBST 3x 5 min.
- Smälta embryona med proteinas K i PBST vid RT (slutkoncentration: 10 μg/mL; 1:2000 i PBST).
Anmärkning: Digestionstid beror på embryona skede: mindre än 36 h post fertilisering (HPF), inget behov; 36 HPF-2 DPF embryo, 3-5 min; 2-3 DPF embryo, 10 min; 3-4 DPF embryo, 15 min; 4-5 DPF-embryo, 15-20 min; 5-6 DPF-embryo, 20-27 min; > 6 DPF-embryo, 25-30 min vid RT (ca 25 ° c). - Kassera digestionslösningen och utför fixering igen med 4% PFA, för 20 min vid RT.
- Tvätta embryon med PBST 2x 10 min.
- Kassera PBST, utför för hybridisering med uppvärmd hybridiseringsbuffert (HB-buffert) vid 65 ° c i 5 min, återvinn HB-bufferten i det ursprungliga röret.
- Utför för hybridisering med ny uppvärmd HB buffert vid 65 ° c minst 1 h.
- Pre-Heat sonden9 (för detta fall var en il34 sond, 1 ng/ml) vid 65 ° c minst 10 min. Återvinn sedan HB-bufferten i det ursprungliga röret. Utför hybridisering med den förvärmd sonden vid 65 ° c över natten.
- Antikroppsbehandling (dag II)
- Värm 50% formamid/2x saltlösning natriumcitrat plus Tween 20 (SSCT), 2x SSCT, 0.2 x SSCT vid 65 ° c.
- Återvinn sonden i det ursprungliga röret och förvara sonden vid-20 ° c.
- Tvätta embryona separat med 50% formamid/2x SSCT; 2x SSCT; 0,2 x SSCT, 3x 20 min eller 2x 30 min vardera vid 65 ° c.
- Tvätta embryona med PBST 3x 5 min.
- Blockera proverna med 600 μL blockeringsbuffert (5% filtrerat fetalt bovint serum (FBS) i PBST) för 1 h vid RT.
- Tillsätt 400 μL av anti-digoxigenin-HRP-antikroppslösningen (1:1000-1:2000 i blockeringsbuffert) och inkubera embryona vid 4 ° c över natten. Om signalerna är svaga, Använd 1:500 utspädning av antikroppar.
- Färgning och primär antikropp inkuberande (dag III)
- Ta bort antikroppen; Tvätta embryona med PBST, 6x 20 min vid RT.
- Skölj provet med 30 μL 1x plus förstärknings spädningsmedel i 5 min vid RT.
- Kassera spädningsvätskan genom att Pipettera ut; Späd fluorophore Tyramid stamlösning (cyanin 3 plus amplifiering reagens (Cy3) eller Cyanine 5 Plus amplifiering reagens (Cy5), för detta fall Cy3 användes) 1:50 i 1x plus amplifiering spädningsvätska för att göra fluorophore Tyramide arbetslösning. Bered 50-100 μL arbetslösning för varje prov.
- Inkubera provet i fluorophore Tyramide arbetslösning för 5-15 min i mörker vid RT. Om signalerna är svaga, förlänga inkubationstiden till 30 min.
- Stoppa reaktionen genom att ändra arbetslösningen med PBST och undersöka signalerna.
- Tvätta embryona med PBST 3x 10 min vid RT.
- Inkubera provet med primär antikropp vid 4 ° c över natten. För detta fall, Använd Get-anti-GFP antikropp som primär antikropp.
- Sekundär antikropps färgning (dag IV)
- Tvätta embryona med PBST i 4x 30 min.
- Inkubera embryona med sekundär antikropp vid 4 ° c över natten. För detta fall, Använd Alexa 488-anti-get antikropp som sekundär antikropp.
- Ta bilder (dag V)
- Tvätta embryona med PBST 3x 10 min vid RT.
- Förvara embryona i 70% glycerol i mörker vid 4 ° c över natten eller-20 ° c längre.
3. live Imaging
-
Exempel på att välja
Obs: Använd Live-bilden för att direkt observera om makrofager av TG (fabp10a: Il34; fabp10a: DSRED; MPEG1: GFP) fisken skulle MIGRERA in i levern under Il-34 induktion under 3-3.5 DPF. Här TG (Fabp10a-dsred) transgena linjen används för att märka levern regionen och göra det synligt, för att underlätta lokalisering av levern och för att avgöra om makrofager migrera in i levern. Före avbildning, Använd ett fluorescensmikroskop för att välja de DsRed-och GFP-dubbelpositiva embryona. -
Fisk montage
- Använd ett metall bad för att värma 1 mL 1% låg smältande aguppstod till över 90 ° c för att helt smälta den.
- Efter låg smältning Agreste kyls till kroppstemperatur, tillsätt 50 μL av 0,2% tricaine, och enhetligt blanda tricaine med aguppstod.
- Flytta sövda embryon till en liten skål monterad med en täckglas på botten, ta bort det omgivande vattnet, sakta släppa den låga smältande aguppstod på embryon, noggrant ställa in positionen av fisken innan aguppstod är stelnat, hålla levern området nära täckglaset på botten av skålen.
- Efter den låga smältande Agreste är stelnat, noggrant täcka den med ett annat lager av aguppstod för att förstärka den.
- Placera skålen på konfokalmikroskopi Mikroskop bärare bord, täck fisken med E2 lösning10 med tricaine och starta Imaging.
-
Programvara drift av det konfokala mikroskopet
- Öppna Zen black 2,3 programvara, installera Living cell Workbench på Mikroskop bärare tabellen.
- Klicka på hitta | Inkubering | Temperatur för att ställa in temperaturen till 29 ° c.
- Placera skålen i mitten av Living cell Workbench, täck fisken med E2 lösning10 med tricaine.
- Klicka på menyn förvärv , Välj önskat skanningsläge och lasrar i Smart setup -menyn och välj sedan Z-stack och position.
- Klicka på menyn experimentsdesigner , Välj Aktivera multi block experiment, i det första blocket, för att hitta provet under den låga förstoringen, och växla sedan till den höga förstoringen, låt det observerade området i mitten av synfältet.
- Ställ in position och Z-stack information, Välj lämplig laserintensitet, skannings skikt och bildhastighet.
- Skapa ett nytt block och upprepa ovanstående steg. När du har konfigurerat alla block ställer du in lämpligt antal slingor och börjar spela in (bild 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De steg som ingår i zebrafiskar-protokollet illustreras i figur 2. Först genererade vi pBLK-fabp10a-il34-sv40-konstruktionen där il34 drevs av den fabp10a promotorn (figur 2). Konstruktionen var mikroinjicerad i encellig fas TG (MPEG1: GFP) zebrafiskar embryon som kan märka makrofager med GFP och WT embryon som höjdes till vuxna för att generera transgena stabil linje (figur 2). Uttrycket av il34 analyserades av hela monteringen fluorescens in situ hybridisering (figur 2 och figur 3). Makrofager som märkts med GFP analyserades genom immunofärgning (figur 2 och figur 3). Vi använde Live Imaging för att direkt observera om makrofager skulle migrera in i levern under il34 induktion under 3-3.5 DPF (figur 2, figur 4, kompletterande film 1 och kompletterande film 2) .
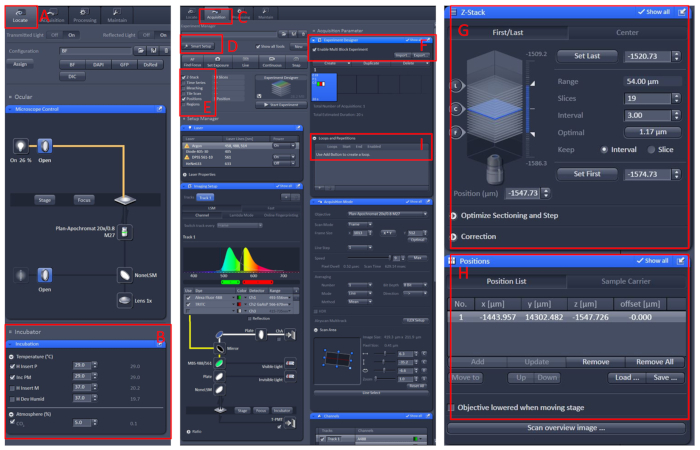
Bild 1: programvara drift av konfokalmikroskopi Mikroskop Live Imaging. Öppna Zen black 2,3 programvara, installera Living cell Workbench på Mikroskop bärare tabellen och klicka sedan på lokalisera (A) | Inkubering | Temperatur (B) för att ställa in temperaturen till 29 ° c. Placera skålen i mitten av Living cell Workbench, täck fisken med E2 lösning10 med tricaine. Efter alla dessa, klicka på menyn förvärv (C), Välj önskat skanningsläge och lasrar i Smart setup (D)-menyn och välj sedan Z-stack och position (E). Klicka slutligen på menyn experiment designer (F), Välj Aktivera multi block experiment, i det första blocket, för att hitta provet under den låga förstoringen, och växla sedan till den höga förstoringen, låt det observerade området i i det visuella fältets mitt, Ställ in positionen och Z-stacken (G och H), Välj lämplig laserintensitet, skannings skikt och bildhastighet. Skapa ett nytt block och upprepa ovanstående steg. När du har ställt in alla block, ange lämpligt antal slingor (I) och starta inspelningen. Vänligen klicka här för att se en större version av denna siffra.

Figur 2: ett arbetsflöde för att undersöka funktionen hos en Chemokine på makrofagmigrering in vivo. Vi konstruerade en vävnads-specifik (lever) överuttryck plasmid till överuttrycker IL-34 och injiceras plasmiden i en cell skede transgena fisk embryon vars makrofager var särskilt märkta med ett fluorescerande protein (TG: (MPEG1: GFP )). De injicerade WT-embryona höjdes för att generera en stabil transgen linje. Vi använde sedan hela montera fluorescerande in situ hybridisering och immunofärgning att upptäcka mönstret av genuttryck och antalet eller lokalisering av makrofager av övergående injicerade embryon eller stabila linjen embryon (4 DPF). Slutligen använde vi konfokalmikroskopi Live Imaging för att direkt observera makrofag beteende i den stabila transgena fisken (3-3.5 DPF) för att studera funktionen av Il-34 på makrofager in vivo. Vänligen klicka här för att se en större version av denna siffra.

Figur 3: fluorescerande önskan kombineras med immunofärgning. Denna siffra har modifierats från Jiang et al.11. Sammanlagt 1,8 nl (30 ng/μl) av konstruktionen PBLK-fabp10a-il34-sv40 mikroinjicerades till en-cells-fas TG (MPEG1: GFP) zebrafiskar-embryon. (A) önskan om il34 Expression (röd) och HELKROPPS färgning av GFP-uttryck (grön) i 4 DPF-embryo (6x). Hela kroppen bilden av fisken består av två separata bilder tagna av konfokala och sydda tillsammans i Photoshop. Insets är hög förstoring (20x) av motsvarande boxed regioner (orange prickade områden). (B) kvantitativ analys av makrofagcellsnummer i un-injiceras och konstruera injicerade embryon lever (visas i den vita streckade området) och svans region (ungefär mellan den 13 och 17 somite, visas mellan två vita streckade linjer). Data analyserades av Mann Whitney U test, * * p < 0,01 jämfört med kontroll. n = 5,5 för de 4 DPF injicerade och kontrollera fisken. Stång: 200 μm (vit linje); 50 μm (gul linje). C) önskan om il34 uttryck och HELKROPPS färgning av GFP-uttryck i 4 DPF stabilt linje embryo (6x). Hela kroppen bilden av fisken består av två separata bilder tagna av konfokala och sydda tillsammans i Photoshop. Insets är hög förstoring (20x) av motsvarande boxed regioner (orange prickade områden). Dkvantitativ analys av makrofagcellsnummer i TG (MPEG1: GFP) och TG (fabp10a: il34; MPEG1: GFP) embryona lever (visas i den vita prickade området) och svans regionen (ungefär mellan den 13 och 17. somite, visas mellan två vita prickade linjer). Vänligen klicka här för att se en större version av denna siffra.

Figur 4: konfokala Live Imaging för att direkt observera makrofagbeteendet hos den stabila transgena fisken. Denna siffra har modifierats från Jiang et al.11. Micrographs av levande Imaging visar processen för en makrofager (grön, märkt av vita pilar) passerar i levern (röd) inom 28 min i kontroll fisk (a) och processen för en makrofager (grön, märkt av vita pilar) migrera in i levern (röd) inom 28 min i IL-34 överuttrycker fisk (B). Skalstreck = 40 μm (vit linje). Vänligen klicka här för att se en större version av denna siffra.

Kompletterande film 1: Live Imaging som visar processen för makrofager (grön, märkt av vita pilar) migrera in i levern (röd) inom 2 h i Il-34 överuttrycker fisk. Skalstreck = 20 μm (vit linje). Denna film har publicerats från Jiang et al.11. Vänligen klicka här för att se denna video. (Högerklicka för att ladda ned.)

Kompletterande film 2: Live Imaging som visar processen för makrofager (grön, märkt av vita pilar) vandra runt i levern (röd) inom 2 h i kontroll fisk. Skalstreck = 20 μm (vit linje). Denna film har publicerats från Jiang et al.11. Vänligen klicka här för att se denna video. (Högerklicka för att ladda ned.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Protokollet som beskrivs här tillåter oss att undersöka funktionen hos en Chemokine på beteendet hos macrophagein vivo och förfarandet kräver viss teknisk expertis. Sammanfattnings, det finns flera kritiska steg för att undvika komplikationer i protokollet: 1) Välj en lämplig transgena linje som visar specifika och starka transgena signalen att märka cellen av intresse; 2) Välj en lämplig vävnad som är tillgänglig för avbildning och transgena genöveruttryck. 3) gör en känslig och specifik RNA-sond; 4) Välj en lämplig observationstid fönster för att korrekt fånga cellens beteende.
I förfarandet för hela monteringen fluorescens in situ hybridisering kombinerat med immunofärgning, RNA-sonden används för att detektera genuttryck bör vara känslig och signalen måste vara stark nog. För att fånga gen funktionen på cellens beteende bör en serie tidspunkter testas. Till exempel, i observation av effekten av il34 på makrofagmigrering, även om fabp10a promotorn började uttrycka på 2-3 DPF, makrofager ackumulering i levern var inte uppenbart på den tiden. Det är endast av 4 DPF att berikningen av makrofagen i levern blir uppenbar. Dessutom, efter in situ hybridisering, kommer signalintensiteten av efterföljande immun färgning påverkas. Till exempel, jämföra med GFP, DsRed är svårt att färga i immunofluorescensfärgning efter in situ hybridisering, förmodligen på grund av de olika proteinstrukturer. Generellt sett skulle signalintensiteten hos immunofärgning efter hela monteringen fluorescens in situ hybridisering vara mindre än för enstaka immunofärgning.
I Live Imaging steg med konfokal Mikroskop, är det nödvändigt att hålla provet nära botten av skålen. När embryona flyter i aguppstod, kan arbetsavståndet för målet vara otillräckligt, också, det aguppstod mellan målet och urvalet skulle påverka kvaliteten på Imaging. Dessutom bör antalet prover för avbildning vid varje tidpunkt ställas in på rätt sätt. Man måste se till att tidsrymden mellan två skanningar av varje fisk inte skulle vara för lång tid att förlora detaljerna i cellens beteende. Så denna metod är inte lämplig för att spåra celler som rör sig snabbt i tjocka vävnader.
Sammanfattningsvis kan detta protokoll användas för att observera funktionen av chemokines på beteendet hos en mängd olika celler såsom makrofager, neutrofiler, och T-celler. Här använde vi Il-34, en nyligen identifierad ligand av CSF-1R funktion i chemotaxis6,7, som en ektopisk uttryckte Chemokine att framkalla makrofager migration. De flesta av de befintliga experimentella modellerna av cell chemotaxis är baserade på in vitro-cell experiment, men in vitro-experiment ibland är alltför enkel att modellera den komplexa miljön in vivo. Också, det är svårt att avbilda chemo-attraktionen abilityin vivo när helt enkelt titta på in vitro-situation. Denna metod utnyttjade de specifika fördelarna med zebrafiskar för direkt cell beteende observation som är svårt för möss. Den nuvarande metoden tillät oss att snabbt testa Chemokine funktioner på cell beteenden inom flera dagar och göra zebrafiskar en kraftfull modell för att studera molekyl-och cellbiologi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har inget att avslöja.
Acknowledgments
Vi tackar Dr Jingrong peng för att dela TG (fabp10a: DsRed) transgena linje; Dr. Zilong Wen för att dela TG (MPEG1: GFP) transgena linjer; Dr Koichi Kawakami för att tillhandahålla pTol2 Vector. Detta arbete stöddes av National Natural Science Foundation i Kina (31771594), Guangdong vetenskap och teknik plan projekt (2019A030317001) och de grundläggande forskningsfonderna för de centrala universiteten (D2191450).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



