Summary
生体内でのマクロファージ募集に対するケモカインの効果を試験するために、その位置ハイブリダイゼーション中のマウント全体を使用してケモカインの異所性発現を検出し、免疫染色を用いてマクロファージの標識を行った。ライブイメージングは、マクロファージ移行のリアルタイム観察に使用されました。
Abstract
ゼブラフィッシュは、基礎研究や生物医学研究で広く使用されています。多くのゼブラフィッシュトランスジェニックラインは、現在、様々なタイプの細胞に標識するために利用可能です。ゼブラフィッシュの透明な胚体のために、生体内の特定のタイプの細胞の挙動に対する1つのケモカインの影響を研究することは便利です。ここでは、生体内でのマクロファージ移行に関するケモカインの機能を調べるためのワークフローを提供した。IL-34を過剰発現させる組織特異的過剰発現プラスミドを構築し、マクロファージが蛍光タンパク質によって特異的に標識された1細胞段階のトランスジェニック魚胚にプラスミドを注入した。その後、その場で蛍光全体を使用し、ケモカイン発現のパターンとマクロファージの数または位置を検出した。注入されたWT胚を、安定なトランスジェニックラインを生成するために上げた。最後に、共焦点ライブイメージングを用いて、安定したトランスジェニック魚のマクロファージ挙動を直接観察し、生体内のマクロファージに対するIL-34の機能を調べた。
Introduction
ゼブラフィッシュは、インド発祥の小さな熱帯硬骨淡水魚です。遺伝子保全に関しては、ゼブラフィッシュはヒト1と87%の類似性を持つ。ゼブラフィッシュの遺伝子調節、タンパク質機能、細胞行動(マイブレーション、増殖et.alなどの細胞行動を研究することにより、ヒトの関連する主題に関する洞察を提供します。ゼブラフィッシュ胚は、色素を阻害した後、異なる段階で初期胚の発達を観察するために使用することができる。一方、ゼブラフィッシュが性的成熟に発展するまでに3ヶ月しかかからないうちに、ゼブラフィッシュは4日ごとに数百個の卵を産むことができる。ミニサイズ、単純な繁殖、強力な生殖能力、これらの利点は、ゼブラフィッシュ培養を非常に省スペースにし、大規模な培養に役立ちます。従来の哺乳類モデルマウスはゼブラフィッシュよりもメンテナンスコストが高いため、マウスの飼育の規模が制限されます。初期の胚の発達の側面では、マウス胚は母親の子宮におけるマウス胚の発達の特徴のために生きている状態で観察することは困難である。それどころか、ゼブラフィッシュ胚は外部から発達し透明であるため、顕微鏡下で観察しやすい。さらに、ゼブラフィッシュは、関連する遺伝子機能研究のための様々なトランスジェニックラインを構築することが非常に容易である。現在、様々なゼブラフィッシュトランスジェニックラインは、異なるタイプの細胞に標識するために利用可能である。特定の場所でケモカインを過剰発現させるトランスジェニックラインを構築し、ゼブラフィッシュの細胞挙動に関するケモカイン機能を研究することは、今や非常に便利です。
ここでは、ビボ2、3、4、5、6、7におけるマクロファージ挙動に対するIL-34の機能を調べるためにゼブラフィッシュトランスジェニックラインを使用するワークフローを提供した。まず、遺伝子il34の肝臓特異的過剰発現プラスミドを構築し、蛍光タンパク質GFPによりマクロファージを特異的に標識した1細胞ステージTg(mpeg1:GFP)魚胚にプラスミドを注入した。次いで、その場で蛍光マウント全体を使用し、il34発現のパターンとマクロファージの数または位置を検出した。注入されたWT胚を、安定なトランスジェニックラインを生成するために上げた。これらのステップでは、サイトカイン産生ラインを確立し検証し、マクロファージ分布に及ぼす影響を視覚的に評価しました。最後に、サイトカインに応答するマクロファージの挙動を調べ、共焦点ライブイメージングを用いてマクロファージ移行を直接観察し、生体内のマクロファージ移行におけるil34の機能を確認した。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注:全ての試料をフェニルチオール(PTU)卵水で処理し、色素を抑制した。
1. Tgの生成 (fabp10a:il34) トランスジェニックコンストラクトと魚の注入
- ゼブラフィッシュの2.8kb fabp10aプロモーター8およびIL-34コード領域(ENSDART0000126460.3)をpTol2ベクターにクローンし、fabp10a-il34構築物を生成する。1細胞ステージTg(mpeg1:GFP)およびWT魚胚にトランスポザーゼmRNAと共に構築物を注入する。 fabp10a-il34注入されたWT胚を成人9に上げ、その場所のハイブリダイゼーションによってトランスジェニックの創始者を同定する。
注:他のトランスジェニックラインが同じトランスポゾンシステムで作られると、Tol2構築物を別のトランスジェニックに直接注入することは問題になる可能性があります。一般的なプラクティスは、独立したトランスジェニックラインを作成し、その後、別のレポーターラインと新しいラインを横断することです。これにより、以前に挿入されたトランスジーンに対する新しいトランスジェネシスの影響がないことを保証します。
2. 蛍光全山インシチュアライブリゼーション(WISH)と免疫染色と組み合わせる
- サンプル固定
- 所望の段階でTg(mpeg1:GFP)と交差した一過性注射または安定なIL-34トランスジェニックラインの胚を収集する。
注:この場合、胚を4d後受精(dpf)で採取した。(必要に応じて)注射器で絨間ゾンを取り除く。 - 胚を4%パラホルムアルデヒド(PFA)で一晩4°Cまたは室温(RT)(約25°C)で2時間固定します。
- 胚をリン酸緩衝生理食生に加えて100(PBST)3x 5分で洗う。
- PBST(50%メタノール/PBST)と100%メタノール、それぞれ1x 5分で胚を別々に脱水します。その後、新鮮な100%メタノールに変更し、-20°C(少なくとも2時間)で保存します。
注:プロトコルはここで一時停止できます。
- 所望の段階でTg(mpeg1:GFP)と交差した一過性注射または安定なIL-34トランスジェニックラインの胚を収集する。
- プローブハイブリダイゼーション(1日目)
- PBST(50%メタノール/PBST)で50%メタノールで前の工程で胚を水分補給し、PBST 3x 5分で洗浄します。
- RTでPBSTでプロテパナーゼKで胚を消化する(最終濃度:10 μg/mL、PBSTで1:2000)。
注:消化時間は胚の段階に依存します:36時間未満の受精後(hpf)、必要ありません。36 hpf-2 dpf胚, 3-5 分;2-3 dpf胚, 10 分;3-4 dpf胚,15分;4-5 dpf胚, 15-20 分;5-6 dpf胚, 20-27 分;>6 dpf胚、RTで25〜30分(約25°C)。 - 消化溶液を廃棄し、RTで20分間、4%のPFAで再度固定を行います。
- 胚をPBST 2x 10分で洗います。
- PBSTを廃棄し、65°Cで加熱ハイブリダイゼーションバッファ(HBバッファ)を用いてハイブリダイゼーション前に5分間行い、HBバッファを元のチューブにリサイクルする。
- 新しい加熱HBバッファーを65°Cで少なくとも1時間でハイブリダイゼーションする前ハイブリダイゼーションを行います。
- プローブ9を予熱し(この場合はil34プローブ、1ng/mL)を65°Cで少なくとも10分間加熱する。次に、HB バッファを元のチューブにリサイクルします。一晩65°Cで予熱プローブでハイブリダイゼーションを行います。
- 抗体治療(第二日目)
- 50%のホルミド/2x生理食塩水ナトリウムと12en 20(SSCT)、2x SSCT、65°Cで0.2x SSCTを予熱します。
- プローブを元のチューブにリサイクルし、-20 °Cにプローブを保管します。
- 50%のホルムアミド/2x SSCTで胚を別々に洗う。2x SSCT;0.2x SSCT、3x 20分または65 °Cでそれぞれ2x 30分。
- PBST 3x 5分で胚を洗います。
- 600 μL のブロッキングバッファー(PBST で 5% 濾過された胎児ウシ血清(FBS))を RT で 1 時間ブロックします。
- 抗ジゴキシゲニン-HRP抗体溶液(ブロッキングバッファーに1:1,000-1:2,000)を400μL追加し、胚を一晩4°Cでインキュベートします。シグナルが弱い場合は、1:500の抗体希釈を使用してください。
- 着色および一次抗体インキュベート(日III)
- 抗体を取り除きます。RTでPBST、6x 20分で胚を洗浄します。
- RTで5分間、1xプラス増幅希釈剤の30 μLでサンプルをすすいでください。
- ピペッティングアウトによって希釈剤を廃棄します。希釈フルオロフォアタイラミドストックソリューション(シアニン3プラス増幅試薬(Cy3)またはシアニン5プラス増幅試薬(Cy5)、この場合Cy3を使用した場合、1xプラス増幅希釈剤で1:50を1xプラス増幅希釈剤を作り出す。各サンプルに対して50~100μLの作業溶液を準備します。
- RTで暗闇の中で5〜15分間、フルオロフォアタイラミドワーキングソリューションでサンプルをインキュベートします。信号が弱い場合は、インキュベーション時間を30分に延長します。
- PBSTで作業溶液を変更して反応を停止し、信号を調べます。
- RTでPBST 3x 10分で胚を洗います。
- 一次抗体で試料を一晩4°Cでインキュベートします。この場合、ヤギ-抗GFP抗体を一次抗体として使用してください。
- 二次抗体染色(IV日目)
- 胚をPBSTで4x 30分間洗います。
- 胚を二次抗体で一晩4°Cでインキュベートする。この場合、二次抗体としてAlexa 488-抗ゴート抗体を使用してください。
- 写真を撮る(日V)
- RTでPBST 3x 10分で胚を洗います。
- 胚を一晩4°Cまたは-20°Cで暗く70%グリセロールに保存します。
3. ライブイメージング
-
サンプル選択
注:ライブ画像を使用して、Tg(fabp10a:il34; fabp10a: DsRed; mpeg1: GFP)魚が3-3.5 dpfの間にIL-34誘導下で肝臓に移行するかどうかを直接観察します。 ここでは、Tg(fabp10a-DsRed)トランスジェニックラインは、肝臓領域にラベルを付け、それを可視化するために使用され、肝臓の局在化を容易にし、マクロファージが肝臓に移行するかどうかを決定する。 イメージングの前に、蛍光顕微鏡を使用してDsRedおよびGFPの二重陽性胚を選択する。 -
魚の取り付け
- 金属風呂を使用して、1%低溶融アガロースの1mLを90°C以上に加熱し、完全に溶かします。
- 低融解アガロースを体温まで冷却した後、0.2%トリカインの50μLを加え、トリカインとアガロースを均一に混合します。
- 麻酔された胚を底部にカバースライドを取り付けた小皿に移動し、周囲の水を取り除き、ゆっくりと胚に低溶融アガロースを落とし、アガロースが固まる前に魚の位置を慎重に設定し、肝領域を近くに保つ皿の底のカバースライド。
- 低溶融アガロースが固化した後、慎重にそれを補強するためにアガロースの別の層でそれをカバーします。
- 皿を共焦点顕微鏡キャリアテーブルの上に置き、トリカインでE2溶液10で魚を覆い、イメージングを開始する。
-
共焦点顕微鏡のソフトウェア動作
- ZENブラック2.3ソフトウェアを開き、生きている細胞ワークベンチを顕微鏡キャリアテーブルに取り付けます。
- [検索]をクリックします |インキュベーション|温度を29°Cに設定する。
- 生細胞ワークベンチの中央に皿を置き、トリカインでE2溶液10で魚を覆う。
- [取得]メニューをクリックし、[スマート セットアップ]メニューで必要なスキャン モードとレーザーを選択し、[Zスタックと位置]を選択します。
- [テスト デザイナ]メニューをクリックし、[マルチブロック実験を有効にする] を選択し、最初のブロックで低倍率の下でサンプルを見つけ、高倍率に切り替えて、視野の中央に観測領域を表示します。
- 位置とZスタック情報を設定し、適切なレーザー強度、走査層および画像速度を選択する。
- 新しいブロックを作成し、上記の手順を繰り返します。すべてのブロックを設定した後、適切な数のループを設定し、記録を開始します(図1)。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ゼブラフィッシュのプロトコルに関与する手順を図2に示します。まず、il34がfabp10aプロモーターによって駆動されたpBLK-fabp10a-il34-sv40コンストラクトを生成した(図2)。この構築物を、トランスジェニック安定線を生成するために成人に提起したGFPおよびWT胚でマクロファージに標識できるゼブラフィッシュ胚(mpeg1:GFP)にマイクロ注入した(図2)。il34の発現は、その中の蛍光全体によって分析された(図2および図3)。GFPによって標識されたマクロファージを免疫染色により分析した(図2および図3)。ライブイメージングを使用して、マクロファージが3-3.5 dpfの間にil34誘導の下で肝臓に移行するかどうかを直接観察しました(図2、図4、補足ムービー1、補足ムービー2).
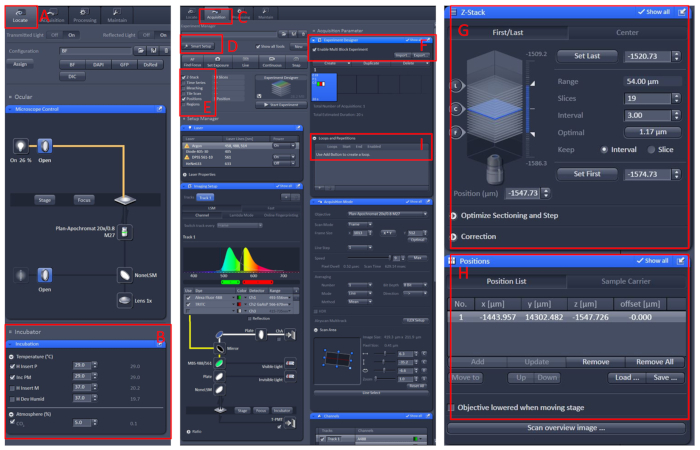
図1:共焦点顕微鏡ライブイメージングのソフトウェア動作。ZENブラック2.3ソフトウェアを開き、生きているセルワークベンチを顕微鏡キャリアテーブルに取り付け、[検索(A)] をクリックします 。インキュベーション|温度(B)温度を29°Cに設定する。生細胞ワークベンチの中央に皿を置き、トリカインでE2溶液10で魚を覆う。これらすべての後、[取得(C)]メニューをクリックし、スマートセットアップ(D)メニューで必要なスキャンモードとレーザーを選択し、Zスタックと位置(E)を選択します。最後に、実験デザイナ(F)メニューをクリックし、[マルチブロック実験を有効にする]を選択し、最初のブロックで、低倍率の下でサンプルを見つけてから、高倍率に切り替えて、観測領域を視野の中心は、位置とZスタック(GおよびH)情報を設定し、適切なレーザー強度、走査層および画像速度を選択する。新しいブロックを作成し、上記の手順を繰り返します。すべてのブロックを設定した後、適切な数のループ(I)を設定し、記録を開始します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:生体内でのマクロファージ移行におけるケモカインの機能を調べるためのワークフロー。IL-34を過剰発現させる組織特異的(肝臓)過剰発現プラスミドを構築し、マクロファージが蛍光タンパク質によって特異的に標識された1細胞段階のトランスジェニック魚胚にプラスミドを注入した(Tg: (mpeg1: GFP))).注入されたWT胚を、安定なトランスジェニックラインを生成するために上げた。次に、その場ハイブリダイゼーションおよび免疫染色における全マウント蛍光を用いて、一過性注入胚または安定ライン胚(4dpf)の遺伝子発現のパターンおよびマクロファージの数または位置を検出した。最後に、共焦点ライブイメージングを用いて、安定なトランスジェニック魚(3-3.5 dpf)におけるマクロファージの挙動を直接観察し、生体内のマクロファージにおけるIL-34の機能を調べた。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:蛍光WISHは免疫染色と組み合わせる。この図は、Jiang et al.11から変更されています。pBLK-fabp10a-il34-sv40構築物の合計1.8nL(30ng/μL)を、1細胞ステージTg(mpeg1:GFP)ゼブラフィッシュ胚にマイクロ注入した。(A)4dpf胚(6倍)におけるGFP発現(緑色)のil34発現(赤)及び全マウント抗体染色のWISH。魚の全身の画像は、共焦点によって撮影され、Photoshopで一緒にステッチされた2つの別々の画像で構成されています。インセットは、対応するボックス化された領域(オレンジ色の点線領域)の高倍率(20倍)です。(B)未注入でマクロファージ細胞数を定量的に分析し、注入された胚の肝臓(白い点線領域に示す)と尾部領域(約13番目と17番目のソマイトの間で、2つの白い点線の間に示す)を構築する。データは、コントロールと比較して、マンホイットニーUテスト、** p <0.01によって分析されました。n = 5, 5 を注入し、魚を制御する 4 dpf.バー:200 μm(白線)。50 μm (黄色の線)。(C)4dpf安定線胚(6倍)におけるGFP発現のil34発現及び全マウント抗体染色のWISH。魚の全身の画像は、共焦点によって撮影され、Photoshopで一緒にステッチされた2つの別々の画像で構成されています。インセットは、対応するボックス化された領域(オレンジ色の点線領域)の高倍率(20倍)です。(D)Tg(mpeg1:GFP)およびTg(fabp10a:il34;mpeg1:GFP)胚の肝臓(白い点線領域に示す)と尾部領域(およそ13日の間)におけるマクロファージ細胞数の定量的分析そして17番目のソミテ、2つの白い点線の間に示す)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:安定なトランスジェニック魚におけるマクロファージの挙動を直接観察する共焦点ライブイメージング。この図は、Jiang et al.11から変更されています。ライブイメージングの顕微鏡写真は、コントロール魚(A)で28分以内に肝臓(赤)を通過するマクロファージ(緑色、白い矢印で標識された)のプロセスと、28年以内に肝臓(赤色)に移行するマクロファージ(緑色、白い矢印でラベル付け)のプロセスを示しています。IL-34の分は魚(B)を過剰発現する。スケールバー = 40 μm (白線)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

補足ムービー1:IL-34の過剰発現魚において2時間以内に肝臓(赤色)に移行するマクロファージ(緑色、白い矢印で標識)のプロセスを示すライブイメージング。スケールバー = 20 μm (白線)。この映画は、Jiangら11から再公開されました。このビデオを見るにはここをクリックしてください。(右クリックしてダウンロードしてください。

補足ムービー2:マクロファージ(緑色、白い矢印で標識)がコントロール魚で2時間以内に肝臓(赤色)の周りをさまよっているプロセスを示すライブイメージング。スケールバー = 20 μm (白線)。この映画は、Jiangら11から再公開されました。このビデオを見るにはここをクリックしてください。(右クリックしてダウンロードしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ここで説明するプロトコルは、マクロファージン生体内の挙動に関するケモカインの機能を調べ、手順にはいくつかの技術的専門知識を必要とします。要約すると、プロトコルの合併症を避けるためにいくつかの重要なステップがあります:1)目的の細胞にラベルを付けるために、特定の強いトランスジェニック信号を示す適切なトランスジェニックラインを選択します。2)イメージングおよびトランスジェニック遺伝子過剰発現のためにアクセス可能な適切な組織を選択します。3)敏感で特定のRNAプローブを作ります。4)セルの挙動を正確にキャプチャするために、適切な観察時間枠を選択します。
免疫染色と組み合わせたその位置ハイブリダイゼーションにおける全マウント蛍光の手順では、遺伝子発現を検出するために使用されるRNAプローブは感度が高く、シグナルは十分に強くする必要があります。細胞の挙動に関する遺伝子機能を捕捉するためには、一連の時点をテストする必要があります。例えば、マクロファージ移行に対するil34の効果を観察する上で、fabp10aプロモーターは2〜3 dpfで発現し始めたが、肝臓におけるマクロファージ蓄積は当時明らかではなかった。肝臓のマクロファージの濃縮が明らかになるのは4dpfだけである。さらに、その後のハイブリダイゼーション後、その後の免疫染色のシグナル強度が影響を受ける。例えば、GFPと比較すると、DsRedは、おそらく異なるタンパク質構造のため、その場所のハイブリダイゼーション後の免疫蛍光染色において着色することが困難である。一般的に言えば、その中で蛍光を全て取り付けた後の免疫染色のシグナル強度は、単一の免疫染色のシグナル強度よりも小さくなるであろう。
共焦点顕微鏡を用いたライブイメージング工程では、試料を皿の底部に近づける必要がある。胚がアガロースに浮かぶと、目的の作業距離が不十分であり、また、目的とサンプルの間のアガロースがイメージングの質に影響を与える。また、各時間のイメージング用サンプル数を適切に設定する必要があります。1つは、各魚の2つのスキャンの間の時間のスパンが細胞の行動の詳細を失うには長すぎないようにする必要があります。したがって、この方法は、厚い組織で速く移動する細胞を追跡するのに適していません。
結論として、このプロトコルは、マクロファージ、好中球、およびT細胞などの様々な細胞の挙動に関するケモカインの機能を観察するために使用することができる。ここでは、ケモタキシス6、7におけるCSF-1R機能の最近同定されたリガンドであるIL-34を、マクロファージ移行を誘導する異所性発現ケモカインとして用いった。細胞化学タキシスの既存の実験モデルのほとんどはインビトロ細胞実験に基づいていますが、インビトロ実験はインビボで複雑な環境をモデル化するには単純すぎる場合があります。また、インビトロの状況を見るだけでは、生体内での化学的魅力をイメージすることは困難です。この方法は、マウスにとって困難である直接細胞挙動観察のためにゼブラフィッシュの特定の利点を利用した。現在の方法では、数日以内に細胞挙動に関するケモカイン機能を迅速にテストし、ゼブラフィッシュを分子生物学と細胞生物学を研究する強力なモデルにすることができました。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者は何も開示していない。
Acknowledgments
私たちは、Tg(fabp10a:DsRed)トランスジェニックラインを共有するためのジンロンペン博士に感謝します。Tg(mpeg1:GFP)トランスジェニックラインを共有するためのジロン・ウェン博士。pTol2ベクターを提供する川上浩一博士。この研究は、中国国家自然科学財団(31771594)、広東科学技術計画プロジェクト(2019A030317001)、中央大学基礎研究基金(D2191450)によって支援されました。
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



