Summary
Om het effect van een Chemokine op macrofaag werving in vivo te testen, werd de hele mount in situ-hybridisatie gebruikt om de ectopische uitdrukking van de Chemokine te detecteren en werd immunokleuring gebruikt om macrofagen te labelen. Live Imaging werd gebruikt voor real-time observatie van macrofaag migratie.
Abstract
Zebravis wordt veel gebruikt in het basis-en biomedisch onderzoek. Veel zebravis transgene lijnen zijn momenteel beschikbaar om verschillende soorten cellen te labelen. Door het transparante embryonale lichaam van zebravis is het voor ons handig om het effect van één Chemokine op het gedrag van een bepaald type cellen in vivo te bestuderen. Hier hebben we een workflow gegeven om de functie van een Chemokine op macrofaag migratie in vivo te onderzoeken. We bouwden een Weefselspecifieke overexpressie plasmide om de IL-34 te overdrukken en injecteerde het plasmide in ééncellige transgene visembryo's waarvan de macrofagen specifiek werden gelabeld door een fluorescerend eiwit. Vervolgens gebruikten we hele Mount fluorescerende in-situ hybridisatie en immunokleuring om het patroon van de Chemokine expressie en het aantal of de locatie van macrofagen op te sporen. De geïnjecteerde WT-embryo's werden verhoogd om een stabiele transgene lijn te genereren. Tot slot gebruikten we confocale Live beeldvorming om het macrofaag gedrag in de stabiele transgene vis direct te observeren om de functie van IL-34 op macrofagen in vivo te bestuderen.
Introduction
Zebravis is een kleine tropische zoet water vis afkomstig uit India. Wat betreft het behoud van genen, zebravis hebben een gelijkenis van 87% voor de menselijke1. Het kan ons inzicht geven in Verwante onderwerpen van mensen door het bestuderen van de genregulatie, eiwit functie en Celgedrag zoals migratie, proliferatie et.al in zebravis. Zebravis embryo kan worden gebruikt om de ontwikkeling van vroege embryo's in verschillende stadia na remming van pigment te observeren. Ondertussen duurt het slechts drie maanden voordat zebravis zich tot seksuele volwassenheid ontwikkelt, waarna de zebravissen elke 4 dagen honderden eieren kunnen produceren. Mini formaat, eenvoudige fokkerij, sterke reproductieve capaciteit, deze voordelen maken zebravis cultuur zeer ruimtebesparend, bevorderlijk voor grootschalige cultuur. Het traditionele zoogdier model muis heeft hogere onderhoudskosten dan zebravis, waardoor de schaal van muis verhoging wordt beperkt. In het aspect van de vroege embryo ontwikkeling is muis embryo moeilijk te observeren in levende toestand als gevolg van de kenmerken van de ontwikkeling van muizen embryo's in de moeder baarmoeder. Integendeel, zebravis embryo's ontwikkelen zich extern en zijn transparant, daarom zijn ze gemakkelijk te observeren onder een microscoop. Bovendien is zebravis heel eenvoudig om een verscheidenheid aan transgene lijnen te construeren voor gerelateerd genfunctieonderzoek. Momenteel zijn verschillende zebravis transgene lijnen beschikbaar om verschillende soorten cellen te labelen. Het is nu erg handig om transgene lijnen te construeren om chemokines op specifieke locaties te overdrukken en de chemokines-functie op Celgedrag in zebravis te bestuderen.
Hier hebben we een workflow voor het gebruik van zebravis transgene lijn voor het onderzoeken van de functie van Il-34 op macrofaag gedrag in vivo2,3,4,5,6,7. Ten eerste bouwden we een leverspecifieke overexpressie plasmide van het gen il34 en injecteerde het plasmide in ééncellige fase TG (MPEG1: GFP) visembryo's die specifiek de macrofagen met fluorescerende proteïne GFP gelabeld. Vervolgens gebruikten we hele Mount fluorescerende in-situ hybridisatie en immunokleuring om het patroon van de il34 expressie en het aantal of de locatie van macrofagen te detecteren. De geïnjecteerde WT-embryo's werden verhoogd om een stabiele transgene lijn te genereren. In deze stappen hebben we de cytokine-producerende lijn vastgesteld en gevalideerd en visueel beoordeeld welke effecten kunnen worden gezien op de macrofaag verdeling. Tot slot, om het macrofaag gedrag te onderzoeken in reactie op de cytokine, gebruikten we confocale Live Imaging om direct de macrofaag migratie te observeren om de functie van il34 op de macrofaag migratie in vivo te bevestigen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Opmerking: Alle monsters werden behandeld met fenylthiourea (PTU) Eier water om pigment te remmen.
1. generatie van TG (fabp10a: il34) transgene constructies en visinjectie
- Kloon de 2,8 KB fabp10a promotor8 en de Il-34 CODERINGS gebieden (ensdart 00000126460.3) van zebravis in de pTol2 vector om de fabp10a-il34 constructie te genereren. Injecteer de constructies in eencellige fase TG (MPEG1: GFP) en WT vissen embryo's samen met de Transposase mRNA. Verhoog de fabp10a-il34 geïnjecteerde WT-embryo's tot volwassen9 en Identificeer de transgene oprichter door in-situ hybridisatie.
Opmerking: De injectie van de Tol2 construct direct in een andere transgene kan problematisch zijn als de andere transgene lijn wordt gemaakt met hetzelfde transposon systeem. Een algemene praktijk zou zijn om een onafhankelijke transgene lijn te maken en vervolgens de nieuwe lijn over te steken met een andere reporter lijn. Dit zorgt ervoor dat er geen effecten zullen zijn van de nieuwe Transgenese op een eerder ingebracht transgene.
2. fluorescerende hele mount in situ hybridisatie (WISH) combineren met immunokleuring
- Monster fixatie
- Verzamel embryo's van voorbijgaande injectie of stabiele IL-34 transgene lijn die gekruist met TG (MPEG1: GFP) in de gewenste stadia.
Opmerking: In dit geval werden de embryo's verzameld bij 4 d post fertilisatie (DPF). (Indien nodig) Verwijder de chorion per spuit. - Bevestig de embryo's met 4% Paraformaldehyde (PFA) 's nachts bij 4 °C of 2 uur bij kamertemperatuur (RT) (ongeveer 25 °C).
- Was de embryo's met fosfaatgebufferde zoutoplossing plus tween 20 (PBST) 3x 5 min.
- Dehydraat de embryo's afzonderlijk met 50% methanol in PBST (50% methanol/PBST) en 100% methanol, 1x 5 min per stuk. Vervolgens verandert u in vers 100% methanol en bewaart u bij-20 °C (minimaal 2 uur).
Opmerking: Het protocol kan hier worden onderbroken.
- Verzamel embryo's van voorbijgaande injectie of stabiele IL-34 transgene lijn die gekruist met TG (MPEG1: GFP) in de gewenste stadia.
- Sonde hybridisatie (dag I)
- Hydrateer de embryo's in de voorgaande stappen met 50% methanol in PBST (50% methanol/PBST) en was vervolgens met PBST 3x 5 min.
- Verteren de embryo's met proteïnase K in PBST bij RT (eindconcentratie: 10 μg/ml; 1:2000 in PBST).
Opmerking: Digestie tijd is afhankelijk van het stadium van de embryo's: minder dan 36 h post bemesting (HPF), geen behoefte; 36 HPF-2 DPF embryo, 3-5 min; 2-3 DPF embryo, 10 min; 3-4 DPF embryo, 15 min; 4-5 DPF embryo, 15-20 min; 5-6 DPF embryo, 20-27 min; > 6 DPF embryo, 25-30 min bij RT (ongeveer 25 °C). - Gooi de digestie oplossing weg en voer de fixatie opnieuw uit met 4% PFA, gedurende 20 min bij RT.
- Was de embryo's met PBST 2x 10 min.
- Gooi de PBST weg, voer pre-hybridisatie uit met verwarmde hybridisatie buffer (HB-buffer) bij 65 °C gedurende 5 minuten, Recycle de HB-buffer in de originele buis.
- Voer pre-hybridisatie uit met de nieuwe verwarmde HB-buffer bij 65 °C ten minste 1 uur.
- Verwarm de sonde9 (voor dit geval was een il34 sonde, 1 ng/ml) bij 65 °c ten minste 10 min. Recycle de HB-buffer vervolgens in de originele buis. Voer met de voorverwarmde sonde bij een nacht van 65 °C hybridisatie uit.
- Behandeling van antilichamen (dag II)
- Verwarm de 50% formamide/2x Saline Natriumcitraat plus tween 20 (SSCT), 2x SSCT, 0.2 x SSCT bij 65 °C.
- Recycle de sonde in de originele buis en bewaar de sonde bij-20 °C.
- Was de embryo's afzonderlijk met 50% formamide/2x SSCT; 2x SSCT; 0.2 x SSCT, 3x 20 min of 2x 30 min elk bij 65 °C.
- Was de embryo's met PBST 3x 5 min.
- Blokkeer de monsters met 600 μL blokkerende buffer (5% gefilterd foetaal runderserum (FBS) in PBST) gedurende 1 uur bij RT.
- Voeg 400 μL anti-digoxigenin-HRP-antilichaam oplossing (1:1000-1:2000 in blokkerende buffer) toe en inbroed de embryo's bij 4 °C 's nachts. Als signalen zwak zijn, gebruik 1:500 verdunning van antilichamen.
- Inkleuring en primair antilichaam drachtige (dag III)
- Verwijder het antilichaam; was de embryo's met PBST, 6x 20 min bij RT.
- Spoel het monster met 30 μL 1x plus versterkings verdunningsmiddel gedurende 5 minuten bij RT.
- Gooi het verdunningsmiddel weg door het pipetteren; verdunde Fluorophore Tyramide stamoplossing (Cyanine 3 plus versterkings reagens (Cy3) of Cyanine 5 plus versterkings reagens (Cy5), voor dit geval Cy3 werd gebruikt) 1:50 in 1x plus versterkings verdunningsmiddel om de Fluorophore Tyramide werkoplossing te maken. Bereid voor elk monster 50-100 μL werkoplossing voor.
- Inincubeer het monster in de werkoplossing Fluorophore Tyramide voor 5-15 min in het donker bij RT. Als de signalen zwak zijn, verlengt u de incubatietijd tot 30 minuten.
- Stop de reactie door de werkoplossing met PBST te veranderen en de signalen te onderzoeken.
- Was de embryo's met PBST 3x 10 min bij RT.
- Incuberen het monster met primair antilichaam bij 4 °C 's nachts. Gebruik voor dit geval het Goat-anti-GFP-antilichaam als primair antilichaam.
- Secundaire antilichaam kleuring (dag IV)
- Was de embryo's met PBST 4x 30 min.
- Incuberen de embryo's met secundair antilichaam bij 4 °C 's nachts. Voor dit geval, gebruik Alexa 488-anti-geiten antilichaam als het secundaire antilichaam.
- Foto's maken (dag V)
- Was de embryo's met PBST 3x 10 min bij RT.
- Bewaar de embryo's in 70% glycerol in het donker bij 4 °C 's nachts of-20 °C langer.
3. live beeldvorming
-
Voorbeeld selecteren
Opmerking: gebruik het live-beeld om direct te observeren of macrofagen van TG (fabp10a: Il34; fabp10a: DSRED; MPEG1: GFP) vis zou migreren naar de lever onder Il-34 inductie tijdens 3-3.5 DPF. Hier wordt de TG (Fabp10a-dsred) transgene lijn gebruikt om de lever regio te labelen en zichtbaar te maken, om de lokalisatie van de lever te vergemakkelijken en om te bepalen of macrofagen migreren naar de lever. Gebruik vóór de beeldvorming een fluorescentiemicroscoop om de dubbele positieve embryo's van DsRed en GFP te selecteren. -
Vis montage
- Gebruik een metaalbad om 1 mL van 1% laag smelt agarose te verwarmen tot boven 90 °C om het volledig te smelten.
- Na de lage smelt agarose wordt gekoeld tot lichaamstemperatuur, voeg 50 μL van 0,2% tricaïne, en gelijkmatig mengen tricaïne met de agarose.
- Verplaats de verdoofd embryo's naar een klein gerecht gemonteerd met een afdekplaat op de bodem, verwijder het omringende water, laat langzaam de lage smelt agarose op de embryo's vallen, stel de positie van de vis zorgvuldig in voordat de agarose wordt gestijgd, houd het levergebied dicht bij de afdekking schuift op de bodem van de schaal.
- Nadat de lage smelt agarose is gestomgd, zorgvuldig bedekken met een andere laag van agarose om het te versterken.
- Plaats het gerecht op de confocale Microscoop drager tafel, bedek de vis met de E2-oplossing10 met tricaïne en begin met beeldvorming.
-
Software werking van de confocale Microscoop
- Open de Zen black 2,3 -software, installeer de Living Cell Workbench op de Microscoop drager tafel.
- Klik op zoeken | Incubatie | Temperatuur om de temperatuur op 29 °c te zetten.
- Plaats het gerecht in het midden van de Living Cell Workbench, bedek de vis met de E2-oplossing10 met tricaïne.
- Klik op het menu acquisitie , selecteer de gewenste scanmodus en lasers in het Smart Setup -menu en selecteer vervolgens Z-stack en Position.
- Klik op het menu experiment ontwerper , selecteer multi-blok experiment inschakelen, in het eerste blok, om het monster onder de lage vergroting te vinden en schakel vervolgens over naar de hoge vergroting, laat het waargenomen gebied in het midden van het gezichtsveld staan.
- Stel de positie en Z-stack informatie in, selecteer de juiste laserintensiteit, scan lagen en imaging snelheid.
- Maak een nieuw blok en herhaal de bovenstaande stappen. Stel na het instellen van alle blokken het juiste aantal lussen in en start de opname (Figuur 1).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De stappen in het Protocol van zebravis worden geïllustreerd in Figuur 2. Eerst genereerden we de pBLK-fabp10a-il34-SV40 construct waarin il34 werd gedreven door de Fabp10a Promoter (Figuur 2). De constructie werd microgeïnjecteerd in eencellige fase TG (MPEG1: GFP) zebravis embryo's die macrofagen kunnen labelen met GFP en WT embryo's die aan volwassenen werden verhoogd om transgene stabiele lijn te genereren (Figuur 2). De uitdrukking van il34 werd geanalyseerd door hele Mount fluorescentie in situ hybridisatie (Figuur 2 en Figuur 3). Macrofagen gelabeld door GFP werden geanalyseerd door immunokleuring (Figuur 2 en Figuur 3). We gebruikten Live Imaging om direct te observeren of macrofagen in de lever zouden migreren onder de il34 -inductie tijdens 3-3.5 DPF (Figuur 2, Figuur 4, aanvullende film 1 en aanvullende film 2) .
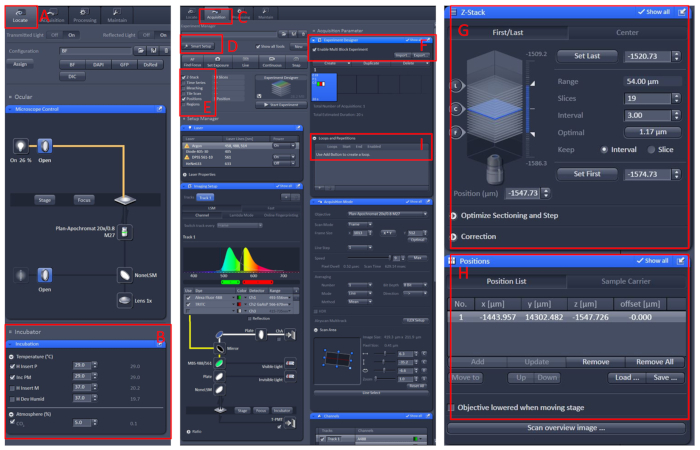
Figuur 1: software werking van de confocale Microscoop Live Imaging. Open de Zen black 2,3 -software, installeer de Living Cell Workbench op de tabel van de Microscoop drager en klik vervolgens op zoeken (A) | Incubatie | Temperatuur B) de temperatuur wordt ingesteld op 29 °c. Plaats het gerecht in het midden van de Living Cell Workbench, bedek de vis met de E2-oplossing10 met tricaïne. Klik na al deze opties op het menu acquisitie (C), selecteer de gewenste scanmodus en lasers in het menu Smart Setup (D) en selecteer Z-stack en Position (E). Klik ten slotte op het menu experiment ontwerper (F), selecteer het multi blok-experiment inschakelen, in het eerste blok, om het monster onder de lage vergroting te vinden en schakel vervolgens over naar de hoge vergroting, laat het waargenomen gebied in de midden van het gezichtsveld, stel de positie en Z-stack (G en H) informatie in, selecteer de juiste laserintensiteit, scan lagen en imaging snelheid. Maak een nieuw blok en herhaal de bovenstaande stappen. Nadat u alle blokken hebt ingesteld, stelt u het juiste aantal lussen in (I) en start u de opname. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 2: een workflow om de functie van een Chemokine op macrofaag migratie in vivo te onderzoeken. We bouwden een weefsel-specifieke (lever) overexpressie plasmide tot vertonen Il-34 en injecteerde het plasmide in ééncellige transgene visembryo's waarvan de macrofagen specifiek werden gelabeld door een fluorescerend eiwit (TG: (MPEG1: GFP )). De geïnjecteerde WT-embryo's werden verhoogd om een stabiele transgene lijn te genereren. Vervolgens gebruikten we hele Mount fluorescerende in-situ hybridisatie en immunokleuring om het patroon van de genexpressie en het aantal of de locatie van macrofagen van de voorbijgaande geïnjecteerde embryo's of stabiele lijn embryo's (4 DPF) te detecteren. Tot slot gebruikten we confocale Live beeldvorming om het macrofaag gedrag in de stabiele transgene vis (3-3.5 DPF) direct te observeren om de functie van IL-34 op macrofagen in vivo te bestuderen. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 3: fluorescerende wens gecombineerd met immunokleuring. Dit cijfer is gewijzigd van Jiang et al.11. Een totaal van 1,8 nL (30 ng/μL) van de pBLK-fabp10a-il34-SV40 construct werd microgeïnjecteerd in eencellige fase TG (MPEG1: GFP) zebravis embryo's. A) wens van il34 expressie (rood) en antilichaam kleuring van de GFP-uitdrukking (groen) in 4 DPF-embryo (6x). Het hele lichaam foto van de vis bestaat uit twee afzonderlijke beelden genomen door confocale en samen gestikt in Photoshop. Insets zijn een hoge vergroting (20x) van de corresponderende boxed gebieden (oranje gestippelde gebieden). B) kwantitatieve analyse van macrofaag cellen in de niet-geïnjecteerde en construct geïnjecteerde embryo's (in het witte gestippelde gebied) en het staart gebied (ongeveer tussen de 13e en 17e Somiet, afgebeeld tussen twee witte stippellijnen). De gegevens werden geanalyseerd door Mann Whitney U test, * * p < 0,01 vergeleken met controle. n = 5,5 voor de 4 DPF geïnjecteerd en controle vissen. Staven: 200 μm (witte lijn); 50 μm (gele lijn). C) wens van il34 expressie en antilichamen voor de gehele montage van GFP-expressie in 4 DPF-stabiele lijn embryo (6x). Het hele lichaam foto van de vis bestaat uit twee afzonderlijke beelden genomen door confocale en samen gestikt in Photoshop. Insets zijn een hoge vergroting (20x) van de corresponderende boxed gebieden (oranje gestippelde gebieden). D) kwantitatieve analyse van macrofaag cellen in TG (MPEG1: GFP) en TG (fabp10a: il34; MPEG1: GFP) de lever van embryo's (weergegeven in het witte gestippelde gebied) en het staart gebied (ongeveer tussen de 13e en 17e Somiet, weergegeven tussen twee witte stippellijnen). Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 4: confocale Live beeldvorming om het macrofaag gedrag in de stabiele transgene vis direct te observeren. Dit cijfer is gewijzigd van Jiang et al.11. Micro grafieken van Live Imaging tonen het proces van een macrofaag (groen, gelabeld door witte pijlen) passeren van de lever (rood) binnen 28 min in de controle vis (a) en het proces van een macrofaag (groen, gelabeld door witte pijlen) migreren in de lever (rood) binnen 28 min in IL-34 het uitdrukken van vis (B). Schaal staven = 40 μm (witte lijn). Klik hier om een grotere versie van dit cijfer te bekijken.

Aanvullende film 1: Live Imaging waarin het proces van macrofagen (groen, gelabeld door witte pijlen) wordt gemigreerd naar de lever (rood) binnen 2 uur in Il-34 met een overexpressie van vis. Schaal staven = 20 μm (witte lijn). Deze film is heruitgegeven uit Jiang et al.11. Klik hier om deze video te bekijken. (Klik met de rechtermuisknop om te downloaden.)

Aanvullende film 2: Live Imaging toont het proces van macrofagen (groen, gelabeld door witte pijlen) dwalen rond de lever (rood) binnen 2 h in controle vis. Schaal staven = 20 μm (witte lijn). Deze film is heruitgegeven uit Jiang et al.11. Klik hier om deze video te bekijken. (Klik met de rechtermuisknop om te downloaden.)
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Het hier beschreven protocol stelt ons in staat om de functie van een Chemokine op het gedrag van macrophagein vivo te onderzoeken en de procedure vereist enige technische expertise. Samenvattend zijn er verschillende kritieke stappen om complicaties in het protocol te voorkomen: 1) Selecteer een geschikte transgene lijn die een specifiek en sterk transgene signaal toont om de cel van belang te labelen; 2) Selecteer een geschikt weefsel dat toegankelijk is voorbeeld vorming en transgene genen overexpressie; 3) Maak een gevoelige en specifieke RNA-sonde; 4) Selecteer een geschikte observatietijd venster om het Celgedrag nauwkeurig vast te leggen.
In de procedure van hele Mount fluorescentie in situ-hybridisatie gecombineerd met immunokleuring, moet de RNA-sonde die wordt gebruikt om de genexpressie op te sporen gevoelig zijn en moet het signaal sterk genoeg zijn. Om de genfunctie op Celgedrag vast te leggen, moet een reeks tijdpunten worden getest. Bijvoorbeeld, bij het observeren van het effect van il34 op macrofaag migratie, hoewel de fabp10a promotor begon te uiten op 2-3 DPF, macrofagen accumulatie in de lever was niet duidelijk op dat moment. Het is alleen door 4 DPF dat de verrijking van macrofaag in de lever duidelijk wordt. Bovendien zal na in-situ hybridisatie de signaalintensiteit van daaropvolgende immunokleuring worden beïnvloed. Bijvoorbeeld, het vergelijken met GFP, DsRed is moeilijk te kleuren in immunofluorescentie kleuring na in situ hybridisatie, waarschijnlijk vanwege de verschillende eiwit structuren. Over het algemeen zou de signaalintensiteit van de immunokleuring na hele Mount fluorescentie in situ-hybridisatie minder zijn dan die van enkelvoudige immunokleuring.
In de Live Imaging stap met de confocale Microscoop is het noodzakelijk om het monster dicht bij de bodem van het gerecht te houden. Wanneer de embryo's drijven in agarose, kan de werkafstand van de doelstelling ontoereikend zijn, ook de agarose tussen de doelstelling en de steekproef zou de kwaliteit van de beeldvorming aantasten. Bovendien moet het aantal monsters voorbeeld vorming op elk moment correct worden ingesteld. Men moet ervoor zorgen dat de tijdspanne tussen twee scans van elke vis niet te lang zou zijn om de details van het Celgedrag te verliezen. Dus deze methode is niet geschikt voor het bijhouden van cellen die snel in dikke weefsels bewegen.
Tot slot kan dit protocol worden gebruikt om de functie van chemokines te observeren op het gedrag van een verscheidenheid aan cellen, zoals macrofagen, neutrofielen en T-cellen. Hier gebruikten we Il-34, een recent geïdentificeerde ligand van CSF-1R functie in chemotaxis6,7, als een buitenbaarmoederlijke uitgedrukt Chemokine voor het opwekken van macrofagen migratie. De meeste bestaande experimentele modellen van cel chemotaxis zijn gebaseerd op in vitro celexperimenten, maar de in vitro experimenten zijn soms te eenvoudig om de complexe omgeving in vivo te modelleren. Ook, het is moeilijk om het beeld van de chemo-attractie abilityin vivo wanneer gewoon kijken naar de in vitro situatie. Deze methode gebruikt de specifieke voordelen van zebravis voor directe Celgedrag observatie die moeilijk is voor muizen. Met de huidige methode konden we de Chemokine-functies binnen enkele dagen snel testen op Celgedrag en zebravis een krachtig model maken om de moleculaire en celbiologie te bestuderen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Wij danken Dr. Jingrong Peng voor het delen van de TG (fabp10a: DsRed) transgene lijn; Dr. Zilong Wen voor het delen van de TG (MPEG1: GFP) transgene lijnen; Dr. Koichi Kawakami voor het leveren van de pTol2 vector. Dit werk werd gesteund door de National Natural Science Foundation of China (31771594), Guangdong Science and Technology plan Projects (2019A030317001) en de fundamentele onderzoeksfondsen voor de centrale universiteiten (D2191450).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Alexa 488-Anti-Goat antibody | Invitrogen | A11055 | |
| Anti-Digoxigenin-HRP | perkinelmer | NEF832001EA | |
| Goat-Anti-GFP antibody | Abcam | ab6658 | |
| Reagent | |||
| CaCl2· 2H2O | Sigma | 21097 | |
| Cyanine 3 Plus Amplification Reagent | perkinelmer | NEL745001KT | |
| E2 solution | 15 mM NaCl +0.5 mM KCl +1.0 mM MgSO4+150 µM KH2PO4 + 50 µM Na2HPO4 +1.0 mM CaCl2 + 0.7 mM NaHCO3 | ||
| Fetal Bovine Serum (FBS) | Life | 10099-133 | |
| Formamide | Diamond | A100314 | |
| Glycerol | Sigma | V900860 | |
| Heparin sodium | Sigma | H3149 | |
| Hybridization buffer(HB) | 50% formamide+ 5×SSC+9 mM sodium citrate+50 μg/ml heparin sodium+ 500 μg/mL tRNA+ 0.1% Tween20 | ||
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Low melting agarose | Sigma | A9414 | |
| Methanol | GHTECH | 1.17112.023 | |
| Methylene blue | Sigma | M9140 | |
| MgSO4 | Sigma | M2643 | |
| Na2HPO4 | Sigma | S5136 | |
| NaCl | Sigma | S5886 | |
| NaHCO3 | Sigma | S5761 | |
| Paraformaldehyde (PFA) | Sigma | 158127 | Suspend 16 g of PFA in 400 ml of 1x PBS, heat at 60 °C to dissolve about 30 min. This solution can be prepared in advance and stored at -4 °C. Caution. Manipulate with mask. |
| 10×PBS | 14.2 g Na2HPO4+80 g NaCl+2 g KCl+ 2.4 g KH2PO4 in 1L ddH2O | ||
| Phenylthiourea (PTU) | Sigma | P7629 | |
| 1×Plus Amplification Diluent | perkinelmer | NEL745001KT | |
| Proteinase K | Fermentas | E00492 | |
| 20×Saline sodium citrate(SSC) | 175.3 g NaCl+ 88.2 g sodium citrate in 1 L ddH2O, PH 7.0 | ||
| Sodium citrate | Sigma | A5040 | |
| Tricaine | Sigma | E10521 | |
| tRNA | Sigma | R6625 | |
| Tween20 | Sigma | P2287 | |
| Plasmid | |||
| pBLK-fabp10a-il34-sv40 | For Tg (fab10a:il34) transgenic line generation | ||
| pBSK-il34 | For il34 probe preparation | ||
| Fish | |||
| Tg (mpeg1: GFP) | Label macrophages with GFP | ||
| Tg (fabp10a: DsRed) | Label liver cells with DsRed | ||
| Tg (fab10a:il34) | Over-expression IL-34 in liver cells |
References
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Wang, Y., et al. IL-34 is a tissue-restricted ligand of CSF1R required for the development of Langerhans cells and microglia. Nature Immunology. 13 (8), 753-760 (2012).
- Lin, H., et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science. 320 (5877), 807-811 (2008).
- Wei, S., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. Journal of leukocyte biology. 88 (3), 495-505 (2010).
- Etienne, D., Foucher, S. B. L. P., Norbert Ifrah, P. G. Y. D. IL-34 Induces the Differentiation of Human Monocytes into Immunosuppressive Macrophages. Antagonistic Effects of GM-CSF and IFNc. PLoS One. 8 (2), e56045 (2013).
- Segaliny, A. I., et al. Syndecan-1 regulates the biological activities of interleukin-34. Biochimica et Biophysica Acta. 1853 (5), 1010-1021 (2015).
- Zhou, S. L., et al. miR-28-5p-IL-34-macrophage feedback loop modulates hepatocellular carcinoma metastasis. Hepatology. 63 (5), 1560-1575 (2016).
- Gordon, J. I., et al. Tissue specific expression and developmental regulation of two genes coding for rat fatty acid binding proteins. Journal of Biological Chemistry. 260 (4), 1995-1998 (1985).
- Westerfield, M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio rerio). , University of Oregon. Eugene, OR. (2000).
- Nüsslein-Volhard, C., Dahm, R. Zebrafish: a practical approach. , Oxford University Press. New York. (2002).
- Jiang, Y., Chen, J., Yen, K., Xu, J. Ectopically Expressed IL-34 Can Efficiently Induce Macrophage Migration to the Liver in Zebrafish. Zebrafish. 16 (2), 165-170 (2019).



