Dendritik Dikenlerin Çalışması için Seri Blok-Yüz Tarama Elektron Mikroskopisi (SBEM)
Summary
Murine hipokampustaki dendritik dikenleri görüntülemek ve analiz etmek için Seri Blok-Yüz Tarama Elektron Mikroskopisi (SBEM) uygulanır.
Abstract
Üç boyutlu elektron mikroskopisi (3D EM), dendritik dikenlerin morfolojik parametrelerini nano ölçekli çözünürlükle analiz etme imkanı sunar. Ek olarak, dendritik dikenlerin hacmi ve sinaptik yoğunluk sonrası (PSD) (sinapsın post-sinaptik kısmını temsil eden), presynaptik terminalin varlığı ve PSD’nin pürüzsüz endoplazmik retikülum veya atipik formu (örneğin, çok içli omurgalar) gibi bazı özellikleri sadece 3D EM ile gözlemlenebilir. Seri blok yüz taramalı elektron mikroskopisi (SBEM) kullanarak, 3D EM verilerini geleneksel seri kesitleme yaparken olduğundan daha kolay ve tekrarlanabilir bir şekilde elde etmek mümkündür. Burada fare hipokampal örneklerinin SBEM analizi için nasıl hazırlanacağını ve bu protokolün dendritik dikenlerin immünofluoresans çalışması ile nasıl birleştirilebileceğini gösteriyoruz. Hafif fiksasyon perfüzyonu beynin bir yarısına hafif mikroskopi ile immünofluoresans çalışmaları yapmamızı sağlarken, diğer yarısı SBEM için hazırlanmıştır. Bu yaklaşım, çalışma için kullanılacak hayvan sayısını azaltır.
Introduction
Merkezi sinir sistemindeki uyarıcı sinapsların çoğu dendritik dikenler üzerinde bulunur – bir nöronal zarın küçük çıkıntıları. Bu çıkıntılar hücre içi sinyal transdüksiyonu kontrol eden sınırlı biyokimyasal bölmeler oluşturur. Dendritik dikenlerin ve sinapsların yapısal plastisitesi, öğrenme ve hafıza gibi önemli süreçlerin altında yatan sinaptik etkinlikteki fonksiyonel değişikliklerle yakından ilgilidir1,2. Elektron mikroskopisinin (EM) dendritik bir omurganın presynaptik bir girişi olup olmadığını belirlemeye izin veren tek teknik olduğunu belirtmek önemlidir. EM çözünürlüğü, bir sinapsın postynaptik bir kısmını temsil eden postsinaptik yoğunluğun (PSD) şekli veya dendritik bir omurganın boyutlarının yanı sıra bir aksonal boutonun boyutu ve şekli gibi ultrayapısal ayrıntıları incelemek için de gereklidir. Ek olarak, EM ile sinapsları ve çevrelerini görselleştirmek mümkündür.
Görüntüleme ve bilgi işlem teknolojilerindeki gelişmeler sayesinde tüm sinir devrelerini yeniden oluşturmak mümkündür. Nöronal devre rekonstrüksiyonlarında seri kesit iletim elektron mikroskopisi (ssTEM), seri blok yüz taramalı elektron mikroskopisi (SBEM) ve odaklanmış iyon ışını tarama elektron mikroskopisi (FIB-SEM) gibi hacimli elektron mikroskopi teknikleri yaygın olarak kullanılmaktadır3.
Çalışmalarımızda, fare hipokampus ve organotipik beyin dilimleri örneklerinde dendritik dikenlerin ve PSD’lerin yapısal plastisitesini araştırmak için SBEM yöntemibaşarıyla4 ,5. SBEM, taramalı elektron mikroskop odası 6 ,7,8,9’uniçine minyatür bir ultramikrotomkurulumunadayanmaktadır. Örnek bloğun üst kısmı görüntülenir ve daha sonra numune ultramikrotom tarafından belirtilen derinlikte kesilir, tekrar görüntülenen ve daha sonra işlem tekrarlanan yeni bir blok yüzü ortaya çıkar8. Sonuç olarak, kesilen dilim enkaz olarak kaybolurken yalnızca bir blok yüzünün görüntüsü bırakılır. Bu nedenle SBEM yıkıcı bir teknik olarak adlandırılır, yani aynı yeri tekrar imgelemek mümkün değildir. Bununla birlikte, yıkıcı blok üzerindeki yöntemlerin avantajı, veri kalitesini ve veri analizini önemli ölçüde etkileyebilecek çarpıtma sorunlarından ve kesit kaybından muzdarip olmamasıdır3. Ayrıca, SBEM yüksek çözünürlükte nispeten geniş bir görüş alanı (> 0,5 mm × 0,5 mm) görüntüleme imkanı verir3.
SBEM’i çalıştırmak için, numunelerin görüntü almak için kullanılan arkadan saçılmış elektron dedektörü nedeniyle özel, son derece zıt bir protokole göre hazırlanması gerekir. 1980’lerde geliştirilen azaltılmış osmium-tiyokarbohidrazür-osmiyum (rOTO) lekeleri kullanılarak Deerinck 10 (Ulusal Mikroskopi ve Görüntüleme Araştırmaları Merkezi (NCMIR) yöntemi ile geliştirilen bir prosedüre dayanan protokole göre numune hazırlamanın nasıl gerçekleştirildiğini burada gösteriyoruz. Buna ek olarak, hafif fiksasyon perfüzyonu ile hem hafif mikroskopi hem de SBEM ile immünofluoresans çalışmaları için aynı beyni kullanmaya izin veren iki aşamalı bir fiksasyon yaklaşımı sunuyoruz.
Protokolde bir fare beyni öncelikle hafif bir fiksatif ile sabitlenir ve daha sonra yarıya indirilir ve bir yarımküre, em çalışmaları için iken, bir yarımküre postfixed ve immünofluoresans (IF) için hazırlanır (Şekil 1).

Şekil 1. SBEM ile analiz için dendritik diken hazırlığı için iş akışının şematik gösterimi. Fareler kurban edildi ve hafif bir birincil fiksatif ile perfüzyon yapıldı. Beyin yarıya indirildi ve bir yarımküreye immünofluoresans (IF)- adanmış fiksatif, kriyoproteksk, kriyostat kullanılarak dilimlenmiş ve IF çalışmaları için işlenmiş, diğer yarımküre ise EM fiksatif ile yapıştırılmış, vibratom ile dilimlenmiş ve EM çalışmaları için hazırlanmıştır. SBEM çalışmaları için beyin dilimleri kontrast oluşturmuş, reçineye gömülü düz, daha sonra hipokampüsün bir CA1 bölgesi pime monte edilmiş ve SBEM ile görüntülenmiştir (Şekil 1). Protokolün sarı bir kutuda vurgulanan kısmı videoda yer aldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Deerinck tarafından 2010 yılında açıklanan birincil NCMIR yönteminin birçok varyasyonu vardır10. Temel ilkeler aynı kalır, ancak çalışılan malzemenin türüne bağlı olarak hafif değişiklikler uygulanır. Daha önce, SBEM için numuneleri gömmek için farklı reçinelerin kullanılabileceği ve örneğin bitkiler söz konusu olduğunda, Spurr’s hücre duvarlarından daha iyi sızmaya izin veren düşük viskozitesi nedeniyle tercih edilen reçinedir22…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nencki Deneysel Biyoloji Enstitüsü’nde görüntüleme çekirdeği tesisi olarak hizmet veren Görüntüleme Doku ve fonksiyon laboratuvarının ekipmanlarının kullanımı ile SBEM görüntüleme, ışık mikroskopi görüntüleme ve elektron mikroskopi numunesi hazırlama yapıldı.
Şekil 1’in hazırlanması için bir farenin (Souris_02) görüntüsü ve https://smart.servier.com/ bir şişe kullanılmıştır.
Bu çalışma, KR’ye verilen Ulusal Bilim Merkezi (Polonya) Grant Opus (UMO-2018/31/B/NZ4/01603) tarafından desteklendi.
Materials
| Anesthetic: | |||
| Ketamine/xylazine mixture (Ketamina/Sedazin) | Biowet Pulawy, Pulawy, Poland | ||
| Sodium pentobarbital (Morbital) | Biowet Pulawy, Pulawy, Poland | ||
| Fixatives: | |||
| Glutaraldehyde (GA) | Sigma-Aldrich,St. Louis, MI, USA | G5882 | Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative |
| Hydrochloric acid (HCl) | POCH, Gliwice, Poland | 575283115 | pure p.a. |
| Paraformaldehyde (PFA) | Sigma-Aldrich,St. Louis, MI, USA | 441244 | prilled, 95% |
| Phosphate buffered saline (PBS), pH 7.4 | Sigma-Aldrich,St. Louis, MI, USA | P4417-50TAB | tablets |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade, 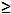 98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich,St. Louis, MI, USA | S3264 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich,St. Louis, MI, USA | S3139 | |
| Perfusion: | |||
| Large blunt/blunt curved scissors (~14.5 cm) | Fine Science Tools, Foster City, CA, USA | 14519-14 | |
| Micro-spatula (double 2" flat ends, one rounded, one tapered to 1/8") | Fine Science Tools, Foster City, CA, USA | 10091-12 | |
| Needle tip, 15 GA, blunt (perfusion needle) | KD Medical GmbH Hospital Products, Berlin, Germany | KD-FINE 900413 | 1.80 x 40 mm |
| Pair of fine (Graefe) tweezers | Fine Science Tools, Foster City, CA, USA | 11050-10 | |
| Perfusion pump | Lead Fluid | BQ80S | |
| Plastic vials | Profilab, Warsaw, Poland | 534.02 | plastic vials with blue cap for tissue storage, 20 ml, 31 x 48 mm |
| Straight iris scissors (~9 cm) | Fine Science Tools, Foster City, CA, USA | 14058-11 | |
| Brain slices preparation for EM: | |||
| 12-well plate | NEST, Rahway, NJ, USA | 712001 | |
| Cyanoacrylic glue | Fenedur, Montevideo, Uruguay | ||
| Glass vials | Electron Microscopy Sciences, Hatfield, PA, USA | 72632 | 20 ml Scintillation Vial, a pack of 100 |
| Pasteur pipette | VWR, Radnor, PA, USA | 612-4545 | LDPE, disposable, 7.5 ml |
| Razor blade | Wilkinson Sword, London, UK | Classic double edge safety razor blades | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Vibratome | Leica Microsystems, Vienna, Austria | Leica VT1000 S | |
| Brain slices preparation for IF: | |||
| 96-well plate | NEST, Rahway, NJ, USA | 701101 | |
| Criostat | Leica Microsystems, Vienna, Austria | Leica CM 1950 | |
| Ethylene glycol | Bioshop, Burlington, Canada | ETH001 | |
| Low-profile disposable blade 819 | Leica Biosystems Inc., USA | 14035838925 | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Sodium azide (NaN3) | POCH, Gliwice, Poland | 792770426 | |
| Sucrose | POCH, Gliwice, Poland | 772090110 | |
| Tissue freezing medium for cryosectioning, OCT-Compound | Leica Biosystems, Switzerland | 14020108926 | |
| Immunostaining: | |||
| 24-well plate | NEST, Rahway, NJ, USA | 702001 | |
| Anti-Post Synaptic Density Protein 95 Antibody | Merck-Millipore, Burlington, MA, USA | MAB1598 | |
| Confocal microscope | Zeiss, Göttingen, Germany | Zeiss Spinning Disc microscope (63 × oil objective, NA 1.4, pixel size 0.13 µm × 0.13 µm) | |
| Cover slide | Menzel Glaser, Braunschweig, Germany | B-1231 | 24 x 60 mm |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen, Carlsbad, CA, USA | A31570 | |
| Fluoromount-G Mounting Medium, with DAPI | Invitrogen, Carlsbad, CA, USA | 00-4959-52 | |
| Microscope slide | Thermo Scientific, Waltham, MA, USA | AGAA00008 | SuperFrost |
| Normal donkey serum (NDS) | Jackson ImmunoResearch Laboratories, West Grove, PA, USA | 017-000-121 | |
| Shaker | JWElectronic, Warsaw, Poland | KL-942 | |
| TritonT X-100 Reagent Grade | Bioshop, Burlington, Canada | TRX506 | |
| Electron microsocpy sample preparation | |||
| Potassium hexacyanoferrate(II) trihydrate | POCH, Gliwice, Poland | 746980113 | |
| Aclar 33C Film | Electron Microscopy Sciences, Hatfield, PA, USA | 50425 | Fluoropolymer Film embedding sheet |
| DMP-30, 2,4,6-Tris(dimethylaminomethyl)phenol | Sigma-Aldrich,St. Louis, MI, USA | T58203 | Epoxy embedding medium accelerator |
| Durcupan ACM single component A, M | Sigma-Aldrich,St. Louis, MI, USA | 44611 | Durcupan ACM single component A, M epoxy resin |
| Durcupan ACM single component B | Sigma-Aldrich,St. Louis, MI, USA | 44612 | Durcupan ACM single component B, hardener 964 |
| Durcupan ACM single component D | Sigma-Aldrich,St. Louis, MI, USA | 44614 | Durcupan ACM single component D , plasticizer |
| Ethyl alcohol absolute | POCH, Gliwice, Poland | 64-17-5 | Ethyl alcohol absolute 99.8 % pure P.A.-BASIC |
| Genlab laboratory oven | Wolflabs, York, UK | Mino/18/SS | Oven Genlab MINO/18/SS 18l volume, no fan circulation, no digital display, standard temperature gradient, standard recovery rate, no timer, 250°C maximum temperature, 240V electrical supply |
| L-Aspartic acid | Sigma-Aldrich,St. Louis, MI, USA | A-9256 | reagent grade, 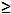 98% (HPLC) 98% (HPLC) |
| Lead (II) nitrate | Sigma-Aldrich,St. Louis, MI, USA | 467790 | 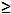 99.95% trace metals basis 99.95% trace metals basis |
| Osmium tetroxide | Sigma-Aldrich,St. Louis, MI, USA | 75632 | for electron microscopy, 4% in H2O |
| pH meter | Elmetron, Zabrze, Poland | CP-5-5 | |
| Rotator | BioSan, Józefów, Poland | Multi Bio RS-24 | rotator Multi Bio RS-24 |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade, 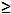 98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sunflower mini shaker | Grant bio, Shepreth,UK | PD-3D | |
| Syringe filter | Millipore, Burlington, MA, USA | SLGP033NB | 0,22 µm pore size |
| Thiocarbohydrazide | Sigma-Aldrich,St. Louis, MI, USA | 88535 | purum p.a., for electron microscopy, 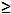 99.0% (N) 99.0% (N) |
| Uranyl acetate | Serva, Heidelberg, Germany | 77870 | Uranyl acetate·2H2O, research grade |
| Water bath | WSL, Swietochlowice, Poland | LWT | |
| Specimen mounting for SBEM | |||
| 96-well culture plate | VWR, Radnor, PA, USA | 734-2782 | 96-well plates, round bottom, non treated |
| AM Gatan 3View stub handling tweezers | Micro to Nano, Haarlem, Netherlands Netherlands |
50-001521 | |
| Binocular | OPTA-TECH, Warsaw, Poland | X2000 | |
| Conductive glue | Chemtronics, Georgia, USA | CW2400 | conductive eopxy |
| Gatan 3View sample pin stubs | Micro to Nano, Haarlem, Netherlands Netherlands |
10-006003 | |
| Parafilm | Sigma-Aldrich,St. Louis, MI, USA | P7793 | roll size 20 in. × 50 ft |
| Pelco conductive silver paint | Ted Pella, Redding, CA, USA | 16062-15 | PELCO® Conductive Silver Paint, 15g |
| Razor blades double edge | Electron Microscopy Sciences, Hatfield, PA, USA | 72000 | Stainless Steel "PTFE" coated. PERSONNA brand .004" thick, wrapped individually, 250 blades in a box. |
| Scanning Electron Microscope | Zeiss, Oberkochen, Germany | Sigma VP with Gatan 3View2 chamber, acceleration voltage 2.5 kV, variable pressure 5 Pa, aperture 20 µm, dwell time 6 µs, slice thickness 60 nm, magnification 15 000 x, image resolution 2048 x 2048 pixels, pixel size 7.3 nm | |
| trim 90° diamond knife | Diatome Ltd., Nidau, Switzerland | DTB90 | |
| Ultramicrotome | Leica Microsystems, Vienna, Austria | Leica ultracutR | |
| Software | webpage | tutorials | |
| FijiJ | https://fiji.sc/ | ||
| Microscopy Image Browser | http://mib.helsinki.fi/ | http://mib.helsinki.fi/tutorials.html | |
| Reconstruct | https://synapseweb.clm.utexas.edu/software-0 | https://synapseweb.clm.utexas.edu/software-0) | |
| Animals | |||
| Mice | Adult 3-month old and 20±1 month old female Thy1-GFP(M) mice (Thy1-GFP +/-) (Feng et al.,2000) which express GFP in a sparsely distributed population of glutamatergic neurons. Animals were bred as heterozygotes with the C57BL/6J background in the Animal House of the Nencki Institute of Experimental Biology. |
References
- Bosch, M., Hayashi, Y. Structural plasticity dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Borczyk, M., Radwanska, K., Giese, K. P. The importance of ultrastructural analysis of memory. Brain Research Bulletin. 173, 28-36 (2021).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience: challenges of SBEM in neuroscience. Journal of Microscopy. 259 (2), 137-142 (2015).
- Śliwińska, M. A., et al. Long-term Memory Upscales Volume of Postsynaptic Densities in the Process that Requires Autophosphorylation of αCaMKII. Cerebral Cortex. 30 (4), 2573-2585 (2020).
- Borczyk, M., Śliwińska, M. A., Caly, A., Bernas, T., Radwanska, K. Neuronal plasticity affects correlation between the size of dendritic spine and its postsynaptic density. Scientific Reports. 9 (1), 1693 (2019).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM – a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial Block-Face Scanning Electron Microscopy to Reconstruct Three-Dimensional Tissue Nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue and Cell. 57, 111-122 (2019).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure: Volume scanning electron microscopy. Biology of the Cell. 108 (11), 307-323 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. . NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , 6-8 (2010).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry & Cytochemistry. 32 (4), 455-460 (1984).
- Feng, G., et al. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2004).
- Walton, J. Lead aspartate, an en bloc contrast stain particularly useful for ultrastructural enzymology. Journal of Histochemistry & Cytochemistry. 27 (10), 1337-1342 (1979).
- Mercer, E. H. a scheme for section staining in electron microscopy. Journal of the Royal Microscopical Society. 81 (3-4), 179-186 (1963).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218 (1), 52-61 (2005).
- Roels, J., et al. An interactive ImageJ plugin for semi-automated image denoising in electron microscopy. Nature Communications. 11 (1), 771 (2020).
- Radwanska, K., et al. Mechanism for long-term memory formation when synaptic strengthening is impaired. Proceedings of the National Academy of Sciences. 108 (45), 18471-18475 (2011).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems: SBFSEM Methods for Plant Cells. Journal of Microscopy. 263 (2), 200-211 (2016).
- Fendrych, M., et al. Programmed Cell Death Controlled by ANAC033/SOMBRERO Determines Root Cap Organ Size in Arabidopsis. Current Biology. 24 (9), 931-940 (2014).
- Russell, M. R. G., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Płachno, B. J., Świątek, P., Jobson, R. W., Małota, K., Brutkowski, W. Serial block face SEM visualization of unusual plant nuclear tubular extensions in a carnivorous plant (Utricularia, Lentibulariaceae). Annals of Botany. 120 (5), 673-680 (2017).
- Genoud, C., Titze, B., Graff-Meyer, A., Friedrich, R. W. Fast Homogeneous En Bloc Staining of Large Tissue Samples for Volume Electron Microscopy. Frontiers in Neuroanatomy. 12, (2018).
- Puhka, M., Joensuu, M., Vihinen, H., Belevich, I., Jokitalo, E. Progressive sheet-to-tubule transformation is a general mechanism for endoplasmic reticulum partitioning in dividing mammalian cells. Molecular Biology of the Cell. 23 (13), 2424-2432 (2012).
- Gluenz, E., Wheeler, R. J., Hughes, L., Vaughan, S. Scanning and three-dimensional electron microscopy methods for the study of Trypanosoma brucei and Leishmania mexicana flagella. Methods in Cell Biology. 127, 509-542 (2015).
- Starborg, T., et al. Using transmission electron microscopy and 3View to determine collagen fibril size and three-dimensional organization. Nature Protocols. 8 (7), 1433-1448 (2013).
- Hughes, L., Borrett, S., Towers, K., Starborg, T., Vaughan, S. Patterns of organelle ontogeny through a cell cycle revealed by whole-cell reconstructions using 3D electron microscopy. Journal of Cell Science. 130 (3), 637-647 (2017).
- Bojko, A., et al. Improved Autophagic Flux in Escapers from Doxorubicin-Induced Senescence/Polyploidy of Breast Cancer Cells. International Journal of Molecular Sciences. 21 (17), 6084 (2020).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature Protocols. 4 (8), 1145-1156 (2009).
- Glauert, A. M., Lewis, P. R. . Biological specimen preparation for transmission electron microscopy. , (2014).
- Genoud, C. Altered Synapse Formation in the Adult Somatosensory Cortex of Brain-Derived Neurotrophic Factor Heterozygote Mice. Journal of Neuroscience. 24 (10), 2394-2400 (2004).

