Abstract
يوضح هذا الفيديو بالتفصيل في المختبر، واحد من الألياف الكهربية بروتوكول تسجيل باستخدام إعداد الماوس القولون العصب. النهج يسمح بتحديد وتوصيف وظيفي متحيز من afferents القولون والمستقيم الفردية. التسجيلات خارج الخلية من إمكانات العمل نشر (الجزائرية) التي تنشأ من واحد أو عدد قليل من وارد (أي الألياف واحد) مصنوعة حقول تقبلا (علوم الاحياء) في القولون من مازحت كراسات الألياف العصبية. تتم إزالة القولون مع أي من الحوض (PN) أو قطني حشوي (LSN) العصبية المرفقة وفتحت طوليا. يتم وضع الأنسجة في غرفة تسجيل، دبس شقة ومع perfused حل كريبس الاوكسيجين. يستخدم التحفيز الكهربائي البؤري لتحديد النهايات وارد القولون والمستقيم، والتي يتم اختبارها مزيدا من ثلاثة محفزات الميكانيكية مميزة (ثلم التحقيق، التمسيد المخاطية وتمتد كفافي) لتصنيف وظيفيا في afferents إلى خمس mechanosensiدروس موانع. وتصنف النهايات الاستجابة لأيا من هذه المحفزات الميكانيكية وafferents ميكانيكيا-حساسة (المفقودين). كلا mechanosensitive ويمكن تقييم المفقودين لتوعية (أي استجابة محسنة، خفضت عتبة، و / أو حيازة mechanosensitivity) من خلال التعرض المترجمة من علوم الاحياء للمواد الكيميائية (مثل حساء التهابات (IS)، كشافات، أدينوسين ثلاثي الفوسفات (ATP)). وصفنا المعدات والقولون العصب إعداد تسجيل، والحصاد من القولون مع PN المرفقة أو LSN، وتحديد علوم الاحياء في القولون، الألياف واحد من تسجيل كراسات العصبية، وتطبيق المترجمة من المواد الكيميائية إلى RF. وبالإضافة إلى ذلك، وتناقش أيضا تحديات إعداد وتطبيق التحفيز الميكانيكي موحد.
Introduction
الألم وفرط الحساسية هي السائدة الشكاوى من المرضى الذين يعانون من اضطرابات الجهاز الهضمي الوظيفية، بما في ذلك متلازمة القولون العصبي (IBS)، والتي توجد في حالة عدم وجود سبب واضح pathobiological أو تلف الأنسجة. على سبيل المثال، والمرضى IBS تظهر فرط الحساسية، بما في ذلك ردود مشددة على المستقيم انتفاخ البالون وزيادة الحساسية خلال وظيفة الأمعاء الطبيعية، فضلا عن فرط الحساسية الإحالة الجسدية (أي، والحنان لملامسة للمنطقة البطن) 1. بسبب استهداف afferents القولون والمستقيم وقد ثبت أن تكون فعالة في تخفيف الألم وفرط الحساسية لدى مرضى القولون العصبي (على سبيل المثال، تقطير داخل المستقيم من التخدير الموضعي 2،3، ابتلاع الشفوي للguanylate محلقة-C ناهض linaclotide 4-6)، وتحسين فهم تعصيب وارد من القولون هو المهم.
afferents الحشوية، بما في ذلك afferents القولون والمستقيم، تكون قادرة على الاستجابة لطرائق الكيميائية / بالمغذيات والحرارية (على سبيل المثال، 7-9). ومع ذلك، فإن afferents الحشوية الاستجابة للمؤثرات الميكانيكية (أي afferents mechanosensitive) ودرس الأكثر بدقة بسبب المحفزات الميكانيكية (على سبيل المثال، وانتفاخ اللمعية، وتمتد) هي تلك التي ينتج عنها عادة الأحاسيس واعية، بما في ذلك الانزعاج والألم 10-16. وبالإضافة إلى ذلك، يتم معصب الأحشاء أيضا afferents حساسة ميكانيكيا (المفقودين)، عادة يطلق nociceptors الصامتة أو النوم 17. في ظل الظروف الفسيولوجية العادية، المفقودين لا تستجيب لالتحفيز الميكانيكي أو لديهم استجابة عالية جدا عتبات 18، ولكن يمكن أن تصبح نشطة واكتساب mechanosensitivity في ظروف الفيزيولوجية المرضية والمساهمة في فرط الحساسية.
عن طريق إعداد في المختبر، وبروتوكول الموصوفة هنا، قمنا بتطوير ويعمل استراتيجية التحفيز الكهربائية إلى البحر RCH لنهايات تقبلا، والسماح تحديد متحيز كل من النهايات mechanosensitive وMIA في القولون 19. ويستمد تعصيب القولون والمستقيم من حشوي قطني (LSN) والعصبية الحوض (PN) مسارات، ويتضمن afferents القولون والمستقيم والتي يمكن تصنيفها إلى خمسة فصول mechanosensitive (المصلي، الغشاء المخاطي، العضلات، والعضلات-المخاطية، المساريقي) وفئة واحدة MIA 20. باستخدام هذا المستحضر في المختبر، وجدنا أن المفقودين القولون والمستقيم mechanosensitivity المكتسب (توعية) بعد التعرض موجز لحقولهم تقبلا لالحساء التهابات (IS)، والذي توعية 71٪ من المفقودين في مسار PN و 23٪ من المفقودين في مسار LSN 19. ونحن كما وثقت توعية طويلة الأمد (تصل إلى 28 يوما) من المفقودين في سياق فرط الحساسية الحشوية السلوكي طويلة الأمد (أي في الفئران تلقي العلاجات intracolonic مع زيموزان 21 أو حامض 2،4،6-trinitrobenzenesulfonic (TNBS) 22) .
jove_content "> ومن بين afferents mechanosensitive، afferents العضلات والعضلات-المخاطية هي الطبقات الوحيدة التي تكود tonically تمتد كفافي من القولون (أي، هي امتداد حساسة) وأيد ترميز الضارة انتفاخ القولون والمستقيم 23،24. وباستخدام الكمبيوتر التي تسيطر عليها قوة المحرك، طبقنا معيار، متجانسة، وقابلة للتكرار تمتد رفعت في اتجاه كفافي من نسيج القولون والمستقيم بالارض وزيادة تصنيفها afferents حساسة تمتد كما منخفضة وعالية عتبة عتبة 23. وبالإضافة إلى ذلك، وبالطبع وقت توعية تمتد afferents -sensitive بعد زيموزان intracolonic 21 أو 22 TNBS العلاج يتوافق مع ظهور، والمثابرة، و / أو استرداد فرط الحساسية الحشوية السلوكي، مما يشير إلى دور حساس تمتد afferents القولون والمستقيم في الألم الحشوية وفرط الحساسية.Subscription Required. Please recommend JoVE to your librarian.
Protocol
ملاحظة: تم استعراض هذا البروتوكول والموافقة عليها من قبل جامعة بيتسبرغ المؤسسي رعاية الحيوان واللجنة الاستخدام.
1. إعداد الحل كريبس التعديل واختبار المخدرات مأخوذة
- جعل 6 L المعدلة حل كريبس الذي يحتوي (مم): 117.9 كلوريد الصوديوم، 4.7 بوكل، 25 NaHCO 3، 1.3 ناه 2 PO 4، 1.2 MgSO 4، 2.5 CaCl 2، 11.1 D-الجلوكوز، الزبدات 2 الصوديوم، خلات الصوديوم 20 ، 0.004 نيفيديبين (لمنع تقلصات العضلات العفوية)، والاندوميتاسين 0.003 (لمنع تخليق البروستاجلاندين الذاتية). استخدام حلول كريبس الجليد الباردة والدافئة للتشريح الأنسجة وتسجيل الألياف واحد، على التوالي.
- إعداد أي المحاليل الكيميائية (على سبيل المثال، IS، كشافات، ATP) في aliquots في تركيزات المطلوب.
2. تشريح الأنسجة القولون العصب
- تخدير والموت ببطء الفئران الذكور (6-8 أسابيع من العمر، 20 - 30 ز) فيغرفة CO 2 بمعدل تدفق أن يزيح 10-30٪ من حجم الغرفة في الدقيقة الواحدة حتى الفئران توقف التنفس تماما كما يدل على ذلك عدم وجود حركة الصدر.
- مباشرة بعد القتل الرحيم، يستنزف من خلال خفض فتح غرفة الصدرية، تثقيب الأذين الأيمن، وغمر الذبيحة الماوس في حجم وافرة (~ 500 مل) من الجليد الباردة كريبس (4 ° C) حل فقاعات مع كربوجين (95٪ O 2 و 5٪ CO 2).
- إزالة بعناية كل الأحشاء ولكن القولون والحوض الأجهزة. القطع الماوس في نصف عبر شريحة الشوكي T12 أعلى قليلا من الحجاب الحاجز والصدر ونقل النصف الذيلية إلى غرفة التشريح التي تحتوي على الجليد الباردة، فقاعات حل كريبس.
- تحت stereomicroscope، إزالة المثانة والأعضاء التناسلية التي transecting عند التقاطعات لمجرى البول، وإزالة الهابطة / الشريان الأورطي البطني حتى bifurcates في الشرايين الحرقفي المشترك. تحرير PN أو LSN من surroundin بهمز الأنسجة عن طريق تشريح حادة واتبع العصبية من خارج العرف الحرقفي حتى نقطة دخول البطنية في L6 وS1 العمود الفقري (لPN) أو T13 وL1 العمود الفقري (لLSN).
- قطع الارتفاق العانة والحق والمفاصل الحقي اليسار، وإزالة العظم الحرقفي. مجانا بعناية إما PN أو LSN من العضلات والنسيج الضام المرفقة من على مقربة من القولون حتى حيث يدخل العصب والعمود الفقري.
- بتر بعناية العظم الحرقفي لفضح القولون البعيدة. تشريح خارج القولون البعيدة مع PN المرفقة أو LSN في التواصل.
- نقل القولون مع العصب تعلق على حجرة حمام للغرفة الأنسجة. إزالة النسيج الضام المفرطة من جانب آخر تشريح، وفتح القولون طوليا على طول الحدود المضادة للالمساريقي.
- مع الجانب المخاطية مواجهة، دبوس حافة المساريقي من القولون المتاخمة للتسجيل مقصورة في قاعدة سيليكون من chambeص وإرفاق طول مقابل المساريق من القولون إلى أشعل النار من السنانير متصلة المحرك قوة (موضح في الشكل (1) وتصويرها في الشكل 2A).
- تمديد PN أو LSN في حجرة التسجيل، وهذا مرتبط إلى حجرة حمام من جحر الفأر والبوابة. وضع بلطف جذع العصب على مرآة زجاجية صغيرة في حجرة التسجيل، التي تنص على سطح ماء لالعصب على الالتزام. Superfuse حجرة حمام دافئ مع (30-32 درجة مئوية)، المؤكسج حل كريبس وملء المقصورة تسجيل مع الزيوت المعدنية.
تسجيل 3. واحد من الألياف وتوطين مجال تقبلا
- قشر بعناية إلى الخلف غلاف (غمد العصب) من PN أو LSN تحت stereomicroscope في تضخم عالية (50 - 60X). باستخدام ملقط غرامة، ندف جذع العصب إلى 5-8 حزم العصبية من ~ 100 ميكرون سمك.
- ضع إشارة البلاتين إيريديومالقطب في اتصال مع الحل كريبس في غرفة الأنسجة. وضع بالتتابع الحزم العصبية الفردية على القطب تسجيل مصنوعة من نفس المادة.
- استخدام فرشاة طلاء ناعمة لاستحضار نقاط وصول من afferents القولون والمستقيم عن طريق التمسيد بلطف صعودا ونزولا على سطح القولون والمستقيم. تحديد موقع حزمة الأعصاب (ق) التي يعصب القولون من خلال كشفها AP (إمكانات العمل) التسجيلات.
ملاحظة: إن PN وLSN أيضا يعصب المثانة البولية وأعضاء الحوض الأخرى. - استخدام زوج من 30 نصائح إبرة G لمزيد من تقسيم حزمة الأعصاب إلى خيوط كراسة غرامة ~ 10 ميكرون سمك ووضع خيوط الأفراد على تسجيل القطب.
- وضع القطب متحدة المركز مستديرة ذات الرؤوس عمودي على سطح الغشاء المخاطي لإثارة كهربائيا النهايات وارد في كثافة suprathreshold التحفيز (10 مللي أمبير الحجم، 0.5 ميللي ثانية مدتها @ 0.3 هرتز)، والتي تنتج ~ 2 مم دائرة نصف قطرها من انتشار الحالي. تحرك القطب منهجية (~ 1.5 ملم خطوات) على طول وعرض القولون بالارض في توطين النهايات تقبلا.
- عندما هو متحمس لإنهاء وارد، وضبط الموقف الكهربائي لتحديد موقع تفعيل (حقل تقبلا، RF) التي تتطلب الحد الأدنى من شدة التحفيز (عتبة التحفيز). تجاهل النهايات مع عتبة التحفيز> 3 مللي أمبير 19.
- حساب سرعة التوصيل (CV) من 1) المسافة بين القطب محفزة في مجال تقبلا (RF) وموقع تسجيل و2) التأخير التوصيل (على سبيل المثال، الشكل 2B) بين القطع الأثرية التحفيز وبداية من إمكانات العمل .
CV (م / ثانية) = المسافة (ملم) / تأخير التوصيل (ميللي ثانية).
4. التصنيف الوظيفي من Mechanosensitive القولون والمستقيم Afferents
- بعد تحديد موقع RF بواسطة التحفيز الكهربائي، وتطبيق ما يلي ثلاثة المحفزات الميكانيكية إلى RF:
- إجراء التحقيق التحفيز عن طريق الضغط على غيض من calibraحيدة تيد فون فراي مثل النايلون (0.4 و 1 غرام القوة) عموديا نحو RF على القولون بالارض.
- إجراء التحفيز التمسيد بلطف بواسطة التمسيد الغشاء المخاطي القولون والمستقيم مع غرامة حبلا خيوط النايلون (10 ملغ قوة) لإنشاء إجهاد القص سطح صغير في RF.
- إجراء تمتد كفافي باستخدام المحرك قوة الكمبيوتر التي تسيطر عليها، والتي توفر قوة تمتد رفعت (0-170 MN في 5 مليون / ثانية) في الاتجاه المحيطي على طول حافة المضادة للالمساريقي من القولون عبر أشعل النار من السنانير هو موضح في الخطوة 2.8 .
- تصنيف afferents كما المصلي (تستجيب فقط لفظة التحقيق)، المخاطية (الرد على المخاطية التمسيد وفظة التحقيق)، والعضلات (الرد على امتداد كفافي وفظة التحقيق) العضلي / المخاطية (الرد على امتداد كفافي، المخاطية التمسيد وفظة التحقيق)، أو MIA (وليس استجابة لأي من المحفزات الميكانيكية ثلاثة).
- لafferents المساريقي (فقط فيوتعصيب LSN) التي يصعب تفعيل انتقائي من قبل التحفيز الكهربائي، تحديد نهايات لها تقبلا من قبل التمسيد الميكانيكية / تحقق من مساريق.
- لafferents حساسة تمتد (العضلات والعضلات-الغشاء المخاطي)، وتحديد عتبة ردا على ذلك، الذي يعرف بأنه القوة التي تثير أول AP خلال تمتد رفعت.
- لafferents المصلي، سجل ردودها على الصعود مستويات منقط تحقق من حقل تقبلا مدفوعا قوة المحرك الكمبيوتر التي تسيطر عليها.
5. التطبيق الكيميائية / التحوير من النهايات التعبيرية
- تسجيل استجابة خط الأساس لحافز الميكانيكية (أي استجابة لتمتد رفعت، منقط التحقيق، أو الغشاء المخاطي التمسيد).
- معطف الحافة السفلية من قطعة من الأنابيب (النحاس أو الفولاذ المقاوم للصدأ، 10 مم عالية و 4 × 4 مم 2 مربع أو 4-5 مم) مع الفازلين ووضعه على الحقل تقبلا على القولون.
- نزعالحل كريبس داخل الأنابيب، ويعرض نهاية تقبلا ل3-5 دقيقة إلى 170 ميكرولتر من محلول يحتوي على مادة كيميائية (ق) لفحصها.
- مراقبة الاستجابة للوارد خلال تطبيق الكيميائي (بعض afferents هي حساس للكيماويات).
- إزالة الحل الكيميائية والأنابيب لإنهاء عمل هذه المادة الكيميائية. ضمن 4-6 دقيقة، واختبار الاستجابة وارد لنفس التحفيز الميكانيكي كما هو الحال في الاستجابة خط الأساس.
- إعادة تطبيق التحفيز الميكانيكي مرة أخرى بعد فترة كافية من غسل المغادرة (> 15 دقيقة).
6. المسامير تسجيل والتمييز AP
- رقمنة الإشارات الكهربائية المسجلة من محاور عصبية في 20 كيلو هرتز وحفظ البيانات إلى جهاز كمبيوتر. مراقبة إشارة على الخط من خلال رصد الصوت.
- تحليل المسامير AP خارج الخط وتميز الوحدات واحدة على أساس تحليل المكون الرئيسي من الطول الموجي ارتفاع الفردية 25.
ملاحظة: يجب أن يحتوي على سجل واحد لا أكثر عشروحدتين النشطة discriminable بسهولة.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ويتضح الإعداد في الشكل 1. ويشمل غرفة الأنسجة حسب الطلب الذي يضم القولون في حمام مقصورة مبطنة سيليكون والعصب المرفقة في معدن متجاورة مقصورة مملؤة بالنفط. تم تشكيله غرفة المقصورة اثنين من كتلة صلبة من البلاستيك الاكريليك بواسطة آلة CNC. وقد اصطف أسفل كل مقصورات في وقت لاحق مع سيليكون ثابت للسماح السهل دبوس أسفل من نسيج القولون والمستقيم. يتم تسجيل نقاط وصول خارج الخلية العصبية من كراسات مثار باستخدام منخفضة الضوضاء، بطارية تعمل بالطاقة التفاضلية مكبر للصوت مع مشترك وضع نسبة الرفض عالية (CMRR ~ 60 ديسيبل). يتم تعيين مكسب مكبر للصوت لx10،000 ومجموعة مرشح الفرقة في ،3-10 كيلو هرتز. يتم تسليم التحفيز الكهربائي من القولون قبل مشجعا بالإضافة بصريا في الوضع الحالي المستمر عبر القطب متحدة المركز في اتصال مع الغشاء المخاطي القولون والمستقيم. يتم تسليم التحفيز الميكانيكي (القولون والمستقيم وتمتد منقط التحقيق) من ميلانomputer تسيطر عليها قوة المحرك. محول م والبرمجيات المناسبة تشرف على حد سواء التحفيز وتسجيل العمليات عن طريق إرسال مخرجات قيادة الجهد للشروع المحفزات الميكانيكية والكهربائية وكذلك تسجيل والتحويل الرقمي الإشارات AP خارج الخلية من مكبر للصوت التفاضلية. عزل من مصادر الضوضاء الميكانيكية والكهربائية، ويتم وضعها في غرفة الأنسجة، والمجهر ومكبر للصوت التفاضلية داخل قفص فاراداي التي شنت على طاولة الهواء هوائي.
كما هو مبين في الشكل 2A، يتم تشريح القولون مع العصب تعلق بها من الماوس، وقطع مفتوحة على طول حافة المضادة للالمساريقي، ودبس شقة في غرفة النسيج مبطنة سيليكون. يتم وضع العصب على مرآة الزجاج في غرفة تسجيل المجاورة. عرض في الشكل 2B هو سجل ممثل لإمكانات العمل (AP) ردا على التحفيز الكهربائي للRF في العتبة. وكالة اسوشييتد برس في هذا السجل متخلفا فن التحفيزifact (•) بنسبة 49 ميللي ثانية بسبب تأخير التوصيل من RF إلى القطب تسجيل، مما أدى إلى سرعة التوصيل محسوبة من 0.43 م / ثانية، وأيضا في مجموعة من امياليني C-الألياف. عرض في الشكل 2C هي استجابات نمطية في وارد للمؤثرات تسليمها باليد (تحقق من RF مع فون المجذوذه فراي الشبيهة، 1 غرام، وغرامة التمسيد المخاطية للRF، 10 ملغ). هذا السجل يحتوي على اثنين من afferents discriminable بسهولة. فقط وارد السعة الكبيرة يستجيب لالتمسيد. كما هو مبين في الشكل 2D، قيمت أيضا الردود وارد إلى التحقيق من قبل قوة المحرك الكمبيوتر التي تسيطر عليها أن يسلم إلى نفس الموقع على القولون سلسلة من القوى الميكانيكية التوقيت تحديدا وقابلة للتكرار (5، 10، 20، 40 و 80 مليون، 5 مدة ثانية). وبالمثل، وتمتد كفافي من القولون - يتم تسليم (0 170 مليون في 5 مليون / ثانية) من قبل نفس المحرك مع استجابة التمثيلية المعروضة في الشكل 2E
كما هو مبين في الشكل (3)، afferents القولون والمستقيم ويمكن تصنيف وظيفيا إلى ست فئات على أساس الملامح استجابتها لثلاثة محفزات الميكانيكية مميزة (راجع الخطوة 4.2 أعلاه). وتقع جميع النهايات وارد باستثناء afferents المساريقي بواسطة التحفيز الكهربائي (STIM الإلكتروني؛ العمود أقصى اليمين، والسهام تشير قطعة أثرية التحفيز). ميكانيكيا afferents حساسة (المفقودين) لا تستجيب لأي من المحفزات الميكانيكية الثلاثة. في المقابل، كل النهايات mechanosensitive تستجيب لسبر (0،4-1،4 ز). من بينها، يتم تنشيط النهايات العضلات والعضلات-المخاطية أيضا عن طريق تمتد كفافي (0-170 MN)، وبالتالي وتسمى afferents حساسة تمتد. يتم تنشيط النهايات العضلات-المخاطية أيضا التمسيد (10 ملغ). يتم تنشيط النهايات المخاطية أيضا التمسيد (10 ملغ)، ولكن لا تمتد ولم يتم تنشيط النهايات المصلي إما عن طريق التمدد أو التمسيد. ويتم تحديد النهايات المساريقي بواسطة ميكانيكيا بالتسرع مساريق.
عرض في الشكل 4A والردود تمثيلية من وارد حساسة تمتد أثار ثلاث فترات متتالية كفافي مفصولة 5 دقائق. واهمال الأرقام ارتفاع بالتساوي إلى ثلاث صناديق وعرض وظائف الحوافز والاستجابة في الشكل 4B، وكشف عن استنساخ عالية في كل من حجم استجابة (عدد سنبلة) وعتبة الاستجابة.
هذا في المختبر إعداد القولون العصب أيضا يسمح التطبيق المحلي للمواد الكيميائية في وارد النهايات تقبلا. يقتصر على التعرض للمواد الكيميائية إلى مناطق حول RF وارد عن طريق وضع النحاس أو الفولاذ المقاوم للأنابيب الصلب فوق الغشاء المخاطي القولون والمستقيم لعزل جسديا RF عن بقية القولون. النتائج النموذجية التالية تطبيق الكيميائية ما يلي: تفعيل المباشر للafferents بناء على طلب من حل مفرط التوتر الحمضية (AHS 26؛ الشكل 5A)، لا التنشيط، ولكن الحصول على mechanosensitivity من قبل MIA بعد التطبيق من حساء التهابات (IS 19، الشكل 5B)، وزيادة استجابة (أي والتوعية) لتمتد الميكانيكية بعد تطبيق IS (الشكل 5C)، وانخفاض استجابة لتمتد الميكانيكية بعد التطبيق من المركب (الشكل 5D).

الشكل 1. تمثيل تخطيطي من الإعداد التجريبية. يتم وضع العصب القولون في غرفة الأنسجة المقصورة اثنين وعزل جنبا إلى جنب مع مكبر للصوت التفاضلية رئيس مرحلة من غيرها من المعدات الإلكترونية التي كتبها قفص فاراداي. يتم تعريف كل وارد RF بواسطة التحفيز الكهربائي (STIM ه) من القولون واختبارها من قبل ثلاثة محفزات الميكانيكية: النايلون حيدة التي تحقق، التمسيد المخاطية، وتمتد كفافي. ال تي تي بي: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
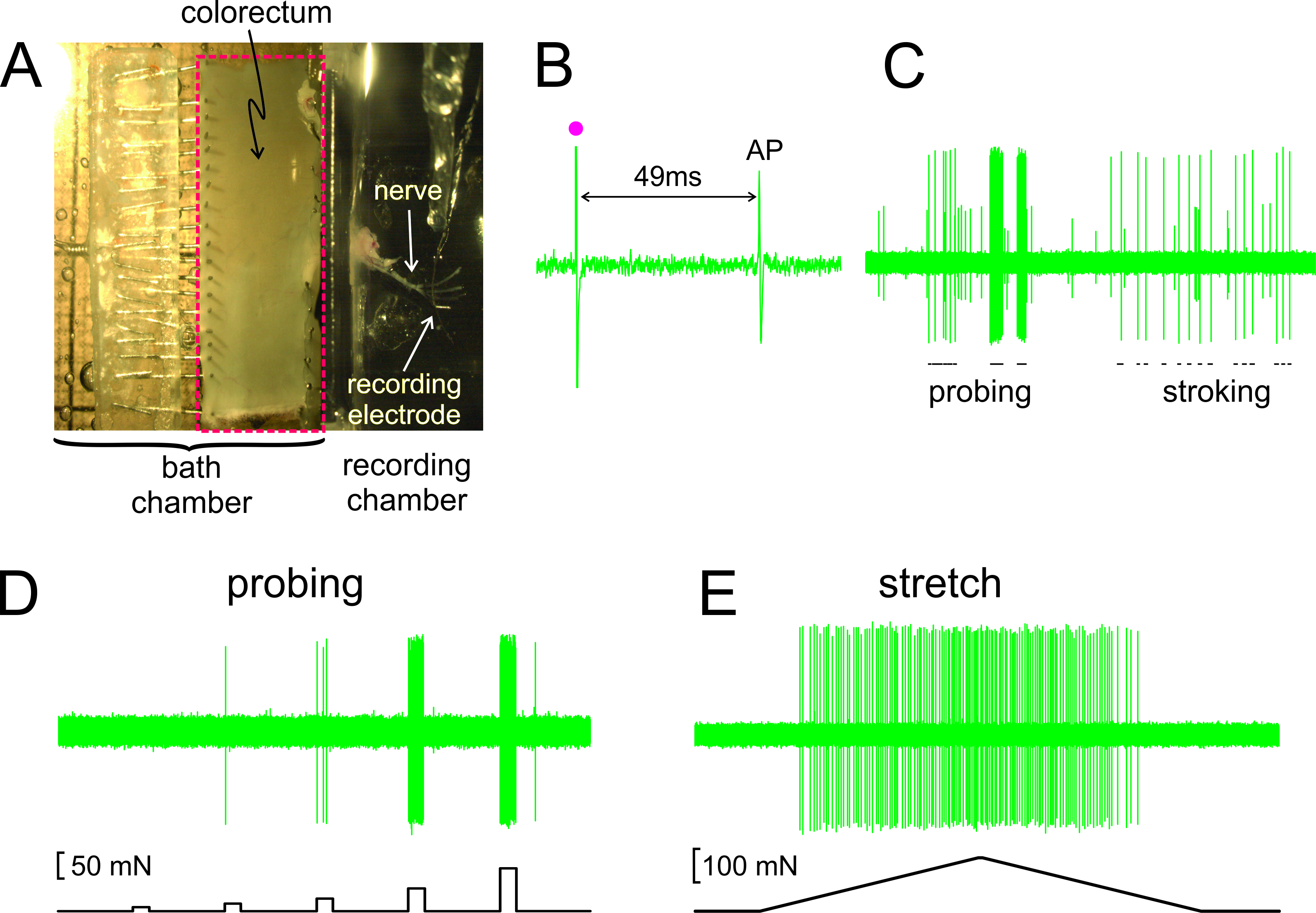
الشكل 2. صورة من خلال stereomicroscope من القولون تشريح الأعصاب مع الحوض المرفقة (A) B - E تظهر سجلات التمثيلية. (ب) إمكانات العمل (AP) التي حركها التحفيز الكهربائي (قطعة أثرية التحفيز، •). (C) ردود النموذجية لباليد حيدة التحقيق والغشاء المخاطي التمسيد. (D، E) ردود على التحقيق وعلى امتداد كفافي تسليمها من قبل قوة المحرك الكمبيوتر التي تسيطر عليها، على التوالي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 3. توصيف الوظيفي للفئات وارد القولون والمستقيم. وتقع Afferents بواسطة التحفيز الكهربائي (STIM ه، ↑) من القولون وتصنيفها إلى خمس فئات mechanosensitive واحد وارد ميكانيكيا-حساس (MIA) فئة على أساس التشكيلات استجابة كل منهما لثلاثة المحفزات الميكانيكية: التحقيق، التمسيد، وتمتد الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 4. ردود ارد لاستنساخه، التحفيز الميكانيكي الكمبيوتر التي تسيطر عليها. (A) الردود من العضلات-الغشاء المخاطي لfferent لثلاث مرات متتالية محمومة تمتد (0-170 MN في 5 مليون / ثانية؛ 5 دقائق الفاصلة بين التحفيز). (B) الردود (عمل المسامير المحتملة) تم اهمال بالتساوي إلى ثلاث صناديق (0-57، 57-113، و113-170 MN) وعرض وظائف الحوافز والاستجابة. يتم عرض عتبة الاستجابة في أقحم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 5. ردود ارد لتطبيق المترجمة الكيميائية إلى تقبلا النهايات. (A) مثال chemosensitivity من وارد المصلي لتطبيق حل مفرط التوتر الحمضية (AHS). (ب) مثال على اكتساب mechanosensitivity (توعية) من قبل MIA تنتهي. لم هذا MIA لا تستجيب مباشرةإلى الحساء التهابات (IS)، ولكن وردت إلى 1.4 ز حيدة التحقيق بعد ذلك. (C) للتوعية (زيادة في حجم الاستجابة وتخفيض عتبة الاستجابة) لتمتد من وارد العضلات بعد التعرض إنهاء لIS. (D) التوهين للاستجابة لتمتد من قبل وارد العضلي-المخاطية بعد التعرض لنهايته لدوري غوانوزين أحادي (المركب). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
وقد ثبت في المختبر إعداد القولون العصب الموصوفة هنا أن يكون طريقة فعالة لدراسة وظائف ترميز العصبية من afferents القولون والمستقيم الفردية، التي تكمل بشكل جيد النهج غير وظيفية أخرى (على سبيل المثال، والدراسات الخلوية والجزيئية والنسيجية) على الخلايا العصبية الحسية الحشوية ( انظر استعراض 27 لمزيد من التفاصيل). وقد كشف الآليات العصبية التي تسهم في حس الألم وطويلة الأجل القولون والمستقيم وفرط الحساسية وقد أجريت التلاعب الدوائية التي لها أهداف كشفت أن يمكن تخفيف الألم الحشوي. وتناقش النقاط الرئيسية التالية المرتبطة التنفيذ الناجح لهذا التحضير أدناه: 1) الحد من الضجيج الكهربائي، 2) زيادة في الكشف عن إشارة، و 3) اختيار حافزا موحد لتقييم التغيرات في الترميز وارد. وبالإضافة إلى ذلك، يتم مناقشة العديد من القيود المفروضة على هذه التقنية.
إمكانات العمل (الجزائرية) propagatiنانوغرام داخل الخلية العصبية على طول محاور عموما لديهم إمكانات عبر الغشاء من 100-130 فولت. ولكن نظرا لسعة محددة صغيرة من الغشاء محور عصبي، وهذا الاستقطاب كبيرة نسبيا النتائج فقط في صغير النزوح الشحنة الكهربائية عبر غشاء الخلية، والتي يمكن تبديد بسهولة في الأنسجة المحيطة خارج الخلية / السائل الخلالي (التي لديها مقاومة كهربائية أقل بكثير من الغشاء الدهني). للتسجيل خارج الخلية من خيوط الأعصاب / محاور، الإشارة الكهربائية عادة في نطاق microvolts، على مقربة من حجم الضوضاء الحرارية / أبيض المرتبطة نموذجي bioelectrical الإعداد تسجيل، مما يجعل الحد من الضوضاء الأولوية الأولى لتسجيل ناجحة. إلى عزل أكثر فعالية من الضجيج الكهربائي المحيط، فإنه يمكن أن تكون مفيدة لوضع غرفة الأنسجة، وتسجيل وأسس الأقطاب، مكبر للصوت التفاضلية (DC بطارية تعمل بالطاقة) وstereomicroscope في قفص فاراداي. إذا الحركة قطعة أثريةالصورة تحدث، ووضع قفص فاراداي على طاولة الهواء هوائي لتخفيف الاهتزاز الميكانيكي مفيد. ومن الناحية المثالية، وتسجيل وإشارة الأقطاب التي تدخل "+" و "-" موانئ مكبر للصوت التفاضلية، على التوالي، وينبغي أن يكون مقاومة مماثلة بالنسبة إلى أرضية مشتركة ويكون موجودا بالقرب من بعضها البعض. وبالتالي، سيتم تسجيل أي ضجيج خارجي حول بالتساوي من قبل كل من الأقطاب الكهربائية، وأخضعوا لصرامة رفض وضع مشترك من مكبر للصوت التفاضلية.
في الإعداد لدينا (الشكل 2A)، وانخفض القطب المرجعية في حل نضح كريبس في غرفة النسيج في حين القطب تسجيل في اتصال مع خيوط الأعصاب غرامة مقاومة كبيرة. هذا التكوين احد الكهربائي مع مقاومة عدم تطابق غير بديهي ليست عادة المثالي للحد من الضوضاء. ومع ذلك، هذا التكوين يوفر الراحة من وضع خيوط الأعصاب غرامة على إلكترونيات واحد فقطقصيدة، والتي هي جذابة بشكل خاص عند التسجيل من الماوس خيوط الأعصاب القولون والمستقيم من طول محدود (15 - 10 مم). وبناء على تجربتنا، وتكوين واحد الكهربائي بشكل مقبول عند من الضوضاء في الخلفية الذروة إلى الذروة هو أقل من 20 μV في المحضر. وإلا، فإن خفض آخر الضوضاء يطالب تكوين تسجيل يومين الكهربائي فيها خيوط الأعصاب غرامة يجب أن يكون على اتصال مع كل تسجيل وإشارة أقطاب كهربية وضعت موازية لبعضها البعض. جميع أجزاء معدنية كبيرة داخل قفص فاراداي بحاجة إلى أن تستند بطريقة تشبه النجمة لأرضية مشتركة واحدة، كتلة النحاس في الإعداد لدينا. الرعاية لابد من اتخاذها لتجنب تشكيل الحلقات الأرض.
لضمان الكشف عن الخلية وكالة الأنباء الجزائرية، فإن الخطوة الأولى هي تشريح الناجح للأنسجة القولون العصب. معسر أو سحب ويجب تجنب العصب أثناء التشريح، والتي يمكن أن تتلف بشكل لا رجعة فيه الأعصاب وتؤثر AP التوصيل. أيضا يحتاج الجذعية العصبية تشريح رس تكون خالية من أي نوع من الأنسجة العضلية المتصلة، والتي تسرب البوتاسيوم عندما التالفة ويمكن منع التوصيل العصبي عن طريق الاستقطاب. ويكتسب هذه المهارة تشريح عموما من خلال الممارسة الدؤوبة على مدى أسابيع إلى أشهر ويتطلب مستوى عال من التنسيق بين العين واليد والبراعة في التعامل مع واستخدام الأدوات الجراحية. وبالإضافة إلى ذلك، لتجنب الأضرار التي لحقت الأنسجة القولون والمستقيم، واستراتيجية البحث الكهربائية تستخدم القطب متحدة المركز الذي يحتوي على صريحا، طرف مستدير وقطر كبير نسبيا (الخارجية Φ0.55 ملم، داخلي Φ0.125 ملم) ويرتبط إلى مياداة مجهرية من قبل جسر متوافقة، مما أدى إلى قوة ميكانيكية متواضعة تطبيقها على سطح الغشاء المخاطي (~ 100 ملغ). من أجل الحصول على أكبر إشارة في تتبع تسجيل، يحتاج الغشاء التيار AP يسببها إلى أن توجه و "المحاصرين" على القطب عن طريق إنشاء جسر صغير بين مقاومة محور عصبي الأعصاب (ق) وسطح القطب. وهكذا، فإن غلاف وperineurium أن عزلالعصب تحتاج إلى تشريح مجانا خلال عملية تقسيم العصب إلى خيوط دقيقة من ~ 10 ميكرون سميكة. لأن الغشاء التيار AP يسببها تبدد إلى حد كبير على مسافة قصيرة من غشاء محور عصبي، وأرق خيوط الأعصاب يؤدي عادة إلى نسبة أفضل إشارة إلى الضوضاء نظرا لقربها من المحاور العصبية "أقرب إلى سطح القطب. في غرفة الزيوت المعدنية، والمرآة التي يتم وضعها على العصب غالبا ما يجذب طبقة رقيقة من كريبس الحل (سطح الزجاج هو ماء). وبالتالي فمن الضروري أن القطب تسجيل وخيوط الأعصاب ليسوا على اتصال مع سطح المرآة أثناء التسجيل. أي قطرات المتبقية من حل كريبس، والتي توفر جسرا منخفضة مقاومة بين القطب وسطح المرآة (أي السحب) سوف تقلل إلى حد كبير السعة إشارة في السجل.
هذا المستحضر القولون العصب يسمح دراسة التغييرات الوظيفية من afferents بعد تعريضعلوم الاحياء لمجموعة متنوعة من الوسائط الكيميائية والشتائم في المختبر وكذلك في سياق الظروف المرضية في جسم المريض على المدى الطويل (على سبيل المثال، colorectums المأخوذة من الفئران التي عولجت سابقا). مقياسا موضوعيا للتغيرات وظيفية من afferents يعتمد على ما يلي: 1) حافزا موحد مع دقة عالية واستنساخ و2) ردود ارد التي هي قوية واستنساخه. من المحفزات الميكانيكية ثلاث تطبيقها على القولون، التحقيق والتمسيد المحفزات للRF غالبا ما يتم تسليمها من قبل باليد فون فراي تشبه خيوط أحادية. لبحث، وعادة ما معايرة حيدة لتقديم قوة عمودي استنساخه عند الانحناء. المجذوذه ومع ذلك، فون فراي مثل (0.4 و 1 غرام) لديها أقطار مستعرضة صغيرة ومختلفة (0.2 و 0.3 ملم، على التوالي)، مما أدى إلى الضغط الاسمي عالية عند تطبيقها عمودي على سطح القولون والمستقيم (124.8 كيلو باسكال 0.4 g و 138.7 كيلو باسكال ل1 غرام)، و، التحفيز الميكانيكي منقط مكثفة beyonد مجموعة الفسيولوجي الطبيعي. وبالإضافة إلى ذلك، على حافة حادة من خيوط المرجح يسبب التوزيع غير المتكافئ للتشدد مع ذروة التوتر البؤري أعلى بكثير من الضغط الاسمي (تركيز الإجهاد). وبالنظر إلى أن حجم RF نموذجي (1 ملم 2) أكبر بكثير من شريحة من حيدة، وعدم القدرة على تحفيز بتكاثر الموقع متطابقة مع حيدة باليد، فإنه من الشائع أن نلاحظ ردود للمؤثرات المتكررة التي تختلف بشكل ملحوظ في وتيرة AP ومدتها. وكمثال على ذلك، فإن الردود على التحقيق هو مبين في الشكل 2C من قبل نفس باليد حيدة (1 غرام) اختلفت إلى حد كبير والتي من المرجح وساهمت في عدم القدرة على سبر بتكاثر الموقع متطابقة ومدة متغيرة والفاصلة بين المحفزات متتالية. المخاطية التمسيد بايدي خيوط باليد هو التحدي بالمثل ويميل أيضا لاستحضار ردود متغير من نفس وارد. التحفيز استنساخ يمكن أن يكونتحسين باستخدام قوة المحرك الكمبيوتر التي تسيطر عليها لتسليم القوات دقيقة التحقيق (وتمتد). لبحث، ونحن نستخدم حيدة مع قطر أكبر (على سبيل المثال، # 6.45، 1 مم) التي تغطي أكثر بالكامل وارد RF نموذجي 24،28. الكمبيوتر التي تسيطر عليها تمتد كفافي، بدلا من الأنسجة تمتد المناهج الأخرى الموجهة إلى الترددات اللاسلكية، ويسمح تشوه متجانس في جميع أنحاء طول القولون، مما يجعل من الممكن العلاقة مع انتفاخ القولون والمستقيم في تكوينه أسطواني الأصلي استنادا إلى إجهاد ميكانيكي كفافي مقارنة (أي 0 - 170 مليون تمتد ما يعادل 0 - 45 ملم زئبق ضغط داخل اللمعة 23). منذ يتم تطبيق قوة تمتد بشكل موحد على حافة المضادة للالمساريقي، وليس مباشرة إلى الترددات اللاسلكية، والإجهاد الميكانيكي المحلي أثار في وارد RF غير قابلة للتكرار بين التطبيقات متتالية من التمدد. وبالإضافة إلى ذلك، أضاف L من نوع كا 2+ قناة مانع نيفيديبين إلى الحمام إلى inhibit عفوية تقلص العضلات الملساء، ويسهم في المحافظة على الامتثال القولون والمستقيم بين الاختبارات تمتد رفعت 23. وأخيرا، فقد أثبتت الردود وارد في البروتوكول تمتد رفعت أن تكون قابلة للتكرار مع تقلبات صغيرة في كل وظيفة التحفيز والاستجابة والاستجابة عتبة (على سبيل المثال، الشكل 4). وهكذا، وقد استخدمت الردود وارد لتمتد رفعت على نطاق واسع تقييم موضوعي للتغيرات في وظيفة وارد في دراسة الآليات العصبية للألم الحشوية وفرط الحساسية (على سبيل المثال، 19-22،24،26،28-31).
إعداد القولون العصب هو أداة قوية لدراسة afferents الحشوية القولون والمستقيم. ومع ذلك، كما أن لديها بعض القيود. أولا، ومقطوع المحاور الهيئات خلية من الخلايا العصبية الحسية في عقدة الجذر الظهري في إعداد، والحيلولة دون دراسة الهويات الجزيئية تلك الهيئات الخلية (على سبيل المثال، خلية واحدة RT-PCR أو آرanscriptome تحليل لفئات مختلفة من afferents القولون والمستقيم). وثانيا، فإن نسبة منخفضة من تسجيل الألياف واحد إشارة إلى الضوضاء تتطلب المثلى الجراحية تشريح / العصبية مهارات تقسيم وتسجيل منخفضة الضوضاء، مما يحد بشكل ملحوظ توسيع نطاق تطبيق هذا البروتوكول في مختبرات أخرى. ثالثا، قد لا يكون هذا المستحضر في المختبر ينطبق على التحقيقات من العوامل النظامية التي تعدل الإحساس الحشوية، مثل الجهاز العصبي اللاإرادي، وتعميم الهرمونات والسيتوكينات، الجراثيم المعوية، وتنازلي تعديل من الجهاز العصبي المركزي.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



