Abstract
Denne videoen viser i detalj en in vitro single-fiber elektrofysiologisk registrering protokollen ved hjelp av en mus colorectum-nerve forberedelse. Tilnærmingen gir objektiv identifikasjon og funksjonell karakterisering av individuelle kolorektal afferenter. Ekstracellulære opptak av spredte aksjonspotensialer (APS) som stammer fra ett eller noen få afferent (dvs., single-fiber) mottakelig felt (RFS) i colorectum er laget av ertet nerve fascicles. Den colorectum fjernes med enten bekken (PN) eller lumbar innvoller (LSN) nerve festet og åpnes på langs. Vevet blir plassert i et opptakskammeret, festet flatt og perfusert med oksygenert Krebs-løsning. Focal elektrisk stimulering brukes til å lokalisere kolorektal afferente avslutninger, som er ytterligere testet av tre forskjellige mekaniske stimuli (sløv sondering, slimhinne stryke og omkrets strekning) til funksjonelt kategorisere afferenter i fem mechanosensitive klasser. Avslutninger som svarer på ingen av disse mekaniske stimuli er kategorisert som mekanisk-ufølsomme afferenter (Mias). Både mechanosensitive og MIAs kan vurderes for allergi (dvs., forbedret respons, redusert terskel, og / eller oppkjøp av mechanosensitivity) ved lokaliserte eksponering av RFS til kjemikalier (f.eks inflammatorisk suppe (IS), capsaicin, adenosintrifosfat (ATP)). Vi beskriver utstyr og colorectum-nerve opptak forberedelse, høsting av colorectum med vedlagt PN eller LSN, identifisering av RFS i colorectum, single-fiber opptak fra nerve fascicles, og lokaliserte bruk av kjemikalier til RF. I tillegg er utfordringene i forberedelse og bruk av standardiserte mekanisk stimulering også diskutert.
Introduction
Smerte og hypersensitivitet er de dominerende klager av pasienter som lider av funksjonelle gastrointestinale forstyrrelser, inkludert irritabel tarm syndrom (IBS), som foreligger i fravær av åpenbar pathobiological årsak eller vevsskade. For eksempel, IBS pasienter viser overfølsomhet, inkludert økt respons på rektal ballong distensjon og økt følsomhet under normal tarmfunksjon, samt overfølsomhet for somatisk henvisning (dvs. ømhet til palpasjon av mageområdet) 1. Fordi målretting kolorektal afferenter har vist seg å være effektive i å lindre smerter og overfølsomhet i IBS pasienter (f.eks intrarektal drypping av lokalanestetika 2,3, oralt inntak av guanylatsyklase-C agonist linaclotide 4-6), forbedret forståelse av afferent innervasjon av colorectum er viktig.
Visceral afferenter, inkludert colorectal afferenter, Er i stand til å reagere på kjemiske / nærings- og termiske modaliteter (f.eks 7-9). Imidlertid har visceral afferenter reagerer på mekaniske stimuli (dvs. mechanosensitive afferenter) vært den mest grundig studert fordi mekaniske stimuli (f.eks luminal distensjon, strekk) er de som vanligvis gir opphav til bevisste opplevelser, blant annet ubehag og smerte 10-16. I tillegg er de indre organene også stimuleres ved mekanisk ufølsomme afferenter (Mias), ofte kalt tause eller sover nociceptors 17. Under normale fysiologiske forhold, trenger MIAs ikke svare på mekanisk stimulering eller har svært høy svar terskler 18, men kan aktiveres og får mechanosensitivity i patofysiologiske forhold og bidra til overfølsomhet.
Ved hjelp av in vitro forberedelse og protokoll beskrevet her, vi utviklet og ansatt en elektrisk stimulans strategi til sjø RCH for mottakelig avslutninger, tillater objektiv identifikasjon av både mechanosensitive og MIA avslutninger i colorectum 19. Den kolorektal innervasjon er avledet fra korsrygg innvoller (LSN) og bekken nerve (PN) trasé, og inkluderer kolorektal afferenter som kan kategoriseres i fem mechanosensitive klasser (serøse, slimhinnene, muskuløs, muskuløs-slimhinnene, mesenteriske) og en MIA klasse 20. Ved hjelp av denne in vitro forberedelse, fant vi at kolorektal MIAs ervervet mechanosensitivity (sensitiv) etter kort eksponering av sine mottakelig felt til en inflammatorisk suppe (IS) som sensitivisert 71% av MIAs i PN sti og 23% av MIAs i LSN pathway 19. Vi har også dokumentert langtids sensibilisering (opp til 28 dager) av MIAs i sammenheng med langvarig atferds visceral hypersensitivitet (dvs. i mus som mottok intrakolonisk behandlinger med zymosan 21 eller 2,4,6-trinitrobenzensulfonsyre syre (TNBS) 22) .
jove_content "> Blant mechanosensitive afferenter, muskuløse og muskel-slimhinne afferenter er de eneste klassene som tonically koder omkrets strekning av colorectum (dvs. er stretch-sensitive) og subserve koding av skadelige kolorektal distensjon 23,24. Ved hjelp av en datastyrt kraft-aktuator, søkte vi en standard, homogen og reproduserbar trappet strekk i omkretsretningen av den flate kolorektal vev og videre kategorisert strekkfølsomme afferenter som lav-terskel og høy terskel 23. I tillegg er tidsforløpet for sensibilisering av strekningen -sensitive afferenter etter intrakolonisk zymosan 21 eller TNBS 22 behandling tilsvarer utbruddet, utholdenhet, og / eller gjenvinning av atferds visceral hypersensitivitet, noe som tyder på en rolle av strekkfølsomme kolorektal afferenter i visceral smerte og overfølsomhet.Subscription Required. Please recommend JoVE to your librarian.
Protocol
MERK: Denne protokollen ble gjennomgått og godkjent av University of Pittsburgh Institutional Animal Care og bruk komité.
1. Utarbeidelse av Modified Krebs Solution og Test Drug Delmengder
- Gjør 6 L av modifisert Krebs-løsning som inneholder (i mM): NaCl 117,9, KCl 4,7, 25 NaHCO3, 1,3 NaH 2PO 4, 1,2 MgSO4, 2,5 CaCl2, 11,1 D-glukose, 2-natriumbutyrat, 20 natriumacetat , 0,004 nifedipin (for å blokkere spontane muskelsammentrekninger), og 0.003 indometacin (for å blokkere syntese av endogene prostaglandiner). Bruk is-kalde og varme Krebs løsninger for vev disseksjon og single-fiber opptak, henholdsvis.
- Forbered noen kjemiske løsninger (f.eks, IS, capsaicin, ATP) i porsjoner på ønskede konsentrasjoner.
2. Disseksjon av Colorectum-nerve Tissue
- Bedøve og avlive hannmus (6 - 8 uker gammel, 20-30 g) ien CO to kammer ved en strømningshastighet som fortrenger 10 - 30% av kammerets volum per minutt inntil mus slutte å puste fullstendig som indikert ved fravær av brystheving.
- Umiddelbart etter avlivning, exsanguinate ved å skjære åpen brystkammeret, perforering av høyre atrium, og neddykking av mus skrotten i et stort volum (~ 500 ml) av iskald Krebs (4 ° C) løsning boblet med karbogen (95% O 2 , 5% CO2).
- Fjerne alle indre organer, men kolon og bekkenorganer nøye. Transekt mus i to på tvers av T12 spinal segment litt over thorax membran og overføre hale halv til en disseksjon kammer som inneholder iskald, boblet Krebs løsning.
- Under en stereomikroskop, fjerne blæren og reproduktive organer ved transecting på sine veikryss til urinrøret, og fjern synkende / abdominal aorta til den deler seg til vanlige bekkenarterier. Frigjøre PN eller LSN fra deres surrounding vev av stump disseksjon og følg nerve fra utenfor hoftekam till sin ventral inngangspunkt til L6 og S1 virvelsøylen (for PN) eller T13 og L1 virvelsøylen (for LSN).
- Skjær symfyseprovokasjonstester og høyre og venstre acetabular ledd, og fjerne hoftebeinet. Nøye fri enten PN eller LSN fra vedlagte muskler og bindevev fra nær colorectum til hvor nerven går inn i ryggraden.
- Resect hoftebein nøye for å avdekke distal colorectum. Dissekere ut distal colorectum med vedlagte PN eller LSN i kontinuum.
- Overfør colorectum med nerve festet til badekaret rommet av vevet kammeret. Fjerne overdreven bindevev ved videre disseksjon, og åpne colorectum lengderetningen langs den anti-mesenteriske grensen.
- Med slimhinnesiden vendt opp, feste den mesenteriske kant av colorectum ved siden av opptaksrommet inn i silikon bunnen av chamber og feste antimesenteric lengden av colorectum til en rake på kroker som er koblet til en kraft aktuatoren (illustrert i figur 1 og fotografert i figur 2A).
- Forlenge PN eller LSN i opptaksrommet, som er koblet til badet rommet ved et musehull og porten. Forsiktig lå nerve bagasjerommet på en liten glass speil i innspillingsrommet, som gir en hydrofil overflate for nerve å følge. Superfuse badekaret rommet med varm (30-32 ° C), oksygenert Krebs-løsning og fylle opptaksrommet med mineralolje.
3. Single-fiber Opptak og lokalisering av Mottakelig Feltet
- Nøye skrelle tilbake epineurium (nerve slire) fra PN eller LSN under stereomikroskop ved høy forstørrelse (50 - 60x). Ved hjelp av fine tang, erte nerve stammen til 5-8 nerve bunter av ~ 100 mikrometer tykkelse.
- Plasser platina-iridium henvisningelektrode i kontakt med Krebs-løsning i vevet kammeret. Sekvensielt å plassere de individuelle nervebunter på opptakselektrode laget av det samme materiale.
- Bruk en myk pensel til å fremkalle APs fra kolorektal afferenter ved forsiktig stryke opp og ned kolorektal overflaten. Finn nerve bunt (er) som innerverer tykktarmen gjennom påvisbare AP (aksjonspotensial) innspillinger.
MERK: PN og LSN også innerverer urinblæren og andre bekken organer. - Bruke et par av 30 G nål tips for ytterligere å dele opp nervebunt i fine Fascicle filamenter av ~ 10 um tykkelse og plassere en individuell filament på opptakselektrode.
- Plasser den runde-tipped konsentrisk elektrode vinkelrett på slimhinneoverflaten til elektrisk opphisse afferente avslutninger på suprathreshold stimulus intensitet (10 mA magnitude, 0,5 msek varighet @ 0,3 Hz), som produserer en ~ 2 mm radius av dagens spredning. Flytt elektroden systematisk (~ trinn 1,5 mm) Langs lengden og bredden av det flattrykte colorectum å lokalisere mottakelige avslutninger.
- Når en afferent ending blir opphisset, juster elektrode posisjon til å fastslå stedet for aktivering (mottakelig felt, RF) som krever minimum stimulus intensitet (stimulus terskel). Forkaste avslutninger med en stimulus terskel> 3 mA 19.
- Beregn ledningshastigheten (CV) fra 1) avstanden mellom den stimulerende elektrode på den mottakelige feltet (RF), og registreringsstedet og 2) ledningsforsinkelse (f.eks, figur 2B) mellom stimulus gjenstanden og utbruddet av virkningspotensialet .
CV (m / sek) = avstand (mm) / lednings forsinkelse (msek).
4. Funksjonell Klassifisering av Mechanosensitive Kolorektal afferenter
- Etter å finne en RF ved elektrisk stimulering, gjelder følgende tre mekaniske stimuli til RF:
- Gjennomføre sondering stimulans ved å trykke på tuppen av en calibrated von Frey-lignende nylon monofilament (0,4 og 1 g kraft) vinkelrett mot RF på den flate colorectum.
- Gjennomføre stryke stimulus ved forsiktig å stryke den kolorektal slimhinnen med et fint nylonfilament tråd (10 mg kraft) for å generere en liten overflate skjærspenning ved RF.
- Gjennomføre omkrets strekningen ved hjelp av en datastyrt kraft aktuator, som leverer en trappet strekning kraft (0-170 mN på 5 mN / sek) i omkrets retning langs anti-mesenteriske kanten av colorectum via rake av kroker som er beskrevet i trinn 2.8 .
- Klassifisere afferenter som serøse (svare bare å sløve sondering), slimhinner (svare på slimhinne stryke og sløv sondering), muskuløs (svare på omkrets stretch og sløv sondering) muskuløs / slimhinne (svare på omkrets strekning, slimhinne stryke og sløv sondering), eller MIA (ikke reagerer på noen av de tre mekaniske stimuli).
- For mesenteriske afferenter (kun iLSN innervasjon) som er vanskelig å aktivere selektivt ved elektrisk stimulering, finne sine mottakelig avslutninger av mekanisk stryke / sondering av mesenterium.
- For strekkfølsomme afferenter (muskuløs og muskuløs-slimhinne), bestemme reaksjonsterskel, som er definert som den kraft som fremkaller den første AP under trappet strekning.
- For serøse afferenter, spille inn sine svar på stigende nivåer av punctate sondering av mottakelig felt drevet av datastyrt kraft aktuator.
5. Kjemisk Søknad / Modulation av mottakelige Endings
- Spill inn en baseline svar på en mekanisk stimulus (dvs. respons på trappet strekning, punktat sondering, eller slimhinnene stryke).
- Coat den nederste kanten av et stykke rør (messing eller rustfritt stål, 10 mm høy og 4 x 4 mm 2 kvadrat eller 4-5 mm diameter) med petrolatum og legg den over den mottakelig feltet på colorectum.
- FjerneKrebs-løsning inne i produksjonsrøret, og utsette den mottakelige avslutning i 3 - 5 minutter til 170 ul av løsningen inneholdende den kjemisk (e) som skal testes.
- Overvåke responsen fra afferent løpet av kjemiske midler (noen afferenter er kjemosensitiv).
- Fjern den kjemiske løsning og slangen for å avslutte virkningen av kjemikaliet. Innen 4-6 min, teste afferent respons til den samme mekaniske stimulus som i referanseresponsen.
- Påfør den mekaniske stimulus igjen etter tilstrekkelig periode av utvasking (> 15 min).
6. Opptak og diskriminerende AP toppene
- Digitalisere de elektriske signalene tatt opp fra axoner ved 20 kHz og lagre dataene til en datamaskin. Overvåke signalet on-line med en lyd monitor.
- Analysere AP toppene off-line og diskriminere enkeltheter basert på prinsipal komponent analyse av enkelt pigg bølgeformer 25.
MERK: En rekord må ikke inneholde mer then to lett discriminable aktive enheter.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Oppsettet er illustrert i figur 1. Det inkluderer en skreddersydd vevkammer som huser colorectum i en silikon-lined bad rommet og festet nerve i en sammenhengende mineralolje fylt kupé. De to-kupé kammeret ble maskinert fra en solid blokk av akrylplast med en CNC-maskin; bunnen av begge seksjonene ble senere foret med fast silikon for å gi enkel pin ned av tykktarms vev. Ekstracellulære APs fra ertet nerve fascicles registreres ved hjelp av en støysvak, batteridrevet differensial forsterker med høy felles-modus avvisning ratio (CMRR ~ 60 dB). Forsterkningen i forsterkeren er satt til x10,000 og båndfilteret område på 0,3 til 10 kHz. Elektrisk stimulering av colorectum leveres av en optisk koblet stimulator i konstantstrømmodus via en konsentrisk elektrode i kontakt med kolorektal slimhinnen. Mekanisk stimulering (kolorektal stretch og punctate sondering) er levert av acomputer styrte kraft aktuator. En AD konverter og passende programvare overvåke både stimulering og innspillingsprosesser ved å sende spenning kommandoen utganger for å initiere mekaniske og elektriske stimuli samt opptak og digitalisering av ekstracellulære AP signaler fra differensialforsterkeren. For å isolere mot mekaniske og elektriske støykilder, blir vevet kammeret mikroskop og differensiell forsterker plassert inne i et Faraday-bur som er montert på en pneumatisk luftbord.
Som vist i figur 2A, er colorectum med vedlagte nerve dissekert ut fra en mus, skåret opp langs den anti-mesenterisk kant, og festet flatt i silikon-kantet vevet kammeret; nerve er plassert på en glass speil i den tilstøtende opptakskammeret. Vist i figur 2B er en representativ oversikt over et aksjonspotensial (AP) som reaksjon på elektrisk stimulering av RF på terskelen. AP i denne posten henger etter stimulans kunstifact (•) ved 49 msek på grunn av ledningsforsinkelsen fra RF til opptakselektrode, hvilket resulterer i en beregnet ledningshastighet på 0,43 m / sek, vel i området fra en unmyelinated C-fiber. Vist i figur 2C er typiske reaksjoner fra en afferent til stimuli levert for hånd (sondering av RF med von Frey-lignende monofilamenter, 1 g, og fine slimhinnene streke av RF, 10 mg). Denne posten inneholder to lett discriminable afferenter; bare den store amplitude afferent reagerer stryke. Som vist i figur 2D, ble afferente responser til sentret også vurdert ved en datamaskinstyrt aktuator som leverer kraft til det samme området på colorectum en serie av nøyaktig tidsbestemt og reproduserbare mekaniske krefter (5, 10, 20, 40 og 80 mN, 5 sekunders varighet). Tilsvarende omkrets strekning av colorectum (0-170 mN ved 5 mN / sek) blir levert av den samme aktuator med et representativt respons vist i figur 2E
Som vist i figur 3, kan kolorektale afferenter være funksjonelt klassifisert i seks klasser basert på deres responsprofilene til tre forskjellige mekaniske stimuli (se trinn 4.2 ovenfor). Alle afferente avslutninger unntatt mesenteriske afferenter ble plassert ved elektrisk stimulering (e-Stim, lengst til venstre kolonne, piler indikerer stimulans artefakt). Mekanisk ufølsomme afferenter (Mias) ikke svare på noen av de tre mekaniske stimuli. I motsetning til dette alle mechanosensitive avslutninger svare på sentret (0,4 til 1,4 g). Blant dem, er muskel- og muskel-slimhinne avslutninger også aktiveres ved omkrets strekning (0-170 mN), og dermed betegnes strekkfølsomme afferenter; muskel-slimhinne avslutninger er også aktiveres ved å stryke (10 mg). Slimhinne avslutninger er også aktiveres ved å stryke (10 mg), men ikke strekke og serøse avslutninger er ikke aktivert ved enten strekk eller stryke. Mesenteriske avslutninger identifiseres med mekanisk brushing mesenterium.
Vist i figur 4A er representative svar fra en strekning sensitive afferent fremkalt av tre påfølgende omkrets strekninger adskilt med 5 min. Pigg tallene er jevnt binned inn i tre skuffer og vises som stimulus-respons funksjoner i 4B, avslører høy reproduserbarhet i både respons magnitude (pigg nummer) og reaksjonsterskel.
Denne in vitro colorectum-nerve forberedelse tillater også lokal påføring av kjemikalier til afferente mottakelige avslutninger. Den eksponering for kjemikalier er begrenset til områdene rundt afferent RF ved å plassere messing eller rustfritt stålrør på toppen av kolorektal mucosa til fysisk isolere RF fra resten av colorectum. Typiske resultater følgende kjemiske midler omfatter: direkte aktivering av afferenter ved anvendelse av en syre hypertonisk oppløsning (AHS 26; Figur 5A), ingen aktivisering, men oppkjøpet av mechanosensitivity av en MIA etter påføring av en inflammatorisk suppe (IS 19; Figur 5B), økt respons (dvs. allergi) til mekanisk stretch etter påføring av IS (figur 5C), og redusert respons på mekanisk stretch etter påføring av cGMP (Figur 5D).

Figur 1. Skjematisk representasjon av det eksperimentelle oppsett. The colorectum-nerve plassert i en to-kammer vev kammeret og isoleres sammen med differensialforsterkeren hodet trinn fra et annet elektronisk utstyr på en Faraday-bur. Hver afferent RF er identifisert av elektrisk stimulering (e-Stim) av colorectum og testet av tre mekaniske stimuli: nylon monofilament sondering, slimhinne stryke, og omkrets strekning. ttps: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Klikk her for å se en større versjon av dette tallet.
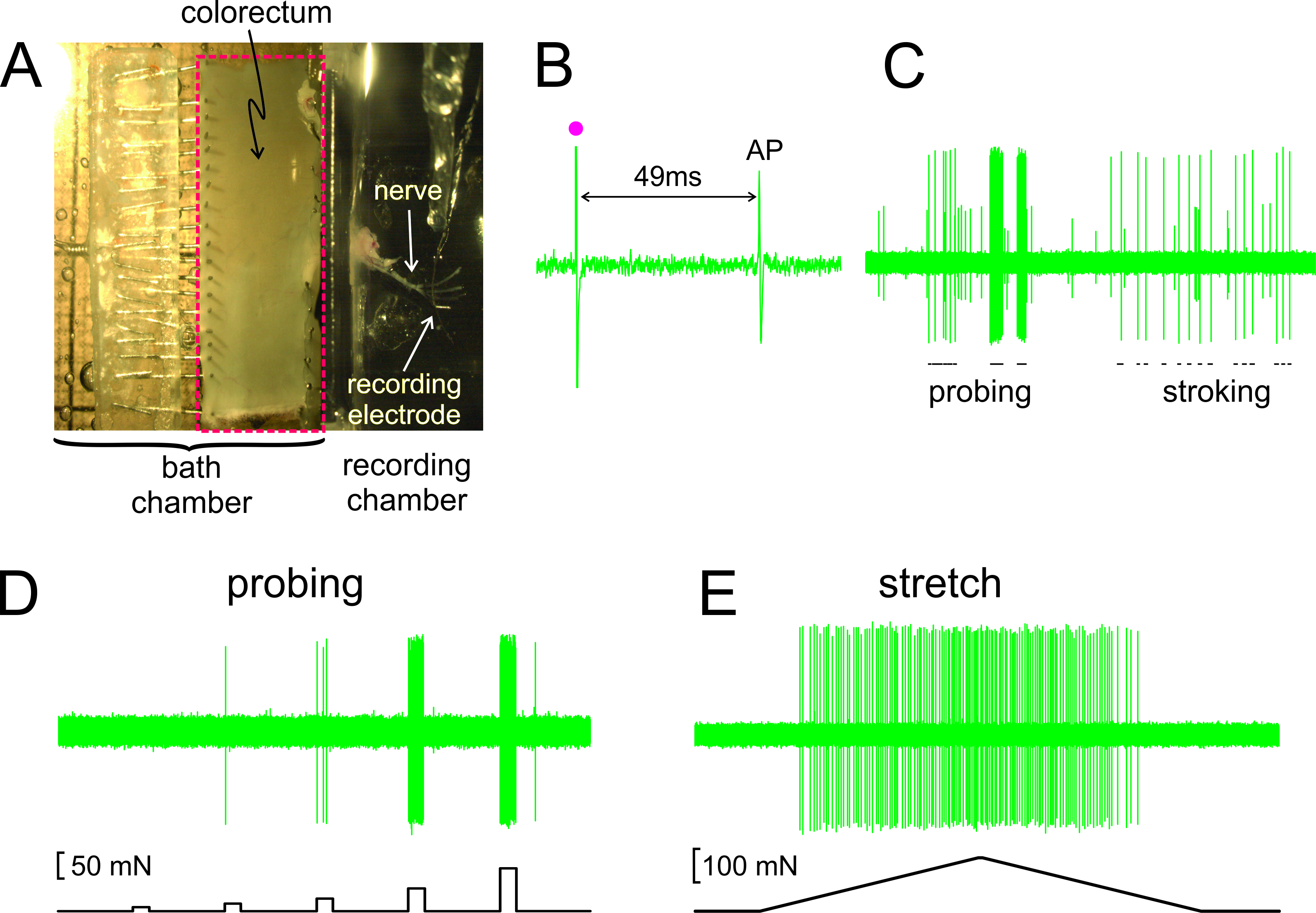
Figur 2. Et bilde gjennom stereo av dissekert colorectum med vedlagte pelvisnerven (A) B -. E viser representative poster. (B) En handling potensial (AP) fremkalt av elektrisk stimulering (stimulans gjenstand, •). (C) Typiske reaksjoner på håndholdte monofilament sondering og slimhinne stryke. (D, E) Responses to sondering og til omkrets strekning levert av datastyrt kraft aktuator, henholdsvis. Klikk her for å se en større versjon av dette tallet.

Figur 3. Funksjonell karakterisering av kolorektal afferente klasser. Afferenter ligger ved elektrisk stimulering (e-Stim, ↑) av colorectum og kategorisert i fem mechanosensitive klasser og en mekanisk-insensitive afferent (MIA) klasse basert på deres respektive responsprofiler til tre mekaniske stimuli:. sondering, stryke, og strekke Vennligst klikk her for å se en større versjon av dette tallet.

Figur 4. afferente svar på reproduserbar, datastyrt mekanisk stimulering. (A) Responses av en muskuløs-slimhinne enfferent til tre påfølgende trappet strekninger (0-170 mN ved 5 mN / sek, 5 min inter-stimulus intervall). (B) Responses (aksjonspotensial pigger) ble jevnt binned inn i tre binger (0-57, 57-113 og 113-170 mN) og vises som stimulus-respons funksjoner; reaksjonsnivå vises i det innfelte. Klikk her for å se en større versjon av dette tallet.

Figur 5. afferente respons på lokaliserte kjemisk påføring til mottakelige avslutninger. (A) Et eksempel på kjemosensitivitet av serøse afferent til anvendelse av sure hypertonisk oppløsning (AHS). (B) Et eksempel på kjøp av mechanosensitivity (allergi) etter en MIA slutt. Dette MIA ikke svare direktetil en inflammatorisk suppe (IS), men svarte til 1,4 g monofilament sondering etterpå. (C) Sensibilisering (en økning i respons magnitude og reduksjon i respons terskel) for å strekke en muskel afferent etter eksponering av sin avslutning på IS. (D) Demping av responsen å strekke av en muskuløs-slimhinnene afferent etter eksponering av sin avslutning på syklisk guanosinmonofosfat (cGMP). Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In vitro colorectum-nerve forberedelse beskrevet her har vist seg å være en kraftig tilnærming for å studere nevrale koding funksjoner av individuelle kolorektal afferenter, som pent utfyller andre ikke-funksjonelle tilnærminger (f.eks cellulære, molekylære og histologiske studier) på viscerale sensoriske nevroner ( se anmeldelse 27 for detaljer). Nevronale mekanismer som bidrar til nociception og langsiktig kolorektal overfølsomhet har blitt avslørt og farmakologiske manipulasjoner er utført som har avdekket mål som kunne lindre visceral smerte. Følgende hovedpunkter knyttet til en vellykket gjennomføring av dette preparatet er omtalt nedenfor: 1) reduksjon av elektrisk støy, 2) økning i signaldeteksjon, og 3) valg av en standardisert stimulans til å vurdere endringer av afferent koding. I tillegg er det flere begrensninger i denne teknikken diskutert.
Aksjonspotensialer (APS) propagating intracellulært langs nerveaxoner generelt har et transmembranpotensialet i 100 til 130 mV. Imidlertid, på grunn av den lille spesifikke kapasitansen axon membranen, bare resulterer denne relativt store depolarisering i en liten elektrisk ladning forskyvning gjennom cellemembranen, noe som lett kan forsvinne inn i det omkringliggende vev ekstracellulære / interstitiell fluid (som har en elektrisk impedans vesentlig lavere enn lipidmembranen). For ekstracellulære opptak fra nervetråder / axoner, er det elektriske signalet som regel i området fra mikrovolt, nær størrelsen av den termiske / hvit støy som er forbundet med en typisk bioelektriske opptak oppsett, rende støyreduksjon første prioritet for vellykket opptak. Til mest effektivt isolere fra ambient elektrisk støy, kan det være nyttig å plassere vev kammer, innspilling og jordingselektroder, differensialforsterker (DC batteridrevet) og stereomikroskopet i et Faraday bur. Hvis bevegelsesartefakters oppstå, plassere Faraday bur på en pneumatisk luft bordet for å dempe mekanisk vibrasjon er nyttig. Ideelt sett opptaket og referanseelektroder som kommer inn på "+" og "-" havner i differensialforsterkeren, henholdsvis bør ha sammenlign impedans i forhold til deres felles interesser og være lokalisert nær hverandre. Således vil en hvilken som helst ekstern støy registreres omtrent likt av begge elektroder og utsettes for de strenge felles modus avvisning av differensialforsterkeren.
I vårt oppsett (figur 2A), er referanseelektroden dyppet i Krebs-løsning perfusjon i vevet kammeret mens opptaks elektroden er i kontakt med en fin nerve filament av betydelig impedans. Dette enkelt-elektrodekonfigurasjon med en triviell impedans mistilpasning er vanligvis ikke ideelt for støyreduksjon. Men denne konfigurasjonen tilbyr bekvemmeligheten av å plassere fin nerve filament på bare ett elekode, noe som er spesielt attraktivt når du tar opp fra mus kolorektal nervetråder av begrenset lengde (10 - 15 mm). Basert på vår erfaring, er det enkelt-elektrode konfigurasjon akseptabelt når peak-to-peak bakgrunnsstøy er under 20 uV i posten. Ellers ville reduksjonen ytterligere støy krever en to-elektrodeopptakskonfigurasjon der den fine nerve filament har til å være i kontakt med begge opptak og referanseelektroder er lagt parallelt med hverandre. Alle de store metalldeler inne i Faraday bur må være jordet i et stjerne-lignende måte til en felles plattform, en kobberblokk i vår oppsett. Forsiktighet må tas for å unngå dannelse av jordsløyfer.
For å sikre ekstracellulære påvisning av APs, er første skritt vellykket disseksjon av colorectum-nervevev. Klemming eller trekke nerve under disseksjon må unngås, noe som kan gjøre ubotelig skade på nerve og påvirke AP ledning. Dissekert nerve stammen trenger også to være fri for hvilken som helst tilkoblet muskelvev, som lekker kalium når de blir skadet, og kan blokkere nerveledning ved depolarisering. Dette disseksjon ferdighet er vanligvis ervervet gjennom flittig praksis over uker til måneder og krever et høyt nivå av øye-hånd koordinasjon og fingerferdighet i håndtering og bruk av kirurgiske instrumenter. I tillegg, for å unngå skade på kolorektal vev, utnytter den elektriske søkestrategi en konsentrisk elektrode som har et butt, avrundet spiss, og med relativt stor diameter (utvendig Φ0.55 mm, indre Φ0.125 mm) og er forbundet med en mikromanipulator av et ettergivende bro, noe som resulterer i en beskjeden mekanisk kraft påføres til slimhinnen (~ 100 mg). For å skaffe et større signal i opptaket spor, må AP-indusert transmembranstrømmen til kanaliseres og "fanget" på elektroden ved å lage en liten impedans bro mellom nerve axon (e) og elektrodeoverflaten. Således epineurium og perineurium som isolerernerve trenger å bli dissekert fri under prosessen med å splitte nerve til fine filamenter av ~ 10 mikrometer tykt. På grunn av at AP-indusert transstrøm avleder betydelig innenfor en kort avstand fra membranen axon, resulterer en tynnere nerve filament vanligvis i et bedre signal-til-støy-forhold på grunn av aksonene 'tettere nærhet til elektrodeoverflaten. I mineralolje kammeret, speilet at nerven er plassert på ofte tiltrekker et tynt lag med Krebs-løsning (glassets overflate er hydrofil). Det er derfor nødvendig at opptakselektrode og nerve filament ikke er i kontakt med speiloverflaten under opptak. Eventuelle gjenværende dråper av Krebs-oppløsning, som gir en lav-impedans bro mellom elektroden og speiloverflaten (dvs. shunting) vil redusere signal amplituden i posten.
Dette colorectum-nerve forberedelse tillater studier av funksjonelle endringer av afferenter etter å eksponereRFS til en rekke kjemiske mediatorer og fornærmelser in vitro samt i sammenheng med langsiktige patofysiologiske tilstander (f.eks colorectums tatt fra tidligere behandlet mus). Et objektivt mål på funksjonelle endringer av afferenter avhenger av følgende: 1) et standardisert stimulus med høy presisjon og reproduserbarhet og 2) afferente responser som er robuste og reproduserbar. Av de tre mekaniske stimuli brukes på colorectum, sondering og streke stimuli av RF er ofte levert av håndholdte von Frey-lignende monofilamenter. For undersøkelser, er monofilament vanligvis kalibrert til å avgi en reproduserbar perpendikulær kraft når bøying. Imidlertid von Frey-lignende monofilamenter (0,4 og 1 g) har små og forskjellige tverrsnittsdiameter (0,2 og 0,3 mm, henholdsvis), som resulterer i en høy nominell spenning når de påføres vinkelrett på kolorektal overflate (124,8 kPa i 0,4 g og 138,7 kPa for 1 g), en intens, punktal mekanisk stimulans beyond det normale fysiologiske området. I tillegg er sannsynlig forårsaker den skarpe kanten av filamentet ujevn fordeling av spenninger med fokal topp spenning er betydelig høyere enn den nominelle spenning (spenningskonsentrasjon). Gitt at den typiske RF-størrelse (1 mm 2) er vesentlig større enn tverrsnittet av et monofilament, og manglende evne til å stimulere reproduserbart identisk område med en håndholdt monofilament, er det vanlig å observere responser til gjentatte stimuli som avviker betydelig i AP hyppighet og varighet. Som et eksempel, svarene på sondering vist i figur 2C ved samme håndholdt monofilament (1 g) variert betydelig som sannsynligvis blir bidratt til av en manglende evne til reproduserbart sondere identisk området og varierende varighet og intervall mellom påfølgende stimuli. Mucosal stryke levert av en håndholdt filament er like utfordrende og også en tendens til å fremkalle variable responser fra samme afferent. Stimulus reproduserbarhet kan væreforbedret ved hjelp av en datastyrt kraft aktuator å levere presise sondering (og strekk) styrker. For undersøkelser, bruker vi en monofilament med en større diameter (f.eks # 6.45, 1 mm) som mer fullstendig dekker et typisk afferent RF 24,28. Datastyrt omkrets strekning, i motsetning til andre vev strekker tilnærminger rettet til RF, tillater ensartet deformasjon i hele lengden av colorectum, noe som gjør det mulig å korrelasjon med kolorektal distensjon i sin opprinnelige sylindriske form, basert på sammenlignbare omkrets mekanisk stress (dvs. 0 - 170 mN strekningen tilsvarer 0-45 mm Hg intraluminal press 23). Siden strekkkraft påføres jevnt på det anti-mesenteriske kant, ikke direkte til RF, er den fremkalte lokale mekaniske påkjenninger ved afferent RF reproduserbar mellom påfølgende anvendelser av strekningen. I tillegg tilsettes den L-type Ca2 + kanalblokkere nifedipin til badet for å inhibit spontan glatt muskelkontraksjon, bidrar til vedlikehold av tykktarms samsvar mellom skråstrekktester 23. Endelig har de afferente respons på rampe strekning protokollen vist seg å være reproduserbar med liten variasjon i både den stimulus-responsfunksjonen og reaksjonsterskelen (som figur 4). Dermed har afferente svar på trappet strekning vært mye brukt som en objektiv vurdering av endringer av afferent funksjon i å studere nevrale mekanismer for visceral smerte og overfølsomhet (f.eks 19-22,24,26,28-31).
Den colorectum-nerve forberedelse er et kraftig verktøy for studiet av kolorektal viscerale afferenter. Men det har også noen begrensninger. Først blir aksonene av cellelegemer av de sensoriske nevroner i dorsal root ganglion transektert ved fremstillingen, hvilket utelukker studiet av molekylære identiteter av disse cellelegemer (f.eks enkelt celle RT-PCR eller transcriptome analyse av de forskjellige klasser av kolorektal afferenter). For det andre, det lave signal-til-støy-forholdet av enkeltfiberopptak krever optimale kirurgiske disseksjon / nerve knuse ferdigheter og lav støy opptak, i betydelig grad begrenser bredere anvendelse av denne protokollen i andre laboratorier. For det tredje kan dette in vitro forberedelse ikke være aktuelt for undersøkelser av systemiske faktorer som modulerer visceral sensasjon, slik som det autonome nervesystemet, sirkulerende hormoner og cytokiner, tarmfloraen, og synkende modulering fra sentralnervesystemet.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



