Abstract
Este video muestra en detalle una fibra única protocolo de registro electrofisiológico in vitro usando una preparación ratón colon y recto-nervio. El enfoque imparcial permite la identificación y caracterización funcional de los aferentes colorrectales individuales. Grabaciones extracelulares de los potenciales de acción se propagan (AP) que se originan en uno o unos pocos aferente (es decir, de una sola fibra) campos receptivos (FR) en el colon y recto están hechos de fascículos de fibras nerviosas burlado. El colon y recto se retira, ya sea con la pelvis (PN) o esplácnico lumbar (LSN) nervio conectado y abierto longitudinalmente. El tejido se coloca en una cámara de registro, clavado plana y perfundidos con solución de Krebs oxigenada. Estimulación eléctrica focal se utiliza para localizar las terminaciones aferentes colorrectales, que son probados además por tres estímulos mecánicos distintos (embotar sondeo, acariciando la mucosa y estiramiento circunferencial) para clasificar funcionalmente los aferentes en cinco mechanosensiclases tivas. Endings responden a ninguno de estos estímulos mecánicos se clasifican como aferentes mecánicamente insensibles (MIAs). Tanto mechanosensitive y MIAs pueden ser evaluados para la sensibilización (es decir, la respuesta mejorada, umbral reducido, y / o adquisición de mechanosensitivity) por la exposición localizada de RFs a los productos químicos (por ejemplo, sopa inflamatoria (IS), la capsaicina, el trifosfato de adenosina (ATP)). Describimos el equipo y preparación de grabación de colon y recto-nervio, la cosecha de colon y recto con PN adjunto o LSN, la identificación de los FR en el colon y recto, la grabación de una sola fibra de los fascículos nerviosos, y la aplicación localizada de productos químicos para la RF. Además, también se discuten los retos de la preparación y la aplicación de la estimulación mecánica estandarizada.
Introduction
El dolor y la hipersensibilidad son las quejas predominantes de pacientes que sufren de trastornos gastrointestinales funcionales, incluyendo el síndrome del intestino irritable (IBS), que existen en la ausencia de causa patobiológico aparente o daño tisular. Por ejemplo, los pacientes con SII presentan hipersensibilidad, incluyendo las respuestas aumentadas a la distensión rectal globo y aumento de la sensibilidad durante la función normal del intestino, así como hipersensibilidad de referencia somáticas (es decir, sensibilidad a la palpación de la zona abdominal) 1. Debido a la orientación aferentes colorrectal ha demostrado ser eficaz en el alivio de dolor e hipersensibilidad en los pacientes con SII (por ejemplo, la instilación intra-rectal de los anestésicos locales 2,3; ingestión oral de la guanilato ciclasa C agonista linaclotide 4-6), la mejora de la comprensión de la inervación aferente del colon y recto es importante.
Aferentes viscerales aferentes, incluyendo colorrectal, Son capaces de responder a las modalidades químicas / en nutrientes y térmicos (por ejemplo, 7-9). Sin embargo, los aferentes viscerales que responden a estímulos mecánicos (es decir, aferentes mechanosensitive) han sido el más estudiado, porque los estímulos mecánicos (por ejemplo, distensión luminal, estrías) son los que generalmente dan lugar a sensaciones conscientes, incluyendo malestar y dolor 10-16. Además, las vísceras también están inervadas por fibras aferentes mecánicamente insensibles (MIAs), comúnmente denominadas nociceptores silenciosos o para dormir 17. En condiciones fisiológicas normales, MIAs no responden a la estimulación mecánica o tienen muy alta respuesta umbrales de 18, pero pueden llegar a ser activa y adquirir mechanosensitivity en condiciones fisiopatológicas y contribuir a la hipersensibilidad.
Uso de la preparación in vitro y el protocolo descrito aquí, hemos desarrollado y empleamos una estrategia de estímulo eléctrico al mar RCH para terminaciones receptivo, que permitan identificar imparcial de ambas terminaciones mechanosensitive y MIA en el colon y recto 19. La inervación colorrectal se deriva de esplácnico lumbar (LSN) y el nervio pélvico (PN) itinerarios, e incluye los aferentes colorrectal que se pueden clasificar en cinco clases mechanosensitive (serosa, mucosa, muscular, músculo-mucoso, mesentéricos) y una clase MIA 20. Usando esta preparación in vitro, se encontró que MIAs colorrectales mechanosensitivity adquirida (sensibilizar) siguiente breve exposición de sus campos receptivos a una sopa inflamatoria (IS), que sensibiliza 71% de MIAs en la vía de PN y 23% de MIAs en la vía LSN 19. También documentamos sensibilización a largo plazo (hasta 28 días) de los desaparecidos en acción en el contexto de larga duración hipersensibilidad visceral comportamiento (es decir, en los ratones que recibieron tratamientos intracolónicas con zymosan 21 o ácido 2,4,6-trinitrobencenosulfónico (TNBS) 22) .
jove_content "> Entre los aferentes mechanosensitive, aferentes musculares y músculo-mucosas son las únicas clases que tónicamente codifican tramo circunferencial del colon y recto (es decir, son sensibles al estiramiento) y estar al servicio de la codificación de la distensión colorrectal nociva 23,24. El uso de un controlado por ordenador la fuerza del actuador, se aplicó un estándar, homogéneo, y el estiramiento en rampa reproducible en la dirección circunferencial del tejido colorrectal aplanada y clasifican además aferentes sensibles al estiramiento como de bajo umbral y de alto umbral 23. Además, el curso temporal de la sensibilización de estiramiento aferentes -sensibles después zimosan intracolónica 21 o 22 TNBS tratamiento corresponde a la aparición, persistencia y / o recuperación de la hipersensibilidad visceral de comportamiento, lo que sugiere un papel de los aferentes colorrectales sensibles al estiramiento en el dolor visceral e hipersensibilidad.Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Este protocolo fue revisado y aprobado por la Universidad de Pittsburgh Institucional Cuidado de Animales y el empleo Comisión.
1. Preparación de la solución de Krebs modificada y Prueba de la Droga alícuotas
- Hacer 6 L de solución de Krebs modificada que contiene (en mM): NaCl 117,9, KCl 4,7, 25 NaHCO 3, 1,3 NaH 2 PO 4, 1.2 MgSO 4, 2.5 CaCl 2, 11,1 D-glucosa, butirato de 2 de sodio, acetato de sodio 20 , 0.004 nifedipina (para bloquear las contracciones musculares espontáneas), y 0,003 de indometacina (para bloquear la síntesis de prostaglandinas endógenas). Utilice soluciones de Krebs hielo frío y caliente para la disección de tejidos y la grabación de una sola fibra, respectivamente.
- Preparar las soluciones químicas (por ejemplo, IS, la capsaicina, ATP) en alícuotas a concentraciones deseadas.
2. La disección del nervio del tejido colorrectal-
- Anestesiar y eutanasia ratones machos (6-8 semanas de edad, 20 - 30 g) enuna cámara de CO 2 a un caudal que desplaza 10 a 30% de volumen de la cámara por minuto hasta que los ratones deje de respirar por completo como se indica por la ausencia de movimiento del pecho.
- Inmediatamente después de la eutanasia, Exsanguinate cortando abierta la cámara torácica, perforando la aurícula derecha, y sumergir el cadáver del ratón en un amplio volumen (~ 500 ml) de helado de Krebs (4 ° C) solución burbujea con carbógeno (95% de O2 , 5% de CO 2).
- Retire con cuidado todas las vísceras, pero los órganos de colon y de la pelvis. Transecto el ratón en un medio a través del segmento vertebral T12 ligeramente por encima del diafragma torácico y transferir la mitad caudal a una cámara de disección que contiene hielo frío, burbujear solución de Krebs.
- Bajo un microscopio estereoscópico, retire la vejiga y los órganos reproductivos por transección en sus uniones a la uretra, y retire la descendente / aorta abdominal hasta que se bifurca en las arterias ilíacas comunes. Libertad para los PN o el LSN de su surrounding tejidos mediante disección roma y seguir el nervio desde fuera de la cresta ilíaca hasta su punto de entrada ventral en la L6 y S1 columna vertebral (por PN) o T13 y L1 columna vertebral (por LSN).
- Cortar la sínfisis púbica y la derecha y articulaciones acetábulo izquierdo, y quitar el hueso ilíaco. Con cuidado, libre ya sea el PN o LSN de los músculos adheridos y tejido conectivo de cerca del colon y recto hasta donde el nervio entra en la columna vertebral.
- Resecar con cuidado el hueso ilíaco para exponer el colon y recto distal. Diseccionar el colon y recto distal con el PN adjunto o LSN en continuo.
- Transferir el colon y recto con el nervio unido al compartimento de baño de la cámara de tejido. Quitar el tejido conectivo excesivo por más de disección, y abrir el colon y recto longitudinalmente a lo largo de la frontera anti-mesentérica.
- Con el lado de la mucosa hacia arriba, el pin del borde mesentérico del colon y recto junto al compartimento de registro en la base de silicona de la chamber y adjuntar la longitud del colon y recto antimesenteric a un rastrillo de ganchos conectados a un accionador de fuerza (ilustrado en la Figura 1 y se fotografió en la Figura 2A).
- Extender el PN o LSN en el compartimento de la grabación, que está conectada al compartimiento de baño por un agujero del ratón y la puerta. Coloque suavemente el tronco nervioso a un pequeño espejo de cristal en el compartimiento de la grabación, lo que proporciona una superficie hidrófila para el nervio que adherirse. Superfuse el compartimiento de baño con agua caliente (30-32 ° C), solución de Krebs oxigenada y llenar el compartimento de grabación con aceite mineral.
3. sola fibra de grabación y localización del campo receptivo
- Retire con cuidado la espalda epineurio (vaina nerviosa) de la PN o LSN bajo el microscopio estereoscópico a gran aumento (50 - 60X). Con unas pinzas finas, se burlan del tronco nervioso en 5-8 haces nerviosos de ~ 100 micras de espesor.
- Coloque la referencia de platino-iridioelectrodo en contacto con la solución de Krebs en la cámara de tejido. Colocar secuencialmente los haces de nervios individuales en el electrodo de registro hecha del mismo material.
- Utilice un pincel suave para evocar APs de los aferentes colorrectales por acariciar suavemente hacia arriba y abajo de la superficie colorrectal. Busque el paquete (s) de nervios que inervan el colon a través de AP detectable (potencial de acción) grabaciones.
NOTA: La PN y LSN también inervan la vejiga urinaria y otros órganos pélvicos. - Use un par de 30 puntas de las agujas G para dividir aún más el conjunto de nervios en filamentos finos fascículos de ~ 10 micras de espesor y colocar un filamento individual sobre el electrodo de registro.
- Coloque el electrodo concéntrico de punta redonda perpendicular a la superficie de la mucosa para excitar eléctricamente terminaciones aferentes en la intensidad del estímulo por encima del umbral (10 mA magnitud, 0,5 mseg de duración @ 0,3 Hz), que produce un radio ~ 2 mm de propagación actual. Mueva el electrodo de forma sistemática (~ 1,5 mm pasos) A lo largo de la longitud y la anchura del colon y recto aplanado para localizar terminaciones receptivas.
- Cuando se excita un final aferente, ajuste la posición del electrodo para localizar el sitio de activación (campo receptivo, RF) que requiere la intensidad del estímulo mínimo (umbral de estímulo). Deseche terminaciones con un umbral de estímulo> 3 mA 19.
- Calcular la velocidad de conducción (CV) a partir de 1) la distancia entre el electrodo de estimulación en el campo receptivo (RF) y el sitio de grabación y 2) el retraso de la conducción (por ejemplo, la Figura 2B) entre el artefacto del estímulo y el inicio del potencial de acción .
CV (m / seg) = distancia (mm) / retraso de la conducción (ms).
4. Clasificación Funcional de mechanosensitive colorrectales Aferentes
- Después de localizar una RF mediante la estimulación eléctrica, aplique los tres estímulos mecánicos siguientes a la RF:
- Llevar a cabo el estímulo sondeo presionando la punta de una calibraciónmonofilamento ted von Frey-como el nylon (0,4 y 1 g fuerza) perpendicularmente hacia la RF en el colon y recto aplanada.
- Llevar a cabo el estímulo acariciando por acariciar suavemente la mucosa colorrectal con un filamento de nylon fino (10 mg fuerza) para generar una pequeña tensión de corte superficial en la RF.
- Realizar el tramo circunferencial utilizando una fuerza de accionamiento controlado por ordenador, que proporciona una fuerza de estiramiento en rampa (0-170 MN en 5 mN / seg) en dirección circunferencial a lo largo del borde anti-mesentérico del colon y recto a través de la comisión de ganchos que se describen en el paso 2.8 .
- Clasificar los aferentes como serosa (responder sólo a despuntar sondeo), la mucosa (responder a la mucosa acariciando y embotar sondeo), muscular (responder a tramo circunferencial y embotar sondeo) musculoso / mucosa (responder a tramo circunferencial, acariciando la mucosa y embotar sondeo), o MIA (no sensible a cualquiera de los tres estímulos mecánicos).
- Para aferentes mesentéricas (sólo enla inervación LSN) que son difíciles de activar selectivamente mediante estimulación eléctrica, localizar sus terminaciones receptivas por caricias mecánica / sondeo del mesenterio.
- Para aferentes sensibles al estiramiento (muscular y músculo-mucosas), determinar el umbral de respuesta, que se define como la fuerza que evoca la primera AP durante tramo en rampa.
- Para los aferentes serosas, grabar sus respuestas a ascendiendo niveles de puntiforme de sondeo del campo receptivo impulsado por la fuerza del actuador controlado por ordenador.
5. Aplicación Química / Modulación de Endings Receptivo
- Grabar una respuesta de línea de base a un estímulo mecánico (es decir, la respuesta al tramo en rampa, punteada de sondeo, o acariciando la mucosa).
- Escudo del borde inferior de un trozo de tubo (latón o acero inoxidable, 10 mm de alto y 4 x 4 mm 2 plaza o 4-5 mm de diámetro) con vaselina y colóquelo sobre el campo receptivo en el colon y recto.
- Quitarla solución de Krebs dentro de la tubería, y exponer el final receptivo durante 3 - 5 min a 170 l de la solución que contiene la sustancia química (s) a ensayar.
- Monitorear la respuesta de la aferente durante la aplicación química (algunas aferentes son quimiosensible).
- Retire la solución química y la tubería para finalizar la operación de la sustancia química. Dentro de 4 - 6 min, probar la respuesta aferente al mismo estímulo mecánico como en la respuesta de línea base.
- Volver a aplicar el estímulo mecánico de nuevo después de un período suficiente de wash-out (> 15 min).
6. picos de grabación y Discriminar AP
- Digitalizar las señales eléctricas registradas de axones a 20 kHz y guardar los datos en una computadora. Monitorizar la señal en línea por un monitor de audio.
- Analizar los picos de AP fuera de línea y discriminar unidades individuales basados en el análisis de componentes principales de las formas de onda de pico individuales 25.
NOTA: Un registro no debe contener más ésimoun dos unidades activas fácilmente discernibles.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La configuración se ilustra en la Figura 1. Incluye una cámara de tejido a medida que alberga el colon y recto en un baño de silicona compartimento forrado y el nervio adjunto en un compartimento lleno de aceite mineral contigua. La cámara de dos compartimentos fue a máquina de un bloque sólido de plástico acrílico por una máquina de CNC; la parte inferior de ambos compartimentos fue posteriormente revestido con silicona firme para permitir una fácil pin abajo del tejido colorrectal. AP extracelulares de fascículos nerviosos burlado se registran utilizando un amplificador diferencial de bajo ruido de baterías con una relación de rechazo de modo común de alta (CMRR ~ 60 dB). La ganancia del amplificador se establece en el rango de X 10.000 y filtro de banda de 0,3 a 10 kHz. La estimulación eléctrica del colon y recto es entregado por un estimulador acoplado ópticamente en modo de corriente constante a través de un electrodo concéntrico en contacto con la mucosa colorrectal. La estimulación mecánica (tramo colorrectal y puntiforme sondeo) es entregado por acomputer controlado por la fuerza del actuador. Un convertidor AD y software apropiado supervisan tanto los procesos de estimulación y de registro mediante el envío de comandos de salidas de voltaje para iniciar estímulos mecánicos y eléctricos, así como la grabación y digitalización de las señales extracelulares AP desde el amplificador diferencial. Para aislar a partir de fuentes de ruido mecánico y eléctrico, la cámara de tejidos, microscopio y amplificador diferencial se colocan dentro de una jaula de Faraday montado en una mesa de aire neumático.
Como se muestra en la Figura 2A, el colon y recto con el nervio adjunto se diseccionó de un ratón, cortada abierta a lo largo del borde anti-mesentérico y fijó plana en la cámara de tejido de silicona forrada; el nervio se coloca en un espejo de cristal en la cámara de grabación adyacente. Se muestra en la Figura 2B es un registro representativo de un potencial de acción (AP) en respuesta a la estimulación eléctrica de la RF en el umbral. La AP en este disco va a la zaga del arte estímuloifact (•) por 49 mseg debido al retraso de la conducción de la RF al electrodo de grabación, lo que resulta en una velocidad de conducción calculado de 0,43 m / seg, bien en el rango de un C-fibra amielínicas. Muestran en la Figura 2C son respuestas típicas de un aferente a los estímulos entregados por mano (sondeo de la RF con monofilamentos von Frey-como, 1 g, y acariciar la mucosa fina de la RF, 10 mg). Este registro contiene dos aferentes fácilmente discernibles; sólo el gran amplitud aferente responde a las caricias. Como se muestra en la Figura 2D, las respuestas aferentes a sondear También se evaluaron por una fuerza de accionamiento controlado por ordenador que proporciona al mismo sitio en el colon y recto una serie de fuerzas mecánicas precisamente cronometrados y reproducibles (5, 10, 20, 40 y 80 mN, 5 segundos de duración). Del mismo modo, tramo circunferencial del colon y recto (0-170 MN en 5 mN / seg) es entregado por el mismo actuador con una respuesta representativa se muestra en la Figura 2E
Como se muestra en la Figura 3, los aferentes colorrectales pueden ser funcionalmente clasifican en seis clases basadas en sus perfiles de respuesta a estímulos mecánicos tres distintos (véase el paso 4.2 anterior). Todas las terminaciones aferentes a excepción de los aferentes mesentéricas fueron localizados por la estimulación eléctrica (e-stim, más a la izquierda la columna, las flechas indican estímulo artefacto). Mecánicamente aferentes insensibles (MIAs) no responden a ninguno de los tres estímulos mecánicos. En contraste, todos los finales mechanosensitive responden a sondaje (0,4-1,4 g). Entre ellos, las terminaciones musculares y muscular-mucosas también son activados por estiramiento circunferencial (0 a 170 mN), y por lo tanto se denominan aferentes sensibles al estiramiento; terminaciones músculo-mucosas también se activan por acariciar (10 mg). Terminaciones de la mucosa también se activan por acariciar (10 mg), pero no se estiran y terminaciones serosas no se activan ya sea por estiramiento o caricias. Terminaciones mesentéricos se identifican por mecánicamente bcorriendo el mesenterio.
Se muestra en la Figura 4A son respuestas representativas de un aferente-tramo sensible evocado por tres tramos circunferenciales consecutivas separadas por 5 min. Los número de espigas se han agrupado de manera uniforme en tres contenedores y se muestran como funciones de estímulo-respuesta en la figura 4B, revelando una alta reproducibilidad tanto en magnitud de respuesta (número pico) y el umbral de respuesta.
Esta preparación colon y recto-nervio in vitro también permite la aplicación local de productos químicos aferente terminaciones receptivos. La exposición a productos químicos se limita a regiones de todo el aferente RF mediante la colocación de latón o de tubo de acero inoxidable encima de la mucosa colorrectal para aislar físicamente la RF del resto del colon y recto. Los resultados típicos después de la aplicación química incluyen: la activación directa de los aferentes tras la aplicación de una solución hipertónica de ácido (AHS 26; Figura 5A), sin activación, pero la adquisición de mechanosensitivity por un MIA después de la aplicación de una sopa inflamatoria (IS 19; Figura 5B), aumento de la respuesta (es decir, la sensibilización) a estiramiento mecánico después de la aplicación de la SI (Figura 5C), y reducción de la respuesta al estiramiento mecánico después de la aplicación de cGMP (Figura 5D).

Figura 1. Representación esquemática de la configuración experimental. El colon y recto-nervio se coloca en una cámara de tejido de dos compartimentos y se aisló junto con la etapa de la cabeza amplificador diferencial de otros equipos electrónicos por una jaula de Faraday. Cada aferente RF se identifica por la estimulación eléctrica (e-stim) del colon y recto y probado por tres estímulos mecánicos: monofilamento de nylon de sondeo, acariciando la mucosa y estiramiento circunferencial. TTP: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
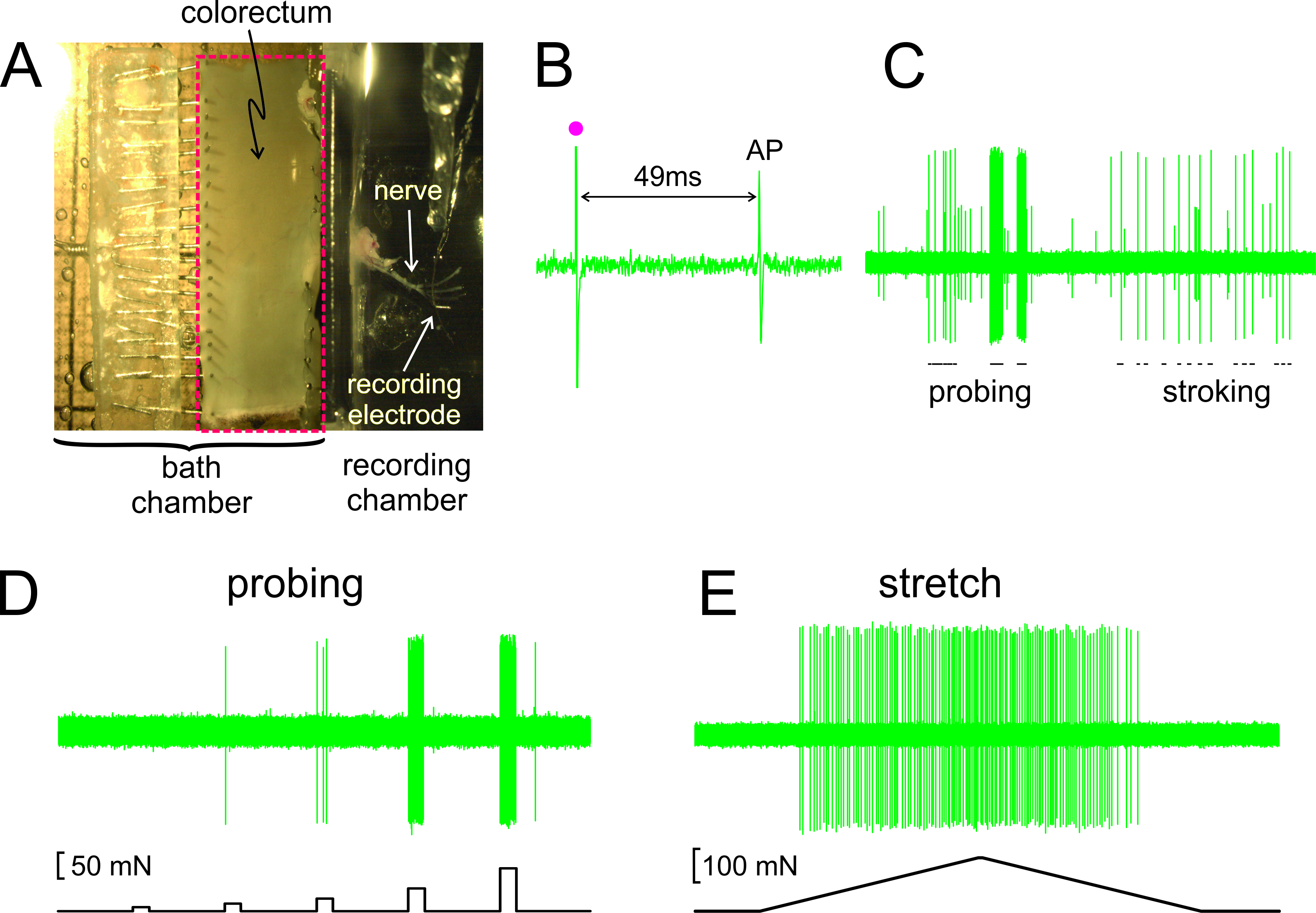
Figura 2. Una imagen a través del microscopio estereoscópico del colon y recto diseccionado con nervio pélvico adjunto (A). B - E muestran registros representativos. (B) Un potencial de acción (AP) evocado por la estimulación eléctrica (artefacto de estímulo, •). (C) Las respuestas típicas de monofilamento sondaje y acariciando la mucosa de mano. (D, E) Las respuestas al sondeo y al tramo circunferencial entregado por el actuador fuerza controlada por ordenador, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Caracterización funcional de clases aferentes colorrectales. Aferentes se encuentran por la estimulación eléctrica (e-stim, ↑) del colon y recto y se clasifican en cinco clases mechanosensitive y uno aferente mecánicamente insensible clase (MIA) basadas en sus respectivos perfiles de respuesta a tres estímulos mecánicos:. sondeo, acariciando, y estirar Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Respuestas aferentes a, la estimulación mecánica reproducible controlado por ordenador. (A) Las respuestas de un músculo-mucoso unferente a tres consecutivos rampa tramos (0-170 mN a 5 mN / seg; 5 min de intervalo entre estímulos). (B) Respuestas (potenciales de acción picos) se binned uniformemente en tres contenedores (0-57, 57-113 y 113-170 MN) y se muestran como funciones de estímulo-respuesta; umbral de respuesta se muestra en el recuadro. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Respuestas aferentes a la aplicación química localizada a receptivas terminaciones. (A) Un ejemplo de quimiosensibilidad de un aferente serosal a la aplicación de la solución hipertónica ácido (AHS). (B) Un ejemplo de adquisición de mechanosensitivity (sensibilización) por un MIA final. Este MIA no respondió directamentea una sopa inflamatoria (IS), pero respondió a 1,4 g de monofilamento de sondeo después. (C) Sensibilización (un aumento en la magnitud de la respuesta y la reducción en el umbral de respuesta) para estirar de un aferente musculares después de la exposición de su final para IS. (D) La atenuación de la respuesta a estirar por un aferente-muscular de la mucosa después de la exposición de su finalización para el monofosfato de guanosina cíclico (GMPc). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
El vitro preparación colon y recto-nervio en descrito aquí ha demostrado ser un poderoso enfoque para estudiar las funciones de codificación neural de aferentes colorrectales individuales, que complementa muy bien con otros métodos no funcionales (por ejemplo, estudios celulares, moleculares e histológicos) sobre las neuronas sensoriales viscerales ( ver el comentario 27 para más detalles). Mecanismos neuronales que contribuyen a la nocicepción y la hipersensibilidad colorrectal a largo plazo han sido revelados y manipulaciones farmacológicas se han realizado que tiene objetivos reveladas que podrían aliviar el dolor visceral. Los siguientes puntos clave asociados con la implementación exitosa de esta preparación se discuten a continuación: 1) reducción de ruido eléctrico, 2) aumento de la detección de la señal, y 3) la selección de un estímulo estandarizado para evaluar los cambios de codificación aferente. Además, se discuten varias limitaciones de esta técnica.
Los potenciales de acción (AP) propagating intracelularmente a lo largo de los axones del nervio generalmente tienen un potencial transmembrana de 100 a 130 mV. Sin embargo, debido a la pequeña capacitancia específica de la membrana del axón, esta relativamente grande despolarización sólo resulta en un pequeño desplazamiento de carga eléctrica a través de la membrana celular, que puede disipar fácilmente en el tejido extracelular / líquido intersticial que rodea (que tiene una impedancia eléctrica considerablemente más baja que la membrana lipídica). Para la grabación extracelular a partir de filamentos nerviosas / axones, la señal eléctrica es por lo general en el rango de microvoltios, cerca de la magnitud del ruido térmico / blanco asociado con una configuración típica de grabación bioeléctrica, haciendo que la reducción de ruido de la primera prioridad para la grabación éxito. Para aislar más eficaz del ruido eléctrico del ambiente, puede ser útil colocar las cámaras de tejido, de grabación y de puesta a tierra electrodos, el amplificador diferencial (batería de potencia DC) y el microscopio estereoscópico en una jaula de Faraday. Si el movimiento del artefactos ocurren, la colocación de la jaula de Faraday en una mesa de aire neumático para amortiguar las vibraciones mecánicas es útil. Lo ideal es que los electrodos de registro y de referencia que entran en el signo "+" y "-" puertos del amplificador diferencial, respectivamente, deben tener comparable impedancia relativa a sus puntos en común y se encuentra cerca de la otra. Por lo tanto, cualquier ruido externo se grabará por igual por ambos electrodos y se sometió a la estricta rechazo de modo común por el amplificador diferencial.
En nuestra configuración (Figura 2A), el electrodo de referencia se sumerge en la solución de perfusión Krebs en la cámara de tejido mientras que el electrodo de registro está en contacto con un filamento nervio multa de considerable impedancia. Esta configuración con un solo electrodo con una falta de concordancia no trivial no suele ser ideal para la reducción de ruido. Sin embargo, esta configuración ofrece la oportunidad de colocar el filamento nervio fino en una sola electroda, que es particularmente atractivo cuando se grabe de ratón filamentos nerviosos colorrectales de longitud limitada (10 a 15 mm). En base a nuestra experiencia, la configuración de un solo electrodo es aceptable cuando el ruido de fondo de pico a pico es inferior a 20 mV en el registro. De lo contrario, la reducción aún más el ruido exigiría una configuración de grabación de dos electrodos en la que el filamento del nervio fina tiene que estar en contacto con ambos electrodos de registro y de referencia colocados en paralelo entre sí. Todas las piezas grandes de metal dentro de la jaula de Faraday necesario conectar a tierra de forma de estrella con una base común, un bloque de cobre en nuestra configuración. El cuidado tiene que ser tomado para evitar la formación de bucles de masa.
Para asegurar la detección extracelular de puntos de acceso, el primer paso es la disección éxito del tejido de colon y recto-nervio. Pellizcos o tirando del nervio durante la disección se debe evitar, que puede dañar irreversiblemente el nervio y afectar AP conducción. El vástago del nervio diseccionado también necesita to estar libres de cualquier tejido muscular conectado, que se escapa de potasio cuando se daña y puede bloquear la conducción nerviosa por la despolarización. Esta habilidad disección se adquiere generalmente a través de la práctica diligente durante semanas o meses y exige un alto nivel de coordinación ojo-mano y la destreza en el manejo y uso de los instrumentos quirúrgicos. Además, para evitar daños en el tejido colorrectal, la estrategia de búsqueda eléctrica utiliza un electrodo concéntrico que tiene un objeto contundente, punta redondeada y relativamente gran diámetro (externo Φ0.55 mm, interna Φ0.125 mm) y está conectado a un micromanipulador por un puente compatible, resultando en una fuerza mecánica modesta aplica a la superficie de la mucosa (~ 100 mg). Con el fin de adquirir una señal más grande en la traza de la grabación, la corriente transmembrana inducida por AP debe ser canalizado y "atrapado" en el electrodo mediante la creación de un pequeño puente de impedancias entre el axón (s) del nervio y la superficie del electrodo. Así, el epineurio y perineuro que aíslannecesita ser diseccionado libre durante el proceso de dividir el nervio en filamentos finos de ~ 10 m de grosor del nervio. Debido a que la corriente transmembrana inducida por AP se disipa considerablemente dentro de una corta distancia de la membrana del axón, un filamento delgado nervio generalmente resulta en una mejor relación de señal a ruido debido a la mayor proximidad de los axones 'a la superficie del electrodo. En la cámara de aceite mineral, el espejo que el nervio se coloca sobre atrae a menudo una capa delgada de solución de Krebs (la superficie de vidrio es hidrófilo). Por tanto, es necesario que el electrodo de registro y el filamento nervio no están en contacto con la superficie del espejo durante la grabación. Cualquier gota residuales de solución de Krebs, que proporcionan un puente de baja impedancia entre el electrodo y la superficie del espejo (es decir, la derivación) reducirán considerablemente la amplitud de la señal en el registro.
Esta preparación colon y recto-nervio permite el estudio de los cambios funcionales de los aferentes después de exponerRFs a una variedad de mediadores químicos y los insultos in vitro, así como en el contexto de condiciones fisiopatológicas a largo plazo (por ejemplo, colorectums tomadas de ratones tratados previamente). Una medida objetiva de los cambios funcionales de los aferentes depende de los siguientes: 1) un estímulo estandarizado con alta precisión y reproducibilidad y 2) las respuestas aferentes que son robustos y reproducibles. De los tres estímulos mecánicos aplicados al colon y recto, de sondeo y acariciando los estímulos de la RF a menudo proceden de von Frey-monofilamentos como portátiles. Para el sondeo, el monofilamento se calibra generalmente para entregar una fuerza perpendicular reproducible cuando se dobla. Monofilamentos Sin embargo, von Frey-como (0,4 y 1 g) tienen diámetros transversales pequeñas y diferentes (0,2 y 0,3 mm, respectivamente), lo que resulta en una alta tensión nominal cuando se aplica perpendicular a la superficie colorrectal (124,8 kPa de 0,4 g y 138,7 kPa durante 1 g), un intenso estímulo mecánico, punteada Beyond del intervalo fisiológico normal. Además, el borde afilado del filamento probable que provoca una distribución desigual de las tensiones con pico de estrés focal considerablemente más alta que la tensión nominal (concentración de tensiones). Dado que el tamaño típico de RF (1 mm 2) es significativamente mayor que la sección transversal de un monofilamento, y la incapacidad para estimular de forma reproducible el sitio idéntico a un monofilamento de mano, es común observar las respuestas a los estímulos repetidos que difieren significativamente en frecuencia y duración AP. Como ejemplo, las respuestas a sondeo muestra en la Figura 2C por el mismo monofilamento de mano (1 g) varió considerablemente probable que se aportan a por la incapacidad de la sonda de forma reproducible el sitio idénticos y duración variable y el intervalo entre los estímulos consecutivos. Mucosa acariciando entregado por un filamento de mano es igualmente difícil y también tiende a evocar respuestas variables de la misma aferente. Reproducibilidad estímulo puede sermejorado mediante el uso de un actuador de fuerza controlado por ordenador para entregar fuerzas precisas de sondeo (y estiramiento). Para el sondeo, se utiliza un monofilamento con un diámetro mayor (por ejemplo, # 6.45, 1 mm) que cubre más plenamente un típico RF aferente 24,28. Controlado por ordenador estiramiento circunferencial, a diferencia de otros enfoques de tejido de estiramiento dirigidas a la RF, permite la deformación homogénea en toda la longitud del colon y recto, lo que hace posible la correlación con la distensión colorrectal en su configuración cilíndrica original, en base a la tensión mecánica circunferencial comparable (es decir, 0 - 170 mN tramo es equivalente a 0-45 mm Hg de presión intraluminal 23). Dado que la fuerza de estiramiento se aplica uniformemente en el borde anti-mesentérico, no directamente a la RF, la tensión mecánica local evocado en el aferente RF es reproducible entre las aplicaciones consecutivas de estiramiento. Además, el tipo L Ca 2+ bloqueador del canal de nifedipina añadió al baño para inhibit contracción del músculo liso espontáneo, contribuye al mantenimiento de cumplimiento colorrectal entre las pruebas de estiramiento 23 en rampa. Finalmente, las respuestas aferentes en el Protocolo de estiramiento en rampa han demostrado ser reproducible con una pequeña variabilidad tanto en el umbral de la función de estímulo-respuesta y la respuesta (por ejemplo, la Figura 4). Por lo tanto, las respuestas aferentes para estirar en rampa se han usado ampliamente como una evaluación objetiva de los cambios de la función aferente en el estudio de los mecanismos neuronales de dolor visceral y la hipersensibilidad (por ejemplo, 19-22,24,26,28-31).
La preparación de colon y recto-nervio es una poderosa herramienta para el estudio de los aferentes viscerales colorrectales. Sin embargo, también tiene algunas limitaciones. En primer lugar, los axones de los cuerpos celulares de las neuronas sensoriales en el ganglio de la raíz dorsal se seccionan en la preparación, lo que impide el estudio de las identidades moleculares de los cuerpos celulares (por ejemplo, una sola célula RT-PCR o transcriptome análisis de las diferentes clases de aferentes colorrectal). En segundo lugar, la baja relación señal-ruido de la grabación de una sola fibra exige disección / habilidades división óptimas quirúrgicos nerviosas y grabación de bajo nivel de ruido, lo que limita significativamente mayor aplicación de este protocolo en otros laboratorios. En tercer lugar, esta preparación in vitro puede no ser aplicable a las investigaciones de los factores sistémicos que modulan la sensación visceral, tales como el sistema nervioso autónomo, que circula hormonas y citoquinas, microbiota intestinal, y la modulación descendente desde el sistema nervioso central.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



