Abstract
Deze video toont in detail een in vitro single-fiber elektrofysiologische opname protocol met behulp van een muis colorectum-zenuw voorbereiding. De aanpak maakt het mogelijk onpartijdige identificatie en functionele karakterisatie van individuele colorectale afferenten. Extracellulaire opnames van gekweekte actiepotentialen (AP's) die afkomstig zijn van één of enkele afferente (dwz één vezel) receptieve velden (RFs) in de dikke darm zijn gemaakt van geplaagd zenuwvezel bundels. De dikke darm is verwijderd met ofwel het bekken (PN) of lumbale splanchnisch (LSN) zenuw bevestigd en lengterichting geopend. Het weefsel wordt in een opname kamer, vastgemaakt vlak en geperfuseerd met geoxygeneerde Krebs oplossing. Focal elektrische stimulatie wordt gebruikt om de colorectale afferente uitgangen, die verder worden getest door drie verschillende mechanische stimuli lokaliseren (blunt sonderen, mucosale strelen en omtrek rek) functioneel categoriseren afferente in vijf mechanosensitieve klassen. Endings reageren op geen van deze mechanische stimuli zijn gecategoriseerd als mechanisch-ongevoelige afferentia (MIA). Zowel mechanosensitieve en MIA kan worden beoordeeld sensibilisatie (bijv verbeterde respons, verminderde drempel en / of verwerving van mechanische gevoeligheid) van plaatselijke blootstelling van RFs voor chemicaliën (bijvoorbeeld inflammatoire soep (IS), capsaïcine, adenosine trifosfaat (ATP)). We beschrijven de apparatuur en de dikke darm-zenuw opname voorbereiding, de oogst van colorectum met aangehechte PN of LSN, identificatie van RFs in de dikke darm, single-fiber opname van zenuw bundels, en gelokaliseerde toepassing van chemicaliën om de RF. Bovendien worden problemen van het preparaat en gestandaardiseerde mechanische stimulatie besproken.
Introduction
Pijn en overgevoeligheid zijn de belangrijkste klachten van patiënten met functionele gastro-intestinale aandoeningen, waaronder prikkelbare darmsyndroom (IBS), die bestaan geen zichtbare pathobiological oorzaak of weefselschade. Bijvoorbeeld, IBS-patiënten vertonen overgevoeligheid, waaronder verhoogde respons op rectale ballondilatatie en verhoogde gevoeligheid tijdens normale darmfunctie, evenals overgevoeligheid somatische verwijzing (dwz tederheid palpatie van de buik) 1. Omdat targeting colorectale afferentia heeft bewezen effectief bij het verlichten van pijn en overgevoeligheid bij IBS-patiënten (bijvoorbeeld intra-rectale instillatie van lokale anesthetica 2,3; orale inname van de guanylaatcyclase-C-agonist linaclotide 4-6) te zijn, een beter begrip van de afferente innervatie van de dikke darm is belangrijk.
Visceraal afferente zenuwbanen, met inbegrip van colorectale afferenten, Kunnen reageren op chemische / voedselrijke en thermische modaliteiten (bijvoorbeeld 7-9). Echter, visceraal afferente zenuwbanen reageren op mechanische stimuli (dwz mechanosensitieve afferentia) zijn de meest grondig bestudeerd omdat mechanische stimuli (bv luminaal buik, stretch) zijn degenen die in het algemeen leiden tot bewuste sensaties, met inbegrip van ongemak en pijn 10-16. Daarnaast worden de ingewanden ook geïnnerveerd door het mechanisch ongevoelig afferenten (MIA), algemeen bekend als stille of slapen nociceptoren 17. Onder normale fysiologische omstandigheden, hoeft MIA niet reageren op mechanische stimulatie of hebben een zeer hoge respons drempels 18, maar kan actief worden en het verwerven van mechanische gevoeligheid in pathofysiologische omstandigheden en bij te dragen tot overgevoeligheid.
Met behulp van de in vitro voorbereiding en de hier beschreven protocol, we ontwikkeld en gebruikt een elektrische prikkel strategie naar zee RCH voor receptieve eindes, waardoor onpartijdige identificatie van zowel mechanosensitieve en MIA eindes in de dikke darm 19. De colorectale innervatie is afgeleid van lumbale splanchnisch (LSN) en bekkenzenuwstimulatie (PN) paden, en omvat colorectale afferentia die kunnen worden onderverdeeld in vijf mechanosensitieve klassen (serosal, mucosale, gespierd, gespierde-mucosale, mesenteriale) en een MIA klasse 20. Gebruik van deze in vitro bereiding, vonden we dat colorectale MIA verkregen mechanische gevoeligheid (gevoelig) na korte blootstelling hun receptieve velden een inflammatoire soep (IS), die 71% van MIA in de PN route en 23% van MIA in het LSN route gesensibiliseerde 19. We hebben ook gedocumenteerd langdurige sensibilisatie (tot 28 dagen) van MIA in de context van langdurige gedrags- viscerale hypersensitiviteit (dwz bij muizen die intracolonische behandelingen met zymosan 21 of 2,4,6-trinitrobenzeensulfonzuur (TNBS) 22) .
jove_content "> Onder mechanosensitieve afferenten, gespierd en gespierd-mucosale afferentia zijn de enige klassen die tonisch coderen omtrek stuk van de dikke darm (dat wil zeggen, zijn stretch-gevoelig) en bevordelijk de codering van schadelijke colorectale uitzetting 23,24. Met behulp van een computer-gestuurde krachtactuator, pasten wij een standaard, homogene en reproduceerbare opgevoerd rek in de omtreksrichting van de afgeplatte colorectaal weefsel en verder onderverdeeld stretch-gevoelige afferente een lage drempel en hoge drempel 23. Bovendien, het tijdsverloop van sensibilisatie van stretch -gevoelige afferentia na intracolonische zymosan 21 of 22 TNBS behandeling is het begin, persistentie en / of herstel van gedrags- viscerale hypersensitiviteit, suggereert een rol van stretch-gevoelige colorectale afferenten in viscerale pijn en overgevoeligheid.Subscription Required. Please recommend JoVE to your librarian.
Protocol
OPMERKING: Dit protocol werd beoordeeld en door de Universiteit van Pittsburgh Institutional Animal Care en gebruik goedgekeurd.
1. Voorbereiding van de Modified Krebs Solution en Test van de Drug Hoeveelheden
- Voeg 6 l gemodificeerde Krebs oplossing die bevat (in mM): NaCl 117,9, KCl 4,7, 25 NaHCO3 1.3 NaH 2PO 4, 1,2 MgSO4, 2,5 CaCl2, 11,1 D-glucose, 2 natrium butyraat, 20 natriumacetaat , 0,004 nifedipine (spontane spiersamentrekkingen te blokkeren), en 0,003 indomethacine (tot synthese van endogene prostaglandines te blokkeren). Gebruik ijskoud en warm Krebs oplossingen voor weefsel dissectie en single-fiber-opname, respectievelijk.
- Bereid elke chemische oplossingen (bv, IS, capsaïcine, ATP) in porties op de gewenste concentraties.
2. Dissectie van de dikke darm-zenuwweefsel
- Verdoven en euthanize mannelijke muizen (6-8 weken oud, 20 - 30 g) inCO 2 kamer bij een stroomsnelheid die 10 verplaatst - 30% van het kamervolume per minuut totdat muizen stoppen met ademen volledig zoals aangegeven door het ontbreken van beweging van de borstkas.
- Onmiddellijk na euthanasie, exsanguinate door opensnijden de thoracale kamer, perforeren het rechter atrium, en onderdompelen van de muis karkas in een ruime volume (-500 ml) ijskoude Krebs (4 ° C) oplossing geborreld met carbogeen (95% O 2 , 5% CO2).
- Verwijder voorzichtig alle ingewanden, maar de dikke darm en de bekkenorganen. Doorsnijden van de muis in de helft over de T12 spinale segment iets boven de thoracale middenrif en de overdracht van de caudale helft tot een dissectie kamer met ijskoud, geborreld Krebs oplossing.
- Onder een stereomicroscoop, verwijder de blaas en de voortplantingsorganen door doorsnijden op hun kruispunten om de plasbuis, en verwijder de afdalende / abdominale aorta totdat het splitst in bekkenslagaders. Bevrijd de PN of de LSN uit hun surrounding weefsels door stompe dissectie en volg de zenuwen van buiten het bekken tot de ventrale instappunt in de L6 en S1 wervelkolom (voor PN) of T13 en L1 wervelkolom (voor LSN).
- Snijd de symfyse en rechts en links acetabular gewrichten, en verwijder de iliacale bot. Zorgvuldig gratis ofwel de PN of LSN op de bijgevoegde spieren en bindweefsel van dicht bij de dikke darm tot waar de zenuw komt in de wervelkolom.
- Reseceren zorgvuldig de iliacale bot aan de distale colorectum bloot. Ontleden de distale dikke darm met de bijgevoegde PN of LSN in continuüm.
- Breng de dikke darm met de zenuw verbonden aan het bad compartiment van het weefsel kamer. Verwijder overmatig bindweefsel door verdere dissectie, en open de dikke darm lengterichting langs de anti-mesenteriale grens.
- Met mucosale zijde omhoog, speld de mesenteriale rand van de dikke darm grenzend aan de opname compartiment in de siliconen basis van de chamber en bevestig de antimesenteric lengte van de dikke darm een hark haken verbonden met een kracht actuator (in figuur 1 en gefotografeerd in figuur 2A).
- Verleng de PN of LSN in de opname compartiment dat is verbonden met het bad compartiment door een muizenhol en poort. Leg de zenuwbaan naar een klein glazen spiegel in de opname-compartiment, die een hydrofiel oppervlak voor het lef om zich te houden aan geeft. Superfuse het bad compartiment met warm (30-32 ° C), geoxygeneerde Krebs oplossing en vul de opname compartiment met minerale olie.
3. Single-fiber Opname en lokalisatie van de Receptief veld
- Schuif nu voorzichtig de epineurium (zenuwschede) uit de PN of LSN onder de stereomicroscoop bij een sterke vergroting (50 - 60X). Met behulp van fijne tang, plagen de zenuwbaan naar 5-8 zenuwbanen van ~ 100 micrometer dik.
- Plaats de platina-iridium verwijzingelektrode in contact met de Krebs oplossing in het weefsel kamer. Opeenvolgend plaats de afzonderlijke zenuwbanen naar de registratie-elektrode gemaakt van hetzelfde materiaal.
- Gebruik een zachte kwast om AP's uit de colorectale afferentia roepen door zachtjes strelen op en neer de colorectale oppervlak. Zoek de zenuw bundel (s) die de dikke darm innerveren door detecteerbare AP (actiepotentiaal) opnames.
OPMERKING: De PN en LSN ook innerveren de urineblaas en andere organen in het bekken. - Gebruik een paar van 30 G naald tips om verder te splitsen van de zenuwbaan in fijne fascicle filamenten van ~ 10 micrometer dikte en plaats een individueel filament op de registratie-elektrode.
- Plaats de round-tip concentrische elektrode loodrecht op het slijmvliesoppervlak elektrisch exciteren afferente uiteinden op suprathreshold stimulusintensiteit (10 mA magnitude 0,5 msec @ 0,3 Hz), die een mm radius van stroomspreiding ~ 2 produceert. Beweeg de elektrode systematisch (~ 1,5 mm stappen) Langs de lengte en breedte van de afgeplatte colorectum receptieve eindes lokaliseren.
- Wanneer een afferente einde is enthousiast, stel de elektrode positie naar de site van de activering (receptieve veld, RF) dat minimaal stimulusintensiteit (prikkeldrempel) vereist lokaliseren. Gooi eindes met een stimulus drempel> 3 mA 19.
- Bereken de geleidingssnelheid (CV) van 1) de afstand tussen de stimulerende elektrode in het receptieve veld (RF) en de opname onderzocht en 2) de geleidingsvertraging (bijvoorbeeld figuur 2B) tussen het stimulus artefact en het begin van de actiepotentiaal .
CV (m / sec) = afstand (mm) / geleiding vertraging (msec).
4. Functionele indeling van mechanosensitieve Colorectale afferenten
- Na het lokaliseren van een RF door elektrische stimulatie, gelden de volgende drie mechanische stimuli aan de RF:
- Het gedrag van de indringende prikkel door op de punt van een Calibrated von Frey-achtige nylon monofilament (0,4 en 1 g kracht) loodrecht naar de RF op de afgeplatte colorectum.
- Het gedrag van de streelde stimulans door zachtjes strelen de colorectale slijmvlies met een fijne nylon filament streng (10 mg kracht) om een klein oppervlak shear stress op de RF te genereren.
- Voer de omtreksrichting uitrekken met een computergestuurde krachtactuatorstelsel, waarbij een hellend stuk kracht levert (0-170 mN bij 5 mN / sec) in omtreksrichting langs de anti-mesenteriale rand van de dikke darm door de hark haken in stap 2.8 beschreven .
- Classificeren afferentia als serosal (alleen reageren op stomp indringende), mucosale (reageren op mucosale strelen en stomp indringende), gespierd (reageren op de omtrek stretch en stomp indringende) gespierd / mucosale (reageren op de omtrek stretch, mucosale strelen en stomp indringende), of MIA (niet reageert op elk van de drie mechanische stimuli).
- Voor mesenteriale afferentia (alleen inLSN innervatie) die moeilijk om selectief geactiveerd door elektrische stimulatie, vinden hun open einde mechanisch strelen / sonderen van het mesenterium.
- Voor stretch-gevoelige afferenten (spier en spier-mucosale genoemd) de drempelwaarde, die wordt gedefinieerd als de kracht die de eerste AP oproept in oplopende rek.
- Voor serosal afferenten, registreren hun reacties op oplopende niveaus van punctata sonderen van het receptieve veld aangedreven door de computergestuurde krachtactuator.
5. Chemische Toepassing / Modulatie van receptieve Endings
- Het opnemen van een basislijn reactie op een mechanische stimulus (dwz, als reactie op oplopende stretch, punctate sonderen, of mucosale strelen).
- De vacht van de onderste rand van een stuk slang (messing of roestvrij staal, 10 mm hoog en 4 x 4 mm 2 vierkante of 4 - 5 mm diameter) met vaseline en plaats deze op de receptieve veld op de dikke darm.
- Verwijderende Krebs oplossing in de buis en het blootstellen ontvankelijk uitgang 3 - 5 min naar 170 pl van de oplossing die de te testen chemische stof (fen).
- Bewaken van de respons van de afferente tijdens chemische toepassing (sommige afferentia zijn chemotherapie gevoelig).
- Verwijder de chemische oplossing en slang aan de werking van de chemische beëindigen. Binnen 4-6 minuten, test de afferente reactie op dezelfde mechanische stimulus in de basislijnreactie.
- Opnieuw de mechanische stimulus opnieuw na voldoende lange wash-out (> 15 min).
6. Opnemen en Discriminerende AP spikes
- Digitaliseren van de elektrische signalen opgenomen van axonen bij 20 kHz en de gegevens opslaan op een computer. Bekijk het signaal on-line door een audio-monitor.
- Analyseer de AP spikes off-line en discrimineren afzonderlijke eenheden op basis van hoofdsom analyse van individuele spike golfvormen 25 component.
OPMERKING: Een plaat mag niet meer th bevatteneen twee gemakkelijk onderscheidbare actieve eenheden.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De opstelling wordt in figuur 1. Het omvat een op maat gemaakte weefsel kamer die de dikke darm in een siliconen beklede bad compartiment en de bijgevoegde zenuw in een aangrenzende minerale olie gevulde compartiment herbergt. De twee compartimenten kamer werd gefreesd uit een massief blok van acrylaat met een CNC machine; de onderkant van beide compartimenten werd vervolgens bekleed met stevige siliconen om eenvoudig pin naar beneden van het colorectaal weefsel mogelijk te maken. Extracellulaire AP's uit gepest zenuw bundels worden opgenomen met behulp van een low-noise, batterij-aangedreven differentiële versterker met een hoge common-mode rejection ratio (CMRR ~ 60 dB). De versterking van de versterker is ingesteld op X10.000 en het bandfilter bereik 0.3 tot 10 kHz. Elektrische stimulatie van de dikke darm wordt afgegeven door een optisch gekoppelde stimulator constante stroom modus via een concentrische elektrode in contact met colorectale mucosa. Mechanische stimulatie (colorectaal stretch en puntvormige sonderen) wordt geleverd door acomputer-gecontroleerde kracht actuator. Een AD-converter en de juiste software toezicht zowel stimulatie en opname processen door het sturen van spanning commando uitgangen aan mechanische en elektrische stimuli, evenals de opname te starten en digitaliseren van de extracellulaire AP signalen van de differentiële versterker. Om te isoleren van de mechanische en elektrische geluidsbronnen, zijn het weefsel kamer, microscoop en differentiële versterker in een kooi van Faraday, gemonteerd op een pneumatische lucht tafel gelegd.
Zoals getoond in figuur 2A, wordt de dikke darm met de bijgevoegde zenuw uitgesneden uit een muis, opengesneden langs de anti-mesenteriale rand, en vastgemaakt flat in de siliconen beklede weefsel kamer; de zenuw wordt geplaatst op een glazen spiegel in de aangrenzende opname kamer. Getoond in Figuur 2B is een representatieve registratie van een actiepotentiaal (AP) in antwoord op elektrische stimulatie van de RF bij drempel. De AP in dit record achterblijft bij de stimulus kunstifact (•) van 49 msec door de geleiding vertraging van de HF naar de registratie-elektrode, wat resulteert in een berekende geleidingssnelheid van 0,43 m / sec, en in het gebied van een niet-gemyeliniseerde C-vezels. Weergegeven in figuur 2C zijn typische reacties van een afferente op stimuli met de hand (sonderen van de RF met von Frey-achtige monofilamenten, 1 g, en fijne mucosale strelen van de RF, 10 mg) opgeleverd. Deze plaat bevat twee gemakkelijk onderscheidbare afferenten; alleen de grote amplitude afferente reageert op strelen. Zoals getoond in figuur 2D, werden afferente reacties op indringende ook beoordeeld door een computergestuurde krachtactuatorstelsel dat levert aan dezelfde plaats op de dikke darm een reeks nauwkeurig getimede en reproduceerbare mechanische krachten (5, 10, 20, 40 en 80 mN, 5 sec duur). Evenzo omtrek rek van de dikke darm (0-170 mN bij 5 mN / sec) wordt afgegeven door dezelfde aandrijving met een representatieve reactie weergegeven in figuur 2E
Zoals getoond in figuur 3, kan colorectale afferente functioneel worden onderverdeeld in zes klassen op basis van hun reactie profielen drie verschillende mechanische stimuli (zie stap 4.2). Alle afferente eindes behalve mesenteric afferentia waren gevestigd door elektrische stimulatie (e-stim; meest linkse kolom, pijlen geven stimulus artefact). Mechanisch ongevoelig afferentia (MIA) niet reageren op een van de drie mechanische stimuli. Daarentegen alle mechanosensitieve uitgangen reageren probing (0,4-1,4 g). Onder hen, zijn gespierd en gespierd-mucosale eindes ook geactiveerd door de omtrek stretch (0-170 mN), en dus worden aangeduid als stretch-gevoelige afferenten; gespierde-mucosale eindes worden ook geactiveerd door strelen (10 mg). Mucosale eindes worden ook geactiveerd door strelen (10 mg), maar niet strekken en serosale eindes zijn niet door een stuk of strelen geactiveerd. Mesenteriale eindes worden geïdentificeerd door mechanisch bhaasten het mesenterium.
Weergegeven in Figuur 4A representatief reacties van een stretch-gevoelige afferente opgewekt door drie opeenvolgende omtrek stukken gescheiden door 5 min. De spike nummers zijn gelijkmatig binned in drie bakken en weergegeven als stimulus-respons functies in figuur 4B, onthullende hoge reproduceerbaarheid, zowel in reactie magnitude (spike nummer) en respons drempel.
Dit in vitro colorectum-zenuw voorbereiding maakt ook lokale toepassing van chemicaliën om ontvankelijk eindes afferente. De blootstelling aan chemicaliën beperkt tot gebieden rond de afferente HF door het plaatsen van messing of roestvrij stalen buis boven de colorectale mucosa fysiek isoleren RF van de rest van de dikke darm. Typische resultaten volgende chemische toepassing zijn: directe activatie van afferentia op verzoek van een zure hypertone oplossing (AHS 26; figuur 5A), geen activering, maar overname van mechanische gevoeligheid door een MIA na toepassing van een inflammatoire soep (IS 19; Figuur 5B), verhoogde respons (dwz sensibilisatie) aan mechanische stretch na toepassing van IS (figuur 5C), en een verminderde reactie op mechanische stretch na toepassing van cGMP (Figuur 5D).

Figuur 1. Schematische weergave van de experimentele opstelling. De colorectum-zenuw geplaatst in een twee-compartiment weefselkamer en geïsoleerd, samen met de differentiële versterker hoofd podium van andere elektronische apparatuur door een kooi van Faraday. Elke afferente RF wordt geïdentificeerd door elektrische stimulatie (e-stim) van de dikke darm en getest door drie mechanische stimuli: nylon monofilament sonderen, mucosale strelen, en omtrek stretch. TTP's: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Klik hier om een grotere versie van deze afbeelding te bekijken.
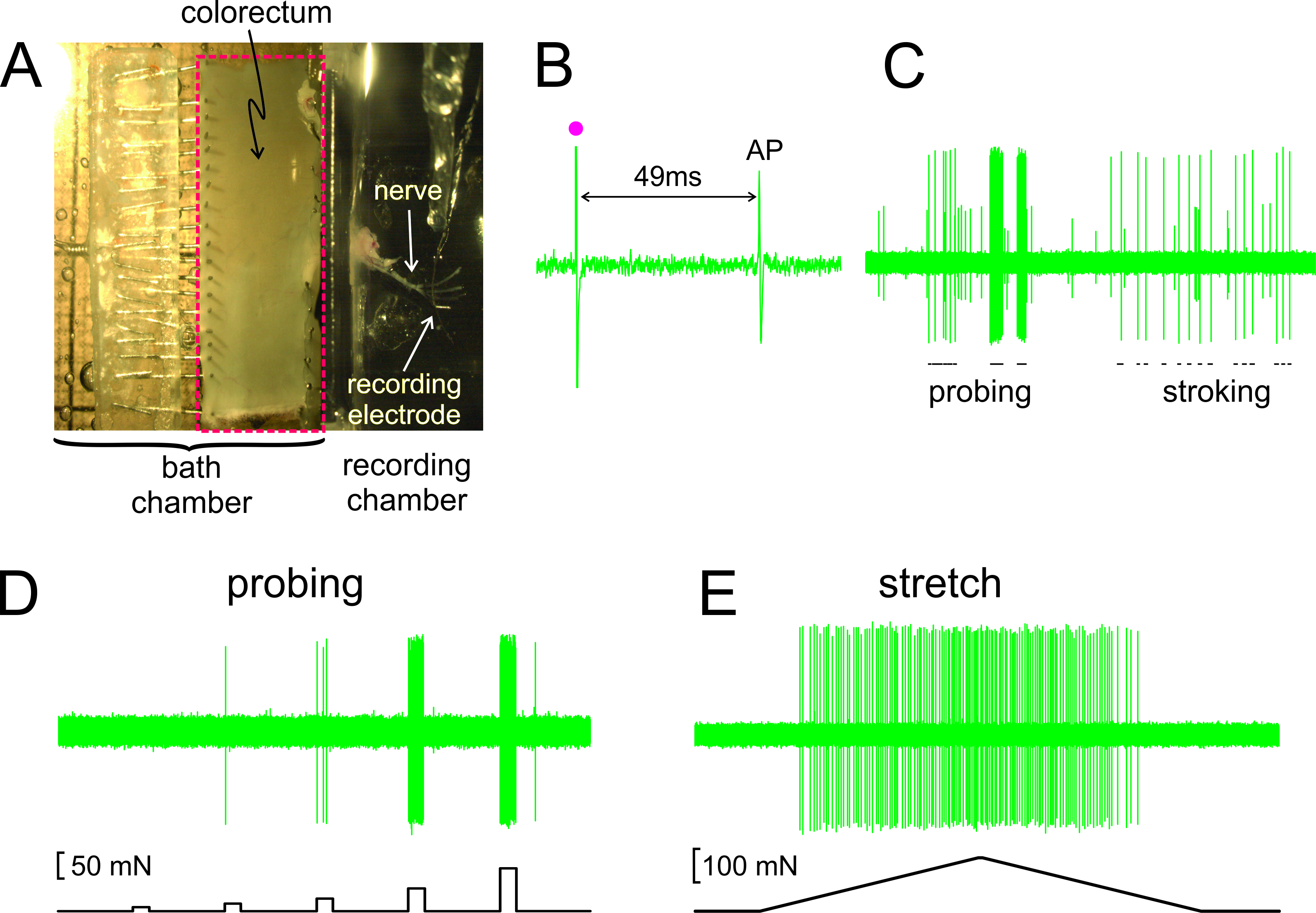
Figuur 2. Een beeld door de stereomicroscoop van de ontleed colorectum met aangehechte bekkenzenuwstimulatie (A) B -. E tonen vertegenwoordiger verslagen. (B) Een actiepotentiaal (AP) opgeroepen door elektrische stimulatie (stimulus artefact, •). (C) Typische reacties op hand-held monofilament indringende en mucosale strelen. (D, E) Reacties op indringende en omtrek stretch door de computer gestuurde kracht actuator geleverd, respectievelijk. Klik hier om een grotere versie van deze afbeelding te bekijken.

Figuur 3. Functionele karakterisering van colorectale afferente klassen. Afferentia liggen door elektrische stimulatie (e-stim, ↑) van de dikke darm en gecategoriseerd in vijf mechanosensitieve klassen en een mechanisch-ongevoelige afferente (MIA) klasse op basis van hun respectieve reactie profielen tot drie mechanische stimuli:. sonderen, strelen, en stretch Klik hier om een grotere versie van deze afbeelding te bekijken.

Figuur 4. Afferent reacties op reproduceerbare, computergestuurde mechanische stimulatie. (A) De antwoorden van een gespierde-mucosale eenfferent tot drie opeenvolgende opgevoerd stukken (0-170 mN op 5 mN / sec; 5 min inter-stimulus interval). (B) Reacties (actiepotentiaal spikes) werden gelijkmatig binned in drie bakken (0-57, 57-113 en 113-170 mN) en weergegeven als stimulus-respons functies; aanspreekdrempel wordt weergegeven in de inzet. Klik hier om een grotere versie van deze afbeelding te bekijken.

Figuur 5. Afferent reacties op gelokaliseerde chemische toepassing eindes receptieve. (A) Een voorbeeld van chemosensitiviteit van een serosal afferente om toepassing van zure hypertone oplossing (AHS). (B) Een voorbeeld van een overname van mechanische gevoeligheid (overgevoeligheid) door een MIA eindigt. Dit MIA niet direct reagereneen inflammatoire soep (IS), maar reageerde op 1,4 g monofilament sonderen achteraf. (C) Overgevoeligheid (een toename van de respons omvang en vermindering van aanspreekdrempel) te rekken van een gespierde afferente na blootstelling van haar eindigt aan IS. (D) Verzwakking van de respons op te rekken door een gespierde-mucosale afferente na blootstelling van haar einde aan cyclisch guanosinemonofosfaat (cGMP). Klik hier om een grotere versie van deze afbeelding te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De in vitro colorectum zenuw bereiding beschreven blijkt een krachtige aanpak om neurale codering functies van individuele colorectale afferenten, die mooi aanvulling andere niet-functionele benaderingen (bijvoorbeeld cellulaire, moleculaire en histologische studies) op viscerale sensorische neuronen (bestuderen zie beoordeling 27 voor details). Neuronale mechanismen die bijdragen aan nociceptie en langdurige colorectale overgevoeligheid zijn geopenbaard en farmacologische manipulaties zijn uitgevoerd waaruit bleek doelen die ingewandspijn kunnen verlichten hebben. De volgende belangrijke punten in verband met een succesvolle uitvoering van dit preparaat worden hieronder besproken: 1) reductie van elektrische ruis, 2) toename van signaaldetectie, en 3) de selectie van een gestandaardiseerde stimulans om veranderingen van afferente codering te evalueren. Bovendien zijn verscheidene beperkingen van deze techniek besproken.
Actiepotentialen (AP's) propagating intracellulair langs axonen algemeen een transmembraanpotentiaal van 100-130 mV. Vanwege de kleine specifieke capaciteit van de axon membraan, deze relatief grote depolarisatie resulteert slechts in een kleine elektrische lading verplaatsing over het celmembraan, die gemakkelijk kan worden afgevoerd in de omringende extracellulaire weefsel / interstitiële vloeistof (waarbij elektrische impedantie aanzienlijk lager is dan het lipide membraan). Voor extracellulaire van zenuwvezels / axonen, het elektrische signaal ligt gewoonlijk in het traject van microvolt, dicht bij de grootte van de thermische / witte ruis geassocieerd met een typische bioelectrical recording setup, waardoor ruisonderdrukking de eerste prioriteit voor geslaagde opnames. Het meest effectief te isoleren tegen ambient elektrische ruis, kan het nuttig zijn om het weefsel kamer, opname en aardingselektroden de differentiële versterker (DC batterij-aangedreven) en de stereomicroscoop in een kooi van Faraday te plaatsen. Als beweging artefacts voordoen, het plaatsen van de kooi van Faraday op een pneumatische lucht tafel te dempen mechanische trillingen is behulpzaam. Idealiter de opname- en referentie-elektroden die de "+" en voer "-" aansluitingen van de differentiële versterker, respectievelijk moet vergelijkbaar impedantie verhouding tot hun raakvlakken hebben en dicht bij elkaar. Aldus zal externe ruis worden geregistreerd ongeveer even door beide elektroden en aan de strenge common mode afwijzing door de verschilversterker.
In onze opstelling (figuur 2A), wordt de referentie-elektrode ondergedompeld in de Krebs perfusievloeistof in het weefsel kamer terwijl het registratie-elektrode in contact is met een fijne zenuw filament aanzienlijke impedantie. Deze single-elektrode configuratie met een niet-triviale impedantie mismatch is meestal niet ideaal voor ruisonderdrukking. Echter, deze configuratie biedt het gemak van plaatsen van de fijne zenuw filament op één elektrode, wat vooral aantrekkelijk bij het opnemen van de muis colorectale zenuw filamenten van beperkte lengte (10-15 mm). Gebaseerd op onze ervaring, de configuratie enkele elektrode is aanvaardbaar als de piek-tot-piek achtergrondruis is dan 20 mV in het record. Anders zou verdere ruisreductie twee elektroden opnameconfiguratie waarin het fijne zenuw filament in contact met zowel het opnemen en referentie elektroden evenwijdig aan elkaar te eisen. Alle grote metalen onderdelen in de kooi van Faraday moet worden geaard in een ster-achtige manier om een gemeenschappelijke grond, een koperen blok in onze opstelling. Zorg moet worden genomen om de vorming van aardlussen voorkomen.
Om extracellulaire detectie AP waarborgen, de eerste stap succesvol dissectie van de dikke darm-zenuwweefsel. Knijpen of trekken de zenuw tijdens dissectie moet worden vermeden, die onomkeerbaar kan beschadigen de zenuw en de invloed AP geleiding. De ontleed zenuw stam moet ook to vrij zijn van elke aangesloten spierweefsel, die kalium lekt wanneer beschadigd en kan de zenuwgeleiding blokkeren door depolarisatie. Deze dissectie vaardigheid wordt over het algemeen verworven door ijverige praktijk gedurende weken tot maanden en vraagt om een hoog niveau van oog-hand coördinatie en behendigheid in het omgaan met en het gebruik van chirurgische instrumenten. Bovendien, om schade aan de colorectale weefsel te voorkomen, de elektrische zoekstrategie gebruikt een concentrische elektrode die een stompe, afgeronde top en relatief grote diameter (extern Φ0.55 mm, inwendige Φ0.125 mm) heeft en is verbonden met een micromanipulator van een conform brug, waardoor een bescheiden mechanische kracht op het mucosale oppervlak (-100 mg). Om een sterker signaal in de opname spoor verkrijgen, de AP-geïnduceerde transmembraan stroom moet worden gekanaliseerd en "gevangen" op de elektrode door een kleine impedantie brug tussen de zenuw axon (s) en het elektrodeoppervlak. Zo is de epineurium en perineurium dat isolerende zenuw moet gratis worden ontleed tijdens het proces van het splitsen van de zenuw in fijne filamenten van ~ 10 micrometer dik. Omdat de AP-geïnduceerde transmembraan lopende verdwijnt aanzienlijk op korte afstand van het axon membraan een dunnere zenuw filament resulteert meestal in een betere signaal-ruis verhouding in de axonen 'dichter bij het elektrodeoppervlak. In de minerale oliekamer, de spiegel die de zenuw geplaatst is vaak trekt een dunne laag van Krebs oplossing (het glasoppervlak hydrofiel). Het is dus noodzakelijk dat de registratie-elektrode en de zenuw filament niet in contact met het spiegelvlak tijdens het opnemen. Resterende druppels Krebs oplossing die een lage impedantie brug tussen de elektrode en het spiegelvlak (dat wil zeggen, rangeren) aanzienlijk de signaalamplitude van de plaat verminderen.
Dit colorectum-zenuw voorbereiding maakt de studie van de functionele veranderingen van afferenten na het blootstellenRFs van verschillende chemische mediatoren en beledigingen in vitro alsook in de context van langdurige pathofysiologische omstandigheden (bijvoorbeeld colorectums uit eerder behandelde muizen). Een objectieve maat functionele veranderingen van afferentia afhankelijk van de volgende: 1) een gestandaardiseerde stimulus met hoge precisie en reproduceerbaarheid en 2) afferente reacties die robuust en reproduceerbaar zijn. Van de drie mechanische stimuli toegepast op de colorectum, indringende en streelde stimuli van de RF worden vaak geleverd door hand-held von Frey-achtige monofilamenten. Voor het sonderen, wordt het monofilament meestal geijkt op een reproduceerbare loodrechte kracht te leveren bij het buigen. Echter, von Frey monofilamenten-achtige (0,4 en 1 g) kleine en verschillende dwarsdoorsnede diameters (0,2 en 0,3 mm, respectievelijk), waardoor een hoge nominale spanning wanneer toegepast loodrecht op de colorectale oppervlak (124.8 kPa 0,4 g en 138,7 kPa gedurende 1 g), een intense, punctate mechanische stimulus beyond de normale fysiologische bereik. Bovendien is de scherpe rand van het filament aandoeningen die ongelijkmatige verdeling van spanningen met focale piekspanning aanzienlijk boven de nominale spanning (stress concentratie). Aangezien de typische RF grootte (1 mm2) aanzienlijk groter is dan de doorsnede van een monofilament, en het onvermogen om reproduceerbaar stimuleren identieke plaats met een hand-held monofilament, is het gebruikelijk om reacties te observeren herhaalde stimuli die verschillen aanzienlijk AP frequentie en duur. Als voorbeeld, de reacties op sonderen figuur 2C door dezelfde hand gehouden monofilament (1 g) aanzienlijke verschillen die waarschijnlijk worden gewerkt door een onvermogen om reproduceerbaar probe de identieke plaats en variabele duur en interval tussen opeenvolgende stimuli. Mucosale Stroking uit met een handbediende filament is eveneens moeilijk en vaak ook variabele reacties oproepen van dezelfde afferente. Stimulus reproduceerbaarheid kan zijnverbeterd door een computergestuurde krachtactuator nauwkeurige indringende (en rek) krachten leveren. Voor het sonderen, gebruiken we een monofilament met een grotere diameter (bijvoorbeeld # 6.45, 1 mm) die vollediger omvat typisch afferente RF 24,28. Computergestuurde omtrek rek, in tegenstelling tot andere weefsels strekken benaderingen gericht op de RF, laat homogene vervorming over de lengte van het colorectum, waardoor mogelijk de correlatie met colorectale distensie in zijn oorspronkelijke cilindrische configuratie gevormd door vergelijkbare omtreksrichting mechanische belasting (dwz 0 - 170 mN stretch is gelijk aan 0-45 mm Hg intraluminale druk 23). Omdat het rek kracht gelijkmatig wordt aangebracht op de anti-mesenteriale rand, niet rechtstreeks aan de RF, de opgewekte lokale mechanische stress op de afferente RF reproduceerbaar tussen opeenvolgende toepassingen van rek. Bovendien, het L-type Ca2 + kanaal blokker nifedipine aan het bad toegevoegd inhibit spontane gladde spiercontractie, draagt bij aan het onderhoud van colorectale overeenstemming tussen hellende strook testen 23. Tenslotte, de afferente reacties op de hellende rek protocol bewezen reproduceerbaar met kleine variabiliteit in zowel de stimulus-respons functie en reactie drempelwaarde is (bijvoorbeeld figuur 4). Aldus afferente reacties op hellende rek op grote schaal gebruikt als een objectieve beoordeling van veranderingen van afferente functie bestuderen neuronale mechanismen van viscerale pijn en overgevoeligheid (bijv 19-22,24,26,28-31).
De colorectum-zenuw voorbereiding is een krachtig hulpmiddel voor de studie van colorectale visceraal afferente zenuwbanen. Het heeft echter ook een aantal beperkingen. Ten eerste, de axonen van de cellichamen van de sensorische neuronen in de dorsale wortel ganglion worden doorsneden bij de voorbereiding, de weg staat aan de studie van de moleculaire identiteit van die cel organen (zoals eencellige RT-PCR of transcriptome analyse van de verschillende klassen van colorectale afferenten). Ten tweede, de lage signaal-ruisverhouding van de single-fiber opname vraagt optimale chirurgische dissectie / zenuw splitsen vaardigheden en low-noise-opname, aanzienlijk beperken van bredere toepassing van dit protocol in andere laboratoria. Ten derde kan deze in vitro preparaat niet geldt voor onderzoeken van systemische factoren viscerale sensatie moduleren, zoals het autonome zenuwstelsel, circulerende hormonen en cytokinen, darmflora en dalen modulatie van het centrale zenuwstelsel.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



