Abstract
Cette vidéo montre en détail une seule fibre protocole d'enregistrement électrophysiologique in vitro en utilisant une préparation souris rectum nerf. L'approche permet l'identification et la caractérisation fonctionnelle impartiale des afférences colorectal individuels. Enregistrements extracellulaires des potentiels d'action (PA) à multiplication qui proviennent d'une ou de quelques afférents (par exemple, une seule fibre) champs récepteurs (RFS) dans le rectum sont fabriqués à partir taquiné faisceaux de fibres nerveuses. Le cancer colorectal est retiré avec soit le pelvienne (PN) ou lombaire splanchnique (LSN) nerf attachée et ouvert longitudinalement. Le tissu est placé dans une chambre d'enregistrement, goupillé plat et perfusé avec une solution oxygénée de Krebs. Stimulation électrique focale est utilisé pour localiser les terminaisons afférentes colorectaux, qui sont ensuite testés par trois stimuli mécaniques distinctes (émousser sondage, muqueuse caresser et de se étirer circonférentielle) de classer fonctionnellement les afférences en cinq mechanosensiles classes tifs. Fins répondu à aucune de ces stimuli mécaniques sont classées comme afférences mécaniquement insensibles (SIAM). Les deux mécanosensible et MIAs peuvent être évalués pour la sensibilisation (par exemple en réponse améliorée, seuil réduit, et / ou l'acquisition d'mécanosensibilité) par l'exposition localisée de la RFS aux produits chimiques (par exemple, la soupe inflammatoire (IS), la capsaïcine, l'adénosine triphosphate (ATP)). Nous décrivons l'équipement et la préparation d'enregistrement rectum nerf, la récolte du côlon et du rectum avec PN ci-joint ou LSN, l'identification de la RFS dans le rectum, l'enregistrement mono-fibre à partir de faisceaux nerveux, et l'application localisée de produits chimiques à la RF. En outre, les défis de la préparation et l'application de la stimulation mécanique normalisée sont également discutés.
Introduction
La douleur et hypersensibilité sont les plaintes prédominantes de patients souffrant de troubles gastro-intestinaux fonctionnels, y compris le syndrome du côlon irritable (IBS), qui existent en l'absence de la cause pathobiologique apparente ou dommages aux tissus. Par exemple, les patients IBS présentent une hypersensibilité, y compris les réponses accrues à rectale distension du ballon et une sensibilité accrue au cours de la fonction intestinale normale, ainsi que l'hypersensibilité de la saisine somatiques (ce est à dire, sensibilité à la palpation de la région abdominale) 1. Parce que le ciblage afférences colorectal se est révélé être efficace pour soulager la douleur et l'hypersensibilité chez les patients IBS (par exemple, l'instillation intra-rectale de 2,3 anesthésiques locaux; ingestion orale de la guanylate cyclase C-agoniste linaclotide 4-6), une meilleure compréhension de la innervation afférente du côlon et du rectum est important.
Afférences viscérales, y compris les afférences colorectal, Sont capables de répondre aux modalités chimiques / en nutriments et thermiques (par exemple, 7-9). Cependant, les afférences viscérales répondant à des stimuli mécaniques (c.-à-afférences mécanosensibles) ont été le plus étudié à fond parce stimuli mécaniques (par exemple, distension luminale, extensibles) sont celles qui donnent généralement lieu à des sensations conscientes, y compris inconfort et la douleur 10-16. En outre, les viscères sont également innervés par les afférences mécaniquement insensibles (SIAM) de, communément appelés nocicepteurs silencieux ou de dormir 17. Dans des conditions physiologiques normales, MIAs ne répondent pas à la stimulation mécanique ou avoir de très haute réponse seuils 18, mais peuvent devenir actifs et se dotent mécanosensibilité dans des conditions physiopathologiques et contribuer à une hypersensibilité.
Utilisation de la préparation et le protocole in vitro décrit ici, nous avons développé et emploie une stratégie de stimulation électrique à la mer RCH pour terminaisons réceptives, permettant l'identification objective des deux terminaisons mécanosensibles et Mia dans le rectum 19. L'innervation colorectal est dérivé de lombaire splanchnique (LSN) et nerf pelvien (PN) les parcours, et comprend afférences colorectal qui peuvent être classés en cinq catégories (mécanosensibles séreuse, muqueuse, musculaire, musculaire-muqueuse, mésentériques) et une classe MIA 20. L'utilisation de cette préparation in vitro, nous avons constaté que MIAs colorectal mécanosensibilité acquise (sensibiliser) après une brève exposition de leurs champs réceptifs à une soupe inflammatoire (IS), qui a sensibilisé 71% des soldats portés disparus dans la voie PN et 23% des soldats portés disparus dans la voie LSN 19. Nous avons également documenté une sensibilisation à long terme (jusqu'à 28 jours) des soldats portés disparus dans le cadre de l'hypersensibilité viscérale comportementale longue durée (ce est à dire, chez les souris recevant des traitements intracoliques avec zymosan 21 ou de l'acide 2,4,6-trinitrobenzène (TNBS) 22) .
jove_content "> Parmi afférences mécanosensibles, afférences musculaires et musculo-muqueuses sont les seules classes qui codent tonique tronçon périphérique du côlon et du rectum (ce est à dire, sont tronçon sensible) et subserve l'encodage des nocive distension colorectale 23,24. L'utilisation d'un contrôlé par ordinateur vigueur actionneur, nous avons appliqué une norme, homogène et reproductible tronçon rampe dans la direction circonférentielle du tissu colorectal aplatie et subdivisés afférences extensibles sensible à seuil bas et seuil haut 23. En outre, le cours du temps de la sensibilisation d'étirement afférences -sensibles après zymosan intracolique 21 ou 22 TNBS traitement correspond à l'apparition, la persistance et / ou le rétablissement de l'hypersensibilité viscérale comportement, suggérant un rôle des afférences colorectal extensibles sensible dans la douleur et l'hypersensibilité viscérale.Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTE: Ce protocole a été examiné et approuvé par l'Université de Pittsburgh institutionnel de protection des animaux et l'utilisation Comité.
1. Préparation de la solution de Krebs modifiée et Drug Test aliquotes
- Ajouter 6 L d'une solution de Krebs modifiée qui contient (en mM): 117,9 NaCl, 4,7 KCl, 25 NaHCO 3, 1,3 NaH 2 PO 4, 1,2 MgSO 4, 2,5 CaCl2, 11,1 D-glucose, le butyrate de 2 sodium, l'acétate 20 de sodium , 0,004 nifédipine (pour bloquer les contractions musculaires spontanées), et 0,003 indométacine (pour bloquer la synthèse des prostaglandines endogènes). Utiliser des solutions glace froides et chaudes Krebs pour la dissection des tissus et l'enregistrement monofibre, respectivement.
- Préparer des solutions chimiques (par exemple, IS, la capsaïcine, ATP) en aliquotes à des concentrations désirées.
2. Dissection du tissu colorectal nerf
- Anesthésier et euthanasier les souris mâles (6 - 8 semaines, de 20 à 30 g) dansune chambre de CO 2 à un débit d'écoulement qui déplace 10 - 30% du volume de la chambre par minute jusqu'à ce que la respiration se arrête complètement les souris, comme indiqué par l'absence de mouvement de la poitrine.
- Immédiatement après l'euthanasie, exsangue en coupant ouvert la chambre thoracique, perforation de l'oreillette droite, et en l'immergeant la carcasse de la souris dans un volume suffisant (~ 500 ml) de glace-froid Krebs (4 ° C) solution barboter avec carbogène (95% O 2 , 5% CO 2).
- Retirez soigneusement tous les viscères, mais le côlon et les organes pelviens. Transect la souris dans la moitié à travers le segment rachidien T12 légèrement au-dessus du diaphragme thoracique et transférer la moitié caudale à une chambre de dissection contenant glacée, barboter solution de Krebs.
- Sous un stéréomicroscope, retirez la vessie et les organes reproducteurs par sectionnant à leurs jonctions à l'urètre, et enlever la descente / aorte abdominale jusqu'à ce qu'elle bifurque dans les artères iliaques communes. Libérer le PN ou la LSN de leur surrounding tissus par dissection et suivre le nerf de l'extérieur de la crête iliaque jusqu'à son point d'entrée dans le L6 ventrale et S1 colonne vertébrale (pour PN) ou T13 et L1 colonne vertébrale (pour LSN).
- Couper la symphyse pubienne et à droite et les articulations du cotyle gauche, et enlever l'os iliaque. Sans précaution soit le PN ou LSN du muscle attenant et du tissu conjonctif de près de la rectum jusqu'à où le nerf pénètre dans la colonne vertébrale.
- Réséquer soigneusement l'os iliaque pour exposer le cancer colorectal distal. Disséquer le cancer colorectal distal avec le PN-joint ou LSN en continuum.
- Transférer le rectum avec le nerf fixé à la chambre de bain de la chambre de tissu. Retirer le tissu conjonctif excessive par la poursuite de la dissection, et ouvrez le rectum longitudinalement le long de la frontière anti-mésentérique.
- Avec côté de la muqueuse vers le haut, la broche le bord mésentérique du côlon et du rectum adjacent au compartiment d'enregistrement dans la base de silicone de la chamber et fixer la longueur du côlon et du rectum antimésentérique à un râteau de crochets reliés à un actionneur de force (illustré sur la figure 1 et photographié à la figure 2A).
- Elargir le PN LSN ou dans le compartiment d'enregistrement, qui est relié au compartiment de bain par un trou de souris et la porte. Posez délicatement le tronc de nerf sur un petit miroir de verre dans le compartiment d'enregistrement, qui fournit une surface hydrophile pour le nerf à respecter. Superfuse le compartiment de salle de bain avec chaud (30-32 ° C), une solution de Krebs oxygénée et remplir le compartiment d'enregistrement avec de l'huile minérale.
Enregistrement 3. monofibre et la localisation du champ récepteur
- Retirer délicatement revenir l'épinèvre (gaine des nerfs) du PN ou LSN sous la loupe binoculaire à fort grossissement (50 - 60X). En utilisant des pinces fines, taquiner le tronc nerveux dans 5-8 faisceaux nerveux de ~ 100 um d'épaisseur.
- Placez la référence de platine-iridiumélectrode en contact avec la solution de Krebs dans la chambre de tissu. Placer séquentiellement les faisceaux de nerfs individuels sur l'électrode d'enregistrement constituée de la même matière.
- Utilisez un pinceau souple pour évoquer les points d'accès des afférences colorectal en caressant doucement monter et descendre la surface colorectal. Localisez le pack (s) de nerf qui innervent le côlon par détectable AP (potentiel d'action) des enregistrements.
NOTE: Le PN et LSN innervent aussi la vessie et d'autres organes pelviens. - Utilisez une paire de 30 g de pointes d'aiguilles de diviser davantage le faisceau nerveux en filaments de fascicule fines de ~ 10 um d'épaisseur et placer un filament individuel sur l'électrode d'enregistrement.
- Placer l'électrode concentrique à bout rond perpendiculaire à la surface de la muqueuse pour exciter électriquement des terminaisons afférentes à supraliminaire intensité de stimulation (10 mA d'amplitude, durée 0,5 ms @ 0,3 Hz), qui produit un rayon de ~ 2 mm de propagation courant. Déplacez l'électrode systématiquement (~ 1,5 mm étapes) Le long de la longueur et la largeur du côlon et du rectum aplatie pour localiser les terminaisons réceptives.
- Lorsque une fin afférente est excité, ajuster la position de l'électrode d'identifier le site d'activation (champ récepteur, RF) qui nécessite l'intensité du stimulus minimum (seuil de stimulation). Jeter terminaisons avec un seuil de stimulation> 3 mA 19.
- Calculer la vitesse de conduction (CV) à partir de 1) la distance entre l'électrode de stimulation au champ récepteur (RF) et le site d'enregistrement et 2) le retard de conduction (par exemple, figure 2B) entre l'artefact du stimulus et le début de potentiel d'action .
CV (m / s) = distance (mm) / conduction retard (ms).
4. Classification fonctionnelle des mécanosensibles colorectal Afférences
- Après avoir localisé un RF par la stimulation électrique, appliquer les trois stimuli mécaniques suivantes à la RF:
- Effectuer le stimulus de sondage en appuyant sur la pointe d'un Calibramonofilament Ted von Frey-comme le nylon (0,4 et 1 g vigueur) perpendiculairement vers la RF sur le cancer colorectal aplatie.
- Effectuer le stimulus caressant en caressant doucement le muqueuse colorectale avec un brin de filament en nylon fine (10 mg de force) pour générer une petite contrainte de cisaillement de surface à la RF.
- Effectuer le tronçon périphérique en utilisant une force actionneur contrôlé par ordinateur, qui fournit une force d'étirement rampe (0-170 mN à 5 mn / sec) en direction circonférentielle le long du bord anti-mésentérique du côlon et du rectum par le râteau de crochets décrites à l'étape 2.8 .
- Classer afférences que séreuse (ne répondre qu'aux émousser sondage), la muqueuse (répondre aux muqueuses caressant et émousser le sondage), musculaire (répondre à tronçon périphérique et émousser le sondage) musculaire / muqueuse (répondre à tronçon périphérique, muqueuse caresser et émousser le sondage), ou MIA (non sensible à l'un des trois stimuli mécaniques).
- Pour afférences mésentériques (uniquement enl'innervation LSN) qui sont difficiles à activer sélectivement par la stimulation électrique, localiser leurs terminaisons réceptives en caressant mécanique / sondage du mésentère.
- Pour afférences stretch-sensibles (musculaire et musculo-muqueux), déterminer le seuil de réponse, qui est définie comme la force qui évoque la première AP cours tronçon rampe.
- Pour afférences séreuses, enregistrer leurs réponses à monter les niveaux de sonder ponctuée du champ récepteur entraîné par la force actionneur contrôlé par ordinateur.
5. Chemical Application / Modulation de Endings réceptives
- Enregistrer une réponse de base à un stimulus mécanique (ce est à dire, la réponse à l'étirement rampe, ponctuée de sondage, ou muqueuse caresser).
- Enduire le bord inférieur d'un morceau de tube (laiton ou en acier inoxydable, 10 mm de haut et 4 x 4 mm 2 carré ou 4 - 5 mm de diamètre) avec de la vaseline et le placer sur le champ récepteur sur le cancer colorectal.
- Supprimerla solution de Krebs à l'intérieur du tube, et exposer la fin réceptif pour les 3 - 5 minutes à 170 ul de la solution contenant le produit chimique (s) à tester.
- Surveiller la réponse du afférent pendant l'application chimique (certains afférences sont chimiosensible).
- Retirer la solution chimique et la tubulure de mettre fin à l'action de la substance chimique. De 4 à 6 min, tester la réponse afférente au même stimulus mécanique comme dans la réponse de référence.
- Réappliquer nouveau le stimulus mécanique après la période suffisante de wash-out (> 15 min).
6. Enregistrement et pointes Discriminating AP
- Numériser les signaux électriques enregistrés à partir des axones à 20 kHz et enregistrer les données dans un ordinateur. Surveiller le signal en ligne par un moniteur audio.
- Analyser les pointes AP off-line et de discriminer sur la base de simples unités analyse en composantes principales de formes d'onde de pic individuels 25.
NOTE: Un enregistrement doit pas contenir plus eun deux unités actives facilement discriminables.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La configuration est illustrée sur la figure 1. Il comprend une chambre de tissu sur mesure qui abrite le rectum dans un compartiment de bain silicone doublée et le nerf fixé dans un compartiment rempli d'huile minérale contiguë. La chambre à deux compartiments a été usiné à partir d'un bloc de plastique acrylique par une machine CNC; le fond des deux compartiments a ensuite été doublé avec de la silicone solide pour permettre à la broche facile bas du tissu colorectal. AP extracellulaires de faisceaux nerveux taquiné sont enregistrés en utilisant un faible bruit, amplificateur différentiel alimenté par batterie avec un taux de réjection de mode commun élevé (CMRR ~ 60 dB). Le gain de l'amplificateur est réglé sur x10,000 et la plage de filtre de bande à 0,3 à 10 kHz. La stimulation électrique du côlon et du rectum est délivré par un stimulateur couplé optiquement en mode de courant continu par l'intermédiaire d'une électrode concentrique en contact avec la muqueuse colorectale. La stimulation mécanique (colorectal étirement et ponctuée de sondage) est livré par acomputer contrôlée par la force d'actionnement. Un convertisseur analogique-numérique et un logiciel approprié supervisent les deux procédés de stimulation et d'enregistrement par l'envoi de sorties de commande de tension pour initier des stimuli mécaniques et électriques ainsi que l'enregistrement et la numérisation des signaux extracellulaires AP provenant de l'amplificateur différentiel. Pour isoler des sources de bruit mécanique et électrique, la chambre de tissu, et microscope amplificateur différentiel sont placés dans une cage de Faraday monté sur une table à air pneumatique.
Comme le montre la figure 2A, le rectum avec le nerf joint est disséqué d'une souris, ouvrir le long du bord anti-mésentérique, et à plat dans la chambre de tissus de silicone bordée épinglé; le culot est placé sur un miroir en verre dans la chambre d'enregistrement adjacent. Présenté dans la figure 2B est un record représentant d'un potentiel d'action (PA) en réponse à une stimulation électrique de la RF au seuil. L'AP dans ce dossier traîne derrière l'art de relanceiFact (•) par 49 msec en raison du retard de conduction de la RF à l'électrode d'enregistrement, ce qui entraîne une vitesse de conduction calculé de 0,43 m / sec, bien dans la portée d'un C-fibres non myélinisées. Affichés dans la figure 2C sont des réponses typiques d'un afférente aux stimuli livrés à la main (sondage de la Fédération de Russie avec von monofilaments Frey-comme, 1 g, et bien caresser muqueuse de la RF, 10 mg). Cet enregistrement contient deux afférences facilement discriminables; que la grande amplitude afférent répond aux caresses. Comme le montre la figure 2D, les réponses afférentes à palpage ont également été évalués par une force d'actionnement commandé par ordinateur qui fournit au même site sur le rectum d'une série de forces mécaniques précisément chronométrés et reproductibles (5, 10, 20, 40 et 80 mN, 5 durée sec). De même, tronçon périphérique du côlon et du rectum (0-170 mN à 5 mn / sec) est délivré par le même actionneur avec une réponse représentant affichée à la figure 2E
Comme le montre la figure 3, les afférences colorectaux peuvent être classés fonctionnellement en six classes basées sur leurs profils de réponse aux trois stimuli mécaniques distinctes (voir l'étape 4.2 ci-dessus). Tous les terminaisons afférentes à l'exception des afférences mésentériques ont été localisés par stimulation électrique (e-stim; colonne de gauche, les flèches indiquent artefact de stimulation). Mécaniquement afférences insensibles (SIAM) de ne répondent pas à l'une des trois stimuli mécaniques. En revanche, toutes les terminaisons mécanosensibles répondent à sonder (0,4 à 1,4 g). Parmi eux, les terminaisons musculaires et musculo-muqueuses sont également activés par étirage circonférentielle (0-170 mN), et sont donc appelés afférences stretch-sensibles; terminaisons musculo-muqueuses sont également activés par caresser (10 mg). Terminaisons muqueuses sont également activés par caresser (10 mg), mais pas étirer et terminaisons séreuses ne sont pas activés soit par étirement ou caresser. Terminaisons mésentériques sont identifiés par mécaniquement bprécipiter le mésentère.
Affiché dans la figure 4A sont des réponses représentatives d'un afférent tronçon sensible évoqué par trois tronçons circonférentielles consécutives séparées par 5 min. Les numéros de pic sont régulièrement mis en cellule en trois bacs et affichés comme des fonctions de stimulus-réponse dans la figure 4B, révélant une reproductibilité élevée à la fois l'ampleur de la réponse (numéro de pic) et le seuil de réponse.
Cette préparation in vitro rectum nerf permet également l'application locale de produits chimiques pour les terminaisons afférentes réceptives. L'exposition à des produits chimiques est restreinte aux régions du RF afférente en plaçant laiton ou en acier inoxydable au sommet de la muqueuse colorectale pour isoler physiquement la RF du reste du côlon et du rectum. Les résultats typiques suivants application de produits chimiques comprennent: activation directe des afférences lors de l'application d'une solution hypertonique acide (AHS 26; figure 5A), aucune activation, mais de mécanosensibilité acquisition par un MIA après application d'une soupe inflammatoire (IS 19; Figure 5B), l'augmentation de la réponse (ce est à dire, une sensibilisation) à étirage mécanique après l'application d'IS (figure 5C), et réduit la réponse à l'étirement mécanique après l'application de cGMP (figure 5D).

Figure 1. Représentation schématique du dispositif expérimental. Le nerf-rectum est placé dans une chambre de tissu à deux compartiments isolés et avec l'étage de tête de l'amplificateur différentiel à partir d'autres appareils électroniques par une cage de Faraday. Chaque RF afférente est identifié par stimulation électrique (e-Stim) du côlon et du rectum et testé par trois stimuli mécaniques: monofilament en nylon sondage, caressant la muqueuse, et se étirer circonférentielle. TTP: //www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "target =" _ blank "> Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
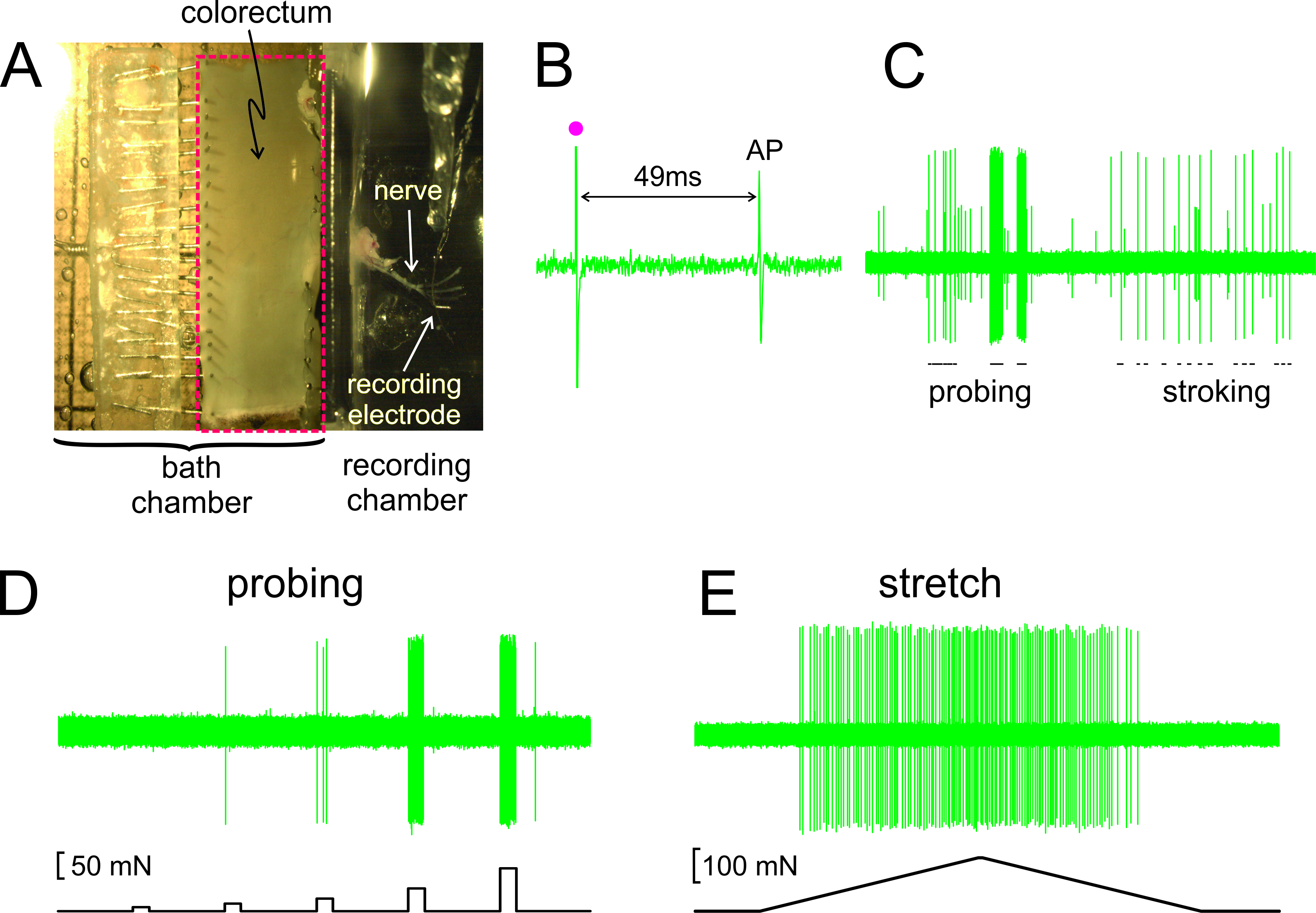
Figure 2. Une image à travers le stéréomicroscope du côlon et du rectum disséqué avec nerf pelvien ci-joint (A) B -. E montrer dossiers représentatifs. (B) Un potentiel d'action (PA) évoquée par stimulation électrique (artefact de stimulation, •). (C) Les réponses typiques à monofilament sondage et muqueuse caresser à main. (D, E) Les réponses à sonder et à étirer circonférentielle délivré par la force actionneur contrôlé par ordinateur, respectivement. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Caractérisation fonctionnelle des classes afférentes colorectal. Afférences sont situés par une stimulation électrique (e-Stim, ↑) du côlon et du rectum et classés en cinq catégories mécanosensibles et une afférente mécaniquement insensibles (MIA) classe basés sur leurs profils de réponse respectifs à trois stimuli mécaniques:. sondage, caressant, et se étirer Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4. afférentes réponses, stimulation mécanique commandé par ordinateur reproductible. (A) les réponses d'un musculo-muqueux unefférent à trois consécutive rampe étendues (de 0 à 170 mN à 5 mn / sec; 5 min d'intervalle inter-stimulus). (B) Les réponses (action de pointes potentiels) étaient également mis en cellule en trois bacs (0-57, 57-113 et 113-170 mN) et affichés en tant que fonctions de stimulus-réponse; seuil de réponse se affiche dans l'encart. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5. Réponses afférentes à l'application chimique localisée à terminaisons réceptifs. (A) Un exemple de la chimiosensibilité d'un afférent séreuse de l'application de la solution hypertonique acide (AHS). (B) Un exemple d'acquisition de mécanosensibilité (sensibilisation) se terminant par un MIA. Ce MIA n'a pas répondu directementà une soupe inflammatoire (IS), mais réagi à 1,4 g de palpage monofilament après. (C) Sensibilisation (une augmentation de l'ampleur de la réponse et de la réduction du seuil de réponse) afin d'allonger d'un afférente musculaire après l'exposition de sa fin pour IS. (D) Atténuation de la réponse à étirer par un afférent musculaire-muqueuse après l'exposition de sa fin de guanosine monophosphate cyclique (GMPc). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le vitro préparation colorectum-nerf décrit ici se est avérée être une approche puissante pour étudier les fonctions de codage neural de afférences colorectal individuels, qui complète bien d'autres approches non-fonctionnels (par exemple, des études cellulaires, moléculaires et histologiques) sur les neurones sensoriels viscérales ( lire l'article 27 pour plus de détails). Mécanismes neuronaux qui contribuent à la nociception et colorectal hypersensibilité à long terme ont été révélés et les manipulations pharmacologiques ont été réalisées qui ont révélé que les objectifs pourraient atténuer la douleur viscérale. Les points clés suivants associés à la mise en œuvre réussie de cette préparation sont discutés ci-dessous: 1) la réduction de bruit électrique, 2) augmentation de la détection du signal, et 3) la sélection d'un stimulus normalisée pour évaluer les changements d'encodage afférente. En outre, plusieurs limites de cette technique sont discutés.
Les potentiels d'action (PA) propagating intracellulairement le long des axones du nerf ont généralement un potentiel transmembranaire de 100 à 130 mV. Toutefois, en raison de la faible capacité spécifique de la membrane axonale, cette relativement grande dépolarisation résulte que dans un petit déplacement de charge électrique à travers la membrane cellulaire, qui peut facilement se dissiper dans le tissu extracellulaire / liquide interstitiel ambiant (qui a une impédance électrique beaucoup plus faible que la membrane lipidique). Pour l'enregistrement extracellulaire nerveuses filaments / axones, le signal électrique est habituellement dans la gamme de microvolts, à proximité de l'ampleur du bruit thermique / blanc associé à une configuration d'enregistrement bioélectrique typique, rendant la réduction du bruit la première priorité pour un enregistrement réussi. Pour isoler plus efficacement contre le bruit électrique ambiant, il peut être utile de placer la chambre de tissu, d'enregistrement et de mise à la terre des électrodes, l'amplificateur différentiel (courant continu alimenté par batterie) et le stéréomicroscope dans une cage de Faraday. Si le mouvement artéfacts se produisent, plaçant la cage de Faraday sur une table d'air pneumatique pour amortir les vibrations mécaniques est utile. Idéalement, l'enregistrement et de référence électrodes qui entrent dans les "+" et "-" ports de l'amplificateur différentiel, respectivement, devraient avoir impédance comparable par rapport à leur terrain d'entente et être situé près de l'autre. Ainsi, tout le bruit extérieur est enregistrée à peu près également par les deux électrodes et on le soumet à la stricte réjection de mode commun par l'amplificateur différentiel.
Dans notre configuration (figure 2A), l'électrode de référence est plongé dans la solution de perfusion de Krebs dans la chambre de tissu tandis que l'électrode d'enregistrement est en contact avec un nerf filament fin de l'impédance considérable. Cette configuration unique électrode avec une désadaptation d'impédance non triviale ne est généralement pas idéal pour la réduction du bruit. Cependant, cette configuration offre la commodité de placer le nerf fil fin sur un seul électrode, ce qui est particulièrement attrayant lors de l'enregistrement de souris colorectal filaments nerveuses de longueur limitée (10 à 15 mm). Basé sur notre expérience, la configuration mono-électrode est acceptable lorsque le bruit de fond crête-à-crête est inférieure à 20 mV dans le dossier. Dans le cas contraire, une nouvelle réduction de bruit exigerait une configuration d'enregistrement à deux électrodes, dans lequel le nerf filament fin doit être en contact avec les deux électrodes d'enregistrement et de référence placés parallèlement les uns aux autres. Toutes les grandes pièces métalliques à l'intérieur de la cage de Faraday doivent être mis à la terre d'une manière semblable à une étoile à une base commune, un bloc de cuivre dans notre configuration. Des précautions doivent être prises pour éviter la formation de boucles de masse.
Pour garantir la détection des points d'accès extracellulaire, la première étape est réussie dissection du tissu colorectal nerf. Pincer ou tirer le nerf lors de la dissection doit être évitée, ce qui peut endommager de manière irréversible le nerf et affecter AP conduction. La tige du nerf disséqué doit également to être libre de tout tissu musculaire connecté, qui fuit potassium lorsqu'il est endommagé et peut bloquer la conduction nerveuse par la dépolarisation. Cette compétence de dissection est généralement acquis par la pratique assidue pendant des semaines ou des mois et exige un haut niveau de coordination œil-main et la dextérité dans la manipulation et l'utilisation des instruments chirurgicaux. En outre, pour éviter d'endommager le tissu colorectal, la stratégie de recherche électrique utilise une électrode concentrique qui possède un instrument contondant, bout arrondi et relativement grand diamètre (externe Φ0.55 mm, interne Φ0.125 mm) et est relié à un micromanipulateur par un pont conforme, résultant en une force mécanique modeste appliqué sur la surface de la muqueuse (~ 100 mg). Afin d'obtenir un signal plus important dans la trace d'enregistrement, le courant transmembranaire induite par des AP doivent être canalisées et "piégé" sur l'électrode en créant un petit pont d'impédance entre l'axone (s) du nerf et la surface d'électrode. Ainsi, l'épinèvre et périnèvre qui isolentle nerf besoin d'être disséqué libre pendant le processus de division du nerf en fins filaments de ~ 10 um d'épaisseur. Étant donné que le courant transmembranaire induite par des AP dissipe sensiblement à une courte distance de la membrane axonale, un nerf filament mince se traduit généralement par un meilleur rapport signal à bruit en raison d'une plus grande proximité des axones à la surface de l'électrode. Dans la chambre de l'huile minérale, le miroir que le nerf est souvent placé sur attire une couche mince de la solution de Krebs (la surface du verre est hydrophile). Il est donc nécessaire que l'électrode d'enregistrement et le nerf filament ne sont pas en contact avec la surface du miroir pendant l'enregistrement. Les gouttelettes résiduelles de solution de Krebs, qui fournissent un pont de faible impédance entre l'électrode et la surface du miroir (ce est à dire, shunt) permettra de réduire considérablement l'amplitude du signal dans le dossier.
Cette préparation rectum nerf permet l'étude des changements fonctionnels de afférences après expositionRFS une variété de médiateurs et d'insultes in vitro chimiques ainsi que dans le contexte des conditions physiopathologiques à long terme (par exemple, colorectums prélevées sur des souris préalablement traités). Une mesure objective de changements fonctionnels de afférences dépend de ce qui suit: 1) un stimulus standardisé avec une grande précision et la reproductibilité et 2) les réponses afférentes qui sont robustes et reproductible. Parmi les trois stimuli mécaniques appliquées à l'rectum, de sondage et de caresser stimuli de la RF sont souvent délivré par von Frey-monofilaments comme portatifs. Pour sonder, le monofilament est généralement calibré pour fournir une force perpendiculaire reproductibles lors de la flexion. Monofilaments Cependant, von Frey-comme (0,4 et 1 g) ont petites et différents diamètres transversales (0,2 et 0,3 mm, respectivement), résultant en une contrainte nominale élevée lorsqu'elle est appliquée perpendiculairement à la surface colorectal (124,8 kPa pour 0,4 g et 138,7 kPa pour 1 g), un stimulus mécanique intense ponctuée beyonD la gamme physiologique normal. En outre, le tranchant du filament provoque susceptibles répartition inégale des contraintes avec le stress de pointe focale considérablement plus élevé que la contrainte nominale (de concentration de contrainte). Étant donné que la taille RF typique (1 mm 2) est nettement plus grande que la section transversale d'un monofilament, et l'incapacité à stimuler de manière reproductible le site identique à un monofilament à main, il est courant d'observer les réponses à des stimuli répétés qui diffèrent de manière significative dans la fréquence et la durée AP. A titre d'exemple, les réponses aux palpage représentée sur la figure 2C par la même monofilament à main (1 g) qui a varié considérablement probable sont apportés par une incapacité à sonder de manière reproductible le site identique et durée variable et un intervalle entre les stimuli consécutifs. Muqueuse Caresser livré par un filament à main est tout aussi difficile et tend aussi à susciter des réponses variables à partir du même afférente. reproductibilité de stimulation peut êtreaméliorée en utilisant une force actionneur contrôlé par ordinateur pour fournir forces précises de sondage (et extensibles). Pour le sondage, nous utilisons un monofilament présentant un diamètre supérieur (par exemple, # 6,45, 1 mm) qui couvre entièrement une plus typique RF afférente 24,28. Commandé par ordinateur étirement circonférentiel, par opposition à d'autres approches de tissu qui se étend à l'adresse du RF, permet une déformation homogène sur toute la longueur du côlon et du rectum, ce qui rend possible la corrélation avec la distension colorectale dans sa configuration d'origine cylindrique sur la base de la contrainte mécanique circonférentielle comparable (ce est à dire, 0 - 170 mN tronçon est équivalent à 0-45 mm Hg de la pression intraluminale 23). Depuis la force d'étirement est appliqué uniformément au bord anti-mésentérique, pas directement à la RF, la contrainte mécanique locale évoquée au RF afférente est reproductible entre deux demandes d'étirement. En outre, le type L Ca2 + bloqueur des canaux nifédipine ajouté au bain à inhibit contraction spontanée du muscle lisse, contribue au maintien de la conformité colorectal entre les tests d'étirage 23 en rampe. Enfin, les réponses afférentes au protocole d'étirage en forme de rampe se sont révélés être reproductible avec une faible variabilité à la fois la fonction seuil stimulus-réponse et la réponse (par exemple, figure 4). Ainsi, les réponses afférentes à étirer rampe ont été largement utilisés comme une évaluation objective des changements de la fonction afférente à étudier les mécanismes neuronaux de la douleur viscérale et d'hypersensibilité (par exemple, 19-22,24,26,28-31).
La préparation rectum nerf est un outil puissant pour l'étude des afférences viscérales colorectal. Cependant, il présente également des limites. Tout d'abord, les axones des corps cellulaires des neurones sensoriels du ganglion de la racine dorsale sont découpées dans la préparation, ce qui empêche l'étude des identités moléculaires de ces corps cellulaires (par exemple, une seule cellule RT-PCR ou transcriptome analyse des différentes classes d'afférences colorectal). Deuxièmement, le faible rapport signal sur bruit de l'enregistrement monofibre exige optimales chirurgicales dissection / nerveuses compétences de fractionnement et l'enregistrement à faible bruit, ce qui limite considérablement plus large application de ce protocole dans d'autres laboratoires. Troisièmement, cette préparation in vitro peut ne pas être applicable aux enquêtes de facteurs systémiques qui modulent la sensation viscérale, tels que le système nerveux autonome, hormones circulantes et des cytokines, microbiote intestinal, et descendant la modulation du système nerveux central.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



