Abstract
このビデオでは、詳細に、マウスの大腸-神経準備を用いたin vitroの単繊維電気生理学的記録プロトコルを示しています。アプローチは公平な識別と個々の大腸求心性の機能解析を可能にします。 1または少数の求心性から生じる伝播し活動電位(APS)の細胞外記録は( すなわち、単一ファイバ)大腸内受容野(RFS)はからかわ神経線維線維束から作られています。大腸は、骨盤(PN)または腰椎内臓(LSN)神経取り付けられており、縦方向に開いたのいずれかで削除されます。組織は、記録チャンバーに入れ、平らに固定し、酸素化クレブス溶液で灌流される。フォーカル電気刺激は、機能的に5 mechanosensiに求心性神経を分類するために、さらに三つの異なる機械的刺激によってテストされている大腸求心性終末を、(プロービング、粘膜なでると周ストレッチを鈍ら)を見つけるために使用されます電性のクラス。これらの機械的刺激のいずれにも応答エンディングは、機械的に小文字を区別しない求心性(MIAs)に分類される。機械受容およびMIAs両方は、化学物質へのRFの局所露光部( 例えば、炎症性スープ(IS)、カプサイシン、アデノシン三リン酸(ATP))によって( すなわち、強化された応答を低減閾値、および/ または機械的感受性の取得)感作のために評価することができる。私たちは、機器や結腸直腸-神経録音の準備、添付のPNまたはLSNと大腸の収穫、大腸内のRFの識別、神経線維束から単心記録、およびRFへの化学物質のローカライズされたアプリケーションを記述する。また、標準化された機械的な刺激の準備とアプリケーションの課題も議論されている。
Introduction
疼痛および過敏症が明らかに病理学的原因または組織損傷の非存在下で存在する過敏性腸症候群(IBS)を含む機能性胃腸障害に罹患している患者の主な不満である。例えば、IBS患者は、体の紹介(腹部の触診に、すなわち、圧痛)1の直腸バルーン膨満への応答を高め、正常な腸機能の間に感受性の増加、ならびに過敏を含む過敏症を呈する。大腸求心性神経を標的にすること(局所麻酔薬2,3の例、直腸内点滴注入、グアニル酸シクラーゼ-Cアゴニストリナクロチド4-6の経口摂取)をIBS患者の痛みや過敏症を緩和するのに有効であることが証明されているため、理解の向上大腸の求心性神経支配が重要です。
大腸求心性神経を含む内臓求心性神経、化学/ nutrient-および熱モダリティ( 例えば、7-9)に応答することができる。機械的な刺激( 例えば、管腔膨満、ストレッチ)は、一般的に不快感や痛み10-16含め意識的な感覚、を生じさせるものであるので、機械的刺激( すなわち、機械受容求心性神経)への対応内臓求心性神経は、最も徹底的に研究されている。また、内臓はまた、一般的に、機械的に区別しない求心性(MIAs)によって神経支配サイレントまたは眠っ侵害受容器17と呼ばれている。正常な生理的条件下では、MIAsは機械的な刺激に応答したり、持っていない非常に高い応答が18をしきい値が、アクティブになり、病態生理学的状態において機械的感受性を取得し、過敏症に寄与することができる。
ここに記載のインビトロ調製およびプロトコルを使用して、我々は、海に電気刺激戦略を開発し、採用大腸19の両方の機械受容とMIA終末の公平な識別を可能に受容語尾のためRCH。結腸直腸の神経支配は腰部内臓(LSN)および骨盤神経(PN)経路に由来し、5機械受容クラス(漿膜、粘膜、筋肉、筋肉、粘膜、腸間膜)と一つMIAクラス20に分類することができる直腸求心性線維を含む。このインビトロ準備を使用して、我々は大腸MIAs獲得した機械的感受性がLSN経路においてPN経路におけるMIAsの71%とMIAsの23%増感炎症スープ(IS)、への受容野の簡単な露出以下(感作)ことがわかった19。また、(ザイモサン21または2,4,6-トリニトロベンゼンスルホン酸(TNBS)22で結腸内処置を受けたマウス、すなわち、)長期間持続する行動内臓過敏の文脈でMIAsの(28日まで)の長期感作を文書化。
機械受容求心性神経のうちjove_content ">、筋肉と筋肉の粘膜求心性は持続的に大腸の周ストレッチをエンコード( すなわち、ストレッチと小文字が区別されます)と有害な結腸直腸拡張23,24のエンコーディングを補助する唯一のクラスである。コンピュータ制御を使用して、フォースアクチュエータは、均質で、基準を適用し、かつ再現性が平坦化された大腸組織とさらに分類ストレッチセンシティブ求心低閾値および高閾値23の周方向に伸縮性を上げ、また、伸縮性の感作の時間経過を結腸内ザイモサン21またはTNBS 22治療後の感受性求心性内臓痛および過敏でストレッチに敏感な大腸求心性神経の役割を示唆し、行動内臓過敏の発症、持続性、および/ または回復に対応している。Subscription Required. Please recommend JoVE to your librarian.
Protocol
注:このプロトコルを見直し、ピッツバーグ大学の施設内動物管理使用委員会によって承認された。
修正クレブス溶液と試験薬品アリコートの調製
- 117.9のNaCl、4.7のKCl、25のNaHCO 3、1.3のNaH 2 PO 4、1.2をMgSO 4、2.5のCaCl 2、11.1 D-グルコース、2酪酸ナトリウム、20酢酸ナトリウム(単位はmM)を含有する改変クレブス液を6 Lを作る0.004ニフェジピン(自発的な筋収縮をブロックする)、及び0.003インドメタシン(内因性プロスタグランジンの合成をブロックする)。それぞれ、組織切開とシングルファイバー記録に氷のように冷たいと暖かいクレブスのソリューションを使用してください。
- 任意の化学溶液を調製する( 例えば、IS、カプサイシン、ATP)は、所望の濃度の分量で。
結腸直腸-神経組織の2解剖
- 中(30グラム - - 8週齢、20 6)雄マウスを麻酔し、安楽死させるマウスは、胸部の動きの欠如によって示されるように、完全に呼吸が止まるまで、毎分チャンバ容積の30% - 10を変位させる流量でCO 2室。
- 直ちに、胸部室切開右心房を穿孔し、氷冷したクレブスの十分な体積(〜500ml)中でのマウスカーカスを浸漬することにより安楽死、放血させると、以下の(4°C)溶液カルボゲン(95%O 2でバブリング、5%CO 2)。
- 慎重にすべての内臓が、コロンと骨盤臓器を取り除く。少し横隔膜より上T12脊髄分節全体の半分にマウスを横断すると氷の寒さを含む解剖室に尾側半分を転送し、クレブス溶液を泡立て。
- 実体顕微鏡下では、尿道への接合部で離断によって膀胱と生殖器官を削除し、それが総腸骨動脈に分岐するまで下行/腹部大動脈を削除します。 PNまたはそれらのsurroundinからLSNを解放鈍的切開によるグラム組織および(PN用)L6とS1脊柱または(LSN用)T13とL1脊柱へのその腹側のエントリポイントまでの腸骨稜の外から神経に従ってください。
- 恥骨結合と左右の寛骨臼関節を切断し、腸骨を取り除く。神経が脊柱に入る場所まで、大腸に近いから添付の筋肉や結合組織からのPNまたはLSNのどちらかを慎重無料。
- 慎重に遠位大腸を露出するように腸骨を切除。連続で添付PNまたはLSNと遠位大腸を解剖。
- 組織室の浴コンパートメントに装着神経と直腸を転送します。さらに切開により過度の結合組織を外し、抗腸間膜の国境に沿って縦方向に大腸を開きます。
- 上に向け粘膜側では、chambeのシリコーンベースに記録コンパートメントに隣接した結腸直腸腸間膜エッジをピンrおよび力アクチュエータに接続されたフックのレーキに大腸のantimesenteric長さを取り付け( 図1に示され、 図2Aで撮影)。
- マウスの穴とゲートで風呂コンパートメントに接続されている記録をコンパートメントの中にPNまたはLSNを拡張します。静かに神経接着させるための親水性表面を提供記録コンパートメント、小さなガラスミラーに神経幹を置く。暖かいと一緒にお風呂コンパートメントSuperfuse(30から32°C)を、Krebs溶液を酸素化し、鉱物油との記録コンパートメントを埋める。
3.シングルファイバーの記録と受容野の局在
- 慎重に高倍率( - 60X 50)での実体顕微鏡下でPNまたはLSNから神経上膜(神経鞘)をバックはがします。 〜100μmの厚さの8神経束 - 細かい鉗子を使用して、5に神経幹をいじめる。
- 白金 - イリジウムリファレンスを置き組織チャンバ内のクレブス溶液と接触する電極。順次同一の材料からなる記録電極上に個々の神経束を置く。
- 穏やかになでることで大腸表面下大腸求心性神経からのAPを呼び起こすために柔らかいペイントブラシを使用してください。検出可能なAP(活動電位)の録音を通じてコロンを支配する神経束(s)を見つけます。
注:PNとLSNも膀胱や他の骨盤内の臓器を支配する。 - さらに〜10μmの厚さの細い束のフィラメントに神経束を分割し、記録電極上に個々のフィラメントを配置するために30 G針先端のペアを使用してください。
- 電気的に現在のスプレッドの〜2mmの半径を生成閾値上の刺激強度(10ミリアンペアの大きさ、0.3 Hzの@ 0.5ミリ秒の持続時間)、での求心性終末を励起するために粘膜表面に垂直なラウンドが先端に付いた同心円状の電極を配置します。体系的に電極を移動(〜1.5ミリメートルステップ)受容語尾をローカライズする扁平な大腸の長さと幅に沿って。
- 求心性エンディングが励起されると、最小刺激強度(刺激しきい値)を必要とする活性化(受容野、RF)のサイトを特定するための電極位置を調整します。 > 3ミリアンペア19刺激閾値と語尾を破棄。
- 刺激アーチファクトと活動電位の開始との間の受容野(RF)での刺激電極と記録部位および2)伝導遅延( 例えば、 図2B)との間の距離)1から伝導速度(CV)を計算する。
CV(10m /秒)=距離(mm)/伝導遅延(ミリ秒)。
機械受容大腸求心性神経の4機能分類
- 電気刺激によってRFを見つけた後、RFに、次の3つの機械的刺激を適用します。
- Calibraでの先端を押して、プロービング刺激を実施テッド·フォン·フレイのようなナイロンモノフィラメント(0.4および1グラム力)垂直に平坦化された大腸上のRF向けた。
- 穏やかRF小さな表面せん断応力を生成するために細かいナイロンフィラメントストランド(10 mgの力)で大腸粘膜をなでることでなでる刺激を行う。
- ステップ2.8に記載されてフックのレーキを介して大腸の抗腸間膜縁に沿って円周方向に( -は5mN /秒で170 MN 0)傾斜伸縮力を提供し、コンピュータ制御の力アクチュエータを用いて円周ストレッチを行う。
- 漿膜として、粘膜を(プロービング平滑末端にのみ反応する)求心性神経を分類筋肉(周ストレッチに対応し、プロービング平滑)筋肉/粘膜を(周ストレッチ、粘膜なでるに対応し、プロービング平滑)、または、(なでる粘膜およびプロービング平滑末端に反応する) MIA(三機械的刺激のいずれかに応答しない)。
- だけで(腸間膜求心性神経のために、電気刺激によって選択的に活性化する腸間膜のプロービング/機械的なストロークによってそれらの受容語尾を見つけることが困難なLSNの神経支配)。
- ストレッチに敏感な求心性(筋肉と筋肉の粘膜)の場合は、傾斜のストレッチ中に最初のAPを呼び起こす力として定義されている応答閾値を決定する。
- 漿膜求心性神経のために、コンピュータ制御力アクチュエータで駆動される受容野のプロービング点状のレベルを昇順に彼らの応答を記録。
5.化学アプリケーション/受容性終末のモジュレーション
- 機械的な刺激に対するベースライン応答を記録( すなわち、傾斜ストレッチ、プロービング点状、または粘膜ストロークへの応答)。
- コートチューブの一片(真鍮やステンレス鋼、10ミリメートル、高と4×4ミリメートル2正方形または4〜5ミリメートルの直径)の下端ワセリンとし、大腸に受容野の上に置きます。
- 削除するチューブ内部のクレブス溶液、および3の受容エンディングさらす - 試験される化学物質(単数または複数)を含む溶液の170μlに5分。
- 化学アプリケーションの間の求心性の応答を監視します(一部の求心性神経は、化学感受性である)。
- 化学物質の作用を終了させる薬液とチューブを外します。 4内 - 6分、ベースライン応答と同様に機械的刺激への求心性応答をテストします。
- ウォッシュアウト(> 15分)の十分な期間の後に再び機械的刺激を再適用します。
6.録音および識別APスパイク
- 20 kHzで軸索から記録された電気信号をデジタル化し、コンピュータにデータを保存します。オーディオモニターにより、オンラインの信号を監視します。
- オフラインAPスパイクを分析し、個々のスパイク波形25の主成分分析に基づいて、単一のユニットを区別する。
注:Oneレコードがこれ以上目を含める必要があります2簡単に識別可能なアクティブユニット。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
セットアップは、 図1に示されている。これは、シリコーン裏打ち浴区画と隣接する鉱物油が充填されたコンパートメントで取り付け神経における大腸を収容するカスタムメイドの組織チャンバを含む。二区画室は、CNC機によるアクリルプラスチックの固体ブロックから機械加工された。両方の区画の底部は、その後の結腸直腸組織の下に簡単にピンを許可するようにしっかりとシリコンが並んでました。いじめ神経線維束から外APは高コモンモード除去比(CMRR〜60デシベル)で低ノイズ、バッテリ駆動の差動増幅器を使用して記録されている。増幅器の利得は0.3〜10 kHzでx10,000バンドフィルタの範囲に設定されている。結腸直腸の電気刺激は、結腸直腸粘膜に接触して同心円状の電極を介して定電流モードで光学的に結合された刺激装置によって送達される。機械的刺激(大腸ストレッチと点状のプロービング)は交流によって配信されるomputer制御力アクチュエータ。 AD変換器および適切なソフトウェアは、機械的および電気的刺激、ならびに記録を開始するために、電圧指令の出力を送信し、差動増幅器から外AP信号をデジタル化することによって、両方の刺激および記録のプロセスを監督する。機械的および電気的なノイズ源から単離するために、組織チャンバ、顕微鏡と、差動増幅器は、空気圧エアテーブル上に取り付けられたファラデーケージの内部に配置されている。
図2Aに示すように、添付の神経と直腸は、マウスから切開した抗腸間膜縁に沿って切開し、そしてシリコーン裏打ち組織チャンバ内に平らに固定されている。神経は、隣接する記録チャンバー内にガラス鏡上に配置される。閾値におけるRFの電気刺激に応答して活動電位(AP)の代表的な記録は、図2Bにある表示。このレコードのAPは、刺激の芸術遅れているifact(•)よく無髄C線維の範囲で、0.43メートル/秒の計算された伝導速度が得られる記録電極へのRFの伝導遅延に起因する49ミリ秒による。 図2Cに表示された(フォン·フライのようなモノフィラメント、1グラム、およびRFの微粘膜なでる、10 mgのRFのプロービング)手で配信刺激に対する求心性の典型的な応答である。このレコードは2簡単に識別可能求心性が含まれています。唯一の大振幅求心性はストロークに応答します。 図2Dに示すように、プロービングの求心性応答はまた、直腸に、同じ部位に正確なタイミングでかつ再現性のある機械的な力(5、10、20、40及び80 50m秒における一連の提供、コンピュータ制御の力アクチュエータによって評価した5秒持続時間)。同様に、結腸直腸の周方向伸び(0 -は5mN /秒で170 MN) 図2Eに表示された代表的な応答と同一のアクチュエータによって送達される
図3に示すように、結腸直腸の求心性は、機能的に三つの異なる機械的刺激(上記のステップ4.2を参照)、その応答プロファイルに基づいて、6つのクラスに分類することができる。腸間膜求心性神経を除くすべての求心性終末は電気刺激によって位置していた(E-STIM、左端の列、矢印は、刺激アーチファクトを示す)。機械的に区別しない求心性(MIAs)は、3つの機械的刺激のいずれかに応答しない。 ( - 1.4グラム0.4)を対照的に、すべての機械受容語尾はプロービングに反応する。これらの中でも、筋肉および筋肉粘膜終末も周ストレッチによって活性化される(0から170のMn)、したがって伸張に敏感な求心性と呼ばれる。筋肉粘膜終末も(10 mg)をなでることによって活性化される。粘膜エンディングも(10 mg)をなでることによって活性化が、伸びていないと漿膜語尾はどちらストレッチやストロークによって活性化されない。腸間膜語尾を機械的にBで識別されます腸間膜を急い。
図4Aに表示された5分で区切られた3つの連続した円周方向のストレッチによって誘発ストレッチに敏感な求心性からの代表応答である。スパイク数が均等に3ビンにビニングされ、両方の応答の大きさ(スパイク数)と反応閾値に高い再現性を明らかにし、 図4(b)の刺激-反応の関数として表示される。
このインビトロ結腸直腸-神経調製物はまた、受容語尾を求心性に化学物質のローカルアプリケーションを可能にします。化学物質への曝露は、物理的に大腸の残りの部分からRFを分離するために結腸直腸粘膜の上に真鍮やステンレススチールチューブを配置することによって、求心性RF周りの領域に制限されている。化学アプリケーション以下の典型的な結果は次のとおり酸高張液の適用時に求心性神経(AHS 26; 図5A)の直接の活性化を、なし活性化、炎症性スープ(19 IS; 図5B)を適用した後のMIAによる機械的感受性の買収は、IS( 図5C)の適用後に機械的なストレッチに応答( すなわち、感作)を増加し、適用後に機械的なストレッチへの応答を減少させたcGMPの( 図5D)。

実験装置の図1の模式図。結腸直腸、神経が二区画組織チャンバ内に配置したファラデーケージによって他の電子機器からの差動増幅器のヘッドステージに沿って分離されている。各求心性RFは大腸の電気刺激(E-STIM)によって識別され、3機械的刺激によってテストされた:ナイロンモノフィラメントプロービング、粘膜なでる、及び周ストレッチ。 ttps://www.jove.com/files/ftp_upload/52310/52310fig1highres.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
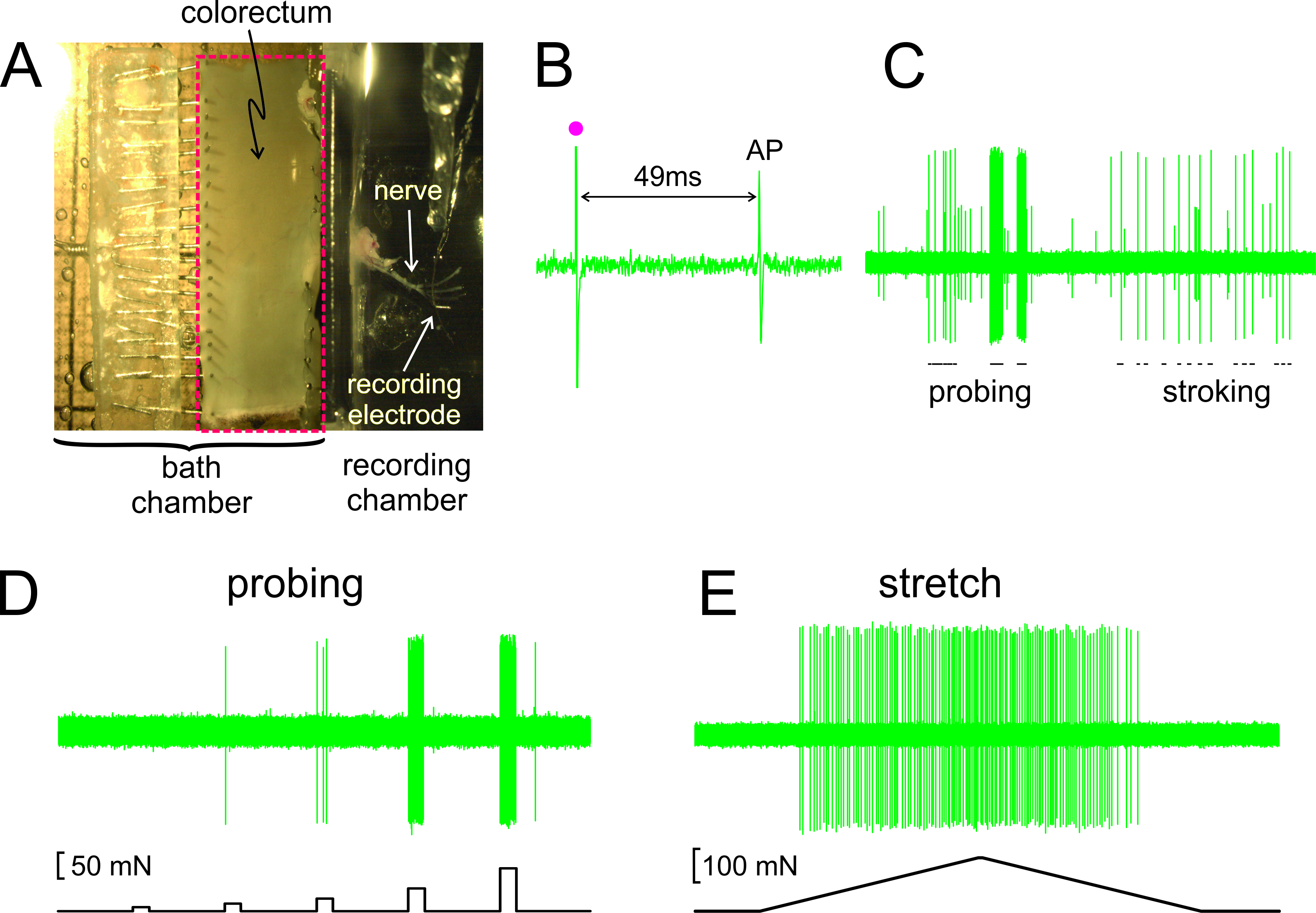
図2.付属の骨盤神経(A)との解剖大腸の実体顕微鏡スルー画像B - 。Eは 、代表レコードを表示。 (B)活動電位(AP)電気刺激により誘発される(刺激アーチファクト、•)。 (C)は、典型的な応答は、モノフィラメントプロービングおよび粘膜ストロークをハンドヘルド手に。 (D、E)プロービングへとコンピュータ制御力アクチュエータで配信周ストレッチへの対応を、それぞれ。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3.大腸求心性のクラスの機能解析。求心性神経は、大腸の電気刺激(E-STIM、↑)で位置しており、3枚に、それぞれの応答プロファイルに基づいて5機械受容クラスと1機械的に小文字を区別しない求心性(MIA)クラスに分類されます機械的刺激:プロービング、なでる、ストレッチこの図の拡大版をご覧になるにはこちらをクリックしてください。

再現性のある、コンピューター制御の機械的刺激に図4.求心性応答。(A)筋肉粘膜aの応答( - ; 5分刺激間隔5 MN /秒で170 MN 0)の連続した3つのfferentはストレッチを傾斜。 ( - 57、57から113、および113 - 0 170 MN)(B)の回答(活動電位スパイク)が均等に3ビンにビニングされ、刺激-応答関数として表示。応答閾値は、挿入図に表示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

受容語尾にローカライズされた化学的なアプリケーションに図5.求心性応答。(A)酸性高張液(AHS)の適用漿膜求心性の化学感受性の一例。 (B)終了MIAによる機械的感受性(感作)の買収の例。このMIAは直接応答しませんでした炎症性スープ(IS)に、が、その後プロービング1.4グラムのモノフィラメントに反応した。 (C)感(応答の大きさおよび反応閾値の低下の増加)がISへの終了の暴露後に筋肉の求心性のストレッチする。応答の(D)減衰が環状グアノシン一リン酸(cGMP)へのエンディングの曝露後の筋肉の粘膜求心性によって伸縮する。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ここに記載のインビトロ結腸直腸神経準備がうまく内臓感覚ニューロン上の他の非機能的アプローチ( 例えば 、細胞、分子、および組織学的研究)を補完する個々の結腸直腸求心性の神経エンコーディング機能(研究するための強力なアプローチであることが証明され)詳細についてはレビュー27を参照してください。痛覚および長期直腸過敏症に寄与神経メカニズムが明らかにされている薬理学的操作は、内臓痛を軽減する可能性の目標を明らかにしたことが行われている。この準備の実装を成功に関連した以下のキーポイントは、以下で説明されています。電気的ノイズの1)削減、信号検出では2)の増加、および求心性エンコーディングの変化を評価するための標準化された刺激の3)選択。また、この技術のいくつかの制限について検討した。
活動電位(APS)propagati130 mVの - 神経軸索に沿って細胞内にngの通常100の膜電位を持っている。しかし、軸索の膜の小さな特定の容量に、この比較的大きな脱分極は、簡単に電気インピーダンスはかなり低く持って周囲の細胞外組織/間質液(に放散することができる細胞膜を横切る小さな電荷変位をもたらす、脂質膜より)。神経フィラメント/軸索から細胞外記録のために、電気信号はノイズ除去の成功記録の最初の優先順位をレンダリングする、典型的な生体記録のセットアップに関連する熱/白色雑音の大きさに近いマイクロボルトの範囲である。最も効果的に周囲の電気的ノイズから隔離するには、差動アンプ(DCバッテリ駆動)と、ファラデーケージ内実体顕微鏡を組織チャンバ、記録及び接地電極を配置するのに役立つことができる。もし運動アーティファクトSは、機械的な振動が役に立つ減衰させる空気式エアテーブル上のファラデーケージを置くこと、起こる。理想的には、「+」を入力して記録し、参照電極と " - "の差動増幅器のポートは、それぞれ、それらの共通のグランドに匹敵インピーダンス性を有するべきであり、互いに近接して配置すること。したがって、外部のノイズが両電極約均等に記録し、差動増幅器による厳格なコモンモード除去を受けることになる。
記録電極は、かなりのインピーダンスの微細な神経フィラメントと接触しているのに対し、我々のセットアップ( 図2A)において、参照電極は、組織チャンバ内のクレブス灌流液中に浸漬される。自明でないインピーダンス不整合を有するこの単一電極構成は、ノイズ低減のために、通常、理想的ではない。しかし、この構成では、1つの電動式に微細な神経フィラメントを配置するのに便利です(10〜15ミリメートル)限られた長さのマウス大腸の神経フィラメントから録音するときに特に魅力的である頌歌、。ピーク·ツー·ピークのバックグラウンドノイズはレコードの20μV未満である場合の経験に基づいて、単一電極構成が許容される。そうでなければ、さらなるノイズ低減細かい神経フィラメントが、互いに平行に配置され、両方の記録電極と参照電極と接触するように持っている2電極記録の設定を要求するだろう。ファラデーケージ内のすべての大型の金属部品は、我々のセットアップで、一つの共通のグランドにスター状に接地する銅ブロックを必要としています。ケアは、接地ループの形成を回避するように注意しなければならない。
APの細胞外の検出を確実にするために、最初のステップは、結腸直腸、神経組織の正常な解剖ある。解剖の際に神経をつまんや引っ張りには不可逆的に神経を損傷し、AP伝導に影響を与える可能性があり、避けなければならない。解剖神経幹はまた、Tを必要としますO破損して脱分極によって神経伝導をブロックすることができたときにカリウムをリークし、接続されている筋肉組織のないこと。この解剖スキルは一般的に数週間から数ヶ月にわたって勤勉な練習を通じて取得し、取り扱いや手術器具を使用する際の目と手の協調と器用さの高いレベルを要求されている。また、結腸直腸組織への損傷を避けるために、電気的な検索戦略は、鈍い、丸い先端および比較的大きな直径(外Φ0.55ミリ、内部Φ0.125mm)を有することによって、マイクロマニピュレータに接続された同心円状の電極を利用するささやかな機械的な力になり準拠したブリッジは、粘膜表面(〜100 mg)のに適用される。記録トレースの大きい信号を取得するために、AP誘導性膜貫通電流が導かれ、神経軸索(複数可)と電極表面との間に小さなインピーダンスブリッジを作成することにより、電極上に「トラップ」される必要がある。断熱したがって、神経上膜および神経周神経は、〜10μmの厚さの細いフィラメントに神経を分割するプロセスの間に切開する必要がある。 AP誘導性膜貫通電流が軸索膜から短い距離で大幅に放散するので、薄い神経フィラメントは、通常、電極表面への軸索 '近接する優れた信号対雑音比をもたらす。鉱物油室において、神経は、しばしば上に配置されるミラーは、クレブス液(ガラス表面が親水性である)の薄層を引き付ける。これは、記録電極と神経フィラメントは、記録時のミラー面と接触していないことが必要である。電極と鏡面との間に低インピーダンスのブリッジを提供クレブス溶液の残留液滴は、( すなわち、シャント)が有意にレコード内の信号振幅を減少させる。
この大腸神経準備が露出させた後求心性神経の機能的変化の研究を可能にする化学伝達物質およびin vitroでの侮辱の様々なだけでなく、長期的な病態生理学的状態のコンテキストでのRF( 例えば、以前に処置したマウスから採取したcolorectums)。堅牢で再現性のある高精度と再現性と2と1)標準化された刺激)求心性の応答:求心性神経の機能変化の客観的な尺度は、以下に依存します。 RFの刺激をプロービングし、なでる直腸に適用する3機械的刺激、多くの場合、ハンドヘルドフォン·フレイのようなモノフィラメントによって配信されます。プロービングのために、モノフィラメントは通常、曲げたときに再現可能な垂直方向の力を提供するために較正される。しかし、フォン·フレイ·モノフィラメント様(0.4 1g)を、結腸直腸の表面に垂直な適用されたときに高い公称応力を生じる(それぞれ、0.2および0.3 mmの)小さなと異なる断面直径を有する(124.8キロパスカル0.4グラムおよび1グラムのための138.7キロパスカル)、強烈な、点状の機械的刺激beyon正常な生理的範囲はd。また、フィラメントの鋭いエッジは、おそらく公称応力(応力集中)よりかなり高い局所ピーク応力を有する応力の不均一な分布を引き起こす。典型的なRFサイズ(1mm 2の) はモノフィラメントの断面、および再現性ハンドヘルドモノフィラメントと同一の部位を刺激することができないことよりも有意に大きいことを考えると、異なる繰り返し刺激に対する応答を観察することが一般的であるかなりのAP頻度及び期間で。例として、同じハンドヘルド型モノフィラメント(1グラム)により、図2Cに示すプロービングへの応答可能性が高い再現性よく、連続する刺激の間で同一サイトと可変の持続時間と間隔をプローブすることができないことによってに貢献しているかなり変化。粘膜は、手持ちフィラメントによって送達なでる同様に困難であるし、また同じ求心から可変応答を誘発する傾向がある。刺激再現性があることができます正確なプロービング(ストレッチ)の力を提供するためにコンピュータ制御の力アクチュエータを使用することによって改善。プロービングのために、我々はより完全に典型的な求心性RF 24,28をカバーして大きな直径( 例えば、#6.45、1ミリメートル)でモノフィラメントを使用しています。コンピュータ制御周ストレッチ、RFに向け、他の組織ストレッチングのアプローチとは対照的に、可能とする、大腸の長さ全体に均質な変形を可能に匹敵する周機械的ストレス( すなわち、0に基づいて、元の円筒形状で結腸直腸拡張との相関- 45ミリメートルHgの管腔内圧力23) - 170 MNのストレッチは0に相当します。ストレッチ力がRFに直接ではなく、抗腸間膜縁に均一に塗布されているので、求心性RFでの誘発局所的な機械的ストレスがストレッチの連続したアプリケーション間の再現性がある。また、L型Ca 2+チャネル遮断薬、ニフェジピンを私に浴に添加nhibit自発的平滑筋収縮、傾斜ストレッチテスト23の間で大腸のコンプライアンスの維持に貢献しています。最後に、傾斜ストレッチプロトコルへの求心性応答は、刺激応答関数と応答閾値の両方における小さな変動( 例えば、 図4)再現性があることが証明されている。このように、傾斜したストレッチの求心性応答は、広く内臓痛と過敏性の神経細胞のメカニズム( 例えば 、19-22,24,26,28-31)を研究する上での求心性機能の変化を客観的に評価として使用されている。
大腸-神経準備が大腸内臓求心性神経の研究のための強力なツールです。しかし、それはまた、いくつかの制限がある。まず、後根神経節における感覚ニューロンの細胞体の軸索は、それらの細胞体( 例えば、単一細胞RT-PCRまたはTRの分子のアイデンティティの研究を排除し、準備に離断されている大腸求心性の異なるクラスのanscriptome分析)。第二に、単繊維記録低い信号対雑音比が大幅に他の研究室では、このプロトコルのより広い適用を制限する、最適な外科的切開/神経分離技術と低ノイズ記録を要求する。第三に、このインビトロ製剤は、自律神経系、ホルモンやサイトカインの循環、腸内細菌叢、および中枢神経系からの変調を降順として内臓感覚を調節し、全身因子の調査には適用できない場合があります。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Leica MZ16 stereo microscope | Leica Microsystems Inc. | ||
| Leica IC D camera | Leica Microsystems Inc. | ||
| Amplifier | World Precision instruments, Inc. | SYS-DAM80 | Low-noise differential amplifier |
| Two-compartment tissue chamber | Custom made | ||
| Power1401 | Cambridge Electronic Design Limited | Power1401 | Data acquisition, analog signal input/out |
| Spike2 v5.02 | Cambridge Electronic Design Limited | Software package that works with the Power1401 | |
| Audio monitor | Natus | Am 8 | |
| Square pulse stimulator | Natus | S48 | To deliver electrical stimuli |
| Photoelectric isolation unit | Natus | PSIU6 | Stimulus isolation to reduce noise |
| Concentric bipolar microelectrode | FHC Inc. | CBFFG75 | To deliver electrical stimuli |
| Dual-mode lever system | Aurora Scientific Inc. | Series 300C | To deliver mechanical stimuli |
| Forceps | Fine Science Tools | 11252-00 | Forceps with fine tips |
References
- Naliboff, B. D., et al. Evidence for two distinct perceptual alterations in irritable bowel syndrome. Gut. 41, 505-512 (1997).
- Verne, G. N., Robinson, M. E., Vase, L., Price, D. D. Reversal of visceral and cutaneous hyperalgesia by local rectal anesthesia in irritable bowel syndrome (IBS) patients. Pain. 105, 223-230 (2003).
- Verne, G. N., Sen, A., Price, D. D. Intrarectal lidocaine is an effective treatment for abdominal pain associated with diarrhea-predominant irritable bowel syndrome. Journal of Pain. 6, 493-496 (2005).
- Chey, W. D., et al. Linaclotide for irritable bowel syndrome with constipation: a 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol. 107, 1702-1712 (2012).
- Rao, S., et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol. 107, 1714-1724 (2012).
- Busby, R. W., et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther. 344, 196-206 (2013).
- Mei, N. Intestinal chemosensitivity. Physiol Rev. 65, 211-237 (1985).
- Mei, N., Lucchini, S. Current data and ideas on digestive sensitivity. J Auton Nerv Syst. 41, 15-18 (1992).
- Su, X., Gebhart, G. F. Mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat are polymodal in character. J Neurophysiol. 80, 2632-2644 (1998).
- McMahon, S. B., Morrison, J. F. Spinal neurones with long projections activated from the abdominal viscera of the cat. J Physiol. 322, 1-20 (1982).
- Cervero, F., Sann, H. Mechanically evoked responses of afferent fibres innervating the guinea-pig's ureter: an in vitro study. J Physiol. 412, 245-266 (1989).
- Sengupta, J. N., Gebhart, G. F. Mechanosensitive properties of pelvic nerve afferent fibers innervating the urinary bladder of the rat. J Neurophysiol. 72, 2420-2430 (1994).
- Sengupta, J. N., Gebhart, G. F. Characterization of mechanosensitive pelvic nerve afferent fibers innervating the colon of the rat. J Neurophysiol. 71, 2046-2060 (1994).
- Habler, H. J., Janig, W., Koltzenburg, M. Activation of unmyelinated afferent fibres by mechanical stimuli and inflammation of the urinary bladder in the cat. J Physiol. 425, 545-562 (1990).
- Habler, H. J., Janig, W., Koltzenburg, M. A novel type of unmyelinated chemosensitive nociceptor in the acutely inflamed urinary bladder. Agents Actions. 25, 219-221 (1988).
- Brierley, S. M., Jones, R. C. 3rd, Gebhart, G. F., Blackshaw, L. A. Splanchnic and pelvic mechanosensory afferents signal different qualities of colonic stimuli in mice. Gastroenterology. 127, 166-178 (2004).
- Meyer, R. A., Davis, K. D., Cohen, R. H., Treede, R. D., Campbell, J. N. Mechanically insensitive afferents (MIAs) in cutaneous nerves of monkey. Brain Res. 561, 252-261 (1991).
- Handwerker, H. O., Kilo, S., Reeh, P. W. Unresponsive afferent nerve fibres in the sural nerve of the rat. J Physiol. 435, 229-242 (1991).
- Feng, B., Gebhart, G. F. Characterization of silent afferents in the pelvic and splanchnic innervations of the mouse colorectum. Am J Physiol Gastrointest Liver Physiol. 300, G170-G180 (2011).
- Feng, B., La, J. H., Schwartz, E. S., Gebhart, G. F. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Neural and neuro-immune mechanisms of visceral hypersensitivity in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 302, G1085-G1098 (2012).
- Feng, B., et al. Long-term sensitization of mechanosensitive and -insensitive afferents in mice with persistent colorectal hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 302, G676-G683 (2012).
- Feng, B., et al. Altered colorectal afferent function associated with TNBS-induced visceral hypersensitivity in mice. Am J Physiol Gastrointest Liver Physiol. 303, G817-G824 (2012).
- Feng, B., Brumovsky, P. R., Gebhart, G. F. Differential roles of stretch-sensitive pelvic nerve afferents innervating mouse distal colon and rectum. Am J Physiol Gastrointest Liver Physiol. 298, G402-G409 (2010).
- Feng, B., et al. Activation of guanylate cyclase-C attenuates stretch responses and sensitization of mouse colorectal afferents. J Neurosci. 33, 9831-9839 (2013).
- Jolliffe, I. T. Principal component analysis. , 2nd, Springer. New York, NY. (2002).
- La, J. H., Feng, B., Schwartz, E. S., Brumovsky, P. R., Gebhart, G. F. Luminal hypertonicity and acidity modulate colorectal afferents and induce persistent visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 303, G802-G809 (2012).
- Christianson, J. A., et al. plasticity and modulation of visceral afferents. Brain Research Reviews. 60, 171-186 (2009).
- Kiyatkin, M. E., Feng, B., Schwartz, E. S., Gebhart, G. F. Combined genetic and pharmacological inhibition of TRPV1 and P2X3 attenuates colorectal hypersensitivity and afferent sensitization. Am J Physiol Gastrointest Liver Physiol. 305, G638-G648 (2013).
- Brumovsky, P. R., Feng, B., Xu, L., McCarthy, C. J., Gebhart, G. F. Cystitis increases colorectal afferent sensitivity in the mouse. Am J Physiol Gastrointest Liver Physiol. 297, G1250-G1258 (2009).
- Shinoda, M., Feng, B., Gebhart, G. F. Peripheral and central P2X receptor contributions to colon mechanosensitivity and hypersensitivity in the mouse. Gastroenterology. 137, 2096-2104 (2009).
- Tanaka, T., Shinoda, M., Feng, B., Albers, K. M., Gebhart, G. F. Modulation of visceral hypersensitivity by glial cell line-derived neurotrophic factor family receptor α-3 in colorectal afferents. Am J Physiol Gastrointest Liver Physiol. 300, G418-G424 (2011).



