Summary
प्रोटीन एकत्रीकरण सेलुलर ऑक्सीडेटिव तनाव में लाना । यह प्रोटोकॉल amyloidogenic प्रोटीन के intracellular राज्यों और उनके साथ जुड़े ऑक्सीडेटिव तनाव की निगरानी के लिए एक विधि का वर्णन करता है, प्रवाह cytometry का उपयोग कर । दृष्टिकोण amyloid-β पेप्टाइड के घुलनशील और एकत्रीकरण प्रवण वेरिएंट के व्यवहार का अध्ययन करने के लिए प्रयोग किया जाता है ।
Abstract
प्रोटीन का खुलासा और amyloid अनुरूपता में एकत्रीकरण कई neurodegenerative रोगों की शुरुआत और प्रगति से संबंधित है । हालांकि, वहां अभी भी कैसे अघुलनशील प्रोटीन समुच्चय vivo मेंउनके विषाक्त प्रभाव डालती के बारे में थोड़ी जानकारी है । सरल prokaryotic और eukaryotic मॉडल जीवों, जैसे बैक्टीरिया और खमीर, intracellular amyloid गठन, समुच्चय प्रचार, और विषाक्तता के पीछे तंत्र की हमारी वर्तमान समझ के लिए महत्वपूर्ण योगदान दिया है । इस प्रोटोकॉल में खमीर का उपयोग प्रोटीन समुच्चय के गठन और सेलुलर ऑक्सीडेटिव तनाव पर उनके प्रभाव के बीच संबंधों को काटना करने के लिए एक मॉडल के रूप में वर्णित है । विधि ऑक्सीडेटिव प्रवाह cytometry (एफसी) का उपयोग कर अपनी अभिव्यक्ति से उत्पंन होने वाली क्षति के ठहराव के साथ एक amyloidogenic प्रोटीन के intracellular घुलनशील/एकीकृत राज्य का पता लगाने को जोड़ती है । इस दृष्टिकोण सरल, तेज, और मात्रात्मक है । अध्ययन correlating सेलुलर ऑक्सीडेटिव तनाव amyloid-β पेप्टाइड वेरिएंट का एक बड़ा सेट की वजह से उनके संबंधित आंतरिक एकत्रीकरण की प्रवृत्ति के साथ तकनीक को दिखाता है ।
Introduction
Proteostasis सेल स्वास्थ्य और उंर बढ़ने प्रक्रियाओं के एक मौलिक निर्धारक है । कोशिकाओं में, प्रोटीन homeostasis परिष्कृत प्रोटीन गुणवत्ता नियंत्रण नेटवर्क द्वारा chaperones और/या उनके कई अच्छी तरह से संरक्षित तंत्र 1 के साथ अपने लक्षित प्रोटियोलिसिस द्वारा प्रकट प्रोटीन अनुरूपता के सही खुलासा सुनिश्चित करने के उद्देश्य से बनाए रखा है ,2,3,4,5. अध्ययनों की एक बड़ी संख्या की शुरुआत और मानव रोगों की एक विस्तृत रेंज की प्रगति और proteostasis की विफलता के बीच की कड़ी को समर्थन प्रदान करते हैं, प्रोटीन का खुलासा और एकत्रीकरण के लिए अग्रणी । उदाहरण के लिए, प्रोटीन जमा की उपस्थिति कई neurodegenerative विकारों की एक रोग की पहचान माना जाता है, जैसे अल्जाइमर, पार्किंसंस, और Huntington के रोगों6,7,8, prionogenic रोग, और गैर-अपक्षय amyloidoses9. यह सुझाव दिया गया है कि शीघ्र oligomeric और protofibrillar असेंबलियों में एकत्रीकरण प्रतिक्रिया cytotoxicity के मुख्य रूप से, भीड़ सेलुलर वातावरण10में अन्य प्रोटीन के साथ ंयायपालिका बातचीत की स्थापना कर रहे हैं । इसके अलावा, प्रोटीन समावेशन (PI) कोशिकाओं के बीच संचारित किया जा सकता है, उनके विषाक्त प्रभाव11,12प्रचार । इसलिए, यह हो सकता है कि PI के गठन वास्तव में एक detoxifying तंत्र है कि कोशिका, जहां वे संसाधित किया जा सकता है या प्रमुख साइड इफेक्ट के बिना जमा कर सकते है में विशिष्ट स्थानों के लिए खतरनाक एकत्रित प्रजातियों की उपस्थिति को प्रतिबंधित गठन 13 , 14.
इन विट्रो में मानक जैव रासायनिक दृष्टिकोण विभिंन प्रजातियों कि एकत्रीकरण प्रतिक्रियाओं और उनके गुण15,16आबाद में महत्वपूर्ण अंतर्दृष्टि प्रदान की है । हालांकि, इन परख में इस्तेमाल की शर्तों सेल के भीतर होने वाली उन से स्पष्ट रूप से अलग है और, इसलिए, उनके शारीरिक प्रासंगिकता सवाल । इस तरह के प्रोटीन गुणवत्ता नियंत्रण, autophagy, या सेलुलर redox राज्य के विनियमन के रूप में सेलुलर रास्ते के उल्लेखनीय संरक्षण के कारण17,18 eukaryotes के बीच19,20,21 ,22,23, नवोदित खमीर Saccharomyces cerevisiae (एस cerevisiae) एक विशेषाधिकार प्राप्त सरल सेलुलर मॉडल के रूप में उभरा है प्रोटीन एकत्रीकरण के आणविक निर्धारकों का अध्ययन और इसके जुड़े साइटोटोक्सिक प्रभाव में जैविक रूप से प्रासंगिक वातावरण24,25,26।
प्रोटीन एकत्रीकरण प्रवृत्ति अंतर्निहित प्राथमिक अनुक्रम में इनकोडिंग सुविधा है । इस प्रकार, amyloid संरचनाओं के गठन की पहचान और एकत्रीकरण-polypeptides27में क्षेत्रों को बढ़ावा देने की शक्ति के मूल्यांकन के आधार पर भविष्यवाणी की जा सकती है । हालांकि, bioinformatic एल्गोरिथ्म की सफलता के बावजूद इन विट्रो में प्रोटीन अनुक्रम के एकत्रीकरण गुणों की भविष्यवाणी करने के लिए, वे अभी भी पूर्वानुमान से दूर कर रहे है कैसे इन प्रवृत्तियां vivo साइटोटोक्सिक प्रभाव में अनुवाद में । अध्ययनों से पता है कि एक व्यवस्थित तरीके से एक दिया प्रोटीन और उससे जुड़े सेलुलर क्षति के समग्र राज्य के बीच की कड़ी को संबोधित इस गणना सीमा को दरकिनार मदद कर सकता है । यह कनेक्शन वर्तमान अध्ययन में संबोधित किया है, amyloid के वेरिएंट का एक बड़ा सेट का लाभ ले-β पेप्टाइड aβ ४२ केवल एक ही अवशेषों में भिन्न है, लेकिन vivo28में एकत्रीकरण की एक सतत श्रृंखला प्रदर्शित. विशेष रूप से, एक एफसी-आधारित दृष्टिकोण ऑक्सीडेटिव नुकसान के लिए संरचना की पहचान करने के लिए लेखांकन में एकत्रीकरण-प्रवण प्रोटीन खमीर कोशिकाओं में वर्णित है । कार्यप्रणाली सादगी, उच्च प्रवाह क्षमता, और सटीक मात्रात्मक माप के रूप में कई फायदे प्रदान करता है । इस दृष्टिकोण यह है कि PI ऑक्सीडेटिव तनाव के खिलाफ एक सुरक्षात्मक भूमिका निभा पुष्टि करने के लिए संभव बना दिया ।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. एस cerevisiae संस्कृतियों और प्रोटीन अभिव्यक्ति
नोट: Aβ वेरिएंट की स्थिति 19 (Phe19) Aβ ४२ पेप्टाइड (आंकड़ा 1a) में एक एकल अवशेषों में एक उत्परिवर्तन के कारण विभिन्न रिश्तेदार एकत्रीकरण प्रवृत्ति दर्शाते हैं । इन पेप्टाइड वेरिएंट ग्रीन फ्लोरोसेंट प्रोटीन (GFP), जो एक एकत्रीकरण रिपोर्टर (चित्रा 1)29के रूप में कार्य करता है के साथ टैग कर रहे हैं ।
- एक BY4741 पैतृक पृष्ठभूमि के साथ खमीर कोशिकाओं में 20 aβ ४२-GFP वेरिएंट के लिए plasmids एन्कोडिंग रूपांतरण (माता उनकी3Δ1 लियू2Δ0 मिले15Δ0 ura3Δ0)30. एक aβ ४२ उत्परिवर्ती एक GSSGSSG लिंकर द्वारा GFP के लिए आपस में जुड़े के लिए प्रत्येक प्लाज्मिड encodes । plasmids pESC (-ुरा) कर रहे है और चयन मार्कर URA329शामिल हैं ।
- uracil बिना सिंथेटिक पूर्ण माध्यम तैयार (अनुसूचित जाति-ुरा) निम्नलिखित घटकों के साथ: १.९ g/l खमीर नाइट्रोजन आधार बिना uracil, 5 ग्राम/l अमोनियम सल्फेट, और ddH2ओ के ९०० मिलीलीटर 20% (डब्ल्यू/वी) ग्लूकोज की १०० मिलीलीटर के साथ संयुक्त ।
- अनुसूचित जाति के 20 मिलीलीटर-ुरा 2% ग्लूकोज युक्त मध्यम और २१० rpm पर आंदोलन के तहत 30 डिग्री सेल्सियस पर रातोंरात संस्कृतियों बढ़ने में बदल खमीर कोशिकाओं की एक कॉलोनी रखो ।
- अगले दिन, नए सिरे से अनुसूचित जाति के 5 मिलीलीटर में रातोंरात संस्कृति के inoculating १०० µ एल द्वारा नई खमीर कोशिकाओं संस्कृतियों बढ़ने-ुरा माध्यम ।
- ०.५ के एक आयुध डिपो में५९० , 4 मिनट के लिए ३,००० x g पर संस्कृतियों के केंद्रापसारक, supernatant त्यागें, और ताजा अनुसूचित जाति-ुरा मध्यम 2% raffinose युक्त की एक ही मात्रा में कोशिकाओं reसस्पेंड ।
- 30 मिनट के लिए २१० rpm पर आंदोलन के तहत 30 डिग्री सेल्सियस पर मशीन । फिर, 4 मिनट के लिए ३,००० x g पर कक्षों को कम करें और supernatant को छोड़ें । रिकॉमबिनेंट प्रोटीन अभिव्यक्ति प्रेरित करने के लिए 2% गैलेक्टोज युक्त ताजा अनुसूचित जाति-ुरा माध्यम में कोशिकाओं reसस्पेंड ।
- अनुसूचित जाति-ुरा में प्रोटीन अभिव्यक्ति उत्प्रेरण के 16 एच के बाद 2% गैलेक्टोज, हार्वेस्ट द्वारा बाँझ microcentrifuge ट्यूबों में प्रेरित कोशिकाओं के 1 मिलीलीटर ३,००० पर 4 मिनट के लिए एक्स जी ।
नोट: सबसे अधिक प्रासंगिक अंतर 16 ज. प्रेरित खमीर कोशिकाओं aβ ४२-GFP वेरिएंट व्यक्त की एक प्रेरण अवधि के बाद हो प्रतिदीप्ति माइक्रोस्कोपी द्वारा visualized किया जा सकता है कोशिकाओं (चित्रा बी1) के अंदर रिकॉमबिनेंट प्रोटीन वितरण का निर्धारण ।
2. सेल धुंधला
नोट: ताजा गैर प्रेरित कोशिकाओं एक नकारात्मक नियंत्रण के रूप में एक एफसी विश्लेषण के दौरान एक फ्लोरोसेंट दहलीज स्थापित करने के लिए आवश्यक हैं ।
- 16 एच प्रेरित खमीर कोशिकाओं लो और उनके ऑप्टिकल घनत्व निर्धारित ५९० एनएम (आयुध डिपो५९०)। ०.१ के एक आयुध डिपो५९० करने के लिए एक बाँझ फॉस्फेट बफर खारा (पंजाब) में उन्हें पतला.
- इस प्रकार के रूप में 1x फास्फेट बफर खारा तैयार: NaCl के 8 माम जोड़ें, KCl के ०.२ ग्राम, एनए के १.४४ जी2HPO4, और ०.२४ जी के KH2पीओ4 से ८०० एमएल के ddH2हे. समाधान भरें 1 एल के ddH2ओ के लिए पीएच समायोजित करने के बाद ७.४ एचसीएल के साथ. ०.२ µm फ़िल्टर के माध्यम से बफ़र फ़िल्टर करें ।
- उचित लेबल ट्यूबों (12 × ७५ mm दौर-नीचे polystyrene) के लिए एक्सप्रेस सेल निलंबन स्थानांतरण और उंहें प्रकाश से बचाने के लिए । सुनिश्चित करें कि वे विश्लेषण के लिए प्रवाह cytometer पर लोड किए जाने के लिए तैयार हैं, एक साथ गैर-प्रेरित और गैर-धुंधला कोशिकाओं के साथ ।
- ऑक्सीडेटिव तनाव जांच जोड़ें (जैसे, CellROX गहरे लाल) 5 µ मीटर की एक अंतिम एकाग्रता पर प्रत्येक नमूने के लिए और अंधेरे में 30 मिनट के लिए 30 डिग्री सेल्सियस पर कोशिकाओं की मशीन ।
- मशीन के बाद, 1x पंजाबियों के साथ 3 बार कोशिकाओं को धोने और उंहें बफर की एक ही मात्रा में एफसी द्वारा उनके विश्लेषण से पहले reसस्पेंड ।
3. फ्लो Cytometry एनालिसिस
नोट: GFP और ऑक्सीडेटिव तनाव जांच प्रतिदीप्ति संकेत का पता लगाने के लिए उपयुक्त पराबैंगनीकिरण और फिल्टर के साथ एक एफसी सेटअप का उपयोग करें । एक प्रवाह cytometer GFP का पता लगाने के लिए एक ४८८ एनएम नीले लेजर के साथ सुसज्जित और ऑक्सीडेटिव तनाव जांच प्रतिदीप्ति का पता लगाने के लिए एक ६३५ एनएम लाल लेजर इस्तेमाल किया जा सकता है । GFP और ऑक्सीडेटिव तनाव जांच के उत्सर्जन प्रतिदीप्ति के अधिग्रहण एक 530/30 एनएम बीपी फिल्टर और एक 660/20 बीपी फिल्टर, क्रमशः (तालिका 1) के साथ किया जाता है ।
- नया कार्यपत्रक फलक खोलें पर क्लिक करें और निम्न अर्जन डॉट प्लॉट बनाएँ.
- उपकरण पट्टी से स्कैटर प्लॉट उपकरण का चयन करें और चर साइड तितर-बितर क्षेत्र (SSC-a) पर y-अक्ष बनाम फॉरवर्ड तितर-बितर क्षेत्र (FSC-a) में x-अक्ष पर रेखीय स्केल में एक भूखंड बनाएं ।
- उपकरण पट्टी से स्कैटर प्लॉट उपकरण पर क्लिक करें और चर FL1-क्षेत्र (FITC) पर x-अक्ष बनामके साथ एक प्लॉट बनाएँ । y-अक्ष पर लघुगणकीय स्केल में FL3-क्षेत्र (APC) ।
- उपकरण सेटिंग्स आइकन पर क्लिक करें । मुआवजा टैब पर क्लिक करें और सभी क्षतिपूर्ति का स्तर निर्धारित किया है । प्राप्ति टैब पर क्लिक करें और दर्ज की जाने वाली २०,००० घटनाओं की कुल संख्या चुनें.
- प्रवाह की दर को कमकरने के लिए स्विच करने के लिए प्रवाह दर चिह्न क्लिक करें ।
- , गैर प्रेरित, दाग कोशिकाओं को चलाने शुरू करने के लिए अधिग्रहण टैब पर क्लिक करें और जब तक आबादी मध्य बाएँ चक्र में वितरित किया जाता है आगे और साइड बिखराव के साधन सेटिंग्स में वोल्टेज को समायोजित ।
- बहुभुज चिह्न पर क्लिक करें कोशिका मलबे को छोड़कर एक क्षेत्र R1 कोशिका आबादी के आसपास स्थापित करने के लिए, और इस gated जनसंख्या P1 का उपयोग करें = R1 सभी फ्लोरोसेंट डॉट भूखंडों और हिस्टोग्राम अभ्यावेदन (चित्रा 3) के लिए ।
- PMT वोल्टेज प्रतिदीप्ति संकेत का समायोजित करने के लिए, FL1-FL3 डॉट प्लॉट में unदाग़ित कोशिकाओं चलाएँ, साधन सेटिंग टैब में लाभ ट्यूनिंग, जब तक कोशिकाओं को निचले बाएँ चक्र में वितरित कर रहे हैं.
- GFP प्रतिदीप्ति को मापने के लिए प्रेरित कक्षों में नमूना परिवर्तित करें । साधन सेटिंग टैब में, FSC में लाभ सेट-ए बनाम FL1 (FITC) जब जनसंख्या कम सही वृत्त का चक्र में वितरित किया जाता है. एक फाटक (गेट P2) के साथ सकारात्मक सेल जनसंख्या को परिभाषित करें ।
- एक FSC-ए बनाम FL3 (APC) डॉट साजिश पर प्रतिदीप्ति द्वारा ऑक्सीडेटिव तनाव प्रदर्शित करने के लिए गैर प्रेरित सना हुआ कोशिकाओं के लिए नमूना बदलें । सेल जनसंख्या छोड़ ऊपरी वृत्त का चक्र में वितरित किया जाता है जब तक लाभ ट्यून. गेट पी पी में सकारात्मक सेल जनसंख्या ।
- कक्ष प्रतिदीप्ति का प्रतिनिधित्व करने के लिए हिस्टोग्राम चिह्न के साथ दो हिस्टोग्राम प्लॉट बनाएं । प्रतिदीप्ति तीव्रता का प्रतिनिधित्व करने के लिए, सुनिश्चित करें कि FL1 (FITC) GFP प्रतिदीप्ति का प्रतिनिधित्व करने के लिए x-अक्ष में है, और FL3 (APC) प्रतिदीप्ति का प्रतिनिधित्व y-अक्ष में है, एक लघुगणक पैमाने पर P2 और पी-पी आबादी लागू क्रमशः ।
नोट: हिस्टोग्राम ओवरले विभिंन Aβ भिन्न रूप व्यक्त करने वाले कक्षों की प्रतिदीप्ति प्रोफ़ाइल के बीच अंतर दर्शाने का एक अच्छा तरीका है ।
4. रिकॉमबिनेंट प्रोटीन Immunodetection
- प्रोटीन अभिव्यक्ति का स्तर निर्धारित करने के लिए, फसल खमीर 6 मिनट के लिए ४,००० x g पर केंद्रापसारक द्वारा 16 घंटे के लिए प्रेरित संस्कृतियों, और दुकान-८० डिग्री सेल्सियस पर सेल छर्रों ।
- एकत्र सेल 16 के लिए रिकॉमबिनेंट प्रोटीन एक्सप्रेस में पंजाबियों में एच reसस्पेंड । प्रत्येक aβ ४२ के २०० µ l सेल सस्पेंशन तैयार करें-GFP उत्परिवर्ती 20 के एक आयुध डिपो५९० के लिए ।
- कुल प्रोटीन अंश विश्लेषण के लिए, फसल १०० µ के प्रत्येक उत्परिवर्ती के एल १४,००० एक्स जी में 20 मिनट के लिए और एक ही मात्रा में खमीर lysis बफर Y प्रति (५० mM Tris-एचसीएल पीएच ८.० के सेल छर्रों reसस्पेंड, 1% DMSO, २०० मिमी NaCl, 1 मिमी EDTA युक्त 10 मिलीग्राम/एमएल SB3-14 (myr istyl sulfobetaine) 1 मिमी phenylmethylsulfonyl फ्लोराइड (PMSF)) के साथ पूरक ।
- हल्के आंदोलन के तहत कमरे के तापमान पर 20 मिनट के लिए नमूनों की मशीन ।
- ब्रैडफोर्ड परख का उपयोग करके प्रोटीन निकालने एकाग्रता का निर्धारण । एक 15% acrylamide एसडीएस पर एक नमूना के प्रोटीन निकालने के 5 µ g करने के लिए लोड-पृष्ठ ट्रो जेल और दाग पर एक polyvinylidene difluoride (PVDF) झिल्ली पर १०० V ६० मिनट के लिए ।
- Coomassie शानदार नीले जी के १०० मिलीग्राम के साथ एक ब्रैडफोर्ड एजेंट तैयार-२५० ९५% इथेनॉल के ५० मिलीलीटर में भंग और १००% (डब्ल्यू/वी) फॉस्फोरस एसिड की ८५ मिलीलीटर जोड़ें । फिर, जब डाई पूरी तरह से भंग कर दिया है, ddH2ओ के साथ मिश्रण को पतला 1 एल और यह केवल उपयोग करने से पहले फाइबर फिल्टर कागज के माध्यम से फिल्टर ।
नोट: ब्रैडफोर्ड रिएजेंट हल्का भूरा होना चाहिए । - ब्रैडफोर्ड रिएजेंट के १,००० µ एल में प्रोटीन के 5-100 µ जी से लेकर गोजातीय सीरम एल्ब्युमिन (BSA) का एक मानक तैयार करें ।
- जोड़ें 1-10 µ एल के प्रोटीन निकालने के लिए 1 मिलीलीटर ब्रैडफोर्ड रिएजेंट और 5 मिनट के लिए कमरे के तापमान पर मिश्रण की मशीन ।
- मानकों के अवशोषण को मापने और प्रोटीन निकालने के नमूनों में आयुध डिपो५९५।
- विश्लेषण के लिए, मानक बनाममानकों के लिए प्राप्त अवशोषक मूल्यों के साथ एक भूखंड बनाओ प्रोटीन की µ जी. मानक वक्र के आधार पर, प्रोटीन की मात्रा से मूल नमूनों की सांद्रता निर्धारित करते हैं, मात्रा और कमजोर पड़ने पर विचार, यदि कोई हो ।
- Coomassie शानदार नीले जी के १०० मिलीग्राम के साथ एक ब्रैडफोर्ड एजेंट तैयार-२५० ९५% इथेनॉल के ५० मिलीलीटर में भंग और १००% (डब्ल्यू/वी) फॉस्फोरस एसिड की ८५ मिलीलीटर जोड़ें । फिर, जब डाई पूरी तरह से भंग कर दिया है, ddH2ओ के साथ मिश्रण को पतला 1 एल और यह केवल उपयोग करने से पहले फाइबर फिल्टर कागज के माध्यम से फिल्टर ।
- 1x Tris के साथ झिल्ली कुल्ला-खारा (टीबीएस), ०.१% 20 के बीच (TTBS), और ब्लॉक यह 5% का उपयोग कर (डब्ल्यू/वी) 1x TTBS में नोनफेट शुष्क दूध ।
- 10x टीबीएस के 1 एल तैयार करने के लिए, Tris बेस के 24 जी भंग और एच2ओडीडी के ९०० मिलीलीटर में NaCl के ८८ जी और ७.६ के लिए पीएच समायोजित करें । 1 एल के एक अंतिम खंड के लिए ddH2ओ जोड़ें । एक 1x समाधान के लिए, ddH2ओ के 9 भागों के साथ 10x शेयर का 1 हिस्सा मिश्रण ।
- एक प्राथमिक β-amyloid एंटीबॉडी 6E10 पतला 1 के साथ 1 एच के लिए झिल्ली की मशीन: 1000 और एक माध्यमिक एंटीबॉडी बकरी विरोधी माउस आईजीजी के साथ कमरे के तापमान पर 1 ज के लिए-एचआरपी संयुग्मी पतला 1:10000 ।
- Luminata फ्लोरोसेंट रिएजेंट के 1 मिलीलीटर का उपयोग कर झिल्ली का विकास और ५.२ कदम में वर्णित के रूप में densitometric विश्लेषण द्वारा बैंड यों ।
5. डेटा विश्लेषण
- के लिए एफसी द्वारा प्राप्त आंकड़ों का विश्लेषण, एक मतलब फ्लोरोसेंट तीव्रता (MFI) और अपनी इसी मानक त्रुटि और/या GFP प्रतिदीप्ति और ऑक्सीडेटिव तनाव के स्तर के लिए विचरण (CV) के गुणांक के साथ औसत प्रतिदीप्ति प्रदर्शित तालिका बनाएं ।
- प्रत्येक चैनल के लिए आवश्यक सांख्यिकीय डेटा अनुकूलित करने के लिए निरीक्षक टैब और आँकड़े आइकन पर क्लिक करें.
नोट: प्रोटीन वेरिएंट की तुलना करते समय, प्रतिदीप्ति मान डेटा को फ़ोल्ड-ओवर पृष्ठभूमि या रिज़ॉल्यूशन मीट्रिक (RD) में कनवर्ट करें: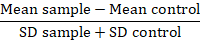
इस मेट्रिक में, माध्य नमूना समस्या नमूनों का माध्य प्रतिदीप्ति है, माध्य नियंत्रण, नियंत्रण के रूप में उपयोग की जाने वाली कक्षों का माध्य प्रतिदीप्ति है, और SD माध्य प्रतिदीप्ति का मानक विचलन है. आरडी फैक्टर MFI मूल्य से एक अधिक सटीक सूचकांक है, क्योंकि यह न केवल नमूनों के बीच अंतर की गणना करता है, लेकिन यह भी डेटा के प्रसार के लिए खातों. यह गणना विशेष रूप से प्रासंगिक है जब डेटा की तुलना समय के साथ किए गए विभिन्न प्रयोगों से की जा रही है. एक बार आरडीएस गणना की गई है, एक सांख्यिकीय परीक्षण का उपयोग प्रोटीन वेरिएंट के बीच मनाया मतभेदों के महत्व की पुष्टि करने के लिए सलाह दी जाती है ।
- प्रत्येक चैनल के लिए आवश्यक सांख्यिकीय डेटा अनुकूलित करने के लिए निरीक्षक टैब और आँकड़े आइकन पर क्लिक करें.
- प्रोटीन immunodetection के लिए, ImageJ सॉफ्टवेयर का उपयोग करके पश्चिमी दाग रिकॉमबिनेंट प्रोटीन का स्तर बढ़ाता है ।
- densitometry विश्लेषण से पहले, विकसित झिल्ली के मूल रॉ छवियों JPEG फ़ाइल स्वरूप और greyscale मोड में कनवर्ट करें ।
- ग्रे मूल्य मतलबकरने के लिए विश्लेषण मेनू के सेट माप अनुभाग समायोजित करें ।
- ImageJ से आयत उपकरण पर क्लिक करें और बैंड densitometry विश्लेषण के लिए एक सुसंगत आकार के साथ ब्याज की एक क्षेत्र (रॉय) को परिभाषित । बनाया आयताकार फ्रेम के अंदर झिल्ली छवि पर प्रत्येक बैंड केंद्र और Ctrl + एम (माप आदेश) का उपयोग कर एक के बाद माप एक रिकॉर्ड ।
- प्रत्येक बैंड से सटे स्थानीय पृष्ठभूमि को मापने, एक ही रॉय क्षेत्र लागू. माप के बाद, प्रत्येक व्यक्ति बैंड से इसी स्थानीय पृष्ठभूमि घटाना ।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
इस प्रोटोकॉल का वर्णन कैसे aβ ४२ पेप्टाइड के 20 वेरिएंट के एक संग्रह को रोजगार के लिए जहां Phe19 है सभी प्राकृतिक proteinogenic अमीनो एसिड के लिए रूपांतरित किया गया है28। इन प्रोटीन के सैद्धांतिक एकत्रीकरण प्रवृत्ति दो अलग bioinformatic एल्गोरिदम का उपयोग कर विश्लेषण किया जा सकता है (AGGRESCAN और टैंगो31,३२). दोनों ही मामलों में, यह विश्लेषण एकत्रीकरण प्रवृत्तियों, ascribing, एक सामान्य नियम के रूप में, hydrophobic अवशेषों को उच्चतम मान और मुझपर और ध्रुवीय लोगों के लिए सबसे कम (चित्रा 1b, 1C) के उत्तरोत्तर वर्गीकरण को रेंडर करता है.
प्रयोग अलग aβ ४२ वेरिएंट के intracellular एकत्रीकरण राज्य ट्रैक करने के लिए, वर्णित प्रयोग एक प्लाज्मिड के रूपांतरण की आवश्यकता है, aβ ४२ के लिए एंकोडिंग और GFP के नियंत्रण में (1a आंकड़ा) गैलेक्टोज-inducible GAL1 से जुड़े हुए, में एस cerevisiae। खमीर 16 एच की एक प्रेरण अवधि के बाद ४२ वेरिएंट aβ एक्सप्रेस कोशिकाओं को एक प्रतिदीप्ति माइक्रोस्कोप के तहत visualized किया जा सकता है । यह दृश्यावलोकन विश्लेषण संग्रह से 20 वेरिएंट में से 10 में PI के गठन की पुष्टि करने के लिए संभव बनाता है. संख्या और फ्लोरोसेंट समुच्चय के आकार भिन्नता से भिन्न (चित्रा 2) करने के लिए अलग. चित्रा 2a दो स्वतंत्र संस्कृतियों में से प्रत्येक में ५०० कोशिकाओं की कुल से PI ठहराव दिखाता है । यहां, हम भविष्यवाणी की और vivo एकत्रीकरण संपत्तियों के बीच एक उत्कृष्ट समझौते का पालन कर सकते हैं ।
पता है कि क्या प्रोटीन समुच्चय के गठन के इस मॉडल सेल प्रणाली में ऑक्सीडेटिव तनाव को ट्रिगर कर सकते हैं, यह प्रोटोकॉल एफसी का उपयोग करता है सेलुलर GFP प्रतिदीप्ति के प्रतिदीप्ति के साथ एक साथ निगरानी करने के लिए प्रतिक्रियाशील ऑक्सीजन का एक संकेतक के रूप में fluorogenic जांच प्रजाति (ROS) उत्पादन । चित्रा 3 Gln और इले म्यूटेंट, जो क्रमशः homogeneously वितरित और PI-बनाने aβ ४२ वेरिएंट के अनुरूप करने के लिए प्रक्रिया और प्राप्त परिणाम दिखाता है.
सबसे पहले, विश्लेषित सेल जनसंख्या gated (P1) FSC-a बनाम SSC में है-विश्लेषण (चित्रा 3ए) से सेल कतरे को दूर करने के लिए एक डॉट साजिश । P1 जनसंख्या के GFP बनाम ऑक्सीडेटिव तनाव जांच के प्रतिदीप्ति संकेत डॉट साजिश रेखांकन में प्रतिनिधित्व किया है जहां हरी फ्लोरोसेंट कोशिकाओं पी ए पी में gated (चित्र बी) हैं । चित्रा 3 सी और 3 डी दिखाने के लिए प्रत्येक के लिए सांख्यिकीय डेटा प्राप्त करने के लिए बनाया हिस्टोग्राम, CV (तालिका 2) सहित व्यक्त, क्रम में मतलब और प्रत्येक फ्लोरोसेंट मार्कर का औसत प्रतिदीप्ति ।
सभी म्यूटेंट के लिए एक ही स्तर पर व्यक्त होने की उंमीद कर रहे है क्योंकि वे एक एमिनो एसिड (aβ ४२-GFP अनुक्रम का ०.०२%) में अलग । हालांकि, proteostasis मशीनरी अपने विशेष एकत्रीकरण के लिए एक अंतर तरीके से प्रतिक्रिया कर सकते हैं । इसलिए, सेलुलर निष्कर्षों में प्रोटीन अभिव्यक्ति का स्तर एक Aβ-विशिष्ट एंटीबॉडी (चित्रा 4) का उपयोग कर quantified हैं । हम देखते है कि, एक सामांय प्रवृत्ति के रूप में, PI-बनाने aβ ४२ वेरिएंट उन शेष cytosol में वितरित homogeneously से निचले स्तर पर मौजूद हैं ।
aβ ४२ वेरिएंट के बीच महत्वपूर्ण अंतर देखा जा सकता है जब उनके ऑक्सीडेटिव तनाव की जांच प्रतिदीप्ति, प्रोटीन का स्तर, और GFP प्रतिदीप्ति गुण अपने PI फार्म और उनके आंतरिक एकत्रीकरण के लिए उनकी क्षमता के सापेक्ष प्रतिनिधित्व कर रहे है ( चित्रा 5) । अधिक एकत्रीकरण प्रवण PI-बनाने वेरिएंट उनके अधिक घुलनशील समकक्षों (चित्रा 5, 5B) की तुलना में बहुत कम ऑक्सीडेटिव तनाव बटोरना । इन परिणामों के साथ, आकार और प्रति व्यक्ति सेल (चित्रा 2) और ऑक्सीडेटिव तनाव के स्तर के अनुसार समुच्चय की संख्या के बीच कोई स्पष्ट संबंध नहीं है । PI-गठन वेरिएंट, विशेष रूप से स्थिति 19 पर टीआरपी और Phe असर म्यूटेंट, सेल में cytosol (चित्रा 5C, 5d) में वितरित उन homogenously से निचले स्तर पर मौजूद हैं । इस करने के लिए अपवाद है, जो के लिए कक्ष के फार्म PI (आंकड़ा 1b, 1C) के 10% से भी कम है । यह तथ्य यह है कि अधिकांश एकत्रीकरण प्रवण वेरिएंट चुनिंदा खमीर गुणवत्ता नियंत्रण क्षरण मशीनरी28द्वारा साफ कर रहे है के साथ संगत । GFP प्रतिदीप्ति और प्रोटीन का स्तर अधिक घुलनशील aβ ४२ रूपों के लिए अच्छी तरह से सहसंबंधी बनाता है, लेकिन PI (figure 5E, 5F) बनाने वालों के लिए नहीं । यह शायद इसलिए है क्योंकि इन सेलुलर आबादी में, प्रतिदीप्ति दो अलग डिब्बों से आता है, cytosol और शामिल किए जाने, और कुल प्रतिदीप्ति के लिए उनके रिश्तेदार योगदान म्यूटेंट३४के बीच अलग है ।

चित्रा 1 . aβ ४२-GFP संलयन के संग्रह के लिए एकत्रीकरण प्रवृत्ति विश्लेषण सभी प्राकृतिक अमीनो एसिड द्वारा aβ ४२ पेप्टाइड में 19 की स्थिति में अवशेषों के उत्परिवर्तन से व्युत्पंन। a. इस छवि wt aβ ४२ के एक 3 डी मॉडल से पता चलता है एक लिंकर द्वारा GFP से जुड़े (aβ ४२, ग्रे; GFP, ग्रीन), Aequorea विक्टोरिया से हरी फ्लोरोसेंट प्रोटीन के लिए PDB 1EMA पर आधारित है और अल्जाइमर 2OTK पेप्टाइड के लिए Aβ जिसमें Phe19 wt ४२ की ओर श्रृंखला लाल रंग में दिखाया गया है । मॉडल पयमोल सॉफ्टवेयर का उपयोग कर बनाया जाता है । अवशेष 19 aβ ४२ अनुक्रम में केंद्रीय hydrophobic क्लस्टर में एक केंद्रीय स्थिति में रह रहे हैं । बार रेखांकन दो अलग bioinformatic भविष्यवक्ताओं के साथ बनाए जाते हैं: B. AGGRESCAN, C. टैंगो. कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्रा 2 . aβ ४२-GFP PI- cerevisiae संस्कृतियों में वेरिएंट का गठन 16 अभिव्यक्ति के ज के लिए प्रेरित। a. बार ग्राफ दो जैविक प्रतिकृति में प्रत्येक संस्करण के लिए ५०० फ्लोरोसेंट कोशिकाओं की कुल से गणना PI की एक अलग संख्या से युक्त कक्षों का प्रतिशत इंगित करता है । B. ये छवियां चुने हुए aβ ४२-GFP वेरिएंट (Phe, इले,, टीआरपी) के प्रतिनिधि फ्लोरोसेंट माइक्रोस्कोपी छवियां हैं । वे GFP (४५०-५०० एनएम) और एक उत्सर्जन रेंज (५१५-५६० एनएम) के लिए एक उत्तेजना फिल्टर का उपयोग यूवी प्रकाश के तहत अधिग्रहीत किया गया था । स्केल बार 10 µm का प्रतिनिधित्व करता है । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण देखने के लिए ।

चित्रा 3 . कीम फॉर फ्लो cytometry (एफसी) एनालिसिस ओएफ एस cerevisiae सेल ने चयनित aβ ४२-GFP वेरिएंट्स को व्यक्तकिया । a. चार्ट डॉट प्लॉट (FSC-a बनाम SSC-a) में gated यीस्ट सेल (P1) दिखाता है जहां सेल की आबादी से कोशिका कतरे निकाली जाती है । Gln की सूक्ष्म छवियों (homogeneously वितरित) और इले (PI-बनाने) वेरिएंट एफसी डॉट भूखंडों के बगल में दिखाया गया है । स्केल बार का प्रतिनिधित्व करता है 10 µm. B. इन तितर बितर डॉट साजिश छवियों GFP-A बनाम ऑक्सीडेटिव तनाव जांच जिसमें gated जनसंख्या (पी पी) केवल फ्लोरोसेंट कोशिकाओं, पृष्ठभूमि संकेत को छोड़कर शामिल है प्रतिनिधित्व करते हैं । कोशिका आवृत्ति हिस्टोग्राम सीके हैं । GFP संकेत (FITC आयाम) P1 और डीसे gated । CellROX (APC आयाम) gated से पी. सेल अधिग्रहण एक प्रवाह cytometer के साथ किया गया था । प्रत्येक भूखंड २०,००० घटनाओं का प्रतिनिधित्व करता है । Q और मैं Gln और इले aβ ४२ म्यूटेंट, क्रमशः के अनुरूप है । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्र 4 . सेलुलर प्रोटीन के स्तर के ठहराव । एस cerevisiaeमें अभिव्यक्ति के 16 ज के बाद यह आंकड़ा aβ ४२-GFP म्यूटेंट के कुल प्रोटीन अंशों के पश्चिमी दाग दिखाता है । PI-बनाने वेरिएंट हरे रंग में हैं और cytosol में वितरित उन diffusely हल्के लाल रंग में हैं । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।

चित्रा 5 . सेलुलर ऑक्सीडेटिव तनाव, intracellular GFP प्रतिदीप्ति, और aβ के लिए सेलुलर प्रोटीन का स्तर ४२-GFP म्यूटेंट में अभिव्यक्ति की 16 ज के बाद निर्धारित किया है । x-अक्ष पर दर्शाए गए वेरिएंट में या तो AGGRESCAN (बाएं पैनल) या टैंगो (दाएं पैनल) द्वारा उनकी अनुमानित एकत्रीकरण की प्रवृत्ति के अनुसार आदेश दिया गया है । पीआई-बनाने वेरिएंट हरे रंग में हैं और गैर-PI-बनाने वेरिएंट हल्के लाल रंग में हैं । ए. B. इन बार रेखांकन ऑक्सीडेटिव तनाव जांच प्रतिदीप्ति aβ ४२-GFP म्यूटेंट के एक एफसी विश्लेषण द्वारा प्राप्त मूल्यों दिखाओ । सी. D. ये बार रेखांकन ImageJ सॉफ्टवेयर का उपयोग कर एक पश्चिमी दाग densitometry विश्लेषण द्वारा quantified के रूप में प्रोटीन के स्तर का प्रतिनिधित्व करते हैं । ई. एफइन बार रेखांकन एक एफसी विश्लेषण के बाद GFP प्रतिदीप्ति मूल्यों को दिखाते हैं । ऑक्सीडेटिव stress जांच और GFP प्रतिदीप्ति मानों के लिए त्रुटि पट्टियां FC-gated कक्षों के गुणांक (CV) का प्रतिनिधित्व करते हैं । प्रोटीन अभिव्यक्ति के स्तर के लिए त्रुटि सलाखों ± एसई (एन = 3) का प्रतिनिधित्व करते हैं । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
| चैनल | Fluorophore | उत्तेजना तरंग दैर्ध्य (एनएम) | बैंड पास फ़िल्टर |
| FITC | GFP | ४८८ | 530/30 |
| Apc | CellRox | ६३५ | 660/20 |
| PerCP | Ip | ४८८ | 585/42 |
तालिका 1. लेजर स्रोत, बैंड-पास फिल्टर, और fluorophores प्रवाह cytometer में इस्तेमाल किया ।
| GFP प्रतिदीप्ति | Cv | CellROX प्रतिदीप्ति | Cv | |
| ए | ९३१६ | ९६.४ | १९६४ | १२७.५ |
| सी | ९७०९ | ९१.९ | १२७५ | १७२.२ |
| डी | ११२१३ | १०१.७ | ३४४३ | १५५.८ |
| ई | १२२५६ | १०१.१ | ३२२० | १५२.२ |
| एफ | ३०१० | ९६.१ | १२४५ | १४६.४ |
| जी | ११५४१ | ९७.२ | २९४७ | १५८ |
| एच | ७८९५ | ९८.२ | ३५८२ | १२०.८ |
| मैं | ७३६५ | ९७.२ | १४१६ | १४१.३ |
| कश्मीर | १०८३९ | १००.४ | ३१०२ | १२२.१ |
| एल | ७६०५ | ९६.९ | १४०१ | १६१.८ |
| एम | ८१४९ | ९६ | १३०८ | १७०.४ |
| एन | १२७४१ | ९७.५ | ३४०३ | १३४.९ |
| पी | ९७६८ | १०२.८ | २६२९ | १४३.६ |
| Q | १३०६६ | ९१.३ | ३३५४ | १६९.९ |
| आर | ८५३७ | १०१.३ | २८३९ | १२७.५ |
| एस | १२०५३ | ९९.१ | ३३१३ | १७४.३ |
| टी | १०६१५ | ९७.७ | २२१३ | १०७.७ |
| वी | ९१६९ | ९६.१ | १८७८ | १२१.७ |
| डब्ल्यू | १७१५ | ९४.७ | १५३१ | १०० |
| वाई | ७५७४ | ९४.५ | १२३४ | १३८ |
तालिका 2. GFP प्रतिदीप्ति के लिए मूल्यों की सूची और ऑक्सीडेटिव तनाव जांच प्रतिदीप्ति aβ ४२-GFP म्यूटेंट के लिए 16 एच के लिए व्यक्त खमीर कोशिकाओं के एफसी विश्लेषण द्वारा प्राप्त की । इस तालिका मतलब प्रतिदीप्ति तीव्रता (MFI) और प्रत्येक उत्परिवर्ती के लिए CV से पता चलता है ।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
रोगों की एक विस्तृत श्रृंखला सेलुलर जमा6,7,8,३३में प्रगट प्रोटीन के संचय के लिए जुड़ा हुआ है । कई प्रयासों को आणविक तंत्र है कि इन गणना दृष्टिकोण है, जो खाते में प्रोटीन सांद्रता, या इन विट्रो दृष्टिकोण, जिसमें प्रोटीन एकाग्रता नहीं लेते का उपयोग कर रोगों की शुरुआत को ट्रिगर खंडित किया गया है प्रतिक्रिया के दौरान निरंतर बनी रहती है. हालांकि, कोशिका के भीतर, प्रोटीन लगातार संश्लेषित और एक भीड़ और गैर सजातीय वातावरण में नीचा दिखा रहे हैं । यह silico में, इन विट्रो में, और amyloidogenic प्रोटीन के vivo एकत्रीकरण गुणों के बीच लगातार विसंगतियों बताते हैं ।
वहां कई कारणों क्यों सरल सेलुलर मॉडल, जैसे खमीर, एक और अधिक जैविक संदर्भ में neurodegenerative रोगों से संबंधित प्रोटीन के एकत्रीकरण और जुड़े विषाक्तता का अध्ययन करने के लिए एक उचित विकल्प हैं । उदाहरण के लिए, वे हमें एक बरकरार सेलुलर जनसंख्या पर एकत्रीकरण के प्रभाव का विश्लेषण करने की संभावना दे तेजी से विश्लेषण ऐसी एक के रूप में यहां लागू किया । हालांकि, हम विचार करना चाहिए कि ऑक्सीडेटिव स्तर खमीर उपभेदों के बीच अलग हो सकता है । इस प्रकार, उपभेदों के बीच तुलना करने के लिए, या यहां तक कि विभिंन प्रोटीन, oxidants और reductants, जैसे डीटीटी और डायमाइन के बीच, एक ऑक्सीकरण/कमी पैमाने पर स्थापित करने के लिए इस्तेमाल किया जाना चाहिए ।
इस लेख में सचित्र उदाहरण में, bioinformatic विश्लेषण, सेलुलर प्रोटीन ठहराव, प्रोटीन स्थानीयकरण इमेजिंग और GFP गतिविधि और ऑक्सीडेटिव तनाव के स्तर के एक साथ एफसी विश्लेषण आणविक की पहचान करने के लिए एकीकृत किया गया है प्रजातियों प्रोटीन एकत्रीकरण प्रतिक्रियाओं से ऑक्सीडेटिव नुकसान के लिए जिंमेदार है । परिणाम प्रदर्शित करता है कि अधिक घुलनशील aβ ४२ वेरिएंट, बजाय अधिक एकत्रीकरण प्रवण, उच्चतम ऑक्सीडेटिव तनाव को बढ़ावा देने । यह diffusible प्रजातियों vivo मेंऔर अधिक खतरनाक aβ ४२ प्रजातियों जा रहा है के लिए अंक । एकत्रीकरण के निचले विषाक्तता के तथ्य यह है कि इन संरचनाओं PI में तनहा है और प्रोटीन की गुणवत्ता मशीनरी द्वारा उनके तरजीही गिरावट के लिए दोनों को जवाब लगता है, कि उनके घुलनशील की तुलना में कम प्रोटीन के स्तर में जिसके परिणामस्वरूप समकक्षों.
वर्णित विधि aβ ४२ समेकित/घुलनशील प्रजातियों द्वारा उत्पादित ऑक्सीडेटिव तनाव के विश्लेषण तक ही सीमित नहीं है और प्रोटीन एकत्रीकरण विकारों की एक किस्म का अध्ययन करने के लिए भी लागू किया जा सकता है । इसके अलावा, तकनीक सेलुलर ऑक्सीडेटिव तनाव पर एकत्रीकरण अवरोधकों के प्रभाव पर नजर रखने के लिए उपयोगी हो सकता है, आगे नैदानिक अनुप्रयोगों उन अणुओं है कि ऑक्सीडेटिव सक्रिय प्रोटीन प्रजातियों के संचय को बढ़ावा देने के लिए त्याग करने की अनुमति । अंत में, जब तक एक fluorogenic जांच उपलब्ध है, दृष्टिकोण एक तेजी से एक आसान तरीका में प्रोटीन एकत्रीकरण से जुड़े अंय विषाक्त प्रभाव के लिए जिंमेदार आणविक प्रजातियों की पहचान करने के लिए उल्लेखनीय अवसर प्रदान करता है, मात्रात्मक डेटा प्रदान करते हैं ।
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Materials
| Name | Company | Catalog Number | Comments |
| Yeast cells BY4741 | ATCC | 201388 | Genotype: MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 |
| pESC(-Ura) plasmid | Agilent Genomics | 217454 | Yeast expression plasmid with a Gal promotor. Selectable marker URA3 |
| Yeast Synthetic Drop-out Medium Supplements | Sigma | Y1501 | Powder |
| Yeast Nitrogen Base Without Amino Acids | Sigma | Y0626 | Powder |
| Raffinose | Sigma | R7630 | Powder |
| Glucose | Sigma | G7021 | Powder |
| Galactose | Sigma | G0750 | Powder |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP3991 | Solution 10X |
| CellROX Deep Red Reagent | Life Technologies | C10422 | Free radical cell-permeant fluorescent sensor, non-fluorescent while in a reduced state, and exhibits bright fluorescence upon oxidation by reactive oxygen species (ROS), with absorption/emission maxima at 644/665 nm. |
| Y-PER protein extraction reagent | Thermo Scientific | 78990 | Liquid cell lysis buffer |
| Acrylamide/Bis-acrylamide | Sigma | A6050 | Solution |
| Bradford dye reagent | Bio-Rad | 5000205 | Dye reagent for one-step determination of protein concentration |
| β-amyloid antibody 6E10 | BioLegend | 803001 | Mouse IgG1. The epitope lies within amino acids 3-8 of beta amyloid (EFRHDS). |
| Goat anti-mouse IgG-HRP conjugate | Bio-Rad | 1721011 | |
| Membrane Immobilon-P, PVDF | Millipore | IPVH00010 | |
| Luminata forte | Merk | WBLUF0100 | Premixed, ready to use chemiluminescent HRP detection reagent |
| Phenylmethanesulfonyl fluoride solution (PMSF) | Sigma | 93482 | Protease inhibitor. Dissolved at 0.1 M in ethanol |
| FACSCanto flow cytometer | BD Biosciences | 657338 | Equipped with a 488 nm blue laser for the detection of GFP, and 635 nm red laser / 530/30 nm BP filter and 660/20 BP filter |
| Mini Trans-Blot Electrophoresis Transfer cell | Bio-Rad | 1703930 | Protein transference system |
| Mini-PROTEAN Tetra Handcast Systems | Bio-Rad | 1658000FC | Electrophoresis system |
References
- Frydman, J. Folding of newly translated proteins in vivo: the role of molecular chaperones. Annual Review of Biochemistry. 70, 603-647 (2001).
- Hartl, F. U., Bracher, A., Hayer-Hartl, M. Molecular chaperones in protein folding and proteostasis. Nature. 475, 324-332 (2011).
- Wong, E., et al. Molecular determinants of selective clearance of protein inclusions by autophagy. Nature Communications. 3, (2012).
- Winkler, J., Tyedmers, J., Bukau, B., Mogk, A. Chaperone networks in protein disaggregation and prion propagation. Journal of Structural Biology. 179, 152-160 (2012).
- Glickman, M. H., Ciechanover, A. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction. Physiological Reviews. 82, 373-428 (2002).
- Dobson, C. M. Getting out of shape. Nature. 418, 729-730 (2002).
- Chiti, F., Dobson, C. M. Protein misfolding, functional amyloid, and human disease. Annual Review of Biochemistry. 75, 333-366 (2006).
- Aguzzi, A., O'Connor, T. Protein aggregation diseases: pathogenicity and therapeutic perspectives. Nature Reviews Drug Discovery. 9, 237-248 (2010).
- Rapezzi, C., et al. Transthyretin-related amyloidoses and the heart: a clinical overview. Nature Reviews Cardiology. 7, 398-408 (2010).
- Deas, E., et al. Alpha-synuclein oligomers interact with metal ions to induce oxidative stress and neuronal death in Parkinson's disease. Antioxidants & Redox Signaling. 24, 376-391 (2016).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nature Reviews Molecular Cell Biology. 11, 301-307 (2010).
- Frost, B., Diamond, M. I. Prion-like mechanisms in neurodegenerative diseases. Nature Reviews Neuroscience. 11, 155-159 (2009).
- Arrasate, M., Mitra, S., Schweitzer, E. S., Segal, M. R., Finkbeiner, S. Inclusion body formation reduces levels of mutant huntingtin and the risk of neuronal death. Nature. 431, 805-810 (2004).
- Ross, C. A., Poirier, M. A. Opinion: what is the role of protein aggregation in neurodegeneration? Nature Reviews Molecular Cell Biology. 6, 891-898 (2005).
- Mishra, R., Sjölander, D., Hammarström, P. Spectroscopic characterization of diverse amyloid fibrils in vitro by the fluorescent dye Nile red. Molecular BioSystems. 7, 1232-1240 (2011).
- Klunk, W. E., Jacob, R. F., Mason, R. P. Quantifying amyloid by congo red spectral shift assay. Methods in Enzymology. 309, 285-305 (1999).
- Khurana, V., Lindquist, S. Modelling neurodegeneration in Saccharomyces cerevisiae: why cook with baker's yeast? Nature Reviews Neuroscience. 11, 436-449 (2010).
- Tenreiro, S., Outeiro, T. F. Simple is good: yeast models of neurodegeneration. FEMS Yeast Research. 10, 970-979 (2010).
- Moosavi, B., Mousavi, B., Macreadie, I. G. Yeast model of amyloid-β and Tau aggregation in Alzheimer's disease. Journal of Alzheimer's Disease. 47, 9-16 (2015).
- Tenreiro, S., Munder, M. C., Alberti, S., Outeiro, T. F. Harnessing the power of yeast to unravel the molecular basis of neurodegeneration. Journal of Neurochemistry. 127, 438-452 (2013).
- Yang, J., Hao, X., Cao, X., Liu, B., Nyström, T. Spatial sequestration and detoxification of huntingtin by the ribosome quality control complex. eLife. 5, (2016).
- Braun, R. J., Büttner, S., Ring, J., Kroemer, G., Madeo, F. Nervous yeast: modeling neurotoxic cell death. Trends in Biochemical Sciences. 35, 135-144 (2010).
- Figley, M. D., Gitler, A. D. Yeast genetic screen reveals novel therapeutic strategy for ALS. Rare Diseases. 1, e24420 (2013).
- Cooper, A. A., et al. Alpha-synuclein blocks ER-Golgi traffic and Rab1 rescues neuron loss in Parkinson's models. Science. 313, 324-328 (2006).
- Johnson, B. S., McCaffery, J. M., Lindquist, S., Gitler, A. D. A yeast TDP-43 proteinopathy model: exploring the molecular determinants of TDP-43 aggregation and cellular toxicity. Proceedings of the National Academy of Sciences of the United States of America. 105, 6439-6444 (2008).
- Bharathi, V., et al. Use of ade1 and ade2 mutations for development of a versatile red/white color assay of amyloid-induced oxidative stress in saccharomyces cerevisiae. Yeast. 33, 607-620 (2016).
- Pallarès, I., Ventura, S. Advances in the prediction of protein aggregation propensity. Current Medicinal Chemistry. , (2017).
- Villar-Piqué, A., Ventura, S. Protein aggregation propensity is a crucial determinant of intracellular inclusion formation and quality control degradation. Biochimica et Biophysica Acta. 1833, 2714-2724 (2013).
- Navarro, S., Villar-Piqué, A., Ventura, S. Selection against toxic aggregation-prone protein sequences in bacteria. Biochimica et Biophysica Acta. 1843, 866-874 (2014).
- Morell, M., de Groot, N. S., Vendrell, J., Avilés, F. X., Ventura, S. Linking amyloid protein aggregation and yeast survival. Molecular BioSystems. 7, 1121-1128 (2011).
- Conchillo-Solé, O., et al. AGGRESCAN: a server for the prediction and evaluation of "hot spots" of aggregation in polypeptides. BMC Bioinformatics. 8, 65 (2007).
- Fernandez-Escamilla, A. M., Rousseau, F., Schymkowitz, J., Serrano, L. Prediction of sequence-dependent and mutational effects on the aggregation of peptides and proteins. Nature Biotechnology. 22, 1302-1306 (2004).
- Renner, M., Melki, R. Protein aggregation and prionopathies. Pathologie Biologie.(Paris). 62, 162-168 (2014).
- Carija, A., Navarro, S., de Groot, N. S., Ventura, S. Protein aggregation into insoluble deposits protects from oxidative stress. Redox Biology. 12, 699-711 (2017).