Summary
Denne artikel giver en effektiv og gennemførlig metode til at konstruere flerlaget stamcelle ark med gunstige stamcelle ejendom.
Abstract
Stamcelleterapi viser en lovende fremtid i regenererende skadede organer og væv, og celle ark teknik er udviklet til at forbedre lav celle fastholdelse og dårlig overlevelse inden for pulszonen. Men under byggeprocessen in vitro- en løsning for at bevare stamceller bioactivity og øge celle i arket celle er tvingende nødvendigt. Her, præsenterer denne protokol en metode til at konstruere et flerlaget celle ark med gunstige stamcelle bioactivity og optimal brugervenlighed. Decellularized svin hjertesækken (DPP) er udarbejdet af fosfolipase en2 (PLA2) decellularization metode som celle ark stillads, og rotte knoglemarv mesenkymale stamceller (BMSCs) er isoleret og udvidet som seedede cellerne. Midlertidig flerlaget celle ark struktur er opbygget ved hjælp af RAD16-jeg peptid hydrogel. Endelig arket celle er kulturperler med en dynamisk perfusion system til at stabilisere strukturen tredimensionale (3D), og arket celle kunne opnås efter en 48-timers kultur i vitro. Denne protokol giver en effektiv og gennemførlig metode til at konstruere et flerlaget stamcelle ark, og arket celle kan udvikles som en gunstig stamcelle terapi produkt i fremtiden.
Introduction
Stamcelleterapi er blevet rapporteret som en effektiv behandling af mange sygdomme; men lav celle fastholdelse og dårlig overlevelse inden for pulszonen fortsat kritiske spørgsmål efter traditionelle stamcelle injektion. For at løse dette problem, udviklet tissue engineering forskere celle ark teknik. En monolayered celle ark med intakt ekstracellulære matrix blev først udarbejdet ved hjælp af temperatur-respons kultur parabol1, og dens opfølgende undersøgelser rapporterede de betydelige forbedringer af stamceller fastholdelse og overlevelse inden for de infarcted område2,3. Blandt metoderne, er konstruere arket flerlaget celle blevet rapporteret som en effektiv strategi for at forbedre celle overlevelse og celle ark terapeutiske virkning3,4. Siden da, har forskere arbejdet på at udvikle forskellige celle ark byggemetoder for at øge celle beløb, stamcelle ejendom og mekaniske ejendom celle ark. Hidtil, visse typer af celle ark er blevet konstrueret og studerede i behandlingen af myokardieinfarkt5, brusk skade6, og huden sår7.
Bioactivity af stamceller før transplantation viste en spirende indflydelse på tilskadekomne væv revitalisering, og forskellige celle ark byggeri strategier har forskellige virkninger på stamcellerne. På den ene side sammenflydende celle plader kun bestod af high-density stamceller og naturlige ekstracellulære matricer kan erhverves ved stabling monolayered celle ark8 eller magnetiske tissue engineering teknikker9. På den anden side udviklet forskere forskellige stilladser for at yde passende mekanisk styrke og støtte celle vækst10,11,12, der tillod en lav stamcelle såning tæthed for at sikre ernæring levering. Trods disse tilgange forbliver lav effektiv ernæring levering inden for ark flerlaget cellestruktur dog en større bekymring under in vitro- konstruktion. En effektiv og gennemførlig celle ark byggeri system er derfor et presserende behov.
Denne protokol beskriver trin for at forberede en multilayeredmesenchymal stamceller (MSC) celle ark. I denne konstruktion system, er cellen ark mekanisk styrke fastsat af en DPP. Baseret på denne stillads, 3D cellestruktur kan hurtigt opbygges med RAD16-jeg peptid hydrogel, og en dynamisk perfusion system bruges til kultur arket flerlaget celle for at stabilisere 3D ark cellestruktur og give tilstrækkelig ernæring levering til cellerne. Ved hjælp af dette system, et flerlaget BMSC ark var med held forberedt og udstillet en optimal terapeutisk effekt på rotte myokardieinfarkt model13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle stamceller og animalske eksperiment procedurer blev gennemføres i henhold til de etiske retningslinjer for den nationale Guide til pleje og anvendelse af forsøgsdyr og godkendt af Jinan University Animal Care og brug Udvalget (Guangzhou, Kina).
1. forberedelse af DPP stillads med PLA2 Decellularization metode14
Bemærk: Se figur 1A for en skematisk af PLA2 decellularization metode.
- Forberede 100 mL 200 U/mL PLA2 opløsning. Tilsæt 0,5 g natrium deoxycholate og 2 mL af PLA2 i 198 mL stødpudeopløsning karbonat. Denne løsning bør anvendes inden for 24 timer efter dens forberedelse.
- Få friske svin hjertesækken (FPP) fra slagteriet og vende tilbage til laboratoriet inden for 1 h.
Bemærk: FPP skal opbevares ved 4 ° C under transport. Trin 1.2-1.10 bør gennemføres med kontinuerlig ryster i en termostat-styret vandbad. - Grundigt vaske FPP med 200 mL fosfatstødpudeopløsning (PBS) indeholdende 1% penicillin-streptomycin i et 500 mL bægerglas på 10 ° Cfor 10 min. Gentag dette trin 2 x.
- Opdele FPP i to lag og fjerner fedtvæv med saks og pincet.
Bemærk: Hold FPP våd ved at tilføje 50 mL PBS hver 20 min under fjernelse af fedtvæv. - Forme FPP i 10 x 10 cm2 stykker med en saks. Vask FPP med 200 mL stødpudeopløsning karbonat (CBS) indeholdende 1% penicillin-streptomycin i et 500 mL bægerglas ved 10 ° C til 10 min. Gentag dette trin 2 x.
- Overføre FPP til rent vand og suge det til 10° C til 12 timer.
- Sættetid 10 x 10 cm2 prøver i 50 mL af CBS som indeholder 200 U/mL PLA2 og 0,5% (w/v) natrium deoxycholate løsning ved 37 ° C i 6 h.
- Vask prøverne med CBS indeholdende 1% penicillin-streptomycin ved 10 ° C i 10 min. Gentag dette trin 2 x.
- Nyd hver prøve i 50 mL af CBS som indeholder 200 U/mL PLA2 og 0,5% (w/v) natrium deoxycholate løsning ved 37 ° C i 2 timer.
- Vask prøverne med CBS indeholdende 1% penicillin-streptomycin ved 10 ° C i 2 h. Gentag dette trin for 10 x mindst. Prøveemner på flade plader og tør dem til konstant vægt i en konstant temperatur ovn ved 55 ° C.
Bemærk: Prøven skal være helt tørt. Vejer DPP prøve hvert 10 min og gentage, at 3 x eller indtil vægten ikke længere ændrer. - Form hver DPP udsnit i en cirkel med en 10,5 mm-diameter med en trephine. Pakke hver DPP i en steril forseglet pose.
- Sterilisere DPP prøver af gammastråling (25 kGy). Gemt DPP prøver ved 4 ° C før brug.
Bemærk: Alle prøver kan opbevares i op til seks måneder ved 4 ° C.
2. præparater til cellen ark byggeri
- Autoklave alle instrumenter og væv carrier komponenter ved 121 ° C til 30 min, herunder 1,5 mL centrifugal rør, pincet, tandede pincet, saks, sort baser (væv carrier komponent), og hvid spænding ringe (væv carrier komponent).
- Forberede 20 mL af Kim-fri 10% rørsukkeropløsning. Vægt 2 g saccharose og opløse saccharose i 18 mL i ultrarent vand. Autoklave 10% rørsukkeropløsning ved 121 ° C i 30 min. eller filtreres løsningen med et 0,22 µm filter.
- Autoklave dynamisk perfusion systemenheder ved 121 ° C i 30 min, herunder en gas udveksling af udstyr, et 500 mL glasflaske, en perfusion kultur container og bindevæv rør.
- Forberede autoklaveres instrumenter og væv carrier komponenter. Sætte den sorte base del af væv luftfartsselskab i en kultur fad.
- Afhente en tørret DPP stillads og sætte det i midten af den sorte base. Sætte en hvid spænding ring på DPP stillads og ordne det i væv luftfartsselskab.
Bemærk: Sikre skafottet er helt fast i væv flyselskabet og der er ingen forskel mellem den sorte base og hvide spænding ring. Hvis ikke, adskille væv luftfartsselskab og lave skafottet igen. - Tilføj 100 µL af næringssubstratet på DPP stillads til rehydrering.
Bemærk: Hvis stillads ikke er fast godt i væv carrier, infiltrere næringssubstratet kultur parabol. - Sætte skafottet i et 37 ° C inkubator og lad det i blød i 15 min.
3. forberedelse af celler til celle ark byggeri
Bemærk: Denne protokol er for cellekultur ved hjælp af en 100 mm parabol. Se figur 1B for en skematisk af opførelsen af den omfangsrige cellestruktur.
- Isolere BMSCs13.
Bemærk: Denne metode er designet til at konstruere et flerlaget MSC celle ark. Rotte BMSCs anvendes i denne protokol. BMSCs er isoleret ved hjælp af metoden hele knoglemarv vedhængende, og BMSCs er udvidet i vitro at få nok celle beløb.- Autoklave instrumenter ved 121 ° C i 30 min, herunder pincet, tandede pincet og saks. Forbered en 2 mL injektion sprøjte og BMSC næringssubstratet (Dulbeccos modificerede Eagle's medium [DMEM], 10% føtal bovint serum, 1% glutamin og 1% penicillin-streptomycin).
- Aflive tre uger gamle mandlige Sprague-Dawley (SD) rotter af halshvirvel dislokation. Sættetid dyret i 100 mL af 75% alkoholopløsning i et bægerglas til 5 min.
- Tage dyret ud af bægerglasset og placere det liggende på driften tabellen. Incise huden på bagsiden af dyret med saks og pincet. Isolere hud og muskel væv for at udsætte låret lårben.
- Isolere låret lårben og sætte det i 30 mL PBS i et 50 mL-centrifugerør. Placer to låret lårben ind i et rør. Vortex centrifugeglasset at vaske vævet grundigt. Gentag dette trin 2 x.
- Skær begge ender af lårben med saks og udsætte marv hulrum.
- Opsug 2 mL af BMSC dyrkningsmedium med en injektion sprøjte. Indsætte nålen ind i marv hulrum og skylle ud knoglemarven med næringssubstratet. Skylle ud hver to låret lårben i en 100 mm kultur skål.
- For hver 100 mm kultur parabol, tilsættes 2 mL af næringssubstratet i kultur parabol. Sætte kultur parabol til 37 ° C inkubator og statisk kultur i 72 timer.
- Tegne kultur fad fra rugemaskinen. Erstatte supernatanten med 6 mL frisk næringssubstratet.
- Observere primære BMSCs under et mikroskop. Efter dette, passage af BMSCs hver 5-7 d.
- Tage celler ud af varmeskabet. Iagttage cellerne under et mikroskop og vælge passende celler til celle ark byggeri. Når BMSCs når 80-90% sammenløb, kan cellerne vælges som de seedede celler.
- Fjerne næringssubstratet fra kultur parabol. Forsigtigt vaske cellerne med 2 mL varm PBS. Fjern alle PBS fra kultur parabol og gøre sikker på ikke flydende resterne. Tilsættes 2 mL 0,25% trypsin (eller en anden dissociating løsning) til fadet og der inkuberes ved 37 ° C i 3 min.
- Stop trypsin effekt ved at tilføje 2 mL af substratet, og forsigtigt vaske cellerne fra fadet. Overføre cellesuspension i en ny 15 mL-centrifugerør. Centrifugate celler ved 225 x g i 5 min.
- Fjern supernatanten. Resuspend celler med 3 mL 10% (w/v) rørsukkeropløsning.
Bemærk: 10% (w/v) rørsukkeropløsning bruges til at vaske cellerne for at opnå en ensartet celle-hydrogel blanding i følgende trin. - Opsug 10 µL af cellesuspension og antal celle med en hemocytometer. Beregning af volumen til det næste trin. For én celle ark bruges tre millioner BMSCs.
- Udtrække tre millioner celler og overføre dem til en ny 15 mL-centrifugerør. Der centrifugeres celler ved 225 x g i 5 min.
- Fjern supernatanten. Resuspend celler med 1 mL 10% (w/v) rørsukkeropløsning. Overføre cellesuspension i en 1,5 mL-centrifugerør.
Bemærk: Ved hjælp af en 1,5 mL centrifugal tube er gavnlige for at forberede den celle-hydrogel blanding. - Der centrifugeres celler på 260 xg for 5 min. helt Fjern supernatanten og opnå celle sediment.
4. forberedelse af BMSCs og RAD16-jeg peptid Hydrogel blanding
Bemærk: Se figur 1B for en skematisk af opførelsen af den omfangsrige cellestruktur.
- Tilføj 20 µL af 10% (w/v) rørsukkeropløsning til 1,5 mL centrifugal tube. Forsigtigt resuspend BMSCs og opnå en ensartet suspension.
Bemærk: Ikke skabe nogen bobler under ophvirvling. - Tilføj 20 µL af RAD16-jeg peptid hydrogel på toppen af suspensionen. Rør forsigtigt rundt i RAD16-jeg peptid og celle suspension med pipette spids. Når cellesuspension og hydrogel er blandet sammen, tilsæt forsigtigt blandingen et par gange.
- Tag DPP stillads fra væv luftfartsselskab og forsigtigt Aspirér næringssubstratet med en pipette spids.
Bemærk: Sikre DPP stillads er fuldt rehydreret før du tilføjer celle-hydrogel blanding. - Opsug blandingen og jævnt føje den til DPP stillads.
Bemærk: Det samlede volumen af blandingen ville være omkring 40-50 µL. Det anbefales at tilføje blanding 10 µL ad gangen fra center uden på skafottet. - Der tilsættes 1 mL af næringssubstratet til bunden af væv luftfartsselskab. Læg arket celle i 37 ° C inkubator for 5 min.
- Tegne celle ark fra rugemaskinen. Forsigtigt tilsættes 4 mL af næringssubstratet i kultur parabol og fordybe arket celle. Læg arket celle i 37 ° C inkubator for 2 h af statisk kultur.
5. in Vitro kultur af en 3D flerlaget celle ark ved hjælp af en dynamisk kultur
Bemærk: Se figur 1 c for en skematisk af den 3D dynamisk system.
- Forberede det dynamiske perfusion system, herunder en peristaltisk pumpe, gas udveksling udstyr, et 500 mL glasflaske, en perfusion kultur container og bindevæv rør. Samle det dynamiske perfusion system, som vist i figur 2.
- Tilføje 200 mL af næringssubstratet til sterilt glasflaske. Indsæt celle ark ind i salen for objektbeholderen kultur.
Bemærk: Opmærksomme på retningen af den øvre overflade af cellen ark. - Tilføj 3 mL af næringssubstratet i objektbeholderen væv og lukke beholderen. Sætte det dynamiske perfusion system i rugemaskinen og starter pumpen. Indstille strømningshastigheden af den peristaltiske pumpe på 8 mL/min. kultur arket celle i det dynamiske perfusion system for 48 h.
6. at opnå flerlaget MSC celle ark
- Autoklave instrumenter og væv carrier komponenter ved 121 ° C i 30 min, herunder 1,5 mL centrifugal rør, pincet og tandede pincet.
- Træk ud i input kanalen fra glasflaske at stoppe levering af næringssubstratet til beholderen.
Bemærk: Stop den peristaltiske pumpe, når kultur beholder er tom. - Tag den celle ark fra objektbeholderen kultur og sætte det i en kultur fad.
- Bruge en pincet til at immobilisere væv luftfartsselskabet og bruge en anden tandede pincet til at adskille den hvide spænding ring fra den sorte base. Endelig får de omfangsrige BMSCs celle ark.
- Kort holdbarhed, kan hver celle ark overføres til en 1,5 mL centrifugal tube med pincet. DPP stillads skal knyttes til den indre væg af centrifugal røret, og arket celle skal sprede sig ud så meget som muligt i centrifugeglasset.
- Forsigtigt tilsættes 1 mL af næringssubstratet i centrifugal røret at fordybe arket celle. Luk hætten af centrifugal røret og gemme arket celle ved 4 ° C.
Bemærk: Celle ark skal transplanteres eller analyseres hurtigst muligt. Det anbefales at bruge arket celle inden for 4 h.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Skematisk af flerlaget stamcelle ark byggeri er vist i figur 1. Forberede celle ark stillads af PLA2 decellularization metode er det første skridt. Baseret på skafottet, er en midlertidig 3D cellestruktur konstrueret ved at blande stamcellerne med RAD16-1 peptid hydrogel. For at opnå et flerlaget celle ark med gunstige stamcelle bioactivity og optimal mekanisk styrke, er arket celle kulturperler i en dynamisk perfusion system. Den dynamiske ernæring forsyningsordning, stamceller får lov til at formere sig og etablere celle kontakter inden for arket flerlaget celle, og endelig stabil flerlaget celle ark produkt kan fås efter en ~ 24-72-timers dyrkning.
I dette tilfælde, celle ark stillads DPP er udarbejdet af PLA2 decellularization metode. Udseendet af tørrede DPP er flad, glat og halvgennemsigtig (figur 3A). På grund af den særlige lyse effekt af PLA2, heterogene cellerne kan fjernes helt mens ultrastruktur af naturlige kollagen inden for DPP stillads er velbevarede (figur 3B), og dette er vigtigt for at opretholde den mekanisk styrke og biokompatibilitet af skafottet. Derudover kan stilladser ændres som en vækstfaktor frigivelse kontrolsystem til at understøtte stamceller vækst og forbedre i vivo regenerering13.
Når stamcellerne nå ~ 80-90% sammenløb, cellerne er isoleret fra kultur parabol og vasket med en 10% rørsukkeropløsning. Efter centrifugering, cellerne er blandet med RAD16-jeg peptid hydrogel og føjet til rehydreret DPP skafottet. En midlertidig flerlaget struktur er dannet efter et to-timers statisk kultur. Endelig, de omfangsrige BMSC ark produkt (fig. 4) er erhvervet efter en 48-timers kultur i dynamisk perfusion system. Med støtte fra Dansk Folkeparti stillads, celle ark kan nemt manipuleres med pincet, og det kan være midlertidigt bevaret i næringssubstratet i 1,5 mL tube ved 4 ° C i 4 timer før eksamen eller transplantation (figur 4). Som immunofluorescens farvning resultat viser, er BMSCs meget positiv for stamcelleforskning markører CD90 og CD29. Efter celle ark byggeri, BMSCs inden for de omfangsrige celle ark viser høje niveauer af CD29 og CD90 (figur 5).

Figur 1 : Rutediagram opbygningen af arket flerlaget stamcelle. (A) ved hjælp af metoden PLA2 decellularized, den heterogene celler i FPP ødelægges mens de naturlige ekstracellulære matricer er velbevaret i DPP stillads. (B) baseret på DPP stillads, midlertidig flerlaget cellestruktur er konstrueret ved at blande stamcellerne og selv samle peptid hydrogel. (C) at følge, celle ark er kulturperler i en 3D dynamisk system, og stamcellerne forventes at formere sig og etablere celle kontakter den dynamiske ernæring forsyningsordning. Venligst klik her for at se en større version af dette tal.

Figur 2 : Væv transportøren og dynamisk perfusion system. (A) dette panel viser 13 mm-diameter væv luftfartsselskab. (B) dette panel viser Forsamlingen af dynamiske perfusion system. Venligst klik her for at se en større version af dette tal.
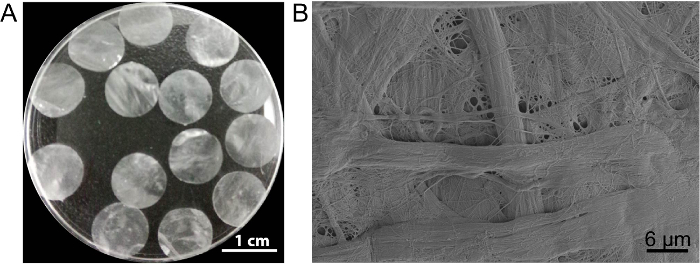
Figur 3 : Udseende og ultrastruktur af DPP. (A) dette panel viser udseendet af 10,5 mm-diameter DPP stilladser. (B) dette panel viser et repræsentativt billede af scanning elektron mikroskop (SEM) resultatet af DPP stillads. Venligst klik her for at se en større version af dette tal.
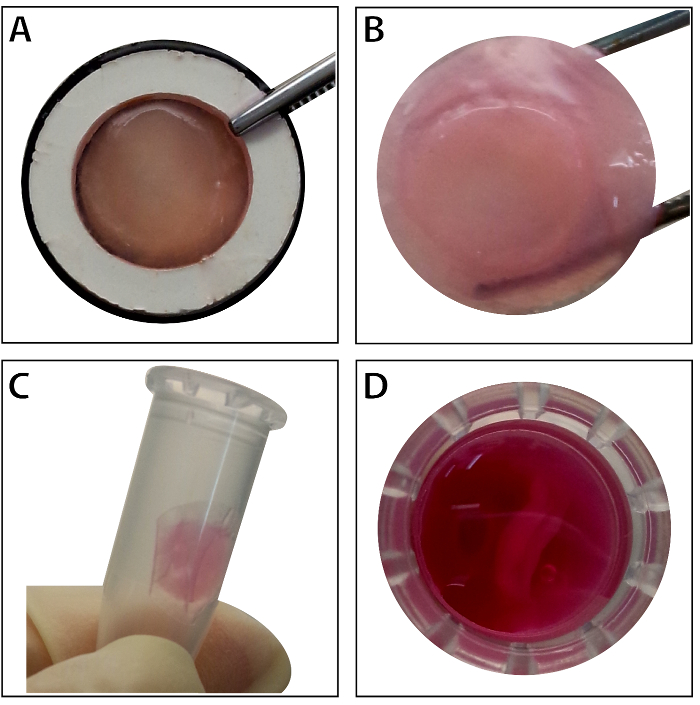
Figur 4 : Udseendet af arket omfangsrige BMSC. (A) dette panel viser udseendet af den omfangsrige BMSC lagen inden for væv luftfartsselskabet. (B) den intakte flerlaget BMSC ark ejes af pincet. (C - D) Arket flerlaget celle kan bevares midlertidigt i 1,5 mL tube før brug. Venligst klik her for at se en større version af dette tal.
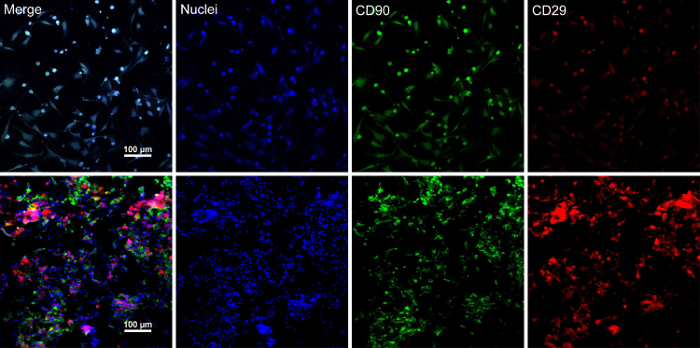
Figur 5 : Immunofluorescens farvning resultaterne af BMSC markører udtryk. (A) dette panel viser immunofluorescens farvning resultaterne af BMSCs før celle ark byggeri. (B) dette panel viser immunofluorescens farvning resultaterne af afsnittet flerlaget BMSC ark. CD90 (grøn) og CD29 (rød) var positivt udtrykt i BMSCs og arket celle. Venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne protokol rapporterer en effektiv metode til at konstruere et flerlaget MSC ark. Denne celle ark udstiller optimal mekanisk styrke, høj celle seeding tæthed og gunstige stamcelle bioactivity. Bruger BMSCs som et eksempel, 3D cellestruktur er hurtigt bygget med RAD16-jeg peptid hydrogel. Efter at være kulturperler i dynamisk perfusion system, arket omfangsrige BMSC er med succes opnået og BMSCs bevare et højt udtryk af stamceller markører.
Konstruere midlertidig flerlaget cellestruktur er den kritiske trin i protokollen. RAD16-jeg er en kommerciel hydrogel peptid, og det består af 1% af aminosyrer og 99% vand. Adskillige undersøgelser rapporterede at dette peptid hydrogel kan efterligne den naturlige ECM miljø og er til gavn for stamcelleforskning spredning og overlevelse15,16,17. I denne protokol, et tre millioner MSC suspension (i 20 µL af 10% rørsukkeropløsning) var blandet med 20 µL af RAD16-jeg peptid hydrogel. Volumen-forholdet på cellesuspension og peptid hydrogel var 1:1. Dette peptid hydrogel er følsomme over for miljømæssige pH-værdien, og peptid molekyler vil automatisk danne 3D-netværk, når pH-værdien ændres fra syre til neutral. Fordi cellens overflade indeholder ladede partikler, ændret celle blandingen fra flydende til hydrogel i kort tid, som har indflydelse selv blanding af cellerne. En gunstig celle-hydrogel bør være en selv blanding af cellesuspension og peptid hydrogel og gør det muligt for celle blanding skal tilføjes jævnt på skafottet. Forskerne kan optimere blanding tilstand ved at ændre seedede celle nummer, saccharose løsning volumen og peptid hydrogel volumen efter deres faktiske behov. Det er værd at bemærke, at vaske cellerne med 10% rørsukkeropløsning og jævnt blanding celle-hydrogel blandingen er de kritiske trin i protokollen, og en ujævn blanding kan forårsage stor celletab og en ustabil midlertidig flerlaget struktur.
Når du har tilføjet den celle-hydrogel blandingen på DPP stillads, er den mekaniske styrke af flerlaget cellestruktur ark svag fordi peptid hydrogel netværk ikke er stærk nok til at opretholde langsigtet flerlaget cellestruktur, og celle forbindelser og ECM sekret er nødvendige for at øge stabiliteten i arket celle. Derudover kan dynamiske infiltration af næringssubstratet lette stamceller til at formere sig og etablere celle kontakter indenfor flerlaget cellestruktur, mens en utilstrækkelig ernæring forsyning vil forårsage celle apoptose og reducere celle tæthed af celle ark13. Derfor, dynamisk perfusion system er vigtigt for stabiliserende ark flerlaget cellestruktur. Desuden bør den passende strømningshastigheden af næringssubstratet justeres efter specifikke stamcelle type og celle såning tæthed. Også, forbliver svag mekaniske forbindelsen mellem DPP stillads og flerlaget cellestruktur begrænsning af den nuværende byggemetoden, som kan forårsage division af de omfangsrige cellelag og skafottet. Derfor, yderligere undersøgelser er forpligtet til at forbedre de mekaniske biokompatibilitet 3D hydrogel stillads og DPP stillads.
Hidtil, har tissue engineering videnskabsfolk været fokus på etablering af effektive ernæring levering systemer i vitro, såsom coculturing endothelial celler18 og ved hjælp af en porøs stillads19. Dog ernæring permeabilitet inden for 3D-struktur er lav i traditionelle statiske 3D kultur-systemet, og stamceller levedygtighed vil blive væsentligt påvirket. I dette tilfælde kan ved hjælp af dynamiske perfusion system give tilstrækkelig ernæring levering for at bevare stamceller levedygtighed. Ved hjælp af denne protokol, forbedret et flerlaget BMSC ark hjertefunktion og angiogenese i en rotte myokardieinfarkt model13. Konstruere en stamcelle ark produkt med en høj celle belastning og gunstige stamcelle egenskab er af betydning for væv revitalisering. Ved hjælp af denne effektive konstrueret metode, kunne forskellige former for flerlaget stamcelle ark konstrueres ved at ændre seedede stamcelle typer, såsom epitelial stamcelle ark, neurale stamceller ark eller hjerte stamcelle ark. Yderligere udforskning af og alternativer til arket flerlaget stamcelle forventes at udvide programmer for mere væv revitalisering.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Dette arbejde blev støttet af den National Natural Science Foundation of China (grant nummer 31771064); Videnskab og teknologi planlægger projektet af Guangdong-provinsen (grant numre 2013B010404030, 2014A010105029 og 2016A020214012); Videnskab og teknologi planlægger projektet i Guangzhou (grant nummer 201607010063); og bachelor Innovation og Entrepreneurship træningsprogram (grant nummer 201610559028); National Science Foundation for unge forskere i Kina (giver nummer 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



