Summary
Questo articolo fornisce un metodo efficiente e fattibile per la costruzione di fogli multistrato sulle cellule staminali con proprietà favorevoli della cellula formativa.
Abstract
Terapia della cellula formativa Mostra un promettente futuro nella rigenerazione di tessuti e organo danneggiato, e la tecnica di foglio di cella è stata sviluppata per migliorare la conservazione delle cellule basse e scarsa sopravvivenza all'interno della zona di destinazione. Tuttavia, durante il processo di costruzione di in vitro , è urgente una soluzione per il mantenimento delle cellule staminali bioattività e aumentando la quantità di cellule all'interno del foglio di cella. Qui, questo protocollo presenta un metodo per la costruzione di un foglio di celle multistrato con cellule staminali favorevole bioattività e un'operatività ottima. Pericardio porcino decellularizzato (DPP) è preparato dalla fosfolipasi un metodo di decellularizzazione2 (PLA2) come l'impalcatura di strato delle cellule e cellule staminali mesenchimali di ratto del midollo osseo (BMSC) sono isolate e ampliate come cellule del seminato. La struttura del foglio temporaneo celle multistrato è costruita usando RAD16-ho peptide idrogel. Infine, strato di cellule è coltivato con un sistema di perfusione dinamica per stabilizzare la struttura tridimensionale (3D) e strato di cellule poteva essere ottenuto seguendo una 48 ore di coltura in vitro. Questo protocollo fornisce un metodo efficiente e fattibile per la costruzione di un foglio di multistrato sulle cellule staminali, e strato di cellule potrebbe essere sviluppato come un prodotto di terapia della cellula formativa favorevole in futuro.
Introduction
Terapia con cellule staminali è stata segnalata come un efficace trattamento per molte malattie; Tuttavia, cella bassa ritenzione e scarsa sopravvivenza all'interno della zona di destinazione rimangono questioni critiche dopo l'iniezione di cellule staminali tradizionale. Per risolvere questo problema, tessuto ingegneria gli scienziati hanno sviluppato la tecnica del foglio di cella. Un foglio monostrato cellulare con intatto della matrice extracellulare in primo luogo è stato preparato utilizzando la risposta di temperatura cultura piatto1e relativi studi di follow-up segnalato i miglioramenti significativi di conservazione delle cellule staminali e la sopravvivenza all'interno il colpito da infarto zona2,3. Tra i metodi, costruendo il foglio di celle multistrato è stata segnalata come una strategia efficace per migliorare la sopravvivenza delle cellule e la cella foglio effetto terapeutico3,4. Da allora, gli scienziati hanno lavorato sullo sviluppo di metodi di costruzione del foglio differenti delle cellule al fine di aumentare la quantità di cellule, cellule staminali proprietà e proprietà meccaniche dei fogli delle cellule. Finora, alcuni tipi di strato delle cellule sono stati costruiti e studiati nel trattamento di infarto miocardico5, cartilagine ferita6, e la pelle ferita7.
La bioattività delle cellule staminali prima di trapianto ha mostrato un'influenza emergente sulla rigenerazione del tessuto danneggiato e cellula diverse strategie di costruzione di foglio hanno effetti diversi sulle cellule staminali. Da un lato, strati delle cellule confluenti consistevano soltanto di cellule staminali ad alta densità e matrici extracellulari naturale potrebbero essere acquistati da impilamento monostrato cellulare fogli8 o utilizzando tessuto magnetico Ingegneria tecniche9. D'altra parte, i ricercatori hanno sviluppato diverse impalcature per fornire un'adeguata resistenza meccanica e supporto delle cellule crescita10,11,12, che ha permesso una cellula staminale bassa densità per garantire la nutrizione di semina fornitura. Tuttavia, nonostante questi approcci, la fornitura di basso efficiente nutrizione all'interno della struttura di strato di celle multistrato rimane delle principali preoccupazioni durante la costruzione in vitro . Di conseguenza, un sistema di costruzione del foglio delle cellule efficiente e fattibile è urgentemente necessario.
Questo protocollo descrive i passaggi per preparare un foglio di cellula staminale (MSC) multilayeredmesenchymal. In questo sistema di costruzione, la resistenza meccanica del foglio di cella è fornita da un DPP. Basato su questa impalcatura, struttura cellulare 3D può essere rapidamente costruita con RAD16-io idrogel peptidici e un sistema di perfusione dinamica viene utilizzata per il foglio di celle multistrato, al fine di stabilizzare la struttura del foglio di cella 3D e fornire sufficiente nutrizione della coltura approvvigionamento per le cellule. Utilizzando questo sistema, un foglio BMSC multistrato è stato preparato correttamente e ha esibito un effetto terapeutico ottimale il ratto infarto miocardico modello13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tutte le cellule staminali e procedure di esperimento sugli animali sono state condotte secondo le linee guida etiche della guida nazionale per la cura e l'uso di animali da laboratorio e approvate dal comitato di uso (Guangzhou, Cina) e Jinan University Animal Care.
1. preparazione dell'impalcatura DPP con il PLA2 decellularizzazione metodo14
Nota: Vedere Figura 1A per un disegno schematico del metodo di decellularizzazione2 PLA.
- Preparare 100 mL di soluzione di2 200 U/mL PLA. Aggiungere 0,5 g di sodio desossicolato e 2 mL di PLA2 in 198 mL di soluzione tampone di carbonato. Questa soluzione deve essere usata entro 24 ore dopo la preparazione.
- Ottenere il pericardio porcino fresco (FPP) da macello e restituire al laboratorio entro 1 h.
Nota: La FPP deve essere conservata a 4 ° C durante il trasporto. Passaggi: 1.2-1.10 dovrebbero essere condotta con continua agitazione in un bagno di acqua termostatata. - Lavare accuratamente la FPP con 200 mL di soluzione tampone fosfato (PBS) contenente 1% di penicillina-streptomicina in un becher da 500 mL a 10 ° Cfor 10 min ripetere questo passaggio x 2.
- Dividere la FPP in due strati e rimuovere il tessuto adiposo con pinze e le forbici.
Nota: Tenere la FPP bagnato con l'aggiunta di 50 mL di PBS ogni 20 min durante la rimozione del tessuto adiposo. - Modellare la FPP 10x10 cm2 pezzi con le forbici. Lavare la FPP con 200 mL di soluzione tampone di carbonato (CBS) contenente 1% di penicillina-streptomicina in un becher da 500 mL a 10 ° C per 10 min. Ripetere questo passaggio x 2.
- Trasferire la FPP per acqua pura e inzupparlo a 10° C per 12 h.
- Immergere i campioni di2 cm 10x10 in 50 mL di CBS contenente 200 U/mL PLA2 e 0,5% (p/v) sodio desossicolato soluzione a 37 ° C per 6 h.
- Lavare i campioni con CBS contenente 1% di penicillina-streptomicina a 10 ° C per 10 min. Ripetere questo passaggio x 2.
- Immergere ogni campione in 50 mL di CBS contenente 200 U/mL PLA2 e 0,5% (p/v) sodio desossicolato soluzione a 37 ° C per 2 h.
- Lavare i campioni con CBS contenente 1% di penicillina-streptomicina a 10 ° C per 2 h. Ripetere questo passaggio per 10 volte almeno. I campioni su piatti piani e asciugarli fino a peso costante nel forno a temperatura costante a 55 ° C.
Nota: Il campione deve essere asciugata completamente. Pesare il campione DPP ogni 10 min e ripetere 3 volte o fino a quando il peso non cambia. - Forma ogni campione DPP in un cerchio di 10,5 mm di diametro con un trapano. Confezione ogni DPP in un sacchetto sigillato sterile.
- Sterilizzare i campioni DPP a raggi gamma (25 kGy). Memorizzati i campioni DPP a 4 ° C prima dell'uso.
Nota: Tutti i campioni possono essere conservati fino a sei mesi a 4 ° C.
2. preparazioni per la cella foglio costruzione
- Autoclave tutti gli strumenti e i componenti di vettore del tessuto a 121 ° C per 30 min, compresi i tubi centrifughi di 1,5 mL, pinze, pinze, forbici, a denti nero basi (componente portante del tessuto) e anelli di tensione bianco (componente portante del tessuto).
- Preparare 20 mL di soluzione di saccarosio di 10% privo di germi. Peso 2 g di saccarosio e sciogliere il saccarosio in 18 mL di acqua ultrapura. Sterilizzare in autoclave la soluzione di saccarosio al 10% a 121 ° C per 30 min o filtro la soluzione con un filtro da 0,22 µm.
- Autoclave i dispositivi di sistema dinamico di aspersione a 121 ° C per 30 min, compreso un gas cambio attrezzature, una bottiglia di vetro da 500 mL, un contenitore di cultura di aspersione e i tubi di tessuto connettivi.
- Preparare gli strumenti sterilizzati in autoclave e tessuto componenti del vettore. Mettere la parte nera di base dell'elemento portante del tessuto in una piastra di coltura.
- Pick up un'impalcatura DPP secca e metterlo al centro della base nera. Mettere un anello bianco di tensionamento sul patibolo DPP e fissarlo nell'elemento portante del tessuto.
Nota: Assicurarsi l'impalcatura è totalmente fisso nell'elemento portante del tessuto e non c'è nessuno spazio tra la base nera e l'anello di tensione bianco. In caso contrario, separare il vettore di tessuto e fissare nuovamente il patibolo. - Aggiungere 100 µ l di terreno di coltura sul patibolo DPP per reidratazione.
Nota: Se l'impalcatura non viene risolto anche nel supporto del tessuto, il terreno di coltura si infiltrano la piastra di coltura. - Mettere l'impalcatura in un incubatore a 37 ° C e lasciare in ammollo per 15 min.
3. preparazione delle cellule per cella foglio costruzione
Nota: Questo protocollo è per la coltura cellulare usando un piatto di 100 mm. Per una schematica della costruzione della struttura celle multistrato, vedere Figura 1B .
- Isolare le BMSC13.
Nota: Questo metodo è progettato per la costruzione di un strato di cellule MSC multistrato. Ratto BMSC sono utilizzati nel presente protocollo. Le BMSC sono isolati utilizzando il metodo aderente intero midollo osseo, e le BMSC sono espanse in vitro per ottenere sufficienti quantità di cellule.- Autoclave gli strumenti a 121 ° C per 30 min, tra cui pinze, pinze dentate e forbici. Preparare una siringa da 2 mL per iniezione e terreno di coltura BMSC (Dulbecco modificato dell'Aquila medio [DMEM], 10% siero bovino fetale, glutamina 1% e 1% di penicillina-streptomicina).
- Eutanasia i ratti maschii di Sprague-Dawley (deviazione standard) di tre-settimana-vecchio dalla dislocazione della vertebra cervicale. Immergere l'animale in 100 mL di soluzione di alcool di 75% in un becher per 5 min.
- Prendere l'animale fuori il becher e posizionarlo incline sul tavolo operatorio. Incidere la pelle sul dorso dell'animale con forbici e pinze. Isolare i tessuti della pelle e del muscolo per esporre i femori di coscia.
- Isolare i femori di coscia e metterlo in 30 mL di PBS in una provetta da centrifuga 50 mL. Inserire due femori di coscia in una provetta. Vortexare la provetta da centrifuga per lavare il tessuto. Ripetere questo passaggio x 2.
- Entrambe le estremità dei femori di tagliare con le forbici ed esporre la cavità del midollo.
- Aspirare 2 mL di terreno di coltura BMSC con una siringa di iniezione. Inserire l'ago nella cavità del midollo e scovare il midollo osseo con terreno di coltura. Scovare ogni femori due coscia in una piastra di coltura di 100 mm.
- Per ogni piatto di cultura di 100mm, aggiungere 2 mL di terreno di coltura nella piastra di coltura. Mettere la piastra di coltura in incubatore a 37 ° C e coltura statica per 72 h.
- Togliere la piastra di coltura dall'incubatrice. Sostituire il surnatante con 6 mL di terreno di coltura fresco.
- Osservare BMSCs primario sotto un microscopio. In seguito, passaggio le BMSC ogni 5-7 gg.
- Prendere le cellule fuori dell'incubatrice. Osservare le cellule al microscopio e scegliere celle adatte per costruzione di strato delle cellule. Quando le BMSC raggiungere confluenza di 80% - 90%, le cellule possono essere scelti come le cellule seminate.
- Rimuovere il terreno di coltura dalla piastra di coltura. Lavare delicatamente le cellule con 2 mL di PBS caldo. Rimuovere tutti i PBS dalla piastra di coltura e rendere sicuro no liquidi resti. Aggiungere 2 mL di tripsina 0,25% (o un'altra soluzione di dissociazione) al piatto e incubare a 37 ° C per 3 min.
- Fermare l'effetto della tripsina aggiungendo 2 mL di terreno di coltura e lavare delicatamente le cellule dal piatto. Trasferire la sospensione cellulare in una nuova provetta da centrifuga da 15 mL. Centrifugare le cellule a 225 x g per 5 min.
- Eliminare il surnatante. Risospendere le cellule con 3 mL di soluzione di saccarosio al 10% (p/v).
Nota: soluzione di saccarosio al 10% (p/v) viene utilizzato per lavare le cellule per ottenere un impasto uniforme delle cellule-idrogel nei passaggi seguenti. - Aspirare 10 µ l di sospensione cellulare e contare il numero di cellulare con un emocitometro. Calcolare il volume necessario per il passaggio successivo. Per foglio di una cella, vengono utilizzati BMSCs 3 milioni.
- Estrarre le cellule 3 milioni e trasferirli in una provetta da centrifuga da 15 mL nuovo. Centrifugare le cellule a 225 x g per 5 min.
- Eliminare il surnatante. Risospendere le cellule con 1 mL di soluzione di saccarosio al 10% (p/v). Trasferire la sospensione cellulare in una provetta da centrifuga da 1,5 mL.
Nota: Utilizzando un tubo da centrifuga 1,5 mL è utile per preparare la miscela di cella-idrogel. - Centrifugare le cellule a 260 xg per 5 minuti completamente rimuovere il supernatante e ottenere il sedimento cellulare.
4. preparazione delle BMSC e il RAD16-ho miscela peptidica Hydrogel
Nota: Vedere Figura 1B per una schematica della costruzione della struttura celle multistrato.
- Aggiungere 20 µ l di soluzione di saccarosio al 10% (p/v) per il tubo centrifugo 1.5 mL. Risospendere le BMSC delicatamente e ottenere una sospensione uniforme.
Nota: Non generare eventuali bolle durante la risospensione. - Aggiungere 20 µ l di RAD16-ho peptide idrogel nella parte superiore della sospensione. Mescolare delicatamente il RAD16-io sospensione delle cellule e del peptide con la punta della pipetta. Quando la sospensione cellulare e idrogel sono mescolati insieme, pipettare delicatamente l'impasto un paio di volte.
- Estrarre l'impalcatura DPP da parte del vettore di tessuto e aspirare delicatamente il terreno di coltura con un puntale.
Nota: Accertarsi che l'impalcatura DPP è completamente reidratato prima di aggiungere la miscela di cella-idrogel. - Aspirare la miscela e uniformemente aggiungerlo al patibolo DPP.
Nota: Il volume totale della miscela sarebbe circa 40-50 µ l. Si consiglia di aggiungere la miscela 10 µ l in un momento dal centro verso l'esterno dell'impalcatura. - Aggiungere 1 mL di terreno di coltura alla parte inferiore dell'elemento portante del tessuto. Mettere il foglio di cella nell'incubatore 37 ° C per 5 min.
- Prendere il foglio delle cellule dall'incubatrice. Delicatamente aggiungere 4 mL di terreno di coltura nella piastra di coltura e immergere il foglio delle cellule. Mettere il foglio di cella nell'incubatore 37 ° C per 2 h di coltura statica.
5. cultura in Vitro di un foglio di celle multistrato 3D utilizzando un sistema di cultura dinamica
Nota: Vedere Figura 1 per una schematica del sistema dinamico 3D.
- Preparare il sistema di perfusione dinamici, tra cui una pompa peristaltica, apparecchiature di scambio di gas, una bottiglia di vetro da 500 mL, un contenitore di cultura di aspersione e i tubi di tessuto connettivi. Assemblare il sistema di perfusione dinamica come mostrato nella Figura 2.
- Aggiungere 200 mL di terreno di coltura per la bottiglia di vetro sterile. Inserire il foglio delle cellule nella camera del contenitore di cultura.
Nota: Prestare attenzione alla direzione della superficie superiore dello strato di cellule. - Aggiungere 3 mL di terreno di coltura nel contenitore del tessuto e chiudere il contenitore. Mettere il sistema dinamico di aspersione nell'incubatrice e avviare la pompa. Impostare la portata della pompa peristaltica a 8 mL/min cultura strato di cellule nel sistema dinamico di perfusione per 48 h.
6. ottenere un strato di cellule MSC multistrato
- Autoclave gli strumenti e i componenti di vettore del tessuto a 121 ° C per 30 min, inclusi tubi centrifughi 1,5 mL, forcipe e forcipe dentato.
- Tirare fuori l'ingresso condotto dalla bottiglia di vetro per interrompere l'alimentazione di coltura per il contenitore.
Nota: Arrestare la pompa peristaltica, quando il contenitore di cultura è vuoto. - Prendere il foglio di cella dal contenitore di cultura e metterlo in una piastra di coltura.
- Utilizzare una pinza per immobilizzare il vettore di tessuto e un altro forcipe dentato per separare l'anello bianco dalla base nera. Infine, ottenere strato di cellule BMSCs multistrato.
- Per breve conservazione, ogni strato di cellule possa essere trasferito a un tubo centrifugo 1.5 mL con il forcipe. L'impalcatura DPP deve essere collegato alla parete interna del tubo centrifugo, e strato di cellule dovrebbe diffondere quanto più possibile la provetta da centrifuga.
- Delicatamente aggiungere 1 mL di terreno di coltura nel tubo centrifugo da immergere il foglio delle cellule. Chiudere il tappo del tubo centrifugo e memorizzare strato di cellule a 4 ° C.
Nota: Strato di cellule dovrebbe essere trapiantato o analizzato quanto prima. Si consiglia di utilizzare il foglio di cella all'interno di 4 h.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Lo schema della costruzione foglio multistrato sulle cellule staminali è illustrato nella Figura 1. Preparando il patibolo di foglio di cella dal metodo di decellularizzazione di PLA2 è il primo passo. Basato sul patibolo, una struttura temporanea delle cellule 3D è costruita mescolando le cellule staminali con l'idrogel di peptide RAD16-1. Al fine di ottenere un foglio di celle multistrato con cellule staminali favorevole bioattività e ottima resistenza meccanica, strato di cellule è coltivato in un sistema dinamico di aspersione. Sotto il rifornimento di nutrizione dinamica, le cellule staminali sono autorizzate a proliferare e stabilire contatti cellula all'interno del foglio di celle multistrato, e il prodotto dello strato finale stabile celle multistrato può essere ottenuto dopo un ~ 24-a 72-coltivazione di ora.
In questo caso, l'impalcatura di foglio cella DPP è preparato con il metodo di decellularizzazione di PLA2 . L'aspetto del DPP secchi è piatta, liscia e semitrasparente (Figura 3A). A causa dell'effetto di lyse specifico di PLA2, le cellule eterogenee possono essere completamente rimosso mentre l'ultrastruttura del collagene naturale entro il patibolo DPP è ben conservato (Figura 3B), e questo è importante per mantenere il resistenza meccanica e biocompatibilità dell'impalcatura. Inoltre, l'impalcature possono essere modificate come un sistema di rilascio del controllo di fattore di crescita per sostenere la crescita delle cellule staminali e migliorare in vivo rigenerazione13.
Quando le cellule staminali raggiungere confluenza ~ 80% - 90%, le cellule sono isolate dalla piastra di coltura e lavati con una soluzione di saccarosio di 10%. Dopo la centrifugazione, le cellule sono mescolate con il RAD16-io idrogel peptidici e aggiunto al patibolo DPP reidratato. Una struttura multistrata temporanea è costituita a seguito di una coltura statica di due ore. Infine, il prodotto di foglio BMSC multistrato (Figura 4) viene acquisito seguendo una coltura di 48 ore nel sistema dinamico di aspersione. Con il sostegno dell'impalcatura DPP, strato di cellule possa essere facilmente manipolato con il forcipe, e può essere temporaneamente conservato in terreno di coltura nel tubo da 1,5 mL a 4 ° C per 4 ore prima di esame o trapianto (Figura 4). Come l'immunofluorescenza colorazione risultato spettacoli, le BMSC sono altamente positivo per gli indicatori di cellule staminali CD90 e CD29. Dopo la costruzione del foglio di cella, BMSC entro i livelli elevati del Visualizza foglio di celle multistrato di CD29 e CD90 (Figura 5).

Figura 1 : Il diagramma di flusso di costruire il foglio di multistrato stem cell. (A) utilizzando il metodo2 decellularized PLA, le cellule eterogenee all'interno la FPP vengono distrutte mentre le matrici extracellulari naturale sono ben conservate nell'impalcatura DPP. (B) basato sul patibolo DPP, la struttura temporanea celle multistrato è costruito mescolando le cellule staminali e autoassemblanti peptide idrogel. (C), a seguire, strato di cellule è coltivata in un sistema dinamico 3D, e le cellule staminali sono attesi a proliferare e stabilire contatti cellula sotto il rifornimento di nutrizione dinamica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Il vettore del tessuto e il sistema di perfusione dinamica. (A), questo pannello mostra i 13 mm-diametro elemento portante del tessuto. (B), questo pannello mostra il montaggio del sistema dinamico di aspersione. Clicca qui per visualizzare una versione più grande di questa figura.
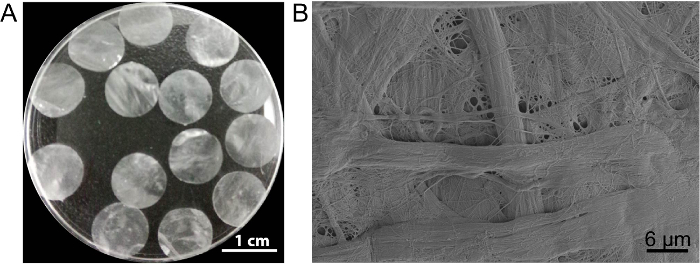
Figura 3 : L'aspetto e l'ultrastruttura del DPP. (A), questo pannello mostra l'aspetto di 10,5 mm-diametro DPP impalcature. (B), questo pannello mostra un'immagine rappresentativa del microscopio elettronico a scansione (SEM) risultato dell'impalcatura DPP. Clicca qui per visualizzare una versione più grande di questa figura.
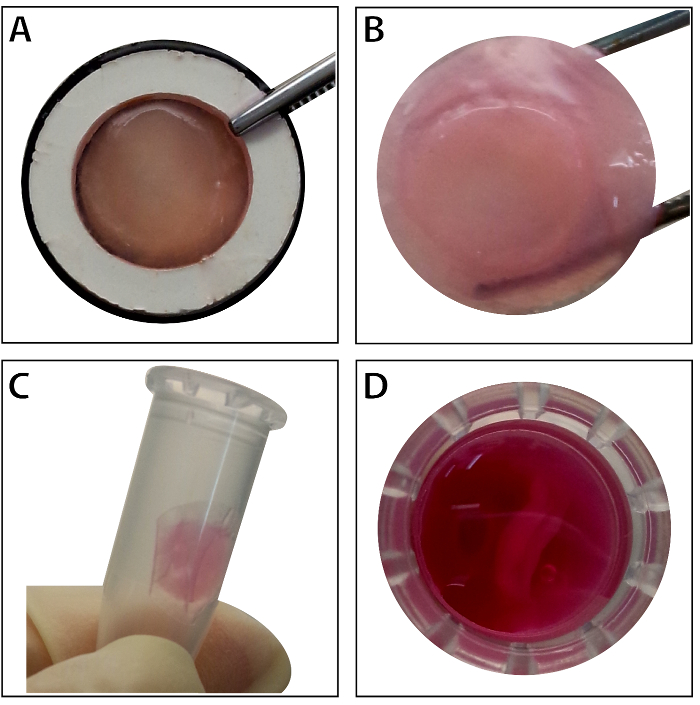
Figura 4 : L'aspetto del foglio multistrato BMSC. (A), questo pannello mostra l'aspetto delle BMSC multistrato foglio all'interno del vettore di tessuto. (B) il foglio BMSC multistrato intatto è detenuto da forcipe. (C - D) Il foglio di celle multistrato possa essere conservato temporaneamente nella provetta da 1,5 mL prima dell'uso. Clicca qui per visualizzare una versione più grande di questa figura.
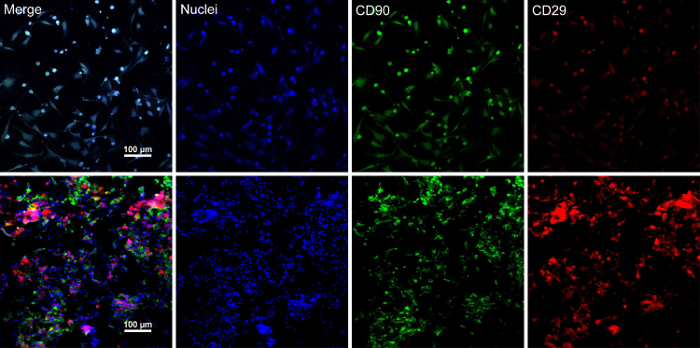
Figura 5 : Immunofluorescenza colorazione risultati di espressione di marcatori BMSC. (A), questo pannello spettacoli immunofluorescenza colorazione risultati di BMSCs prima costruzione strato delle cellule. (B), questo pannello mostra i risultati della sezione foglio BMSC multistrato di macchiatura di immunofluorescenza. CD90 (verde) e CD29 (rosso) sono stati espressi positivamente le BMSC e strato di cellule. Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il presente protocollo segnala un metodo efficiente per la costruzione di un foglio multistrato di MSC. Questo strato di cellule presenta resistenza meccanica ottima, cell ad alta densità di semina e bioattività favorevole sulle cellule staminali. Utilizzando BMSCs come esempio, la struttura cellulare 3D rapidamente costruita con RAD16-io del peptide idrogel. Dopo in coltura nel sistema dinamico di aspersione, il foglio BMSC multistrato è ottenuto con successo e le BMSC mantenere un'alta espressione di marcatori di cellule staminali.
Costruire la struttura temporanea celle multistrato è il passaggio fondamentale del protocollo. Il RAD16-I è un peptide di idrogel commerciale, e si compone di 1% dell'aminoacido e il 99% di acqua. Parecchi studi riferito che questo peptide idrogel può imitare l'ambiente naturale di ECM ed è benefico per cellule staminali proliferazione e sopravvivenza15,16,17. Nel presente protocollo, una sospensione MSC 3 milioni (in 20 µ l di soluzione di saccarosio al 10%) è stato mescolato con 20 µ l di RAD16-ho peptide idrogel. Il rapporto di volume della sospensione cellulare e l'idrogel di peptide era 1:1. Questo idrogel peptidici è sensibile al valore pH ambientale, e le molecole del peptide formerebbe automaticamente la rete 3D quando cambia il valore di pH da acido a neutro. Poiché la superficie della cellula contiene particelle cariche, la miscela di cella modificato da liquido a idrogel in breve tempo, con influenze la miscelazione anche delle cellule. Un cella-idrogel favorevole dovrebbe essere una miscela omogenea di sospensione delle cellule e l'idrogel di peptide e permette la miscela di cella da aggiungere in modo uniforme sul patibolo. I ricercatori possono ottimizzare la condizione di miscela alterando il numero di cellulare seminato, volume di soluzione di saccarosio e il volume di idrogel peptidici secondo la loro effettiva necessità. Vale la pena di notare che le cellule con 10% di soluzione di saccarosio di lavaggio e miscelazione uniformemente la miscela di cella-idrogel sono i passaggi critici del protocollo, e una miscela irregolare potrebbe causare la perdita delle cellule grandi e una struttura multistrata temporanea instabile.
Dopo aver aggiunto la miscela di cella-idrogel sul patibolo DPP, la resistenza meccanica della struttura di strato di celle multistrato è debole perché la rete di idrogel di peptide non è abbastanza forte per mantenere la struttura di celle multistrato a lungo termine e delle cellule connessioni e secrezioni di ECM sono necessari per migliorare la stabilità dello strato di cellule. Inoltre, la dinamica infiltrazione nel terreno di coltura può facilitare le cellule staminali per proliferare e stabilire contatti cellula all'interno della struttura di celle multistrato, mentre un rifornimento di nutrizione insufficiente causerà l'apoptosi cellulare e ridurre la densità delle cellule della cella foglio13. Pertanto, il sistema di perfusione dinamico è importante per stabilizzare la struttura del foglio di celle multistrato. Inoltre, la portata appropriata nel terreno di coltura deve essere regolata secondo il tipo specifico delle cellule staminali e la densità di semina cellulare. Inoltre, la debole connessione meccanica tra il patibolo DPP e la struttura di celle multistrato rimane la limitazione presente metodo di costruzione, che può causare la divisione degli strati celle multistrato e il patibolo. Di conseguenza, ulteriori studi sono richiesti per migliorare la biocompatibilità meccanica del patibolo idrogel 3D e l'impalcatura DPP.
Finora, gli scienziati di ingegneria del tessuto sono concentrate recante nutrizione efficiente fornitura sistemi in vitro, come coculturing endothelial cells18 e utilizzando un impalcatura porosa19. Tuttavia, la permeabilità di nutrizione all'interno della struttura 3D è bassa nel sistema tradizionale cultura 3D statico e l'attuabilità delle cellule staminali ne risentiranno notevolmente. In questo caso, utilizzando il sistema di perfusione dinamica può fornire sufficiente approvvigionamento di nutrizione per mantenere la vitalità delle cellule staminali. Usando questo protocollo, un foglio multistrato di BMSC migliorato la funzione cardiaca e l'angiogenesi in un modello di infarto del miocardio del ratto13. La costruzione di un prodotto dello strato di cellule staminali con alta cella carico e proprietà favorevoli della cellula formativa è significativo per la rigenerazione dei tessuti. Utilizzando questo metodo efficiente costruito, diversi tipi di fogli multistrato sulle cellule staminali potrebbero essere costruiti modificando i tipi di teste di serie sulle cellule staminali, ad esempio foglio delle cellule staminali epiteliali, cellule staminali neurali foglio o foglio di cellule staminali cardiache. Ulteriori esplorazioni di e alternative al foglio multistrato sulle cellule staminali sono previsto per espandere le applicazioni per la rigenerazione dei tessuti più.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla a rivelare.
Acknowledgments
Questo lavoro è stato supportato dal National Natural Science Foundation della Cina (concessione numero 31771064); la scienza e la tecnologia pianificazione progetto della provincia di Guangdong (sovvenzione numeri 2013B010404030, 2014A010105029 e 2016A020214012); la scienza e la tecnologia pianificazione progetto di Guangzhou (concessione numero 201607010063); e l'innovazione dello studente non laureato e il programma di formazione all'imprenditorialità (concessione numero 201610559028); la National Science Foundation per giovani scienziati della Cina (grant numero 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



