Summary
Este artículo proporciona un método eficiente y factible para la construcción de hojas de varias capas de células madre con células madre favorable propiedad.
Abstract
Terapia con células madre muestra un prometedor futuro en regenerar las heridas órganos y tejidos, y la técnica de la hoja de la célula ha sido desarrollada para mejorar la retención baja celular y la supervivencia pobre dentro de la zona de destino. Sin embargo, durante el proceso de construcción en vitro , una solución para mantener la actividad biológica de células madre y aumento de la cantidad de células dentro de la hoja de la célula es urgente. Aquí, este protocolo presenta un método para la construcción de una hoja de varias capas de células con células madre favorable bioactividad y óptima operatividad. Pericardio porcino decellularized (DPP) es preparado por fosfolipasa un método de descelularización2 (PLA2) como el andamio de la hoja de la célula, y rata médula ósea las células madre mesenquimales (BMSCs) son aisladas y ampliadas como las células sembradas. La estructura de la hoja temporal varias capas celulares se construye mediante el uso de RAD16-I péptido hidrogel. Finalmente, la hoja de la célula se cultiva con un sistema de perfusión dinámica para estabilizar la estructura tridimensional (3D), y la hoja de la célula podría obtenerse después de un cultivo de 48-horas en vitro. Este protocolo proporciona un método eficiente y factible para la construcción de una hoja de varias capas de células, y la hoja de la célula podría desarrollarse como un producto de terapia de células madre favorable en el futuro.
Introduction
Terapia de células madre se ha divulgado como un tratamiento efectivo para muchas enfermedades; sin embargo, retención celular baja y pobre supervivencia dentro de la zona de destino siguen siendo cuestiones críticas después de la inyección de células madre tradicional. Para resolver este problema, científicos ingeniería tejido desarrollado la técnica de la hoja de la célula. Una hoja monolayered célula con la matriz extracelular intacta en primer lugar se preparó utilizando la temperatura de respuesta cultura plato1, y sus seguimiento estudios informaron mejorías significativas de la célula de vástago de retención y sobrevivencia en el infartado zona2,3. Entre los métodos, construcción de la hoja de varias capas de células se ha divulgado como una estrategia efectiva para mejorar la supervivencia de la célula y la célula hoja efecto terapéutico3,4. Desde entonces, los científicos han trabajado en el desarrollo de métodos de construcción de hoja de diferentes células con el fin de aumentar la cantidad de celulares, propiedad de la célula de vástago y propiedades mecánicas de las hojas de la célula. Hasta ahora, ciertos tipos de hoja de la célula han sido construidos y estudiados en el tratamiento del infarto de miocardio5, cartílago lesión6, y7de la herida de la piel.
La actividad biológica de células antes del trasplante demostró una influencia emergente sobre la regeneración del tejido lesionado, y estrategias de construcción de hoja de diferentes células tienen diferentes efectos sobre las células madre. Por un lado, hojas de células confluentes sólo consistieron de alta densidad de las células madre y matrices extracelulares naturales podían ser adquiridos por apilamiento de hojas monolayered celular8 o mediante el uso de técnicas ingeniería de tejido magnético9. Por otra parte, los investigadores desarrollaron diferentes andamios para proporcionar una resistencia mecánica adecuada y apoyo celular crecimiento10,11,12, que permitió una baja siembra densidad para asegurar la nutrición la célula de vástago de la fuente. Sin embargo, a pesar de estos enfoques, la fuente de baja nutrición eficiente dentro de la estructura de la hoja de varias capas de la célula sigue siendo una preocupación importante durante la construcción en vitro . Por lo tanto, se necesita urgentemente un sistema de construcción de hoja celular eficiente y factible.
Este protocolo describe los pasos para preparar una hoja de células multilayeredmesenchymal la célula de vástago (MSC). En este sistema de construcción, la resistencia mecánica de la hoja de la célula proviene de una DPP. Partiendo de este andamio, la estructura 3D de la célula puede rápidamente construir con RAD16-I hidrogel de péptido y un sistema de perfusión dinámica se utiliza para la hoja de varias capas de células, con el fin de estabilizar la estructura de la hoja de celular 3D y proporciona nutrición suficiente de la cultura fuente para las células. Usando este sistema, una hoja de varias capas de CMMo se preparó con éxito y exhibe un efecto terapéutico óptimo en el infarto de miocardio de rata modelo13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Todos los procedimientos de experimento animal y la célula de vástago se llevó a cabo según las normas éticas de la guía nacional para el cuidado y uso de animales de laboratorio y aprobados por la Universidad de Jinan Animal cuidado y uso (Guangzhou, China).
1. preparación del andamio DPP con la descelularización de PLA2 método14
Nota: Ver figura 1A para un esquema del método de descelularización de2 PLA.
- Preparar 100 mL de 200 U/mL PLA2 solución. Añadir 0,5 g de desoxicolato de sodio y 2 mL de PLA2 en 198 mL de tampón carbonato. Esta solución debe utilizarse dentro de las 24 h después de su preparación.
- Obtener el pericardio porcino fresco (FPP) del matadero y volver al laboratorio dentro de 1 h.
Nota: La FPP debe almacenarse a 4 ° C durante el transporte. Medidas 1.10 1.2 deben realizarse con agitación continua en un baño de agua con termostato. - Lave bien la FPP con 200 mL de tampón fosfato (PBS) que contiene 1% de penicilina-estreptomicina en un vaso de precipitados de 500 mL a 10 ° c 10 minutos repetir este paso 2 x.
- Dividió la FPP de dos capas y eliminar el tejido adiposo con pinzas y tijeras.
Nota: Mantenga la FPP mojado por la adición de 50 mL de PBS cada 20 min durante la extracción del tejido adiposo. - Forma de la FPP en2 piezas de 10 x 10 cm con unas tijeras. Lave la FPP con 200 mL de tampón carbonato (CBS) que contiene 1% de penicilina-estreptomicina en un vaso de precipitados de 500 mL a 10 ° C por 10 minutos repetir la operación 2 x.
- Transferir la FPP a puro agua y remojar en 10° C por 12 h.
- Tomar las muestras de 10 x 10 cm2 en 50 mL de CBS que contiene 200 U/mL PLA2 y solución de desoxicolato de sodio 0.5% (p/v) a 37 ° C por 6 h.
- Lavar las muestras con CBS que contiene penicilina-estreptomicina de 1% a 10 ° C durante 10 minutos, repetir este paso 2 x.
- Remoje cada muestra en 50 mL de CBS que contiene 200 U/mL PLA2 y solución de desoxicolato de sodio 0.5% (p/v) a 37 ° C por 2 h.
- Lavar las muestras con CBS que contiene penicilina-estreptomicina de 1% a 10 ° C por 2 h. Repita este paso para 10 x menos. Coloque las muestras en placas planas y secar hasta peso constante en un horno de temperatura constante a 55 ° C.
Nota: La muestra debe ser secada completamente. Pesar la muestra DPP cada 10 minutos y repetir 3 x o hasta que el peso no cambia. - Forma de cada muestra DPP en un círculo de 10,5 mm de diámetro con un trépano. Embalar cada DPP en una bolsa estéril sellada.
- Esterilizar las muestras DPP por irradiación gamma (25 kGy). Almacenan las muestras DPP a 4 ° C antes de usar.
Nota: Todas las muestras pueden almacenarse hasta por seis meses a 4 ° C.
2. preparación de la celda de hoja de construcción
- Autoclave de todos los instrumentos y componentes del tejido portador a 121 ° C por 30 min, incluyendo tubos centrífuga de 1,5 mL, pinzas, pinzas, tijeras, con dientes negro bases (componente portador de tejido) y anillos de tensión blanco (componente portador de tejido).
- Prepare 20 mL de solución de sacarosa al 10% libre de gérmenes. Peso de 2 g de sacarosa y disolver el sacarosa en 18 mL de agua ultrapura. Autoclave de la solución de sacarosa al 10% a 121 ° C por 30 min o filtro de la solución con un filtro de 0,22 μm.
- Autoclave de los dispositivos de sistema de perfusión dinámica a 121 ° C durante 30 minutos, incluyendo un gas intercambian de equipo, una botella de vidrio de 500 mL, un contenedor de cultura de la perfusión y los tubos de tejido conectivos.
- Preparar los instrumentos esterilizados y tejidos componentes del portador. Poner la parte negra de la base del portador del tejido en una placa de cultivo.
- Recoger un andamio DPP seco y poner en el centro de la base negra. Poner un anillo de tensión blanco en el andamio DPP y fijarla en el portabebés de tejido.
Nota: Asegúrese de andamio es totalmente fijado en el portabebés de tejido y no hay ningún espacio entre la base negra y el anillo de tensión blanco. Si no, separar el portador de tejido y fijar otra vez el andamio. - Añada 100 μl de medio de cultivo en el andamio DPP para la rehidratación.
Nota: Si el andamio no se fija bien en el portabebés de tejido, el medio de cultivo se infiltran en la placa de cultivo. - Poner el andamio en una incubadora de 37 ° C y deje que se remoje durante 15 minutos.
3. preparación de las células para la construcción de hoja de la célula
Nota: Este protocolo es para cultivo de células utilizando un plato de 100 mm. Ver figura 1B para un esquema de la construcción de la estructura de varias capas de células.
- Aislar BMSCs13.
Nota: Este método está diseñado para la construcción de una hoja varias capas de células MSC. BMSCs rata se utilizan en el presente Protocolo. Las BMSCs están aislados mediante el método adherente de toda la médula ósea, y las BMSCs son ampliados en vitro para obtener suficiente cantidad de células.- Autoclave de los instrumentos a 121 ° C durante 30 minutos, incluyendo fórceps, pinzas dentadas y las tijeras. Preparar una jeringa de inyección de 2 mL y CMMo medio de cultivo (Dulbecco modificado Eagle medio [DMEM] 10% suero fetal bovino, glutamina 1% y 1% penicilina-estreptomicina).
- Eutanasia a las ratas de Sprague-Dawley (SD) macho de tres semanas de edad por la dislocación de la vértebra cervical. Remoje el animal en 100 mL de solución de alcohol 75% en un vaso durante 5 minutos.
- El animal saca el vaso y coloque propensa en la mesa de operación. Haga una incisión en la piel en la parte posterior del animal con tijeras y pinzas. Aislar los tejidos de la piel y el músculo para exponer el fémur del muslo.
- Aislar el fémur del muslo y ponerlo en 30 mL de PBS en un tubo de centrífuga de 50 mL. Coloque dos fémur muslo en un tubo. Vórtice el tubo de la centrífuga para lavar completamente el tejido. Repetir este paso 2 x.
- Cortar ambos extremos de los fémures con tijeras y exponer la cavidad de la médula ósea.
- Aspirar 2 mL de medio de cultivo CMMo con una jeringa de inyección. Inserte la aguja en la cavidad de la médula ósea y eliminar la médula ósea con medio de cultivo. Lave cada fémur dos muslo en una placa de cultivo de 100 mm.
- Para cada placa de cultivo de 100 mm, añadir 2 mL de medio de cultivo en la placa de cultivo. Coloque la placa de cultivo en la incubadora de 37 ° C y la cultura estática durante 72 h.
- Sacar la placa de cultivo de la incubadora. Vuelva a colocar el sobrenadante con 6 mL de medio de cultivo fresco.
- Observar BMSCs primarias bajo un microscopio. Después de esto, de paso las BMSCs cada 5-7 días.
- Tomar las células fuera de la incubadora. Observar las células bajo un microscopio y elegir las células convenientes para la construcción de la hoja de la célula. Cuando las BMSCs alcanzan 80% - 90% de confluencia, las células pueden ser elegidas como las células sembradas.
- Retire el medio de cultivo de la placa de cultivo. Lave suavemente las células con 2 mL de PBS caliente. Quitar todos los PBS de la placa de cultivo y hacer restos seguro no líquidos. Añadir 2 mL de tripsina 0.25% (u otra solución disociación) al plato e incubar a 37 ° C durante 3 minutos.
- Detener el efecto de la tripsina por añadir 2 mL de medio de cultivo y lave suavemente las células del plato. Transferir la suspensión de células en un nuevo tubo de centrífuga de 15 mL. Centrifugado las células a 225 x g durante 5 minutos.
- Eliminar el sobrenadante. Resuspender las células con 3 mL de solución 10% (p/v) de sacarosa.
Nota: solución sacarosa al 10% (w/v) se utiliza para lavar las células con el fin de obtener una mezcla uniforme de célula-hidrogel en los siguientes pasos. - Aspire 10 μl de la suspensión de células y contar el número de células con un hemocitómetro. Calcular el volumen necesario para el siguiente paso. Para la hoja de una célula, se utilizan BMSCs 3 millones.
- Extracto de 3 millones de células y transferirlos a un nuevo tubo de centrífuga de 15 mL. Centrifugar las células a 225 x g durante 5 minutos.
- Eliminar el sobrenadante. Resuspender las células con 1 mL de solución 10% (p/v) de sacarosa. Transferir la suspensión de células en un tubo de centrífuga de 1.5 mL.
Nota: Usando un tubo centrífuga de 1.5 mL es beneficioso para la preparación de la mezcla células-hidrogel. - Centrifugar las células a 260 xg por 5 minutos completamente Quite el sobrenadante y obtener el sedimento celular.
4. preparación de las BMSCs y el RAD16-mezcla hidrogel de péptido
Nota: Ver figura 1B para un esquema de la construcción de la estructura de varias capas de células.
- Añadir 20 μl de solución de sacarosa al 10% (w/v) para el tubo centrífuga de 1.5 mL. Suavemente agite las BMSCs y obtener una suspensión uniforme.
Nota: No generan las burbujas durante la resuspensión. - Añadir 20 μl de RAD16-I péptido hidrogel en la parte superior de la suspensión. Revuelva suavemente el RAD16-I suspensión péptido y de la célula con la punta de la pipeta. Cuando se mezclan la suspensión celular y el hidrogel, pipetee suavemente la mezcla un par de veces.
- Sacar el andamio DPP de la compañía de tejidos y aspirar suavemente el medio de cultivo con una punta de pipeta.
Nota: Asegúrese de que el andamio de la DPP es rehidratado completamente antes de agregar la mezcla de células-hidrogel. - Aspirar la mezcla y agregarla uniformemente al andamio DPP.
Nota: El volumen total de la mezcla sería de 40-50 μl. Se recomienda agregar la mezcla 10 μL en un momento desde el centro hacia el exterior del andamio. - Añadir 1 mL de medio de cultivo a la parte inferior del transportador del tejido. Poner la hoja de la célula en la incubadora de 37 ° C durante 5 minutos.
- Sacar la hoja de la célula de la incubadora. Añadir 4 mL de medio de cultivo en la placa de cultivo y sumerja la hoja de la célula. Poner la hoja de la célula en la incubadora de 37 ° C por 2 h de cultura estática.
5. cultivo in Vitro de una hoja de varias capas 3D de la célula mediante un sistema dinámico de la cultura
Nota: Ver figura 1 para un diagrama esquemático del sistema dinámico de 3D.
- Preparar el sistema de perfusión dinámico, incluyendo una bomba peristáltica, equipo de intercambio de gas, una botella de vidrio de 500 mL, un contenedor de cultura de la perfusión y los tubos de tejido conectivos. Montar el sistema de perfusión dinámico como se muestra en la figura 2.
- Añadir 200 mL de medio de cultivo a la botella de vidrio estéril. Inserte la hoja de la célula en la cámara del contenedor de la cultura.
Nota: Preste atención a la dirección de la superficie superior de la hoja de la célula. - Añadir 3 mL de medio de cultivo en el contenedor de tejido y cerrar el recipiente. Ponga el sistema de perfusión dinámica en la incubadora y arranque la bomba. Fijar el caudal de la bomba peristáltica en 8 mL/min cultura la hoja de la célula en el sistema de perfusión dinámica durante 48 h.
6. obtención de la hoja de la célula de varias capas de MSC
- Autoclave de los instrumentos y componentes del tejido portador a 121 ° C durante 30 minutos, incluyendo tubos centrífuga de 1.5 mL, pinzas y pinzas dentadas.
- Sacar el conducto de entrada de la botella de vidrio para detener el suministro del medio de cultivo en el contenedor.
Nota: Detenga la bomba peristáltica cuando el contenedor de la cultura es vacíelo. - Sacar la hoja de la célula desde el contenedor de la cultura y ponerla en una placa de cultivo.
- Utilice una pinza para inmovilizar el portador de tejido y otros pinzas dentadas para separar el anillo blanco de la tensión de la base negra. Finalmente, obtener la hoja de la célula de BMSCs varias capas.
- Para la preservación de corto, cada hoja de la célula puede transferirse a un tubo centrífuga de 1.5 mL con el fórceps. El andamio DPP debe fijarse a la pared interna del tubo centrífugo y debe difundir la hoja de la célula hacia fuera tanto como sea posible en el tubo de centrífuga.
- Suavemente añadir 1 mL de medio de cultivo en el tubo centrífugo para sumergir la capa celular. Cierre la tapa del tubo de centrífuga y guarde la hoja de la célula a 4 ° C.
Nota: La hoja de la célula debe trasplantada o analizada tan pronto como sea posible. Se recomienda utilizar la hoja de la célula dentro de 4 h.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
El esquema de la construcción de la hoja de varias capas de células madre se muestra en la figura 1. Preparando el andamio de la hoja de la célula por el método de descelularización de2 PLA es el primer paso. Basado en el andamio, una estructura temporal celular 3D se construye mediante la mezcla de las células madre con el hidrogel del péptido RAD16-1. Para obtener una hoja de varias capas de células con células madre favorable bioactividad y óptima resistencia mecánica, se cultiva la hoja de celda en un sistema de perfusión dinámica. Bajo la fuente de alimentación dinámica, las células pueden proliferar y establecer contactos de celular dentro de la hoja de varias capas de células, y el producto de la hoja final estable celular de varias capas se puede obtener después de un ~ 24-72-cultivo de hora.
En este caso, el andamio de hoja celular DPP es preparado por el método de descelularización de2 PLA. La aparición de DPP seco es plana, lisa y semitransparente (Figura 3A). Debido al efecto específico lyse de PLA2, las células heterogéneas pueden retirarse completamente mientras que la ultraestructura del colágeno natural en el andamio de la DPP es bien conservada (figura 3B), y esto es importante para mantener la mecánicas y la biocompatibilidad del andamio. Además, los andamios pueden ser modificados como un sistema de liberación del control de factor de crecimiento para apoyar el crecimiento de la célula de vástago y mejorar en vivo regeneración13.
Cuando las células alcanzan ~ 80% - 90% de confluencia, las células se aíslan de la placa de cultivo y lavaron con una solución de sacarosa al 10%. Después de la centrifugación, las células se mezclan con el RAD16-I péptido hidrogel y añadido al andamio DPP rehidratado. Una estructura temporal de varias capas se forma siguiendo una cultura estática de dos horas. Por último, el producto de varias capas de hoja de CMMo (figura 4) se adquiere después de un cultivo de 48 horas en el sistema de perfusión dinámica. Con el apoyo del andamio DPP, la hoja de la célula puede ser fácilmente manipulada con pinzas, y puede ser temporalmente conservó en medio de cultivo en el tubo de 1,5 mL a 4 ° C durante 4 horas antes de la examinación o el trasplante (figura 4). Como la inmunofluorescencia que manchaba resultado muestra, las BMSCs son altamente positivas para los marcadores de la célula de vástago CD90 y CD29. Después de la construcción de la hoja celular, BMSCs dentro de los célula varias capas hoja Mostrar altos niveles de CD29 y CD90 (figura 5).

Figura 1 : El diagrama de flujo de la construcción de la hoja de varias capas de células madre. (A) por el método de PLA2 decellularized, las células heterogéneas dentro de la FPP son destruidas mientras que las matrices extracelulares naturales están bien conservadas en el andamio DPP. (B) basado en el andamio de la DPP, la estructura temporal de varias capas celulares se construye mezclando las células madre y autoensamblada péptido hidrogel. (C) a continuación, la hoja de la célula se cultiva en un sistema dinámico de 3D, y se espera que las células proliferan y establecer contactos de celular bajo el suministro de nutrición dinámica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : El portador del tejido y el sistema de perfusión dinámica. Portador de tejido (A) este panel muestra los 13 mm de diámetro. (B) este panel muestra el montaje del sistema de perfusión dinámica. Haga clic aquí para ver una versión más grande de esta figura.
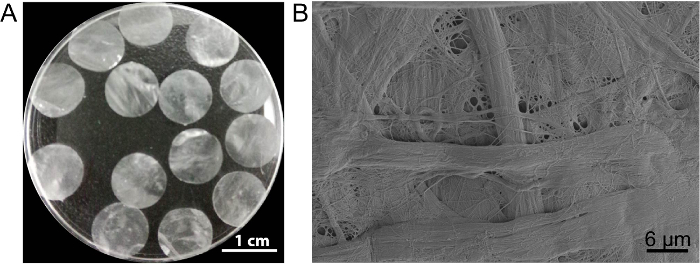
Figura 3 : El aspecto y la ultraestructura de DPP. (A) este panel muestra el aspecto de los andamios DPP 10,5 mm de diámetro. (B) este panel muestra una imagen representativa de los resultados de microscopio electrónico de barrido (SEM) del andamio DPP. Haga clic aquí para ver una versión más grande de esta figura.
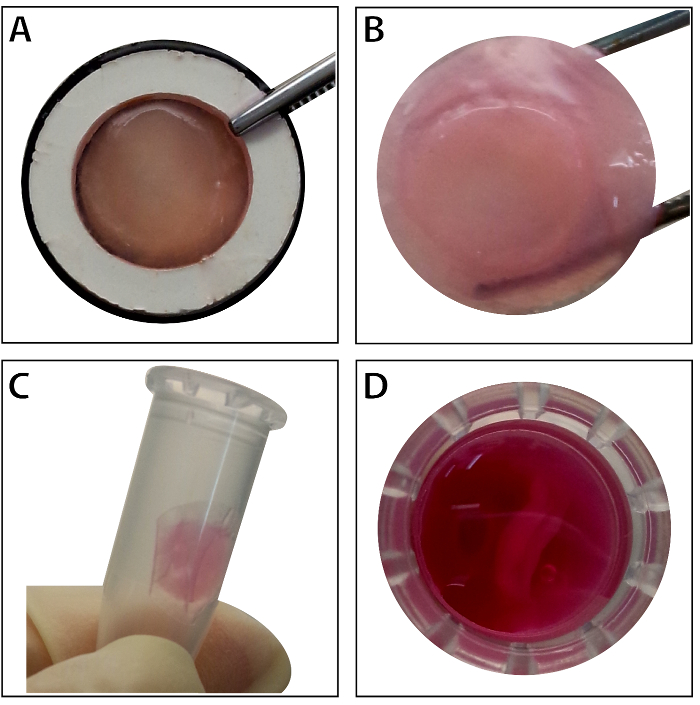
Figura 4 : La aparición de la hoja de varias capas de CMMo. (A) este panel muestra el aspecto de CMMo varias capas de la hoja dentro del portador del tejido. (B) la hoja varias capas intacta de CMMo es sostenida por pinzas. (C - D) La hoja de varias capas de la célula puede conservarse temporalmente en el tubo de 1,5 mL antes de su uso. Haga clic aquí para ver una versión más grande de esta figura.
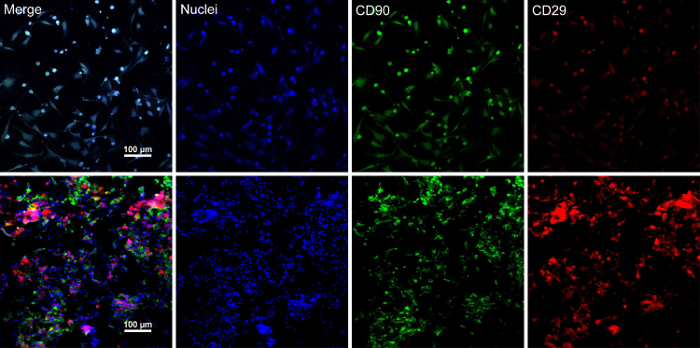
Figura 5 : Inmunofluorescencia que manchaba resultados de expresión de marcadores de CMMo. (A) este panel de inmunofluorescencia muestra tinción resultados de BMSCs antes de la construcción de la hoja de la célula. (B) este panel muestra la inmunofluorescencia que manchaba los resultados de la sección de hoja de varias capas de CMMo. CD90 (verde) y CD29 (rojo) se expresaron positivamente en las BMSCs y la hoja de la célula. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
El presente Protocolo informa un método eficiente para la construcción de una hoja de varias capas de MSC. Esta hoja celular exhibe óptima resistencia mecánica, alta siembra densidad celular y células madre favorable bioactividad. Utilizando BMSCs como ejemplo, la estructura 3D de la célula rápidamente se construye con RAD16-I péptido hidrogel. Después de ser cultivadas en el sistema de perfusión dinámica, la hoja de varias capas de CMMo se obtiene con éxito y las BMSCs mantienen una alta expresión de marcadores de células madre.
Construcción de la estructura temporal de varias capas celulares, es el paso crítico del protocolo. El RAD16-I es un péptido de hidrogel comercial, y consiste en 1% del aminoácido y 99% de agua. Varios estudios informaron que este hidrogel de péptido puede imitar el entorno natural de ECM y es beneficioso para las células proliferación y supervivencia15,16,17. En el presente Protocolo, una suspensión MSC 3 millones (en 20 μl de solución de sacarosa al 10%) se mezcló con 20 μl de RAD16-I péptido hidrogel. La relación de volumen de la suspensión celular y el hidrogel péptido fue 1:1. Este hidrogel de péptido es sensible al valor del pH del medio ambiente, y las moléculas péptido automáticamente formaría la red 3D cuando cambia el valor de pH de ácido a neutro. Porque la superficie de la célula contiene partículas cargadas, la mezcla de la célula cambia de líquido a hidrogel en poco tiempo, que tiene influencias la mezcla incluso de las células. Un hidrogel de celular favorable debe ser una mezcla uniforme de la suspensión celular y el hidrogel de péptido y permite la mezcla de células agregarse uniformemente sobre el andamio. Los investigadores pueden optimizar las condiciones de mezcla alterando el número de células sembradas, volumen de solución de sacarosa y el volumen de hidrogel péptido según su necesidad real. Vale la pena notar lavar las células con solución de sacarosa al 10% y mezclar uniformemente la mezcla células-hidrogel son los pasos críticos del Protocolo, y una mezcla desigual puede causar pérdida de la célula grandes y una estructura de varias capas temporal inestable.
Después de agregar la mezcla de células-hidrogel en el andamio de la DPP, la resistencia mecánica de la estructura de la hoja de varias capas de la célula es débil porque la red de hidrogel del péptido no es lo suficientemente fuerte para mantener la estructura de varias capas de células a largo plazo y de la célula las conexiones y las secreciones de la ECM son necesarios para mejorar la estabilidad de la capa celular. Por otra parte, la infiltración dinámica en el medio de cultivo puede facilitar el células madre para proliferar y establecer contacto dentro de la estructura de varias capas de células, mientras que una fuente de nutrición insuficiente causará la apoptosis de las células y reducir la densidad celular de la celda de la hoja13. Por lo tanto, el sistema de perfusión dinámica es importante para estabilizar la estructura de la hoja de varias capas de células. Además, el caudal adecuado de medio de cultivo debe ajustarse según el tipo de células específicas y siembra la densidad de la célula. Además, la débil conexión mecánica entre el andamio de la DPP y la estructura de varias capas de la célula sigue siendo la limitación del método de construcción actual, que puede causar la división de las capas de múltiples capas de la célula y el andamio. Por lo tanto, se necesitan estudios adicionales para mejorar la biocompatibilidad mecánica de andamio 3D del hidrogel y el andamio DPP.
Hasta ahora, científicos ingeniería de tejidos se ha centrado en establecer nutrición eficiente suministro sistemas en vitro, tales como cocultivo endothelial células18 y utilizando un andamio poroso19. Sin embargo, la permeabilidad de la nutrición dentro de la estructura 3D es baja en el sistema tradicional cultura 3D estático y afectará enormemente la viabilidad de la célula de vástago. En este caso, utilizando el sistema de perfusión dinámica puede proporcionar suficiente fuente de nutrición para mantener la viabilidad de la célula de vástago. Mediante este protocolo, una hoja de varias capas de CMMo mejoró la función cardiaca y la angiogénesis en un infarto de miocardio de rata modelo13. Construcción de un producto de la hoja de la célula de vástago con una carga de alta celular y células madre favorable propiedad es importante para la regeneración de los tejidos. Usando este método de construcción eficiente, diferentes tipos de hojas de varias capas de células madre pudieran construirse mediante la alteración de los tipos de células sembradas, como hoja de células epiteliales, células madre neurales hoja u hoja de células madre cardiacas. Más exploraciones de y alternativas a la hoja de varias capas de células se esperan ampliar las aplicaciones para la regeneración de tejido más.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este trabajo fue financiado por la Fundación Nacional de Ciencias naturales de China (número 31771064); la ciencia y tecnología de planificación proyecto de la provincia de Guangdong (grant números 2013B010404030, 2014A010105029 y 2016A020214012); la ciencia y la tecnología de planificación proyecto de Guangzhou (número 201607010063); y el grado de innovación y programa de formación empresarial (número 201610559028); la Fundación Nacional de ciencia para jóvenes científicos de China (la concesión número 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



