Summary
この資料では、プロパティが有利な幹細胞幹細胞の多層シートを構築するため効率的かつ実行可能な方法を提供します。
Abstract
幹細胞療法は有望なを示す将来負傷した臓器や組織を再生・細胞シート技術は低細胞保存とターゲット ゾーン内で貧しい人々 の生存を改善するために開発されました。ただし、体外施工中に幹細胞の活性を維持して細胞シート内細胞量の増加のためのソリューションが急務します。ここでは、このプロトコルは有利な幹細胞の生物活性と最適な操作性と多層の細胞シートを構築する手法を提案します。細胞シート足場として2 (PLA2) decellularization メソッド ホスホリパーゼによって脱ブタの心膜 (DPP) を用意し、ラット骨髄間葉系幹細胞 (BMSCs) が分離されシード細胞として展開されます。一時的な多層細胞シート構造は、RAD16 を使用して作成されます-私ペプチド ハイドロゲルです。最後に、三次元 (3 D) の構造を安定させるために動的な灌流システムと細胞シートを培養し、48 時間培養の in vitro細胞シートを得ることができた。このプロトコルは、多層の細胞シートを構築するための効率的かつ実行可能な方法を提供し、細胞シートが将来的に有利な幹細胞療法製品として開発される可能性があります。
Introduction
幹細胞療法は多くの病気の効果的な治療法として報告されています。ただし、低細胞保存とターゲット ゾーン内で貧しい人々 の生存伝統的な幹細胞の注入の後の重要な問題に残る。この問題を解決するためには、組織工学科学者は、細胞シート技術を開発しました。そのままの細胞外マトリックスを持つ単層細胞シートまず温度応答文化料理1を使用して調製し、, そのフォロー アップ研究幹細胞の保存と、梗塞内生存の重要な改善を報告しました。エリア2,3。方法のうちは、多層の細胞シートを構築する細胞の生存率と細胞シート治療効果3,4を改善するための効果的な戦略として報告されています。以来、科学者は細胞量、幹細胞プロパティ、および細胞シートの機械的性質を高めるために別の細胞シート工法の開発に働いています。これまでのところ、細胞シートの特定の種類を構築し、心筋梗塞の5、軟骨損傷6治療の研究、皮膚傷7。
移植前に幹細胞の生物活性を示した負傷した組織再生に新たな影響を及ぼす、異なる細胞シートの構築戦略は、幹細胞の異なる効果を持ちます。一方、コンフルエントの細胞シートはのみ高密度の幹細胞で構成され、重なり単層細胞シート8または磁気ティッシュ エンジニア リング技術9を使用して、自然な細胞外マトリックスを取得できます。その一方で、研究者は、十分な機械的強度を提供し、細胞成長10、11,12、低細胞播種密度栄養を確保するための許可をサポートする異なる足場を開発しました。供給。ただし、これらのアプローチにもかかわらず多層細胞シート構造内で低効率の高い栄養供給は体外工事主要な関心事を残ります。したがって、効率的かつ実行可能な細胞シート施工システムは緊急に必要です。
このプロトコルでは、multilayeredmesenchymal 幹細胞 (MSC) の細胞シートを準備する手順について説明します。この工法では、細胞シートの機械的強度は、DPP によって提供されます。この足場を基に、3 D の細胞構造を素早く構築できます RAD16 で-私ペプチド ハイドロゲルと動的な灌流システム、3 D の細胞シート構造の安定化し、十分な栄養を提供するために、多層の細胞シートを文化に使用セルの供給。このシステムを使用すると、多層 BMSC シート準備ができましたし、ラット心筋梗塞モデル13の最適な治療効果を展示します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
すべての幹細胞および動物実験プロシージャがケアと実験動物の使用のため全国のガイドの倫理的なガイドラインに従って実施、済南大学動物ケアおよび使用委員会 (中国・広州) によって承認します。
1. PLA2 Decellularization と DPP 足場の準備方法14
注: は、PLA2 decellularization 法の模式図を図 1 aを参照してください。
- 200 U/mL PLA2溶液 100 mL を準備します。198 mL 炭酸緩衝液に 0.5 g デオキシ コール酸ナトリウムと PLA2 2 mL を追加します。このソリューションは、その準備の後 24 h 内で使用する必要があります。
- 食肉処理場から新鮮なブタの心膜 (FPP) を取得し、1 時間以内に検査室に返します。
注: FPP は、輸送中に 4 ° C で保存する必要があります。手順 1.2 1.10 は、サーモスタット制御の水浴の連続振動で行われなければなりません。 - 徹底的に洗って 200 ml の 10 ° Cfor 10 分で 500 mL ビーカーに 1% ペニシリン-ストレプトマイシンを含むリン酸緩衝液 (PBS) の FPP は、この手順の 2 倍を繰り返します。
- FPP を 2 つのレイヤーに分割し、鉗子、はさみと脂肪組織を削除します。
注意: 50 mL の PBS を追加することによりウェット FPP 20 分中脂肪の除去。 - はさみで 10 × 10 cm2個セットに、FPP を形状します。10 分を繰り返します 2 倍の 10 ° C で 500 mL ビーカーに 1% ペニシリン-ストレプトマイシンを含む炭酸塩緩衝液 (CBS) の 200 mL の FPP を洗います。
- 純粋な水に、FPP を転送し、12 h 10 ° C で浸します。
- 200 U/mL PLA2と 6 h 37 ° C で 0.5% (w/v) ナトリウム デオキシ コール酸溶液を含む CBS の 50 mL で 10 × 10 cm2の試料を浸します。
- このステップ 2 x 10 の ° c で 10 分間繰り返し 1% ペニシリン-ストレプトマイシンを含む CBS でサンプルを洗ってください。
- 200 U/mL PLA2と 37 ° c 2 h 0.5% (w/v) ナトリウム デオキシ コール酸溶液を含む CBS の 50 mL で各サンプルを浸します。
- サンプルで洗う 2 h. 繰り返し 10 ° C で 1% ペニシリン-ストレプトマイシンを含む CBS 10 x に対してこの手順を少なくとも。平板のサンプルを置き、恒温オーブン 55 ° C で一定重量まで乾燥
注: サンプルは、完全に乾燥する必要があります。繰り返すし、DPP サンプル 10 分毎の重量を量る 3 x または重量まで変更されなく。 - 10.5 mm 径の円に、トレフィンで各 DPP サンプルを形状します。滅菌密封された袋の各 DPP をパックします。
- Γ 線照射 (25 kGy) DPP サンプルを滅菌します。使用前に 4 ° C で DPP サンプルを格納されます。
注意: すべてのサンプルが 4 ° C で最大 6 ヶ月間保存することができます。
2 セルの準備シート工事
- オートクレーブの 30 分、1.5 mL 遠心チューブ、鉗子を含む歯の鉗子、はさみ、黒基地 (組織キャリア成分) と白テンション リング (組織キャリア成分) すべての楽器と 121 ° c 組織キャリア成分。
- 無菌 10% ショ糖溶液の 20 mL を準備します。ショ糖の 2 g の重量し、超純水の 18 mL のショ糖を分解します。オートクレーブ 121 ° C、30 分または 0.22 μ m のフィルターとフィルター ソリューションで 10% ショ糖液。
- オートクレーブ、ガスを含む、30 分の 121 ° C で動的な灌流システム デバイス交換結合管灌流培養容器、500 mL 瓶装置。
- オートクレーブ器と組織のキャリア成分を準備します。培養皿で組織のキャリアの黒いベース部分を置きます。
- 乾燥 DPP 足場をピックアップし、黒ベースの中心にそれを置きます。DPP 足場に白いテンション リングを置いて、組織のキャリアでそれを修正します。
注意: 必ず足場は組織のキャリアに完全固定、黒ベースと白のテンション リング間のギャップはありません。そうでない場合は、別の組織のキャリアと足場を再度修正します。 - 水分補給のための DPP の足場に培養液 100 μ L を追加します。
注: 組織のキャリアでも足場が固定されていない場合、培養培地は培養皿を潜入します。 - 37 ° C の定温器に足場を入れて、15 分間浸すことができます。
3. 着工準備中のセルの細胞シート
メモ: このプロトコルは、100 mm ディッシュを使用して細胞培養.多層セル構造の構造の模式図を図 1 bを参照してください。
- BMSCs13を分離します。
注: このメソッドは多層 MSC 細胞シートを構築するために設計されています。ラット BMSCs はこのプロトコルで使用されます。BMSCs 全体骨髄付着性メソッドを使用して分離、BMSCs 拡大培養細胞の十分な量を取得します。- オートクレーブ 121 ° C で鉗子、歯の鉗子、はさみなど、30 分間の楽器。2 mL 注射器とボーマン培 (ダルベッコ改変イーグルの 1% ペニシリン-ストレプトマイシンや 1% グルタミン 10% 牛胎児血清中 [DMEM]) を準備します。
- 頚椎脱臼で 3 週齢雄 Sprague-dawley (SD) ラットを安楽死させます。5 分間で 75% アルコール溶液の 100 mL で動物を浸します。
- ビーカーの動物を取るし、操作テーブルの上になりやすい配置です。はさみ鉗子と動物の背中の皮膚を切開します。太ももの大腿骨を公開する皮膚や筋肉組織を分離します。
- 太ももの大腿骨を隔離し、30 mL の PBS 50 mL 遠心管中でそれを置きます。1 つの管に 2 つの太ももの大腿骨を配置します。渦遠心管組織を徹底的に洗浄します。2 x この手順を繰り返します。
- に対する大腿骨の両端をハサミでカットし、骨髄腔を公開します。
- BMSC 培養液 2 mL を注射器で吸引します。骨髄腔に針を挿入、骨髄培養液を洗い流します。100 mm ディッシュ用 1 つにすべての 2 つの太ももの大腿骨をフラッシュします。
- 各 100 mm 培養皿の培養皿で培養液 2 mL を追加します。37 ° C の定温器に 72 時間静置培養培養皿を置きます。
- インキュベーターから培養皿を取り出してください。6 ml の新鮮な培養液の上清を交換してください。
- 顕微鏡下でプライマリ BMSCs を観察します。次に、すべての 5-7 d、BMSCs の通路します。
- インキュベーター外細胞を取る。顕微鏡で細胞を観察し、細胞シート工法の適切なセルを選択します。BMSCs 80%-90% の合流点に達すると、シードのセルとセルを選択できます。
- 培養培地を培養皿から削除します。2 ml の温かい PBS のセルは水洗い。すべての PBS を培養皿から外し、遺体を確かに液体。皿に 0.25% トリプシン (または別の分離ソリューション) の 2 mL を追加し、3 分の 37 ° C で孵化させなさい。
- 2 mL の培養液を追加することによってトリプシンの効果を停止し、水洗いしてお皿からセル。新しい 15 mL 遠心チューブに細胞懸濁液を転送します。Centrifugate 225 x gで 5 分で細胞。
- 上澄みを除去します。3 ml の 10% (w/v) ショ糖液の細胞を再懸濁します。
メモ: 10% (w/v) ショ糖液は、次の手順で均一なセル ヒドロゲル混合物を得るために細胞を洗浄する使用されます。 - 細胞懸濁液の 10 μ L を吸引し、診断のセル数をカウントします。次のステップに必要な量を計算します。1 つの細胞シート 300 万 BMSCs が使用されます。
- 300 万セルを抽出し、新しい 15 mL 遠心管にそれらを転送します。225 x gで 5 分で細胞を遠心します。
- 上澄みを除去します。1 ml の 10% (w/v) ショ糖液の細胞を再懸濁します。1.5 mL 遠心チューブに細胞懸濁液を転送します。
注: 1.5 mL 遠心管を使用する携帯ハイドロゲルの混合物を準備するため有益です。 - 5 分は完全に上澄みを除去し、セル堆積物を得るために 260 xgで細胞を遠心分離機します。
4 作成、BMSCs と、RAD16-私ペプチド ヒドロゲル混合物
注: は、多層の細胞構造の構造の模式図を図 1 bを参照してください。
- 1.5 mL 遠心チューブに 10% (w/v) ショ糖溶液 20 μ L を追加します。軽く、BMSCs 再懸濁します、均一な懸濁液を得る。
注: は、再懸濁の中に任意の気泡を生成しません。 - RAD16 の 20 μ L を追加-私懸濁液の上部にペプチド ハイドロゲルです。軽くかき混ぜ、RAD16-私にピペット チップ ペプチドと細胞懸濁液。ときに細胞懸濁液とゲルが一緒に混合される、混合物を数回の優しくピペットします。
- 組織のキャリアから DPP 足場を取り出し、そっとピペット チップで培養液を吸引します。
注: は、DPP の足場が完全に携帯ハイドロゲルの混合物を追加する前にステータス復元されるを確認します。 - 混合物を吸引し、均等に DPP 足場にそれを追加します。
注: 混合物の総量は約なる 40-50 μ L。足場の外側に、中心から一度に混合物 10 μ L を追加することをお勧めします。 - 組織のキャリアの下部に培養液 1 mL を追加します。5 分の 37 ° C の定温器で細胞シートを置きます。
- インキュベーターから細胞シートを取り出してください。優しく培養皿で培養液 4 mL を追加し、細胞シートを浸します。静置培養の 2 h の 37 ° C の定温器で細胞シートを置きます。
5 します動的培養系を用いた 3次元多層細胞シートの体外培養。
注: 3 D の動的システムの概略図を図 1を参照してください。
- 蠕動性ポンプ、ガス交換装置、500 mL の瓶、灌流培養コンテナー結合管など動的な灌流システムを準備します。図 2に示すように、動的な灌流システムを組み立てます。
- 滅菌瓶に 200 mL の培養液を追加します。商工会議所文化容器に細胞シートを挿入します。
注: は、細胞シートの上面の方向に注意を払います。 - 組織コンテナー内培養液 3 mL を加えるし、コンテナーを閉じます。インキュベーターに動的な灌流システムを入れ、ポンプを起動します。48 h の血流の動的システムの細胞シート 8 mL/分文化で蠕動運動型ポンプの流量を設定します。
6. 多層 MSC 細胞シートの取得
- オートクレーブ 121 ° c 30 分、歯の鉗子、鉗子、1.5 mL 遠心管を含む組織キャリア成分器具。
- コンテナーに培養液の供給を停止するガラス瓶から入力ダクトを引き出します。
メモ: は、文化容器が空のときに蠕動性ポンプを停止します。 - 文化容器から細胞シートを取り出し、培養皿にそれを置きます。
- 組織のキャリアを固定し、黒ベースから白テンション リングを分離する別の歯の鉗子を使用して 1 つの鉗子を使用します。最後に、多層 BMSCs 細胞シートを取得します。
- 短い保全の各細胞シートは 1.5 mL 遠心チューブに鉗子で転送できます。遠心管の内壁をアタッチする DPP 足場と細胞シートを広める必要がありますアウト遠心管中の可能な限り。
- 優しく細胞シートを浸漬する遠心管内培養液 1 mL を追加します。遠心チューブのキャップを閉じ、4 ° C で細胞シートを保管
注: 細胞シートを移植したり分析したりできる、できるだけ早く。4 時間の内で細胞シートを使用することをお勧めします。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
多層幹細胞シート工法の模式図は、図 1に表示されます。PLA2 decellularization 法による細胞シート培養足場を準備する最初のステップです。足場に基づき、一時 3 D セル構造は、RAD16 1 ペプチド ハイドロゲルと幹細胞を混合することによって構築されます。有利な幹細胞の生物活性と最適な強度、多層の細胞シートを取得するために動的な灌流システムで細胞シートを培養します。動的栄養供給のもとで幹細胞が増殖し、多層の細胞シート内のセル連絡先が許可され、~ 24-72、最終的な安定した多層細胞シート製品を得ることができる-時間栽培。
この場合、細胞シート培養足場 DPP は、PLA2 decellularization メソッドによって作成されました。乾燥 DPP の外観はフラット、滑らかな、半透明 (図 3 a)。PLA2特定 lyse 効果により異種細胞完全に削除できる DPP 足場内の自然なコラーゲンの微細構造はよく保存された (図 3 b)、これを維持するために重要ですし、機械的強度と足場の生体適合性。さらに、足場に幹細胞の成長をサポートし、生体内で保存再生13を向上させる成長因子コントロール リリース システムとして変更できます。
幹細胞に達する 〜 80%-90% の合流と、細胞は培養皿から隔離され、10% ショ糖溶液で洗浄しました。遠心分離した細胞を RAD16 と混合-私ペプチド ハイドロゲル、水分を補給された DPP 足場に追加されます。後、2 時間静置培養一時的な多層構造が形成されます。最後に、動的灌流システムで 48 時間培養の後、多層 BMSC シート製品 (図 4) を取得します。DPP 足場のサポート、鉗子、細胞シートを簡単に操作できるし、一時的に保全できる 4 ° C で 1.5 mL のチューブに培地の 4 時間前に検査または移植 (図 4)。蛍光抗体法により染色の結果、BMSCs が CD90 と (cd29) 幹細胞マーカーのポジです。細胞シート工法、シートが (cd29) と CD90 の高レベルを表示する多層セル内 BMSCs 後 (図 5)。

図 1: 多層幹細胞シートの作成のフローチャート。(A) 自然の細胞外マトリックスが DPP 足場でよく保存された PLA2脱メソッドを使用して、FPP 内で異種の細胞が破壊されます。(B) DPP 足場、幹細胞を混合し、自己組織化ペプチド ハイドロゲルによって一時的な多層セル構造を構築します。(C) に従って、3 D ダイナミック システムで培養細胞シートと幹細胞が増殖し、動的栄養供給の下で細胞の接触を確立すると予想します。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 組織のキャリアと動的な灌流システム。このパネル表示、13 mm 径 (A) 組織のキャリア。(B) このパネルの動的な灌流システムのアセンブリを示します。この図の拡大版を表示するのにはここをクリックしてください。
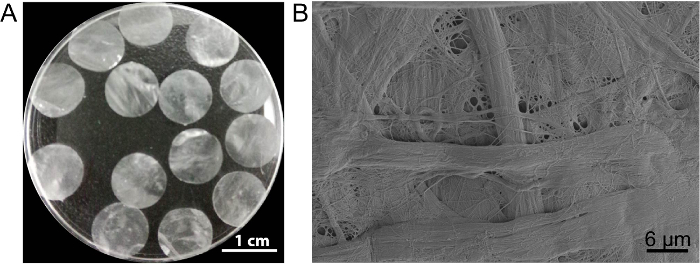
図 3: 外観と DPP の微細構造。(A) このパネルが 10.5 mm 直径 DPP 足場の外観を示します。(B) このパネルは、DPP 足場の走査型電子顕微鏡 (SEM) 結果の代表的なイメージを示しています。この図の拡大版を表示するのにはここをクリックしてください。
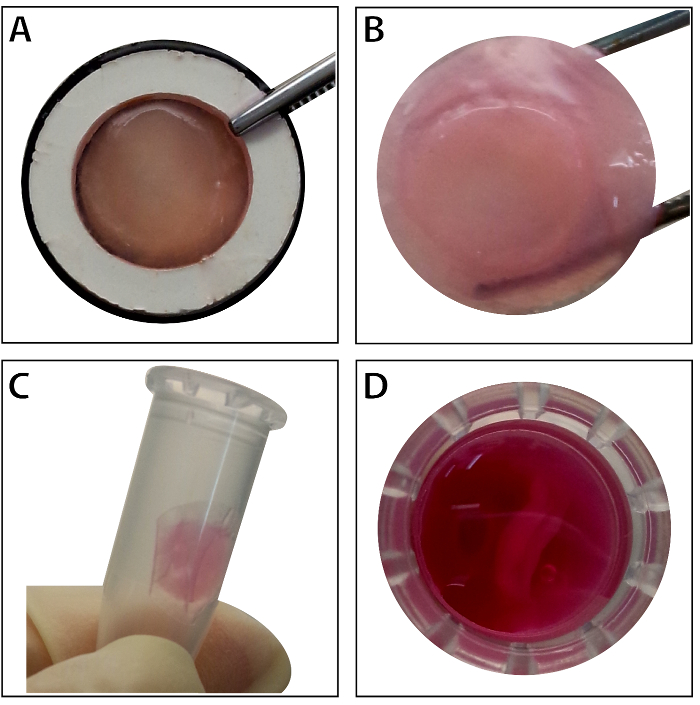
図 4: 多層 BMSC シートの外観。(A) このパネル内組織のキャリア シートの多層 BMSC の外観を示しています。(B) そのまま多層 BMSC シートは、鉗子で開催されます。(C ・ D)多層細胞シートは、使用前に 1.5 mL チューブに一時的に保存できます。この図の拡大版を表示するのにはここをクリックしてください。
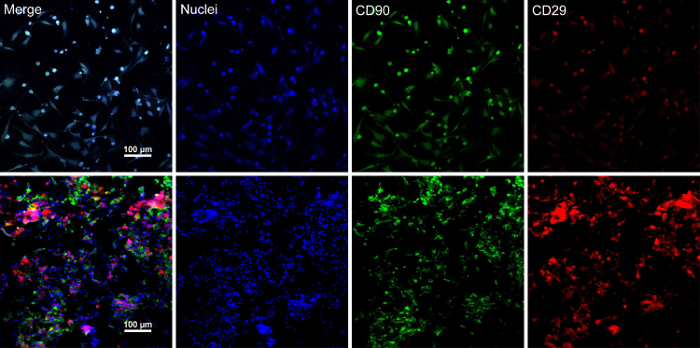
図 5: 蛍光染色のボーマン マーカー式の結果。(A) このパネル ショー蛍光染色の細胞シート施工前に、BMSCs の結果。(B) このパネルは、蛍光染色の多層 BMSC シート セクションの結果を示しています。CD90 (緑)、(赤) (cd29) 積極的に、BMSCs と細胞シートで表現されました。この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
この議定書は、多層 MSC シートを構築するための効率的な方法を報告します。この細胞シートは、最適な強度、高い細胞播種密度および有利な幹細胞活性を展示します。BMSCs を例として使用して、3 D の細胞の構造がすぐに RAD16 で構築されて-私ペプチド ハイドロゲルです。動的な灌流システムで培養されて後、多層 BMSC のシートは正常に取得し、BMSCs 高幹細胞マーカー発現を維持します。
プロトコルの重要なステップは、一時的な多層セル構造を構築します。RAD16-私は商業ハイドロゲル ペプチドを 1% のアミノ酸および 99% の水で構成されています。いくつかの研究は、このペプチド ハイドロゲルが自然の ECM 環境をまねることができる、幹細胞の増殖と生存15,16,17のために有益に報告しました。この議定書で、300 万 MSC 懸濁液 (10% ショ糖溶液 20 μ L) は RAD16 の 20 μ L と混合した-私ペプチド ハイドロゲルです。細胞懸濁液およびペプチド ハイドロゲルの容積比 1:1 であった。このペプチド ハイドロゲルは環境の ph に敏感、ペプチド分子が自動的に 3 D ネットワークを形成し、pH 値が中性に酸から変更されたとき。細胞表面には、荷電粒子が含まれている、ため細胞の混合物液体からに変更影響を持って短期間でハイドロゲル セルの混合も。有利な携帯ハイドロゲル細胞懸濁液とペプチド ハイドロゲルのも混合物をする必要がありますでき、足場の上に均等に追加するセルの混合物。研究者は、播種細胞数、ショ糖ソリューション ボリューム、および彼らの実際の必要性に従ってペプチド ハイドロゲルのボリュームを変更することにより、混合状態を最適化できます。10% ショ糖液で細胞を洗浄するに注意してくださいする価値があると素晴らしいセルの損失、不安定な一時的な多層構造不均一な混合物の原因しプロトコルの重要なステップは、セル ヒドロゲル混合物を均等に混ぜ合わせます。
ペプチド ハイドロゲル ネットワークは長期的な多層の細胞構造を維持し、細胞に十分な強さではないため DPP 足場に携帯ハイドロゲルの混合物を追加すると、多層の細胞シート構造の機械的強度が弱い接続および ECM の分泌物は、細胞シートの安定性を高めるために必要です。また、培地の動的浸透が容易に増殖し、不十分な栄養供給は細胞のアポトーシスを引き起こすし、細胞密度を低減しながら多層セル構造内で細胞の接触を確立する幹細胞細胞シート13。したがって、動的な灌流システムは多層の細胞シート構造を安定させるため重要です。また、培地の適切な流量を調整して、特定の幹細胞と細胞播種密度に従ってください。また、DPP 足場と多層セル構造の弱い機械的接続は、多層の細胞層と足場の区分を引き起こす可能性があります現在の構法の制限を残ります。そのため、さらに研究は三次元ハイドロゲル足場と DPP 足場の力学的生体適合性を強化する必要があります。
これまでのところ、組織工学者は18取込み内皮細胞など効率的な栄養供給システムの in vitro、確立し、多孔質足場材料19を使用してに注力しています。ただし、3 D 構造内で栄養浸透率は伝統的な静的な 3次元培養システムの低され、幹細胞生存率は大きく影響を受けます。この場合、動的な灌流システムを使用すると、幹細胞の生存を維持するために十分な栄養供給が提供できます。このプロトコルを使用して、多層 BMSC シート改善心機能と血管新生ラット心筋梗塞モデル13。高細胞負荷有利な茎セル プロパティと幹細胞シート製品を構築する組織の再生に重要です。この効率的な構築メソッドを使用すると、多層の幹細胞シートの種類は上皮幹細胞シート、神経幹細胞シート、心臓幹細胞シートなどシードの幹細胞の種類を変えることによって組み立てることができます。さらなる探求と多層幹細胞シートの選択肢はより組織再生用アプリケーションを展開する予定です。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
この仕事に支えられた中国の国家自然科学基金 (許可番号 31771064)科学技術計画プロジェクトの広東省 (許可番号 2013B010404030、2014A010105029、および 2016A020214012)。科学技術計画プロジェクトの広州 (許可番号 201607010063)学部の技術革新と起業家研修 (許可番号 201610559028)(許可番号 31800819) 中国の若い科学者を全米科学財団。
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



