Summary
Denne artikkelen gir en effektiv og mulig måte for å konstruere flerlags stamcelleforskningen ark med gunstige stamcelleforskningen eiendom.
Abstract
Stilk cellen terapi viser en lovende fremtid regenererer skadet orgel og vev, og cellen ark teknikken har blitt utviklet for å forbedre lav celle oppbevaring og dårlig overlevelse innenfor målsonen. Men under byggeprosessen i vitro en løsning for å opprettholde stilk cellen bioactivity og øke celle i cellen arket er et presserende behov. Her gir denne protokollen en metode for å konstruere et flerlags celle ark med gunstige stilk cellen bioactivity og optimal brukbarhet. Decellularized svin pericardium (DPP) er utarbeidet av fosfolipase2 (PLA2) decellularization metode som cellen ark stillaset, og rotta benmarg mesenchymal stamceller (BMSCs) er isolert og utvidet som seeded cellene. Midlertidig flerlags ark cellestrukturen er konstruert ved hjelp av RAD16-jeg peptid hydrogel. Endelig celle arket er kultivert med en dynamisk perfusjon å stabilisere tredimensjonale (3D) strukturen, og cellen arket kan hentes etter en 48-timers kultur i vitro. Denne protokollen gir en effektiv og mulig metode for å konstruere et flerlags stamcelleforskningen ark, og cellen arket kunne utvikles som gunstige stilk cellen terapi produkt i fremtiden.
Introduction
Stilk cellen terapi har blitt rapportert som en effektiv behandling for mange sykdommer; lav celle oppbevaring og dårlig overlevelse innenfor målsonen beholdes imidlertid kritiske problemer etter tradisjonelle stamcelleforskningen injeksjon. For å løse dette problemet, utviklet vev engineering forskere celle ark teknikken. Et monolayered celle ark med intakt ekstracellulær matrix ble først utarbeidet ved hjelp av temperatur-svar kultur parabol1, og dens oppfølgingsstudier rapportert betydelige forbedringer av stilk cellen bevaring og overlevelse i den infarcted området2,3. Blant metodene, har konstruere flerlags celle arket blitt rapportert som en effektiv strategi for å forbedre celle overlevelse og celle ark terapeutisk effekt3,4. Siden da har forskere jobbet med å utvikle ulike celle ark konstruksjonsmetoder for å øke celle beløpet, Stamcelle eiendom og mekanisk-egenskapen for cellen arkene. Så langt, visse typer celle ark er konstruert og studerte i behandlingen av hjerteinfarkt5, brusk skade6, og huden sår7.
Bioactivity av stamceller før transplantasjon viste en voksende innflytelse på skadet vev gjenfødelse, og ulike celle ark bygging strategier har ulike effekter på stamceller. På den ene siden confluent celle ark bare besto av høy tetthet stamceller og naturlig ekstracellulære matriser kan skaffes ved stabling monolayered celle ark8 eller magnetiske tissue engineering teknikker9. På den annen side, utviklet forskere ulike stillaser for å gi tilstrekkelig mekanisk styrke og støtte celle vekst10,11,12, som tillot en lav stamcelleforskningen seeding tetthet for å sikre ernæring Angi. Til tross for disse tilnærmingene imidlertid lav effektiv ernæring levering innen flerlags ark cellestrukturen et stort problem under bygging i vitro . Derfor er en effektiv og mulig celle ark bygging systemet raskt påkrevd.
Denne protokollen beskriver fremgangsmåten for å forberede en multilayeredmesenchymal stilk cellen (MSC) cellen ark. I dette bygging systemet, er celle ark mekanisk styrke levert av en DPP. Basert på denne skafottet, 3D cellestrukturen raskt konstrueres med RAD16-jeg peptid hydrogel, og en dynamisk perfusjon system brukes til kultur flerlags celle arket, for å stabilisere ark for 3D cellestruktur og gi tilstrekkelig ernæring tilførsel til cellene. Bruke dette systemet, et flerlags BMSC ark var er forberedt og utstilt en optimal terapeutisk effekt på rotte hjerteinfarkt modell13.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle stilk cellen og dyr prosedyrer ble gjennomført i henhold til etiske retningslinjer for nasjonale og bruk av forsøksdyr og godkjent av Jinan University Animal Care og bruk Committee (Kroatia).
1. utarbeidelse av DPP stillaset med PLA2 Decellularization metode14
Merk: Se figur 1A for en skjematisk av metoden PLA2 decellularization.
- Forberede 100 mL 200 U/mL PLA2 løsning. Legge til 0,5 g av natrium deoxycholate og 2 mL av PLA2 i 198 mL karbonat buffer løsning. Denne løsningen bør brukes innen 24 timer etter sin forberedelse.
- Skaffe frisk svin pericardium (FPP) fra slakteri og gå tilbake til laboratoriet i 1 time.
Merk: FPP bør lagres på 4 ° C under transport. Trinn 1.2-1.10 bør utføres med kontinuerlig risting i en termostat-kontrollerte vannbad. - Grundig vask FPP med 200 mL fosfat buffer løsning (PBS) som inneholder 1% penicillin-streptomycin i et 500 mL beaker 10 ° Cfor 10 min. Gjenta dette trinnet 2 x.
- Delt FPP i to lag og fjerne fettvev med tang og saks.
Merk: Holde FPP våt ved å legge til 50 mL av PBS hvert 20 min under fjerning av fettvev. - Form FPP til 10 x 10 cm2 stykker med saks. Vask FPP med 200 mL karbonat buffer løsning (CBS) som inneholder 1% penicillin-streptomycin i et 500 mL beaker på 10 ° C for 10 min. Gjenta dette trinnet 2 x.
- Overføre FPP til rent vann og suge den på 10° C i 12 h.
- Nyt 10 x 10 cm2 prøvene i 50 mL av CBS som inneholder 200 U/mL PLA2 og 0,5% (w/v) natrium deoxycholate løsning på 37 ° C 6t.
- Vask prøvene med CBS som inneholder 1% penicillin-streptomycin på 10 ° C i 10 min. Gjenta dette trinnet 2 x.
- Suge hver prøve i 50 mL av CBS som inneholder 200 U/mL PLA2 og 0,5% (w/v) natrium deoxycholate løsning på 37 ° C i 2 timer.
- Vask prøvene med CBS som inneholder 1% penicillin-streptomycin på 10 ° C i 2 h. Gjenta dette trinnet for 10 x minst. Plasser prøvene på flat plater og tørkes konstant vekt i en konstant temperatur ovn ved 55 ° C.
Merk: Utvalget må være helt tørt. Veie DPP prøven hvert 10 min og gjenta det 3 x eller til vekten ikke lenger endres. - Form hver DPP prøve til en 10,5 mm-diameter sirkel med en trephine. Pakke hver DPP i et sterilt forseglet bag.
- Sterilisere DPP prøvene av gamma bestråling (25 kGy). Lagret DPP prøvene på 4 ° C før bruk.
Merk: Alle prøver kan lagres i opptil seks måneder på 4 ° C.
2. forberedelser for cellen ark konstruksjon
- Autoclave alle instrumenter og vev carrier komponenter ved 121 ° C for 30 min, inkludert 1,5 mL sentrifugal rør, tang, toothed tang, saks, svart baser (vev carrier komponent) og hvit spenning ringer (vev carrier komponent).
- Forberede 20 mL bakterie-fri 10% sucrose løsning. Vekt 2 g av sukrose og oppløse sukrose i 18 mL ultrapure vann. Autoclave 10% sukrose løsningen ved 121 ° C i 30 minutter eller filter løsningen med filtere 0.22 µm.
- Autoclave dynamisk perfusjon systemenheter 121 ° c i 30 min, inkludert en gass bytte utstyr, en 500 mL glassflaske, en perfusjonsmåling kultur beholder og connective rørene.
- Forberede autoklaveres instrumenter og vev carrier komponenter. Sette den svarte base delen av vev holderen i en kultur parabol.
- Plukke opp en tørket DPP stillaset og putte den i midten av en svart base. Sett en hvit spenning ring på DPP skafottet og fikse det i vev holderen.
Merk: Kontroller stillaset er helt fast vev holderen og det er ingen gapet mellom svart base og hvite spenning ringen. Hvis ikke, separate vev holderen og fastsette stillaset atter. - Legg 100 µL av kultur medium på DPP skafottet for utvanning.
Merk: Hvis stillaset ikke er løst i vev holderen, kultur medium infiltrere kultur parabolen. - Stillaset inn en 37 ° C inkubator og la den suge i 15 min.
3. forberedelse av cellene til cellen ark konstruksjon
Merk: Denne protokollen er cellekultur med en 100 mm rett. Se figur 1B for en skjematisk av byggingen av flerlags cellestrukturen.
- Isolere BMSCs13.
Merk: Denne metoden er utformet for å konstruere et flerlags MSC celle ark. Rat BMSCs brukes i denne protokollen. BMSCs er isolert med metoden hele benmarg tilhenger av BMSCs er utvidet i vitro å få nok celle beløpet.- Autoclave instrumentene på 121 ° C for 30 min, inkludert tang, toothed tang og saks. Forberede en 2 mL injeksjon sprøyte og BMSC kultur medium (Dulbeccos endret Eagle's medium [DMEM], 10% fosterets bovin serum, 1% glutamin og 1% penicillin-streptomycin).
- Euthanize tre uke gamle hannrotter-Sprague-Dawley (SD) av cervical vertebra forvridning. Suge dyret i 100 mL 75% alkohol-løsning i et beaker i 5 min.
- Ta dyret av begeret og plasser den utsatt på operasjonsbordet. Incise huden på baksiden av dyr med saks og tang. Isolere hud og muskel vev for å avsløre femurs låret.
- Isolere lår femurs og putte den i 30 mL PBS i et 50 mL sentrifuge rør. Plass to lår femurs i en tube. Vortex sentrifuge røret til vask vevet. Gjenta dette trinnet 2 x.
- Skjær begge ender av femurs med saks og utsette margtransplantasjon hulrom.
- Sug opp 2 mL BMSC kultur medium med en injeksjon sprøyte. Sette inn nålen inn i margtransplantasjon hulrommet og skylle ut benmargen med kultur medium. Tømme ut hver to lår femurs i en 100 mm kultur parabol.
- For hver 100 mm kultur parabol, legge 2 mL kultur medium i kultur parabolen. Sette kultur parabol i 37 ° C inkubatoren og statisk kultur 72 h.
- Ta ut kultur parabol settefiskanlegg. Erstatt nedbryting med 6 mL av fersk kultur medium.
- Observere primære BMSCs under et mikroskop. Denne passasje av BMSCs hver 5-7 d.
- Ta cellene av inkubator. Observere cellene under et mikroskop og Velg passende celler for celle ark konstruksjon. Når BMSCs når 80-90% samløpet, kan cellene bli valgt seeded cellene.
- Fjern kultur medium fra kultur parabolen. Forsiktig vaske cellene med 2 mL av varm PBS. Fjerne alle PBS fra kultur parabol og gjør sikkert ikke flytende restene. Legg 2 mL 0,25% trypsin (eller en annen dissociating løsning) til retten og ruge ved 37 ° C i 3 minutter.
- Stopp trypsin effekten ved å legge til 2 mL kultur medium, og forsiktig vaske cellene fra parabolen. Overføre celle suspensjon i en ny 15 mL sentrifuge tube. Centrifugate cellene på 225 x g i 5 min.
- Fjerne nedbryting. Resuspend cellene med 3 mL 10% (w/v) sucrose løsning.
Merk: 10% (w/v) sucrose løsning til å vaske cellene for å få en enhetlig celle-hydrogel blanding i fremgangsmåten. - Sug opp 10 µL av cellen suspensjon og antall cellen med en hemocytometer. Beregne volumet trengs for neste trinn. Én celle ark brukes tre millioner BMSCs.
- Ekstra tre millioner celler og overføre dem til en ny 15 mL sentrifuge tube. Sentrifuge cellene på 225 x g i 5 min.
- Fjerne nedbryting. Resuspend cellene med 1 mL av 10% (w/v) sucrose løsning. Overføre celle suspensjon i en 1,5 mL sentrifuge rør.
NOTE Bruker en sentrifugal 1,5 mL-tube er gunstig for å forberede celle-hydrogel blandingen. - Sentrifuge cellene på 260 xg for 5 min. fjerne nedbryting og få celle sediment.
4. forberedelse av BMSCs og RAD16-jeg peptid Hydrogel blanding
Merk: Se figur 1B for en skjematisk av byggingen av flerlags cellestrukturen.
- Legge til 20 µL av 10% (w/v) sucrose løsning til 1,5 mL sentrifugal røret. Forsiktig resuspend BMSCs og få en ensartet suspensjon.
Merk: Ikke generere bobler under rørets. - Legge til 20 µL av RAD16-jeg peptid hydrogel øverst i suspensjon. Forsiktig røre i RAD16-jeg peptid og celle suspensjon med Pipetter spissen. Når de celle suspensjon og hydrogel sammen, Pipetter forsiktig blandingen et par ganger.
- Ta ut DPP stillaset fra vev holderen og forsiktig Sug opp kultur medium med Pipetter tips.
Merk: Kontroller DPP stillaset er fullt utvannet før du legger til celle-hydrogel blandingen. - Sug opp blandingen og jevnt legge den til DPP stillaset.
Merk: Det totale volumet av blandingen ville være om 40-50 µL. Det anbefales å legge til blandingen 10 µL samtidig fra midten på utsiden av stillaset. - Legg 1 mL av kultur medium til bunnen av vev holderen. Sett celle arket i 37 ° C inkubator for 5 min.
- Ta ut celle arket settefiskanlegg. Forsiktig legge 4 mL kultur medium i kultur parabol og fordype celle arket. Sett celle arket i 37 ° C inkubator for 2t statisk kultur.
5. in Vitro kultur av 3D flerlags celle arket bruker dynamiske System
Merk: Se figur 1 c for en skjematisk av 3D dynamisk system.
- Forberede dynamisk perfusjon systemet, inkludert en peristaltiske pumpe, gass exchange utstyr, en 500 mL glassflaske, en perfusjonsmåling kultur beholder og connective rørene. Samle dynamisk perfusjon systemet som vist i figur 2.
- Legge til 200 mL kultur medium sterilt glassflaske. Sett inn celle arket i chamber of beholderen kultur.
Merk: Vær oppmerksom på retningen på den øvre overflaten av cellen arket. - Legge 3 mL kultur medium i beholderen vev og Lukk beholderen. Sette dynamisk perfusjon systemet i kuvøse og starte pumpen. Angi inntakets peristaltiske pumpen på 8 mL/min. kultur celle arket i dynamiske perfusjon systemet for 48 timer.
6. å få flerlags MSC celle arket
- Autoclave instrumentene og vev carrier komponenter ved 121 ° C i 30 min, inkludert 1,5 mL sentrifugal rør, tang og tenner tang.
- Trekk ut inngangsrør fra glassflaske å stoppe tilførselen av kultur medium beholderen.
Merk: Stopp peristaltiske pumpen når beholderen kultur er tom. - Ta ut celle arket fra kultur beholderen og legg den i en kultur parabol.
- Bruk en tang nakkens vev holderen og bruke en annen toothed tang skille hvit spenning ringen fra svart base. Endelig få flerlags BMSCs celle arket.
- For kort bevaring, kan hver celle ark overføres til en 1,5 mL sentrifugal tube med tang. DPP stillaset skal knyttes til den indre veggen av sentrifugal rør, og cellen arket bør spredt ut så mye som mulig i sentrifuge røret.
- Forsiktig legge 1 mL av kultur medium i sentrifugalpumper røret å fordype celle arket. Lukk lokket av sentrifugal røret og lagre celle arket på 4 ° C.
Merk: Cellen arket bør transplantert eller analysert så snart som mulig. Det anbefales å bruke celle arket innen 4 timer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Skjematisk av flerlags stamcelleforskningen ark konstruksjonen er vist i figur 1. Forbereder celle ark stillaset av PLA2 decellularization metoden er første skritt. Basert på skafottet, er en midlertidig 3D celle-struktur konstruert ved å blande stamceller med RAD16-1 peptid hydrogel. For å få et flerlags celle ark med gunstige stilk cellen bioactivity og optimal mekanisk styrke, er celle arket kultivert i et dynamisk perfusjon system. Under dynamisk ernæring levering, stamceller er tillatt å spre og etablere celle kontakter i flerlags celle arket, og siste stabile flerlags celle ark produktet kan oppnås etter en ~ 24-72-timers dyrking.
I dette tilfellet celle ark stillas DPP er utarbeidet av metoden PLA2 decellularization. Utseendet på tørket DPP er flat, jevn og delvis gjennomsiktig (figur 3A). Bestemt lyse effekten av PLA2, heterogene cellene kan fjernes helt mens ultrastructure av naturlige kollagen i DPP stillaset er godt bevart (figur 3B), og dette er viktig for å opprettholde den mekanisk styrke og biokompatibilitet av stillaset. I tillegg kan stillasene bli endret som en vekstfaktor kontrollsystem løslate å støtte stammen cellevekst og forbedre i vivo gjenfødelse13.
Når stamceller når ~ 80-90% samløpet, cellene er isolert fra kultur parabol og vasket med en 10% sukrose løsning. Etter sentrifugering, cellene er blandet med RAD16-jeg peptid hydrogel og lagt til utvannet DPP stillaset. En midlertidig flerlags struktur er dannet etter en to-timers statisk kultur. Til slutt, flerlags BMSC ark produktet (Figur 4) er ervervet etter en 48-timers kultur i dynamiske perfusjon systemet. Med støtte fra DPP skafottet, celle arket kan lett manipuleres med tang og det kan bli midlertidig bevart i kultur medium i 1,5 mL tube på 4 ° C i 4 timer før eksamen eller transplantasjon (Figur 4). Immunofluorescence flekker resultatet viser, er BMSCs svært positivt for stamcelleforskningen markørene CD90 og CD29. Etter celle ark, BMSCs innen flerlags celle ark viser høye nivåer av CD29 og CD90 (figur 5).

Figur 1 : Flytskjemaet for å bygge flerlags stamcelleforskningen arket. (A) ved hjelp av metoden PLA2 decellularized, heterogene cellene i FPP er ødelagt mens de naturlige ekstracellulære matriser er godt bevart i DPP stillaset. (B) basert på DPP skafottet, midlertidige flerlags cellestrukturen er konstruert ved å blande stamceller Self montering peptid hydrogel. (C) å følge, celle arket er kultivert i et 3D dynamisk system og stamceller er forventet å spre og etablere celle kontakter under dynamisk ernæring levering. Klikk her for å se en større versjon av dette tallet.

Figur 2 : Vev holderen og dynamisk perfusjon systemet. (A) dette panelet viser 13 mm-diameter vev transportør. (B) dette panelet viser samlingen av dynamiske perfusjon. Klikk her for å se en større versjon av dette tallet.
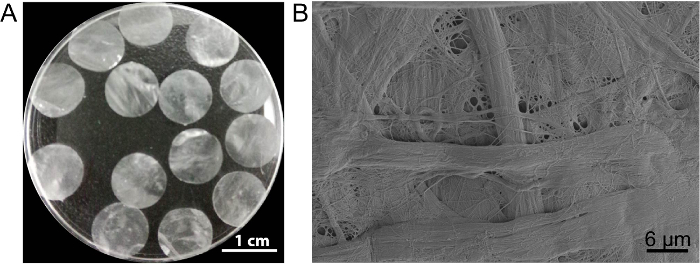
Figur 3 : Utseendet og ultrastructure av DPP. (A) dette panelet viser utseendet på 10,5 mm-diameter DPP stillasene. (B) dette panelet viser et representativt bilde av scanning elektron mikroskop (SEM) resultatet av DPP stillaset. Klikk her for å se en større versjon av dette tallet.
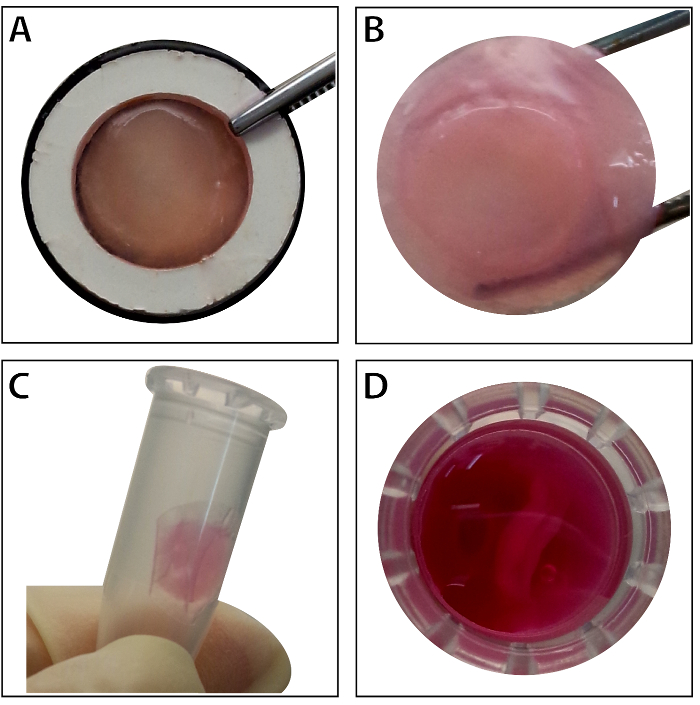
Figur 4 : Utseendet på flerlags BMSC arket. (A) dette panelet viser utseendet på flerlags BMSC ark i vev holderen. (B) holdes intakt flerlags BMSC arket av tang. (C - D) Flerlags celle arket kan lagres midlertidig i 1,5 mL tube før bruk. Klikk her for å se en større versjon av dette tallet.
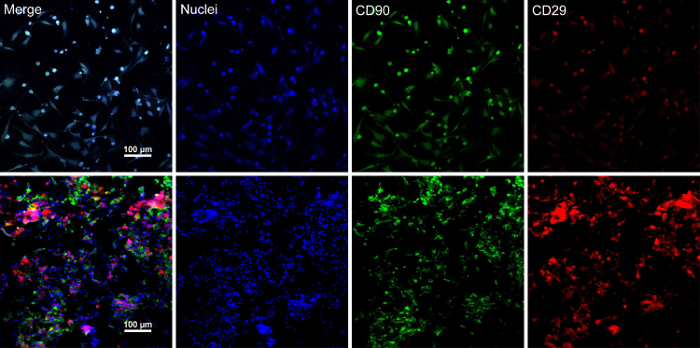
Figur 5 : Immunofluorescence fargeresultatene BMSC markører uttrykksformer. (A) dette panelet viser immunofluorescence fargeresultatene av BMSCs før celle ark konstruksjon. (B) dette panelet viser immunofluorescence fargeresultatene flerlags BMSC ark avsnitt. CD90 (grønn) og CD29 (rød) ble positivt uttrykt i BMSCs og celle arket. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Nåværende protokollen rapporterer en effektiv metode for å lage en flerlags MSC ark. Denne cellen ark utstillinger optimal mekanisk styrke, høyt seeding tetthet og gunstige stamcelleforskningen bioactivity. Bruker BMSCs som et eksempel, 3D cellestrukturen er raskt konstruert med RAD16-jeg peptid hydrogel. Etter blir kultivert i dynamiske perfusjon systemet, flerlags BMSC arket er med hell fått og BMSCs opprettholde en høy uttrykk for stamcelleforskningen markører.
Opprette midlertidige flerlags cellestrukturen er det kritiske trinnet av protokollen. RAD16-jeg er en kommersiell hydrogel peptid og består av 1% aminosyre og 99% vann. Flere studier rapportert at denne peptid hydrogel kan etterligne ECM naturen og er gunstig for stamcelleforskningen spredning og overlevelse15,16,17. I stede protokollen, en tre millioner MSC suspensjon (i 20 µL av 10% sucrose løsning) ble blandet med 20 µL av RAD16-jeg peptid hydrogel. Volumforholdet celle suspensjon og peptid-hydrogel var 1:1. Denne peptid hydrogel er følsom for miljømessige pH-verdi, og peptid molekylene ville automatisk formen 3D nettverket når pH-verdi endres fra syre til nøytral. Fordi celleoverflaten inneholder ladede partikler, endret celle blandingen fra væske til hydrogel på kort tid, som har innflytelse med blanding av cellene. En gunstig celle-hydrogel bør være en selv blanding av cellen suspensjon og peptid-hydrogel og gjør celle blandingen legges jevnt på skafottet. Forskerne kan optimalisere blanding tilstanden ved å endre seeded celle nummer, sukrose løsning volum og peptid hydrogel volumet etter deres faktiske behov. Det er verdt å merke at vaske cellene med 10% sucrose løsning og jevnt miksing celle-hydrogel blandingen er viktige skritt å protokollen og en ujevn blanding kan forårsake stor celle tap og en ustabil midlertidig flerlags struktur.
Etter tilføyer celle-hydrogel blandingen på DPP skafottet, er mekanisk styrke flerlags ark cellestrukturen svak fordi peptid hydrogel nettverket ikke er sterk nok til å opprettholde langsiktige flerlags cellestrukturen, og celle tilkoblinger og ECM sekreter er nødvendig å styrke stabiliteten i cellen arket. Videre kan dynamisk infiltrasjon av kultur medium rette stamceller å spre og etablere celle kontakter i flerlags cellestrukturen, mens en utilstrekkelig ernæring supply vil føre til celle apoptose og redusere celle tetthet cellen ark13. Dynamisk perfusjon systemet er derfor viktig for stabilisere flerlags ark cellestrukturen. I tillegg bør den aktuelle strømningshastighet på kultur medium justeres i henhold bestemt stamcelleforskningen type og celle seeding tetthet. Også fortsatt svake mekanisk forbindelsen mellom DPP stillaset og flerlags cellestrukturen begrensning av nåværende byggingen metode, som kan forårsake delingen av flerlags celle lag og stillaset. Derfor er videre studier nødvendig å styrke mekaniske biokompatibilitet av 3D hydrogel stillaset og DPP stillaset.
Så langt, har vev engineering forskere hatt fokus på å etablere effektive ernæring forsyning systemer i vitro, som coculturing endothelial celler18 og bruker en porøs stillaset19. Imidlertid ernæring permeabilitet i 3D strukturen er lav i tradisjonelle statisk 3D kultur-systemet, og stamcelleforskningen levedyktigheten vil bli påvirket. I dette tilfellet kan bruker dynamiske perfusjon system gi nok ernæring forsyning å opprettholde stamcelleforskningen levedyktighet. Et flerlags BMSC ark, som bruker denne protokollen, forbedret hjertefunksjon og angiogenese i en rotte hjerteinfarkt modell13. Konstruere en stilk cellen ark produkt med en høyt belastning og gunstige stamcelleforskningen eiendom er viktig å vev gjenfødelse. Bruker denne effektiv konstruert metoden, kan ulike typer flerlags stamcelleforskningen ark være konstruert ved å endre hvilke seeded stilk cellen som epithelial stamcelleforskningen ark, nevrale stamceller ark eller hjerte stamcelleforskningen ark. Videre undersøkelser av og alternativer til flerlags stamcelleforskningen arket forventes å utvide programmer for flere vev gjenfødelse.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Dette arbeidet ble støttet av National Natural Science Foundation of China (bevilgning nummer 31771064); Vitenskap og teknologi planlegging prosjektet av Guangdongprovinsen (grant tall 2013B010404030, 2014A010105029 og 2016A020214012); Vitenskap og teknologi planlegging prosjektet Guangzhou (bevilgning nummer 201607010063); og undervisning innovasjon og entreprenørskap treningsprogram (bevilgning nummer 201610559028); National Science Foundation for unge forskere i Kina (gi nummer 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



