Summary
Dit artikel biedt een efficiënt en haalbaar methode voor de opbouw van meerdere lagen stamcel bladen met de cel van de stam van de gunstige eigenschap.
Abstract
Stamcel therapie toont een veelbelovende toekomst in het regenereren van de benadeelde orgel en weefsels, en de cel blad techniek is ontwikkeld ter verbetering van het lage cel retentie en de overleving van de arme binnen de doelzone. Echter tijdens het bouwproces in vitro , is een oplossing voor het behoud van de stamcel topicale en verhoging van het bedrag van de cel binnen de cellaag dringend nodig. Dit protocol presenteert hier een methode voor de bouw van een meerdere lagen cellaag met gunstige stamcel topicale en optimale bruikbaarheid. Decellularized varkens hartzakje (DPP) wordt bereid door fosfolipase een methode decellularization2 (PLA2) als de cel blad steiger en rat beenmerg mesenchymale stamcellen (BMSCs) zijn geïsoleerd en uitgebreid als de geplaatste cellen. De tijdelijke meerdere lagen blad celstructuur is gebouwd met behulp van RAD16-ik peptide hydrogel. Tot slot, de cellaag is gekweekt met een dynamische perfusie-systeem te stabiliseren van de driedimensionale (3D) structuur en de cellaag kon worden verkregen na een 48-urige cultuur in vitro. Dit protocol biedt een efficiënt en haalbaar methode voor de bouw van een vel met meerdere lagen cel van de stam en het blad van de cel kan worden ontwikkeld als een gunstige stamcel therapie product in de toekomst.
Introduction
Stamcel therapie werd gerapporteerd als een effectieve behandeling voor vele ziekten; lage cel retentie en arme overleven binnen de doelzone blijven echter kritieke problemen na injectie van de traditionele cel van de stam. U kunt dit probleem oplossen, ontwikkeld weefsel engineering wetenschappers de cel blad techniek. Een monolayered cellaag met intact extracellulaire matrix bereid was om te beginnen met behulp van de temperatuur-respons cultuur schotel1, en haar follow-up studies rapporteerde de significante verbeteringen van de stamcel retentie en overleven in de infarcted gebied2,3. Onder de werd bouw van de meerdere lagen cellaag gerapporteerd als een doeltreffende strategie ter verbetering van de overleving van de cel en de cel blad therapeutisch effect3,4. Sindsdien hebben wetenschappers gewerkt aan andere cel blad bouwmethoden te ontwikkelen teneinde het bedrag van de cel, stamcel eigenschap en mechanische eigenschap van de bladen van de cel. Tot nu toe, bepaalde soorten cellaag zijn gebouwd en studeerde bij de behandeling van myocardinfarct5,6van de schade van kraakbeen, en huid wond7.
De topicale van stamcellen voor transplantatie toonde een opkomende invloed op benadeelde Weefselregeneratie en andere cel blad bouw strategieën hebben verschillende effecten op de cellen van de stam. Aan de ene kant confluente cel bladen alleen bestond uit high-density stamcellen en natuurlijke extracellulaire matrices kunnen worden verworven door stapelen monolayered cel bladen8 of met behulp van magnetische weefsel engineering technieken9. Aan de andere kant, ontwikkelde onderzoekers verschillende steigers voldoende mechanische sterkte te en te ondersteunen cel groei10,11,12, waardoor een laag stamcel dichtheid om ervoor te zorgen de voeding zaaien aanbod. Echter, ondanks deze benaderingen, de lage efficiënte voeding levering binnen de meerdere lagen celstructuur blad blijft een groot probleem tijdens de bouw in vitro . Dus is een bouwsysteem van efficiënt en haalbaar cel blad dringend noodzakelijk.
Dit protocol beschrijft de stappen ter voorbereiding van de cellaag van een multilayeredmesenchymal-cel van de stam (MSC). In dit bouwsysteem, wordt het blad van de mechanische sterkte van cel verzorgd door een DPP. Op basis van deze steiger, de 3D celstructuur kan worden snel geconstrueerd met RAD16-ik peptide hydrogel, en een dynamische perfusie-systeem wordt gebruikt voor de cultuur van de meerdere lagen cellaag, om te stabiliseren van de 3D blad celstructuur en voldoende voeding aanbod voor de cellen. Met behulp van dit systeem, een meerdere lagen BMSC blad met succes werd voorbereid en een optimaal therapeutisch effect op de rat myocardiaal infarct model13tentoongesteld.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle stamcel en dierlijke experiment procedures werden uitgevoerd volgens de ethische richtsnoeren voor de nationale gids voor de verzorging en het gebruik van proefdieren en goedgekeurd door het Jinan Universiteit Animal Care en gebruik Comité (Guangzhou, China).
1. bereiding van de DPP steiger met de PLA2 Decellularization methode14
Opmerking: Zie figuur 1A voor een schematische voorstelling van de PLA-2 decellularization-methode.
- 100 mL 200 U/mL PLA2 oplossing voor te bereiden. Voeg 0,5 g natrium deoxycholate en 2 mL PLA2 in 198 mL van de bufferoplossing carbonaat. Deze oplossing moet binnen 24 uur na de bereiding worden gebruikt.
- De verse varkens hartzakje (FPP) verkrijgen bij het slachthuis en terug te keren naar het laboratorium binnen 1 uur.
Opmerking: De FPP moet worden bewaard bij 4 ° C tijdens het vervoer. 1.2-1.10 stappen moeten worden uitgevoerd met continue schudden in een waterbad met thermostaat-gecontroleerde. - Grondig wassen de FPP met 200 mL fosfaatbuffer (PBS) met 1% penicilline-streptomycine in een bekerglas van 500 mL op 10 ° Cfor 10 min. Herhaal deze stap 2 x.
- De FPP gesplitst in twee lagen en verwijderen van het vetweefsel met Tang en schaar.
Opmerking: Houd de FPP NAT door toevoeging van 50 mL PBS iedere 20 minuten tijdens het verwijderen van het vetweefsel. - Vorm de FPP in 10 x 10 cm2 stukken met een schaar. De FPP met 200 mL van de bufferoplossing carbonaat (CBS) met 1% penicilline-streptomycine in een bekerglas van 500 mL op 10 ° C voor 10 min. Herhaal deze stap 2 x wassen.
- De FPP overbrengen in zuiver water en geniet het bij 10° C gedurende 12 h.
- Geniet van de 10 x 10 cm2 monsters in 50 mL CBS met 200 U/mL PLA2 en 0,5% (w/v) natrium deoxycholate oplossing bij 37 ° C gedurende 6 uur.
- Wassen van de monsters met CBS met 1% penicilline-streptomycine bij 10 ° C gedurende 10 min. Herhaal deze stap 2 x.
- Geniet van elk monster in 50 mL CBS met 200 U/mL PLA2 en 0,5% (w/v) natrium deoxycholate oplossing bij 37 ° C gedurende 2 uur.
- Wassen de monsters met CBS met 1% penicilline-streptomycine bij 10 ° C gedurende 2 h. Herhaal deze stap voor 10 x ten minste. Leg de monsters op vlakke platen en droog ze tot constant gewicht in een constante temperatuur oven op 55 ° C.
Opmerking: Het monster moet volledig worden gedroogd. Weeg het DPP monster elke 10 min en herhaal dat 3 x of totdat het gewicht niet meer verandert. - Elk monster DPP vorm in een cirkel met diameter van 10.5 mm met een trephine. Pak elk DPP in een steriele verzegelde zak.
- Steriliseren de DPP monsters door gamma bestraling (25 kGy). De DPP monsters bij 4 ° C vóór gebruik opgeslagen.
Opmerking: Alle monsters kunnen worden opgeslagen voor maximaal zes maanden bij 4 ° C.
2. voorbereiding van de cel blad bouw
- Autoclaaf alle instrumenten en weefsel vervoerder onderdelen bij 121 ° C voor 30 min, met inbegrip van 1,5 mL centrifugaal buizen, pincet, pincet, schaar, getande zwarte basen (onderdeel van de drager van de weefsel) en witte spanning ringen (onderdeel van de drager van de weefsel).
- 20 mL 10% sacharoseoplossing kiem-vrije voor te bereiden. Gewicht 2 g van sacharose en los van de sucrose in 18 mL ultrazuiver water. Autoclaaf de 10% sacharoseoplossing bij 121 ° C gedurende 30 minuten of filter de oplossing met een 0,22 µm filter.
- Autoclaaf de dynamische perfusie systeemapparaten bij 121 ° C gedurende 30 minuten, met inbegrip van een gas uitwisseling van apparatuur, een 500 mL glazen fles, een perfusie cultuur container en het bindweefsel buizen.
- Bereiden de gesteriliseerde met autoclaaf instrumenten en weefsel vervoerder onderdelen. De zwarte basisartikel van de drager van weefsel in een cultuur schotel plaatsen
- Pak een gedroogde DPP-steiger en zet het in het midden van de zwarte basis. Een ring van wit spanning zetten de DPP-steiger en repareren in de drager van weefsel.
Opmerking: Zorg ervoor de steiger is helemaal vast in het weefsel drager en er is geen kloof tussen de zwarte basis en de spanning van de witte ring. Als dat niet het geval is, scheiden de vervoerder weefsel en monteren van de steiger weer. - Voeg 100 µL cultuurmedium op het schavot DPP voor rehydratie.
Opmerking: Indien het schavot niet goed in het weefsel drager is vastgesteld, zal het kweekmedium infiltreren de cultuur schotel. - Het schavot gebracht een incubator 37 ° C en laat ze weken 15 min.
3. voorbereiding van de cellen van de cel blad bouw
Opmerking: Dit protocol is voor de cultuur van de cel met behulp van een schotel van 100 mm. Zie figuur 1B voor een schematische voorstelling van de bouw van de meerdere lagen celstructuur.
- BMSCs13te isoleren.
Opmerking: Deze methode is bedoeld voor de bouw van een meerdere lagen cellaag van MSC. BMSCs van de rat worden in dit protocol gebruikt. De BMSCs zijn geïsoleerd met behulp van de hele beenmerg aanhangend methode, en de BMSCs zijn uitgevouwen in vitro genoeg cel bedrag te verkrijgen.- Autoclaaf de instrumenten bij 121 ° C gedurende 30 minuten, inclusief pincet, getande Tang en schaar. Bereid een 2 mL injectiespuit en BMSC kweekmedium (Dulbecco van gewijzigd Eagle's medium [DMEM], foetale runderserum 10%, 1% glutamine en 1% penicilline-streptomycine).
- De drie weken oude mannelijke Sprague-Dawley (SD) ratten door cervicale wervel dislocatie euthanaseren. Geniet van het dier in 100 mL 75% alcohol oplossing in een bekerglas gedurende 5 minuten.
- Neem het dier uit het bekerglas en plaats het gevoelig op de operatie tafel. Incise de huid op de rug van het dier met een schaar en pincet. Isoleren van de huid en spier weefsels om de dij dijbeen bloot te stellen.
- Isoleren van de dij dijbeen en zet het in 30 mL PBS in een centrifugebuis 50 mL. Plaats twee dij dijbeen in één buis. Vortex de centrifugebuis te grondig wassen van het weefsel. Herhaal deze stap 2 x.
- Snijd beide uiteinden van het dijbeen met een schaar en bloot de holte van het beenmerg.
- 2 mL BMSC-kweekmedium gecombineerd met een injectiespuit. Plaats de naald in de holte van beenmerg en spoelen van het beenmerg met kweekmedium. Spoelen van elke twee dij dijbeen in één schotel van 100 mm cultuur.
- Voor elke 100 mm cultuur schotel, voeg toe 2 mL gestolde voedingsbodem in de cultuur-schotel. Zet de schotel van cultuur in de 37 ° C incubator en statische cultuur gedurende 72 uur.
- Neem de cultuur schotel uit de incubator. De bovendrijvende substantie vervangen door 6 mL verse kweekmedium.
- Primaire BMSCs onder een microscoop te observeren. Na dit, passage de BMSCs elke 5-7 d.
- Nemen de cellen uit de incubator. Observeren van de cellen onder een microscoop en kiezen van geschikte cellen voor cel blad bouw. Wanneer de BMSCs 80% - 90% samenvloeiing bereikt, kunnen de cellen als de geplaatste cellen worden gekozen.
- Verwijder het kweekmedium uit de cultuur-schotel. Voorzichtig wassen de cellen met 2 mL warme PBS. Verwijder alle PBS uit de cultuur-schotel en maak zeker niet vloeibaar blijft. Voeg 2 mL trypsine van 0,25% (of een andere dissociating oplossing) aan de schotel en Incubeer bij 37 ° C gedurende 3 minuten.
- Stop het trypsine effect door toevoeging van 2 mL gestolde voedingsbodem, en de cellen van de schotel voorzichtig te wassen. Breng de celsuspensie in een nieuwe centrifuge-tube van 15 mL. Centrifugate de cellen bij 225 x g gedurende 5 min.
- Verwijder het supernatant. Resuspendeer de cellen met 3 mL 10% (m/v) sacharoseoplossing.
Opmerking: 10% (m/v) sacharoseoplossing wordt gebruikt om te wassen van de cellen met het oog op een uniforme cel-hydrogel mengsel in de volgende stappen. - 10 µL van de celsuspensie gecombineerd en tellen van het aantal cellen met een hemocytometer. Berekenen van het volume die nodig zijn voor de volgende stap. Voor één cellaag, worden drie miljoen BMSCs gebruikt.
- Pak drie miljoen cellen en ze vervolgens overbrengen naar een nieuwe centrifuge-tube van 15 mL. Centrifugeer de cellen bij 225 x g gedurende 5 min.
- Verwijder het supernatant. Resuspendeer de cellen met 1 mL 10% (m/v) sacharoseoplossing. Breng de celsuspensie in een centrifugebuis 1,5 mL.
Opmerking: Met behulp van een centrifuge buis van 1,5 mL is gunstig voor het voorbereiden van het mengsel van cel-hydrogel. - De cellen op 260 xg centrifugeren voor 5 min. volledig verwijderen van het supernatant en verkrijgen van het sediment van de cel.
4. voorbereiding van de BMSCs en de RAD16-ik Peptide Hydrogel mengsel
Opmerking: Zie figuur 1B voor een schematische voorstelling van de bouw van de meerdere lagen celstructuur.
- 20 µL van 10% (m/v) sacharoseoplossing aan de centrifugaal tube van 1,5 mL toevoegen. Zachtjes resuspendeer de BMSCs en een uniforme suspensie te verkrijgen.
Opmerking: Tijdens de resuspensie geen bubbels genereren. - Voeg 20 µL van RAD16-ik peptide hydrogel aan de bovenkant van de schorsing. Roer voorzichtig de RAD16-ik peptide en cel ophanging met het uiteinde van de pipet. Wanneer de celsuspensie en hydrogel zijn vermengd, Pipetteer zacht het mengsel een paar keer.
- Neem de DPP-steiger uit het weefsel vervoerder en zachtjes gecombineerd het kweekmedium met een pipet tip.
Opmerking: Zorg ervoor is volledig gerehydrateerd de DPP-steiger alvorens de cel-hydrogel mengsel toe te voegen. - Het mengsel gecombineerd en gelijkmatig toe te voegen aan de DPP-steiger.
Opmerking: Het totale volume van het mengsel zou ongeveer 40-50 µL. Het is aanbevolen om het mengsel 10 µL per keer toevoegen vanuit het midden naar de buitenkant van de steiger. - Voeg 1 mL gestolde voedingsbodem aan de bodem van de drager van weefsel. Zet de cellaag in de incubator van de 37 ° C gedurende 5 minuten.
- Haal het vel van de cel uit de incubator. Zachtjes Voeg 4 mL gestolde voedingsbodem in de cultuur-schotel en dompel het blad van de cel. Zet de cellaag in de incubator van de 37 ° C gedurende 2 uur van statische cultuur.
5. in Vitro cultuur van een 3D meerdere lagen cellaag met behulp van een systeem van dynamische cultuur
Opmerking: Zie Figuur 1 c voor een schematische voorstelling van de 3D dynamische systeem.
- Het dynamische perfusie-systeem, inclusief een peristaltische pomp, gas uitwisseling apparatuur, een 500 mL glazen fles, een perfusie cultuur container en het bindweefsel buizen voor te bereiden. Monteer het dynamische perfusie-systeem zoals weergegeven in Figuur 2.
- Voeg 200 mL gestolde voedingsbodem aan de steriele fles. Plaats de cellaag in de kamer van de cultuur-container.
Opmerking: Let op de richting van de bovenkant van het blad van de cel. - Voeg 3 mL gestolde voedingsbodem in de container van de weefsels en sluiten van de container. Zet het dynamische perfusie-systeem in de incubator en start van de pomp. Het debiet van de peristaltische pomp vastgesteld op 8 mL/min. cultuur, wordt de cellaag in het dynamische perfusie-systeem gedurende 48 uur.
6. het verkrijgen van de cellaag van meerdere lagen MSC
- Autoclaaf de instrumenten en het weefsel vervoerder onderdelen bij 121 ° C gedurende 30 minuten, inclusief 1,5 mL centrifugaal buizen, pincet en getande pincet.
- Het input kanaal van de fles om te stoppen met de levering van kweekmedium aan de container uitlichten.
Opmerking: Stop de peristaltische pomp wanneer de cultuur-container leeg is. - Neem de cellaag van de cultuur-container en zet het in een cultuur schotel.
- Gebruik één verlostang om te immobiliseren van de vervoerder weefsel en gebruik een andere getande pincet te scheiden van de spanning van de witte ring van de zwarte basis. Ten slotte krijgen de meerdere lagen cellaag van de BMSCs.
- Voor korte behoud, kan elke cellaag worden overgedragen aan een centrifugaal tube van 1,5 mL met de pincet. De DPP-steiger moet worden gekoppeld aan de binnenwand van de centrifugaal buis, en de cellaag moet verspreid uit zo veel mogelijk in de centrifugebuis.
- Zachtjes toevoegen 1 mL gestolde voedingsbodem in de centrifuge buis om te dompelen de cellaag. Sluit de dop van de centrifugaal buis en slaan de cellaag bij 4 ° C.
Opmerking: De cellaag moet worden getransplanteerd of zo spoedig mogelijk geanalyseerd. Het is aanbevolen om gebruik van de cellaag binnen 4 uur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Het schema van de opbouw van meerdere lagen stamcel blad is afgebeeld in Figuur 1. Voorbereiding van de cel blad steiger door de PLA2 decellularization methode is de eerste stap. Gebaseerd op de steiger, is een tijdelijke 3D celstructuur gebouwd door het mengen van de cellen van de stam met de RAD16-1 peptide hydrogel. Het verkrijgen van een meerdere lagen cellaag met gunstige stamcel topicale en optimale mechanische sterkte, is de cellaag gekweekt in een dynamische perfusie-systeem. In het kader van het dynamische voeding aanbod, de stamcellen mogen cel contacten binnen de meerdere lagen cellaag te vermenigvuldigen, en de uiteindelijke stabiele meerdere lagen cel blad product kan worden verkregen na een ~ 24-tot en met 72-uur teelt.
In dit geval de cel blad steiger DPP wordt bereid door de PLA-2 decellularization-methode. De verschijning van gedroogde DPP is vlak, glad en semi-transparante (figuur 3A). Als gevolg van het effect van de specifieke lyse van PLA2, de heterogene cellen kunnen volledig worden verwijderd terwijl de ultrastructuur van de natuurlijke collageen binnen de DPP-steiger goed bewaard gebleven (figuur 3B is), en dit belangrijk voor het behoud van is de mechanische sterkte en biocompatibiliteit van de steiger. Bovendien kunnen de steigers worden gewijzigd als een groeifactor controle release systeem ter ondersteuning van de groei van de cel van de stam en verbeteren van het in vivo regeneratie13.
Wanneer de cellen van de stam ~ 80% - 90% samenvloeiing bereikt, de cellen worden geïsoleerd uit de cultuur-schotel en gewassen met een 10% sacharoseoplossing. Na het centrifugeren, de cellen worden gemengd met de RAD16-ik peptide hydrogel en toegevoegd aan de gerehydrateerd DPP-steiger. Een tijdelijke meerdere lagen structuur wordt gevormd na een twee uur durende statische cultuur. Tot slot, wordt het meerdere lagen BMSC blad product (Figuur 4) verworven na een 48-urige cultuur in het dynamische perfusie-systeem. Met de steun van de DPP-steiger, de cellaag gemakkelijk kan worden behandeld met een tang, en het kan worden tijdelijk in cultuur medium bewaard in de buis 1,5 mL bij 4 ° C voor 4 uur vóór onderzoek of transplantatie (Figuur 4). Als de immunofluorescentie kleuring resultaat laat zien, zijn de BMSCs zeer positief voor de markeringen van de stamcel CD90 en CD29. Na de cel blad bouw, de BMSCs binnen de meerdere lagen cel blad Toon hoge niveaus van CD29 en CD90 (Figuur 5).

Figuur 1 : Het stroomdiagram van de bouw van het blad meerdere lagen stamcel. (A) met behulp van de methode van de2 decellularized PLA, de heterogene cellen binnen de FPP worden vernietigd, terwijl de natuurlijke extracellulaire matrices goed bewaard gebleven in de DPP-steiger zijn. (B) gebaseerd op het schavot DPP, de tijdelijke meerdere lagen celstructuur is gebouwd door het mengen van de stamcellen en het zelf monteren van peptide hydrogel. (C) te volgen, de cellaag wordt gekweekt in een 3D dynamische systeem, en de cellen van de stam wordt verwacht dat vermenigvuldigen en contacten van de cel onder de dynamische voeding levering. Klik hier voor een grotere versie van dit cijfer.

Figuur 2 : De vervoerder weefsel en het systeem van dynamische perfusie. (A) dit paneel toont de 13 mm-diameter weefsel vervoerder. (B) dit paneel toont de vergadering van het dynamische perfusie-systeem. Klik hier voor een grotere versie van dit cijfer.
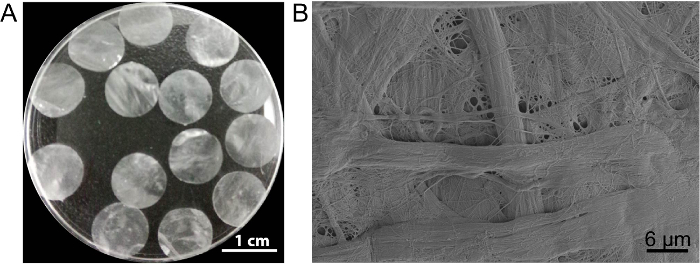
Figuur 3 : Het uiterlijk en de ultrastructuur van DPP. (A) dit paneel toont het uiterlijk van de 10.5 mm diameter DPP steigers. (B) dit paneel toont een representatief beeld van de scannende elektronen microscoop (SEM) resultaat van het DPP schavot. Klik hier voor een grotere versie van dit cijfer.
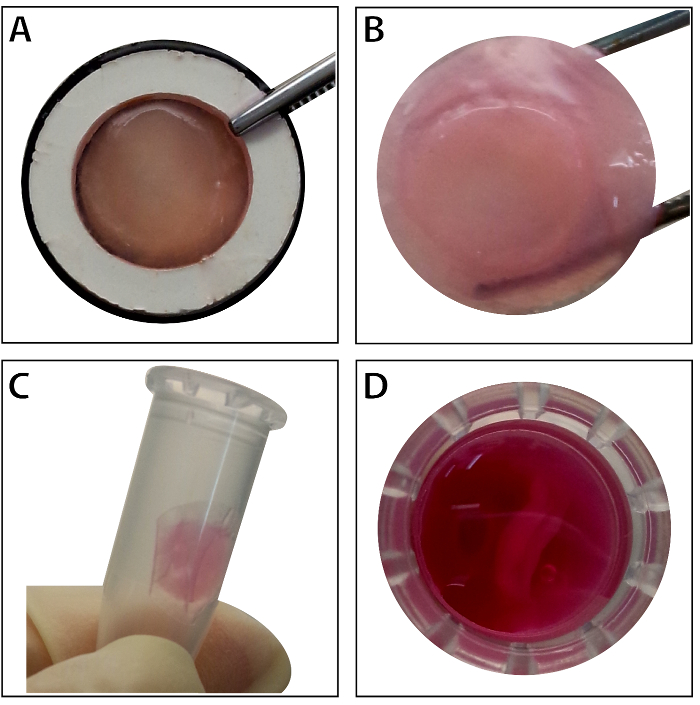
Figuur 4 : De verschijning van het blad dat meerdere lagen BMSC. (A) dit paneel toont het uiterlijk van de meerdere lagen BMSC blad binnen de vervoerder weefsel. (B) het intact meerdere lagen BMSC blad wordt gehouden door pincet. (C - D) De meerdere lagen cellaag kan tijdelijk worden bewaard in de buis 1,5 mL vóór gebruik. Klik hier voor een grotere versie van dit cijfer.
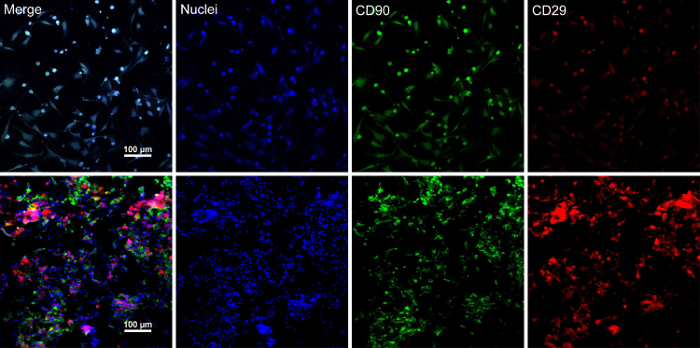
Figuur 5 : Immunofluorescentie kleuring van de resultaten van BMSC markeringen expressie. (A) dit paneel toont immunofluorescentie kleuring van de resultaten van BMSCs vóór cel blad bouw. (B) dit paneel toont immunofluorescentie kleuring van de resultaten van de meerdere lagen BMSC blad sectie. CD90 (groen) en CD29 (rood) werden positief uitgedrukt in de BMSCs en het blad van de cel. Klik hier voor een grotere versie van dit cijfer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dit protocol rapporteert een efficiënte methode voor de bouw van een meerdere lagen MSC blad. Deze cellaag vertoont optimale mechanische sterkte, hoge celdichtheid seeding en gunstige stamcel topicale. BMSCs als een voorbeeld gebruikt, is de 3D celstructuur snel gebouwd met RAD16-ik peptide hydrogel. Na wordt gekweekt in het dynamische perfusie-systeem, het meerdere lagen BMSC blad met succes wordt verkregen en de BMSCs handhaven een hoog expressie van markeringen in een cel van de stam.
Bouw van de tijdelijke meerdere lagen celstructuur is de kritische stap van het protocol. De RAD16-I is een commerciële hydrogel peptide, en het bestaat uit 1% aminozuur en 99% uit water. Verschillende studies gerapporteerd dat dit peptide hydrogel van het natuurlijke milieu van de ECM nabootsen kan en gunstig voor stamcel verspreiding en overleving15,16,17 is. In het huidige protocol, een drie miljoen MSC suspensie (in 20 µL van 10% sacharoseoplossing) werd gemengd met 20 µL van RAD16-ik peptide hydrogel. De volumeverhouding van de celsuspensie en de peptide hydrogel was 1:1. Dit peptide hydrogel is gevoelig voor het milieu pH-waarde, en de peptide-moleculen zouden automatisch het 3D netwerk vormen wanneer de pH-waarde van zuur tot neutraal verandert. Omdat het celoppervlak geladen deeltjes bevat, het mengsel van de cel gewijzigd van vloeistof in hydrogel in een korte tijd, die invloeden heeft het zelfs mengen van de cellen. Een gunstige cel-hydrogel moet een zelfs mengsel van de celsuspensie en de peptide hydrogel en maakt de cel mengsel gelijkmatig op de steiger worden toegevoegd. De onderzoekers kunnen de voorwaarde mengsel optimaliseren door een wijziging van de geplaatste celaantal, sacharose oplossing volume en het volume van de hydrogel peptide volgens hun werkelijke behoefte. Het is de moeite waard om op te merken dat de cellen met 10% sacharoseoplossing wassen en de cel-hydrogel mengsel gelijkmatig te mengen zijn de essentiële stappen van het protocol, en een ongelijke mengsel kan leiden tot grote cel verlies en een unstable tijdelijke meerdere lagen structuur.
Na het toevoegen van de cel-hydrogel mengsel op het schavot DPP, is de mechanische sterkte van de meerdere lagen celstructuur blad zwak, omdat het peptide hydrogel netwerk niet sterk genoeg is om de lange termijn meerdere lagen celstructuur gehandhaafd blijft, en cel verbindingen en ECM afscheidingen zijn nodig ter verbetering van de stabiliteit van de cellaag. Bovendien, de dynamische infiltratie van het kweekmedium kan het vergemakkelijken van de cellen van de stam om te vermenigvuldigen en cel contacten binnen de meerdere lagen celstructuur, terwijl een onvoldoende voeding aanbod zal cel apoptosis veroorzaken en verminderen van de celdichtheid blad13van de cel. De dynamische perfusie-systeem is daarom belangrijk voor de stabilisatie van de meerdere lagen celstructuur blad. Bovendien moet het juiste debiet van het kweekmedium worden aangepast volgens de specifieke cel van de stam cel zaaien dichtheid. Ook blijft de zwakke mechanische verbinding tussen de DPP-steiger en de meerdere lagen celstructuur de beperking van de huidige bouwmethode, die leiden de verdeling van de meerdere lagen cel lagen en het schavot tot kan. Dus zijn verdere studies nodig ter verbetering van de mechanische biocompatibiliteit van de 3D hydrogel steiger en de DPP-steiger.
Tot nu toe zijn weefsel engineering wetenschappers gericht op de totstandbrenging van efficiënte voeding levering systemen in vitro, zoals18 coculturing endotheliale cellen en het gebruik van een poreuze steiger19. Echter, de doorlaatbaarheid van de voeding in de 3D-structuur is laag in het traditionele statische 3D cultuur-systeem, en de levensvatbaarheid van de cellen van de stam zal sterk worden beïnvloed. In dit geval kan het gebruik van de dynamische perfusie-systeem bieden onvoldoende aanbod is voeding om de levensvatbaarheid van de cellen van de stam. Met behulp van dit protocol, verbeterd een meerdere lagen BMSC blad de hartfunctie en de angiogenese in een rat myocardiaal infarct model13. De bouw van een stamcel blad product met een hoge cel belasting en de cel van de stam van de gunstige eigenschap is belangrijk voor de weefselregeneratie. Using zulks werkwijze voor efficiënte gebouwd, kunnen verschillende soorten meerdere lagen stamcel bladen worden geconstrueerd door het veranderen van de geplaatste cel van de stam-types, zoals de cel van de stam van de epitheliale blad, neurale stamcellen blad of de cel van de stam van de cardiale blad. Verdere verkenningen van alternatieven voor het blad van meerdere lagen cel van de stam naar verwachting uit te breiden van de verzoeken om meer weefselregeneratie.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Dit werk werd gesteund door de National Natural Science Foundation of China (subsidie nummer 31771064); de wetenschap en de technologie Planning Project van de provincie Guangdong (subsidie nummers 2013B010404030, 2014A010105029 en 2016A020214012); de wetenschap en de technologie Planning Project van Guangzhou (subsidie nummer 201607010063); en de Undergraduate innovatie en ondernemerschap trainingsprogramma (subsidie nummer 201610559028); de National Science Foundation voor jonge wetenschappers van China (verlenen nummer 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



