Summary
Dieser Artikel bietet eine effiziente und praktikable Methode für den Bau von vielschichtigen Stammzell-Blätter mit günstigen Stammzell-Eigenschaft.
Abstract
Stammzell-Therapie zeigt eine viel versprechende Zukunft bei der Regeneration von verletzten Organ und Gewebe, und die Zelle-Blatt-Technik wurde entwickelt, um die niedrigen Zelle Aufbewahrung und Armen überleben innerhalb der Zielzone zu verbessern. Während des Bauprozesses in Vitro ist eine Lösung für die Aufrechterhaltung der Stammzelle Bioaktivität und Erhöhung der Zelle innerhalb der Zelle Blatt jedoch dringend erforderlich. Dieses Protokoll stellt eine Methode für das Konstruieren einer vielschichtigen Zelle Blatt mit günstigen Stammzellen Bioaktivität und optimale Bedienbarkeit. Decellularized porcinen Perikard (DPP) wird vorbereitet, indem Phospholipase2 (PLA2) Decellularization Methode als die Zelle Blatt Gerüst und Ratte Knochenmark mesenchymale Stammzellen (BMSCs) sind isoliert und als die gesetzten Zellen erweitert. Die temporäre vielschichtigen Zellstruktur Blatt mit RAD16 konstruiert ist-ich Peptid Hydrogel. Schließlich Zelle Blatt ist mit einem dynamischen Perfusion System zu stabilisieren die dreidimensionale (3D) Struktur kultiviert, und die Zelle Blatt konnte nach einer 48-Stunden-Kultur in Vitroabgerufen werden. Dieses Protokoll bietet eine effiziente und praktikable Methode für den Bau von einem vielschichtigen Stammzell-Blatt und das Blatt Zelle in der Zukunft als günstige Stammzell-Therapie Produkt entwickelt werden könnte.
Introduction
Stammzell-Therapie als eine wirksame Behandlung für viele Krankheiten berichtet; niedrige Zelle Retention und Armen überleben innerhalb der Zielzone bleiben jedoch kritische Fragen nach der traditionellen Stammzell-Injektion. Um dieses Problem zu lösen, entwickelte Gewebe-engineering-Wissenschaftler die Zelle Blatt Technik. Eine monolayered Zelle Blatt mit intakten extrazelluläre Matrix war zunächst mithilfe der Temperatur-Antwort Kultur Gericht1vorbereitet, und seine Follow-up Studien berichtet die signifikanten Verbesserungen der Stammzellen Aufbewahrung und Überleben in das infarzierte Bereich2,3. Unter den Methoden Bau der vielschichtigen Zelle Blatt als eine wirksame Strategie zur Verbesserung der Zelle überleben und die Zelle Blatt therapeutische Wirkung3,4berichtet. Seitdem haben Wissenschaftler gearbeitet, auf andere Zelle Blatt Bauweisen zu entwickeln, um die Zelle Höhe, Stammzell-Eigenschaft und mechanischen Eigenschaften der Zelle Blätter erhöhen. So weit, bestimmte Arten von Zelle Blatt wurden konstruiert und studierte bei der Behandlung von Herzinfarkt5, Knorpel Verletzung6, und Haut Wunde7.
Die Bioaktivität der Stammzellen vor der Transplantation zeigten einen aufstrebenden Einfluss auf die Regeneration des verletzten Gewebes, und andere Zelle Blatt Bau Strategien haben unterschiedliche Auswirkungen auf die Stammzellen. Auf der einen Seite konfluierende Zelle Blätter bestand nur aus High-Density-Stammzellen, und natürliche extrazelluläre Matrizen konnte durch Stapeln monolayered Zelle Blätter8 oder mithilfe magnetischer Tissue engineering Techniken9erworben werden. Auf der anderen Seite entwickelten die Forscher verschiedene Gerüste um ausreichende mechanische Festigkeit und Unterstützung Zelle Wachstum10,11,12, ermöglichte eine niedrige Stammzelle Aussaat Dichte um die Ernährung zu gewährleisten liefern. Die niedrigen effizienten Nährstoffversorgung innerhalb der vielschichtigen Zellstruktur Blatt bleibt jedoch trotz dieser Ansätze ein Hauptanliegen beim in-vitro- Bau. Eine effiziente und praktikable Zelle Blatt Bausystem ist daher dringend erforderlich.
Dieses Protokoll beschreibt die Schritte, um ein Multilayeredmesenchymal Stammzellen (MSC) Zelle Blatt vorbereiten. In diesem Bausystem bietet ein DPP die Zelle Blatt mechanische Festigkeit. Basierend auf diesem Gerüst, die 3D Zellstruktur kann schnell aufgebaut werden mit RAD16-ich Peptid Hydrogel und eine dynamische Perfusion System wird verwendet, um die Kultur der vielschichtigen Zelle Blatt, um die 3D Blatt Zellstruktur stabilisieren und für eine ausreichende Ernährung Versorgung der Zellen. Mit diesem System, ein vielschichtiges BMSC Blatt wurde erfolgreich erstellt und einen optimalen therapeutischen Effekt auf die Ratte Myokardinfarkt Modell13ausgestellt.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle Stammzellen und Tierversuch Verfahren wurden nach den ethischen Richtlinien des nationalen Leitfadens für die Pflege und Verwendung von Labortieren durchgeführt und durch die Jinan Universität Animal Care and Use Committee (Guangzhou, China) genehmigt.
1. Vorbereitung des DPP-Gerüst mit PLA2 Decellularization Methode14
Hinweis: Siehe Abbildung 1A für eine schematische Darstellung des PLA2 Decellularization Methode.
- 100 mL 200 U/mL PLA2 Lösung vorzubereiten. 0,5 g Natrium-Deoxycholate und 2 mL PLA2 in 198 mL Pufferlösung Carbonat hinzufügen. Diese Lösung sollte innerhalb von 24 h nach der Zubereitung verwendet werden.
- Erhalten Sie frische porcinen Perikardium (FPP) aus dem Schlachthaus und an das Labor innerhalb von 1 h zurück.
Hinweis: Die FPP ist bei 4 ° C während des Transports aufzubewahren. Schritte 1.2-1.10 sollten durchgeführt werden, mit kontinuierlichen schütteln in einem Wasserbad mit Thermostat gesteuert. - Gründlich waschen die FPP mit 200 mL Phosphat-Pufferlösung (PBS) mit 1 % Penicillin-Streptomycin in einen 500-mL-Becherglas 10 ° Cfür 10 min. Schritt 2 X wiederholen.
- Die FPP in zwei Ebenen aufgeteilt und das Fettgewebe mit Zange und Schere zu entfernen.
Hinweis: Halten Sie der FPP nass durch Zugabe von 50 mL PBS alle 20 Minuten während der Entfernung des Fettgewebes. - Formen Sie die FPP in 10 x 10 cm2 Stück mit einer Schere. Waschen Sie die FPP mit 200 mL Pufferlösung Carbonat (CBS) mit 1 % Penicillin-Streptomycin in einen 500-mL-Becherglas bei 10 ° C für 10 min. Wiederholen Sie diesen Schritt 2 X.
- Übertragen Sie die FPP zu reinem Wasser und genießen Sie es bei 10° C für 12 h.
- Einweichen Sie die 10 x 10 cm2 Proben in 50 mL von CBS mit 200 U/mL PLA2 und 0,5 % (w/V) Natrium-Deoxycholate-Lösung bei 37 ° C für 6 Stunden.
- Waschen Sie den Proben mit CBS mit 1 % Penicillin-Streptomycin bei 10 ° C für 10 min. Wiederholen Sie diesen Schritt 2 X.
- Einweichen Sie jede Probe in 50 mL von CBS mit 200 U/mL PLA2 und 0,5 % (w/V) Natrium-Deoxycholate-Lösung bei 37 ° C für 2 Stunden.
- Waschen Sie Proben mit CBS mit 1 % Penicillin-Streptomycin bei 10 ° C für 2 h wiederholen Sie diesen Schritt für 10 X mindestens. Legen Sie die Proben auf flache Teller und trocknen Sie sie zur Gewichtskonstanz in eine Konstante Temperatur Backofen bei 55 ° C.
Hinweis: Das Beispiel muss vollständig getrocknet werden. Wägen Sie die DPP-Probe alle 10 Minuten und wiederholen, 3 x oder bis das Gewicht nicht mehr ändert. - Gestalten Sie jede DPP-Probe in einen Durchmesser von 10,5 mm Kreis mit einer Trephine. Packen Sie jede DPP in einem sterilen versiegelten Beutel.
- Sterilisieren Sie die DPP Proben durch Gammastrahlung (25 kGy). Die DPP-Proben bei 4 ° C vor dem Gebrauch gespeichert.
Hinweis: Alle Proben können bis zu sechs Monate bei 4 ° c gelagert werden
(2) die Vorbereitungen für die Zelle Blatt Bau
- Autoklav alle Instrumente und Gewebe Trägerkomponenten bei 121 ° C für 30 min, einschließlich 1,5 mL zentrifugale Röhren, Zangen, Pinzetten, Scheren, gezahnten schwarze Basen (trägerbauteil Gewebe) und weiße Spannringe (trägerbauteil Gewebe).
- Bereiten Sie 20 mL 10 % Saccharose-Lösung keimfrei. Gewicht 2 g Saccharose und löst die Saccharose in 18 mL Reinstwasser. Autoklaven die 10 % Saccharoselösung bei 121 ° C für 30 min oder Filter die Lösung mit einem 0,22 µm-Filter.
- Autoklaven der dynamische Perfusion Systemgeräte bei 121 ° C für 30 min, einschließlich eine Gas austauschen, Ausrüstung, eine 500 mL-Glasflasche, Perfusion Kultur Container und die verbindenden Rohre.
- Bereiten Sie die Instrumente autoklaviert und Gewebe Trägerkomponenten. Setzen Sie das schwarzen Basisteil des Trägers Gewebe in der Kulturschale.
- Eine getrocknete DPP-Gerüst holen Sie ab und legen Sie es in der Mitte des schwarzen Sockel. Das DPP-Gerüst eine weiße Spannring anziehen und im Gewebe Träger befestigen.
Hinweis: Stellen Sie sicher das Gerüst ist total fest im Gewebe Träger und es gibt keine Lücke zwischen Schwarzen und den weißen Spannring. Ist dies nicht der Fall, die Gewebe-Träger zu trennen und das Gerüst wieder zu beheben. - 100 µL Kulturmedium auf der DPP-Gerüst für die Rehydratation hinzufügen.
Hinweis: Wenn das Gerüst nicht gut im Gewebe Träger fixiert ist, wird das Nährmedium der Kulturschale infiltrieren. - Genommen Sie das Gerüst in einem 37 ° C Inkubator und lassen Sie es 15 Minuten einweichen lassen.
3. Vorbereitung der Zellen für Zelle Blatt Bau
Hinweis: Dieses Protokoll ist für die Zellkultur mit einer 100 mm Schale. Siehe Abbildung 1 b für eine schematische Darstellung des den Bau der vielschichtigen Zellstruktur.
- BMSCs13zu isolieren.
Hinweis: Diese Methode ist für den Bau von einem vielschichtigen MSC Zelle Blatt vorgesehen. Ratte BMSCs werden in diesem Protokoll verwendet. Die BMSCs sind mit die ganze Knochenmark anhaftende Methode isoliert, und die BMSCs sind erweiterte in Vitro genügend Zelle zu erhalten.- Autoklaven der Instrumente bei 121 ° C für 30 min, einschließlich Zangen, gezahnten Zangen und Scheren. Bereiten Sie eine 2 mL Injektionsspritze und BMSC Kulturmedium (Dulbeccos modifiziert Adlers Medium [DMEM] fötalen Rinderserum 10 %, 1 % Glutamin und 1 % Penicillin-Streptomycin).
- Die drei Wochen alten männlichen Sprague-Dawley (SD) Ratten von Halswirbel Verrenkung einschläfern. Das Tier in 100 mL 75 % Alkohol-Lösung in ein Becherglas für 5 Minuten einweichen.
- Nehmen Sie das Tier aus den Becher und anfällig auf dem OP-Tisch. Einschneiden der Haut auf dem Rücken des Tieres mit Schere und Pinzette. Isolieren Sie die Haut und Muskel Gewebe um die Oberschenkel Oberschenkelknochen verfügbar zu machen.
- Isolieren der Oberschenkel Oberschenkelknochen und legen Sie es in 30 mL PBS in einer 50 mL Zentrifugenröhrchen. Legen Sie zwei Oberschenkel Oberschenkelknochen in eine Röhre. Vortex Zentrifugenröhrchen, das Gewebe gründlich zu waschen. Wiederholen Sie diesen Schritt 2 X.
- Geschnitten Sie beide Enden der Oberschenkelknochen mit einer Schere und setzen Sie den Knochenmark Hohlraum.
- Aspirieren Sie 2 mL Kulturmedium BMSC mit einer Injektionsspritze. Stechen Sie die Nadel in den Hohlraum des Knochenmarks und spülen Sie das Knochenmark mit Nährmedium. Spülen Sie alle zwei Oberschenkel Oberschenkelknochen in einer Kulturschale von 100 mm.
- Hinzugeben Sie für jede 100 mm Kulturschale 2 mL Kulturmedium in der Kulturschale. Setzen Sie die Kulturschale in die 37 ° C Inkubator und statische Kultur für 72 h.
- Herausnehmen der Kulturschale aus dem Inkubator. Den Überstand mit 6 mL frisches Nährmedium zu ersetzen.
- Primäre BMSCs unter dem Mikroskop zu beobachten. Im Anschluss daran Durchgang der BMSCs jeden 5-7-d.
- Nehmen Sie die Zellen aus dem Inkubator. Beobachten Sie die Zellen unter dem Mikroskop und wählen Sie geeignete Zellen für Zelle Blatt Bau. Wenn die BMSCs 80 % - 90 % Zusammenfluss erreichen, können die Zellen als die gesetzten Zellen gewählt werden.
- Entfernen Sie das Kulturmedium aus der Kulturschale. Vorsichtig waschen der Zellen mit 2 mL warmen PBS. Entfernen Sie alle PBS aus der Kulturschale und machen Sie sicher nicht flüssig bleibt. 2 mL 0,25 % Trypsin (oder eine andere Trennendem Lösung) in die Schale hinzufügen und bei 37 ° C für 3 min inkubieren.
- Die Trypsin-Wirkung durch Zugabe von 2 mL Kulturmedium zu stoppen, und vorsichtig waschen der Zellen aus der Schale. Übertragen Sie die Zellsuspension in eine neue 15 mL Zentrifugenröhrchen. Entmischen der Zellen bei 225 X g für 5 Minuten.
- Den überstand zu entfernen. Die Zellen mit 3 mL 10 % (w/V) Saccharoselösung aufzuwirbeln.
Hinweis: 10 % (w/V) Saccharoselösung wird verwendet um die Zellen zu waschen um eine einheitliche Zelle-Hydrogel-Mischung in den folgenden Schritten zu erhalten. - Aspirieren Sie 10 µL Zellsuspension und zählen Sie die Anzahl von Zellen mit einem Hemocytometer. Berechnen Sie das Volumen für den nächsten Schritt benötigt. Für eine Zelle-Blatt sind 3 Millionen BMSCs verwendet.
- 3 Millionen Zellen zu extrahieren und in einem neuen 15 mL Zentrifugenröhrchen überführen. Zentrifugieren Sie die Zellen bei 225 X g für 5 min.
- Den überstand zu entfernen. Die Zellen mit 1 mL 10 % (w/V) Saccharoselösung aufzuwirbeln. Übertragen Sie die Zellsuspension in einem 1,5 mL Zentrifugenröhrchen.
Hinweis: Mit einer zentrifugalen 1,5 mL-Tube ist vorteilhaft für die Vorbereitung der Zelle-Hydrogel-Mischung. - Zentrifugieren Sie die Zellen bei 260 Xg , für 5 min. ganz herauszudrehen überstand und die Zelle Sediment erhalten.
4. Vorbereitung der BMSCs und der RAD16-ich Peptid Hydrogel Mischung
Hinweis: Siehe Abbildung 1 b für eine schematische Darstellung des den Bau der vielschichtigen Zellstruktur.
- Die zentrifugale 1,5 mL-Tube 20 µL 10 % (w/V) Saccharoselösung hinzufügen. Sanft Aufschwemmen Sie der BMSCs und erhalten Sie eine homogene Suspension zu.
Hinweis: Erzeugen Sie keine Bläschen während der Wiederfreisetzung. - Fügen Sie 20 µL des RAD16-ich Peptid Hydrogel an der Spitze der Suspension. Rühren Sie leicht die RAD16-ich Peptid und Zelle Federung mit der Pipettenspitze. Wenn die Zellsuspension und Hydrogel miteinander vermischt sind, pipette vorsichtig der Mischung ein paar Mal.
- Nehmen Sie das DPP-Gerüst aus dem Gewebe-Träger und Aspirieren Sie sanft das Kulturmedium mit einer PIPETTENSPITZE.
Hinweis: Sicherstellen Sie, dass die DPP-Gerüst vollständig rehydriert ist, bevor Sie die Zelle-Hydrogel-Mischung hinzufügen. - Aspirieren Sie die Mischung und fügen Sie es gleichmäßig auf der DPP-Gerüst.
Hinweis: Das Gesamtvolumen der Mischung wäre etwa 40-50 µL. Es empfiehlt sich, die Mischung 10 µL jeweils von der Mitte an der Außenseite des Gerüstes hinzufügen. - Fügen Sie 1 mL Kulturmedium auf den Grund des Trägers Gewebe. Legen Sie die Zelle Blatt im Inkubator 37 ° C für 5 Minuten.
- Nehmen Sie die Zelle Blatt aus dem Inkubator. Sanft fügen Sie 4 mL Kulturmedium in der Kulturschale und Tauchen Sie die Zelle Blatt. Legen Sie die Zelle Blatt im 37 ° C Inkubator für 2 h statische Kultur.
5. in-vitro- Kultur aus einem 3D vielschichtigen Zelle Blatt mit einem dynamischen Kultursystem
Hinweis: Siehe Abbildung 1 für eine schematische Darstellung des dynamischen 3D-System.
- Bereiten Sie das dynamische Perfusion System, einschließlich einer peristaltischen Pumpe, Gasgeräte Austausch, eine 500 mL-Glasflasche, Perfusion Kultur Container und den verbindenden Rohren. Montieren Sie das dynamische Perfusion System, wie in Abbildung 2dargestellt.
- Die sterile Glasflasche 200 mL Kulturmedium hinzufügen. Legen Sie die Zelle Blatt in der Kammer des Behälters Kultur.
Hinweis: Achten Sie auf die Richtung der oberen Oberfläche des Blattes Zelle. - Fügen Sie 3 mL Kulturmedium im Gewebe Container hinzu, und schließen Sie den Container. Die dynamische Perfusion System im Inkubator und einschalten Sie die Pumpe. Inmitten des Durchfluss der peristaltischen Pumpe 8 mL/min. Kultur der Zelle Blatt das dynamische Perfusion System für 48 h.
6. Erhalt der vielschichtigen MSC Zelle Blatt
- Autoklaven der Instrumente und Gewebe Trägerkomponenten bei 121 ° C für 30 min, einschließlich 1,5 mL zentrifugale Röhren, Zange und gezahnten Zangen.
- Ziehen Sie den Eingang Kanal aus der Glasflasche, die Lieferung von Kulturmedium in den Container zu stoppen.
Hinweis: Beenden der peristaltischen Pumpe, wenn der Kultur-Behälter leer ist. - Nehmen Sie die Zelle Blatt aus dem Kultur-Container und steckte es in eine Kulturschale.
- Verwenden Sie eine Zange zu immobilisieren den Gewebe-Träger und ein anderes gezahnte Pinzette verwenden, um den weißen Spannring aus dem schwarzen Sockel trennen. Schließlich erhalten Sie die vielschichtige BMSCs Zelle Blatt.
- Für kurze Konservierung kann jede Zelle Blatt auf eine zentrifugale 1,5 mL-Tube mit der Zange übertragen werden. DPP-Gerüst sollte an der Innenwand des zentrifugalen Rohres angebracht werden, und das Blatt Zelle verbreiten sollte, so viel wie möglich in die Zentrifugenröhrchen.
- Fügen Sie sanft 1 mL Kulturmedium in der zentrifugalen Röhre, die Zelle Blatt einzutauchen. Verschließen Sie die Kappe der zentrifugalen Röhre und speichern Sie die Zelle Blatt bei 4 ° C.
Hinweis: Die Zelle Blatt sollte transplantiert oder schnellstmöglich analysiert. Es wird empfohlen, die Zelle Blatt innerhalb von 4 Stunden zu verwenden.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Die schematische Darstellung der vielschichtigen Stammzell-Blatt Bau ist in Abbildung 1dargestellt. Vorbereitung der Zelle Blatt Gerüst von der PLA-2 -Decellularization-Methode ist der erste Schritt. Basierend auf dem Schafott, entsteht eine temporäre 3D Zellstruktur durch Mischen der Stammzellen mit der RAD16-1-Peptid-Hydrogel. Um ein vielschichtiges Zelle Blatt mit günstigen Stammzellen Bioaktivität und optimale mechanische Festigkeit zu erhalten, ist die Zelle Blatt in eine dynamische Perfusion System kultiviert. Unter der dynamischen Nährstoffversorgung dürfen die Stammzellen zu vermehren und Kontakte der Zelle innerhalb der vielschichtigen Zelle Blatt, und das letzte stabile vielschichtigen Zelle Blatt Produkt erhalten Sie nach ca. 24-72-Stunden-Anbau.
In diesem Fall bereitet die Zelle Blatt Gerüst DPP die PLA-2 -Decellularization-Methode. Das Aussehen der getrockneten DPP ist flach, glatt und halbtransparent (Abb. 3A). Aufgrund der spezifischen Lyse Wirkung von PLA2, die heterogenen Zellen können komplett entfernt während der Ultrastruktur des natürlichen Kollagens innerhalb der DPP-Gerüst gut erhalten (Abb. 3 b ist), und dies wichtig für die Aufrechterhaltung ist der mechanische Festigkeit und Biokompatibilität des Gerüstes. Darüber hinaus können die Gerüste als Wachstumsfaktor Kontrollsystem Release Stammzell-Wachstum unterstützen und verbessern die in Vivo Regeneration13geändert werden.
Wenn die Stammzellen ~ 80-90 % Zusammenfluss erreichen, die Zellen sind von der Kulturschale isoliert und mit einer 10 % Saccharose-Lösung gewaschen. Nach Zentrifugation, werden die Zellen mit der RAD16 gemischt-ich Peptid Hydrogel und hinzu kommt das eingeweichtes DPP-Gerüst. Eine temporäre mehrschichtige Struktur ist nach einer zweistündigen statische Kultur gebildet. Zu guter Letzt wird das vielschichtige BMSC Blatt Produkt (Abbildung 4) erworben nach einer 48-Stunden-Kultur in das dynamische Perfusion System. Mit der Unterstützung von der DPP-Gerüst die Zelle-Blatt mit der Pinzette leicht manipuliert werden kann, und es kann vorübergehend erhalten in Kulturmedium in der 1,5 mL Tube bei 4 ° C für 4 Stunden vor der Untersuchung oder Transplantation (Abbildung 4). Als die Immunfluoreszenz-Färbung Resultat zeigt sind die BMSCs sehr positiv für die Stammzell-Marker CD90 und CD29. Nach dem Zelle Blatt Bau, die BMSCs innerhalb der vielschichtigen Zelle Blatt zeigen hohe CD29 und CD90 (Abbildung 5).

Abbildung 1 : Das Flussdiagramm für den Bau der vielschichtigen Stammzell-Blatt. (A) mithilfe der PLA-2 decellularized-Methode, die heterogenen Zellen innerhalb der FPP sind zerstört, während die natürliche extrazellulären Matrizen in der DPP-Gerüst gut erhalten sind. (B) anhand der DPP-Gerüst, die temporäre vielschichtigen Zellstruktur ist durch das Mischen der Stammzellen und selbst zusammenbauen Peptid Hydrogel konstruiert. (C) zu folgen, die Zelle Blatt ist in einem dynamischen 3D-System kultiviert und die Stammzellen werden voraussichtlich vermehren und Kontakte der Zelle unter der dynamischen Nährstoffversorgung. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Der Gewebe-Träger und das dynamische Perfusion System. (A) dieses Panel zeigt die 13 mm Durchmesser Gewebe Träger. (B) dieses Panel zeigt die Montage des Systems dynamische Perfusion. Bitte klicken Sie hier für eine größere Version dieser Figur.
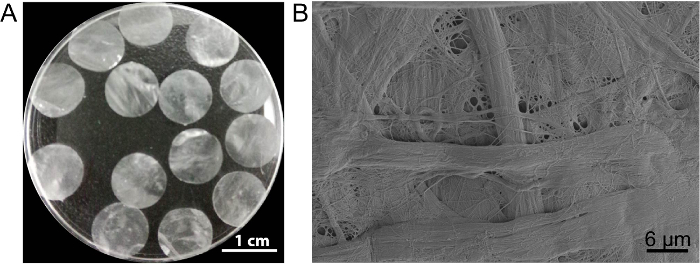
Abbildung 3 : Das Aussehen und die Ultrastruktur der DPP. (A) dieses Panel zeigt das Erscheinungsbild von 10,5 mm Durchmesser DPP Gerüsten. (B) dieses Panel zeigt ein repräsentatives Bild über das Rasterelektronenmikroskop (REM) Ergebnis der DPP-Gerüst. Bitte klicken Sie hier für eine größere Version dieser Figur.
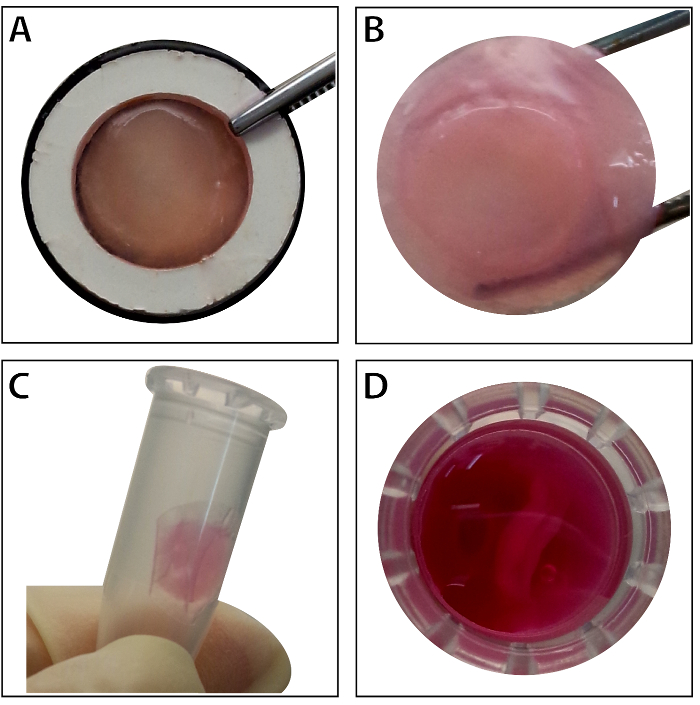
Abbildung 4 : Die Darstellung der vielschichtigen BMSC Blatt. (A) dieses Panel zeigt die Darstellung der vielschichtigen BMSC Blatt innerhalb der Gewebe-Träger. (B) hält die intakte vielschichtige BMSC Blatt Zange. (C - D) Das vielschichtige Zelle Blatt kann vorübergehend in der 1,5 mL Tube vor Gebrauch aufbewahrt werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
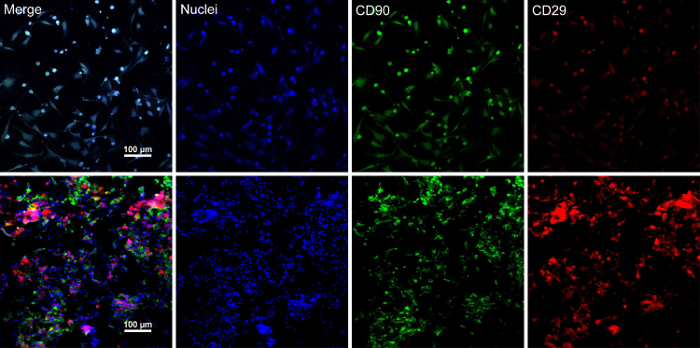
Abbildung 5 : Immunfluoreszenz-Färbung Ergebnisse BMSC Marker Ausdrucks. (A) dieses Panel zeigt Immunfluoreszenz Färbung Ergebnisseder BMSCs vor Zelle Blatt Bau. (B) dieses Panel zeigt Immunfluoreszenz-Färbung Ergebnisse des Abschnitts vielschichtigen BMSC Blatt. CD90 (grün) und CD29 (rot) wurden in die BMSCs und die Zelle Blatt positiv geäußert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dieses Protokoll meldet eine effiziente Methode für das Konstruieren einer vielschichtigen MSC-Blatt. Dieses Blatt Zelle weist optimale mechanische Festigkeit, hohe Zelldichte seeding und günstige Stammzellen Bioaktivität. Mit BMSCs als ein Beispiel, die 3D Zellstruktur ist schnell aufgebaut mit RAD16-ich Peptid Hydrogel. Nach in das dynamische Perfusion System kultiviert wird, erhält man das vielschichtige BMSC Blatt erfolgreich und die BMSCs pflegen eine hohe Expression der Stammzell-Marker.
Bau der temporären vielschichtigen Zellstruktur ist der entscheidende Schritt des Protokolls. Die RAD16-I ist eine kommerzielle Hydrogel-Peptid, und 1 % Aminosäure und 99 % aus Wasser besteht. Mehrere Studien berichtet, dass dieses Peptid-Hydrogel die natürliche ECM-Umgebung imitieren kann und vorteilhaft für Stem Cell Proliferation und das Überleben15,16,17 ist. In diesem Protokoll 3 Millionen MSC Suspension (in 20 µL 10 % Saccharoselösung) mischte mit 20 µL des RAD16-ich Peptid Hydrogel. Das Lautstärkeverhältnis der Zellsuspension und Peptid-Hydrogel betrug 1:1. Dieses Peptid-Hydrogel ist empfindlich gegenüber der Umwelt pH-Wert und Peptid-Molekülen würde automatisch bilden die 3D Netzwerk wechselt der pH-Wert von sauer auf neutral. Da die Zelloberfläche geladene Teilchen enthält, die Zelle Mischung von Flüssigkeit zu geändert Hydrogel in kurzer Zeit, die Einflüsse hat sogar Mischen der Zellen. Eine günstige Handy-Hydrogel sollte eine sogar Mischung aus der Zellsuspension und Peptid-Hydrogel und ermöglicht es der Zelle-Mischung gleichmäßig auf dem Schafott hinzugefügt werden. Die Forscher können die Mischung Zustand optimieren, durch Veränderung der gesäten Handynummer, Saccharose Lösung Volumen und das Peptid-Hydrogel-Volumen nach ihrem tatsächlichen Bedarf. Es lohnt sich zu bemerken, dass die Zellen mit 10 % Saccharoselösung waschen und gleichmäßig mischen die Zelle-Hydrogel-Mischung sind die entscheidenden Schritte des Protokolls und eine ungleichmäßige Mischung könnte dazu führen, dass große Zellverlust und eine instabile temporäre mehrschichtige Struktur.
Nach dem Hinzufügen der Zelle-Hydrogel-Mischung auf die DPP-Gerüst, ist die mechanische Festigkeit der vielschichtigen Zellstruktur Blatt schwach, da das Peptid-Hydrogel-Netzwerk nicht stark genug ist, um pflegen langfristige vielschichtigen Zellstruktur und Zelle Verbindungen und ECM Sekrete sind notwendig, um die Stabilität der Zelle Blatt zu verbessern. Darüber hinaus kann die dynamische Infiltration des Kulturmediums erleichtern die Stammzellen zu vermehren und zellkontakte innerhalb der vielschichtigen Zellstruktur zu etablieren, während eine unzureichende Nährstoffversorgung zellapoptose verursachen und verringern die Zelldichte wird der Zelle Blatt13. Daher ist das dynamische Perfusion System wichtig für die Stabilisierung der vielschichtigen Zellstruktur Blatt. Darüber hinaus sollte der entsprechende Volumenstrom des Kulturmediums entsprechend der spezifischen Stammzell-Art und Dichte Aussaat Zelle angepasst werden. Auch bleibt die schwache mechanische Verbindung zwischen den DPP-Gerüst und die vielschichtigen Zellstruktur die Einschränkung der vorliegenden Bauweise, die die Teilung der vielschichtigen Zellschichten und das Gerüst verursachen. Daher sind weitere Studien notwendig, um die mechanischen Biokompatibilität der 3D Hydrogel-Gerüst und die DPP-Gerüst zu verbessern.
Bisher haben sich Gewebe-engineering-Wissenschaftler zum effizienten Ernährung Versorgung Systeme etablieren in Vitro, wie z. B. coculturing endothelial Zellen18 und verwenden eine poröse Gerüst19konzentriert. Jedoch die Ernährung Durchlässigkeit innerhalb der 3D Struktur ist in der traditionellen statischen 3D Kultursystem niedrig, und die Stammzell-Rentabilität erheblich beeinflusst werden. In diesem Fall bieten mit dem dynamischen Perfusion System ausreichend Nährstoffversorgung um Stammzellen Lebensfähigkeit zu erhalten. Unter Verwendung dieses Protokolls, verbessert ein vielschichtiges BMSC Blatt die Herzfunktion und die Angiogenese in Ratte Myokardinfarkt Modell13. Bau einer Stammzelle Blatt Produkts mit einer hohen Belastung und günstige Stammzell-Eigenschaft ist wichtig, die Geweberegeneration. Mit dieser effizienten konstruierte Methode konnte verschiedene Arten von vielschichtigen Stammzell-Blätter durch Veränderung ausgesät Stammzelltypen wie epithelialen Stammzellen Blatt, neurale Stammzellen Blatt oder kardiale Stammzellen Blatt erstellt werden. Weitere Erforschungen und Alternativen zu dem vielschichtigen Stammzell-Blatt sollen die Anwendungen für weitere Geweberegeneration zu erweitern.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Diese Arbeit wurde unterstützt durch die National Natural Science Foundation of China (Grant-Nummer 31771064); Wissenschaft und Technik Planung Projekt der Provinz Guangdong (Zuschuss Zahlen 2013B010404030, 2014A010105029 und 2016A020214012); Wissenschaft und Technik Planung Projekt von Guangzhou (Grant-Nummer 201607010063); der Student Innovation und Entrepreneurship Trainingsprogramm (Grant-Nummer 201610559028); die National Science Foundation für junge Wissenschaftler von China (Gewährungsnummer 31800819).
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



