Summary
Bu makale uygun kök hücre özelliği ile çok katmanlı kök hücre tabloları oluşturmak için verimli ve uygun bir yöntem sağlar.
Abstract
Kök hücre tedavisi bir umut verici yaralanan organ ve doku Yenileyici gelecekteki gösterir ve hücre sayfası teknik düşük hücre saklama ve hedef bölge içinde yoksul hayatta kalma artırmak için geliştirilmiştir. Ancak, vitro İnşaat sürecinde acilen kök hücre bioactivity bakımı ve hücre sayfası içinde hücre miktarı artan bir çözüm gerekir. Burada, bu protokole uygun kök hücre bioactivity ve en uygun kullanım ile bir çok katmanlı hücre sayfası oluşturmak için bir yöntem sunuyor. Decellularized domuz kalp zarını (DPP)2 (PLA2) decellularization yöntemi olarak hücre sayfası iskele fosfolifaz tarafından hazırlanan ve sıçan kemik iliği mezenkimal kök hücre (BMSCs) izole ve numaralı seribaşı hücreler olarak genişletilmiş. Geçici çok katmanlı hücre sayfa yapısı RAD16 kullanarak inşa edilmiştir-Ben peptid hidrojel. Son olarak, hücre sayfası üç boyutlu (3D) yapısı stabilize etmek dinamik perfüzyon sistemi ile kültürlü ve 48 saat kültür vitrotakip hücre sayfası alınamadı. Bu iletişim kuralı bir çok katmanlı kök hücre sayfası oluşturmak için verimli ve uygun bir yöntem sağlar ve hücre sayfası bir olumlu kök hücre terapisi ürün olarak gelecekte geliştirilebilir.
Introduction
Kök hücre tedavisi birçok hastalık için etkili bir tedavi olarak bildirilmiştir; Ancak, düşük hücre saklama ve hedef bölge içinde yoksul hayatta kalma kritik konularda geleneksel kök hücre enjeksiyon takip kalır. Bu sorunu çözmek için doku mühendisliği bilim adamları hücre sayfası tekniği geliştirdi. Monolayered hücre sabıkası olduğu gibi hücre dışı matriks ile öncelikle sıcaklık-yanıt kültür çanak1kullanılarak hazırlanan ve kök hücre saklama ve hayatta kalma hazır içinde önemli gelişmeler takip çalışmalarına bildirdi alan2,3. Yöntemler arasında çok katmanlı hücre sayfası oluşturmak hücre hayatta kalma ve hücre sayfası tedavi etkisi3,4geliştirmek için etkili bir strateji olarak bildirilmiştir. O zamandan beri bilim adamları hücre miktarı, kök hücre özellik ve mekanik özelliği hücre yaprak artırmak için farklı hücre sayfası inşaat yöntemler geliştirilmesi üzerinde çalıştı. Şimdiye kadar hücre sayfasının belirli türleri inşa ve miyokard infarktüsü5, kıkırdak hasarı6, tedavisinde okudu ve7cilt yara.
Bioactivity kök hücre nakli önce yaralı doku rejenerasyonu ortaya çıkan bir etkisi gösterdi ve farklı hücre sayfası inşaat stratejileri kök hücreler üzerinde farklı etkileri vardır. Bir yandan konfluent hücre sayfaları yalnızca yüksek yoğunluklu kök hücrelerinin oluşuyordu ve doğal hücre dışı matrisler yığın monolayered hücre sayfaları8 veya manyetik doku mühendisliği teknikleri9kullanarak elde edilebilir. Öte yandan, geliştirilen araştırmacılar yeterli mekanik mukavemeti sağlamak ve düşük bir kök hücre yoğunluk beslenme sağlamak için tohum verilen hücre büyüme10,11,12, destek için farklı iskele kaynağı. Ancak, bu yaklaşımlardan rağmen düşük verimli beslenme kaynağı çok katmanlı hücre sayfa yapısı içinde önemli bir endişe vitro inşaat sırasında kalır. Bu nedenle, bir verimli ve uygun hücre sayfası yapı sistemi şiddetle ihtiyaç var.
Bu iletişim kuralı bir multilayeredmesenchymal kök hücre (MSC) hücre sayfası hazırlamak için adımları açıklar. Bu yapı sistemi, hücre sayfası mekanik mukavemeti DPP tarafından sağlanır. Bu iskele üzerinde bağlı olarak, 3D hücre yapısı hızlı bir şekilde RAD16 ile inşa edilebilir-ben peptid hidrojel ve dinamik perfüzyon sistemi 3D hücre sayfa yapısı stabilize ve yeterli beslenme sağlamak için çok katmanlı hücre levha, kültür için kullanılır hücreleri için kaynağı. Bu sistemi kullanarak, bir çok katmanlı BMSC sayfa başarılı bir şekilde hazırlanan ve sıçan miyokard infarktüsü modeli13üzerinde en uygun tedavi edici etkisi sergilenmektedir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tüm kök hücre ve hayvan deney yordamlar bakım ve kullanım Laboratuvar hayvanlarının Ulusal Kılavuzu etik kurallarına göre yürütülen ve Jinan Üniversitesi hayvan bakım ve kullanım Komitesi (Guangzhou, Çin Halk Cumhuriyeti) tarafından onaylanmış.
1. hazırlanması PLA2 Decellularization ile DPP iskele yöntemi14
Not: PLA2 decellularization yönteminin şematik için Şekil 1A ' ya bakınız.
- 100 mL 200 U/mL PLA2 çözeltisi hazırlamak. 0.5 g sodyum deoxycholate ve PLA2 2 mL 198 mL karbonat tampon çözeltisi ekleyin. Bu çözüm onun hazırlık sonra 24 saat içinde kullanılmalıdır.
- Taze domuz kalp zarını (FPP) mezbaha elde etmek ve Laboratuvar 1 saat içinde geri dönün.
Not: FPP taşıma sırasında 4 ° C'de muhafaza edilmelidir. Adımları 1.2-1,10 sürekli bir termostat kontrollü su banyosunda sallayarak ile yapılmalıdır. - Bu adım 2 x 200 mL % 1 penisilin-streptomisin 10 ° Cfor 10 dk., bir 500 mL ölçek içeren fosfat tampon çözeltisi (PBS) ile FPP tekrar iyice yıkayın.
- FPP iki katmanlara bölmek ve yağ dokusu forseps ve makas ile kaldırın.
Not: PBS 50 mL ekleyerek ıslak FPP yağ dokusu kaldırma sırasında her 20 dk devam et. - FPP 10 x 10 cm2 adet makasla şekil. FPP %200 1 penisilin-streptomisin bir 500 mL ölçek 10 ° C'de 10 dk. yinelemek için bu adım 2 x içeren mL karbonat tampon çözeltisi (CBS) ile yıkayın.
- Saf su için FPP aktarmak ve 12 h için 10 ° C'de ıslatın.
- 10 x 10 cm2 örnekleri 50 ml 200 U/mL PLA2 ve 6 h için 37 ° C'de % 0,5 (w/v) sodyum deoxycholate çözüm içeren CBS emmek.
- Örnekleri bu adım 2 x %1 penisilin-streptomisin için 10 dk. tekrar 10 ° C'de içeren CBS ile yıkayın.
- CBS 200 U/mL PLA2 ve 2 h 37 ° C'de % 0,5 (w/v) sodyum deoxycholate çözüm içeren 50 ml her örnek emmek.
- Örnekleri % 1 penisilin-streptomisin 2 h. tekrarlamak için 10 ° C'de içeren CBS ile 10 x için bu adım en azından yıka. Örnekleri üzerinde düz tabak yerleştirin ve kuru onları sabit sıcaklık fırın 55 ° C'de sabit ağırlık
Not: Örnek tamamen kurumuş gerekiyor. DPP örnek her 10 min tartmak ve tekrar 3 x veya ağırlığı kadar artık değiştirir. - Her DPP örnek bir trephine ile 10.5 mm çaplı daire şekli. Her DPP içinde steril mühürlü çantanı hazırla.
- DPP örnekleri gama ışınlama (25 kGy) tarafından sterilize. DPP örnekler kullanmadan önce 4 ° C'de depolanan.
Not: Tüm örnekleri 4 ° C'de altı aya kadar saklanabilir
2. hücre hazırlıkları inşaat sac
- Otoklav siyah üsleri (doku taşıyıcı bileşeni) ve beyaz gerilim halkaları (doku taşıyıcı bileşeni) 30 min 1,5 mL santrifüj tüpleri, forseps, dahil olmak üzere, pens, makas, dişli için tüm aletleri ve doku taşıyıcı bileşenleri 121 ° C'de.
- 20 mL döl-özgür % 10 sükroz çözeltisi hazırlamak. Sukroz 2 g ağırlık ve Ultrasaf Su 18 ml sukroz geçiyoruz. Otoklav 30 dk veya 0,22 µm filtre ile filtre çözümü için 121 ° C'de % 10 sükroz çözüm.
- Otoklav dinamik perfüzyon sistemi aygıtlarını 121 ° C'de 30 dk, bir gaz da dahil olmak üzere Döviz ekipman, 500 mL Cam şişe, bir perfüzyon kültür kapsayıcı ve bağ tüpleri.
- Autoclaved aletleri ve doku taşıyıcı bileşenleri hazırlayın. Siyah taban parçası doku taşıyıcı bir kültür tabak koyun.
- Kurutulmuş bir DPP iskele toplar ve siyah Bankası Merkezi'nde koyardım. Bir beyaz gerginlik yüzük DPP iskele üzerinde koymak ve doku taşıyıcıya düzeltebilirim.
Not: iskele doku taşıyıcıya tamamen sabit ve siyah taban ve beyaz gerginlik halka arasında boşluk yok olun. Eğer değilse, doku taşıyıcı ayrı ve iskele tekrar düzeltmek. - Rehidrasyon DPP iskele üzerinde 100 µL kültür ortamının ekleyin.
Not: iskele de doku taşıyıcıya düzeltilmemişse, kültür orta kültür çanak sızmak. - İskele 37 ° C kuluçka koy ve 15dk için emmek sağlar.
3. hücre sayfa yapımı için hücreleri hazırlanması
Not: Bu 100 mm tabak hücre kültürü için protokolüdür. Şekil 1B inşaat çok katmanlı hücre yapısının şematik için bkz.
- BMSCs13yalıtmak.
Not: Bu yöntem bir çok katmanlı MSC cep sayfası oluşturmak için tasarlanmıştır. Sıçan BMSCs bu protokol için kullanılır. BMSCs bütün kemik iliği yapisan yöntemle izole edilmiştir ve BMSCs genişletilmiş vitro hücre yeteri kadar elde etmek için vardır.- Otoklav 121 ° C'de aletleri forseps, dişli forseps ve makas gibi 30 dk için. 2 mL enjeksiyon şırınga ve BMSC Kültür (değiştirilmiş Dulbecco'nın kartal orta [DMEM], % 10 fetal Sığır serum, % 1 glutamin ve % 1 penisilin-streptomisin) orta hazırlayın.
- 3-hafta-yaşlı erkek Sprague-Dawley (SD) rats servikal omur çıkığı tarafından ötenazi. 100 mL % 75 alkol çözeltisi 5 min için bir ölçek içinde hayvan emmek.
- Hayvan kabı dışına alıp eğilimli işlemi masaya yerleştirin. Arkadaki hayvan cilt makas ve forseps ile deşmek. Kalça kemiklerine ortaya çıkarmak için cilt ve kas dokuları yalıtmak.
- Kalça kemiklerine yalıtmak ve PBS 30 mL 50 mL santrifüj tüpü içinde koydu. İki kalça kemiklerine bir tüpün içine yerleştirin. Girdap santrifüj tüpü doku iyice yıkayın. 2 x bu adımı yineleyin.
- Her iki ucunda da kemiklerine makasla kesmek ve iliği kavite bulaşmasına neden.
- BMSC kültür orta 2 mL enjeksiyon şırınga ile Aspire edin. İğne iliği boşluğa yerleştirmek ve kültür orta ile kemik iliği dışarı floş. Her iki kalça kemiklerine bir 100 mm Kültür çanak içine dışarı floş.
- Her 100 mm Kültür yemeğin için kültür orta 2 mL kültür tabakta ekleyin. 37 ° C kuluçka ve 72 h için statik kültür kültür tabak koyun.
- Kültür bulaşık kuluçka makinesi üzerinden dışarı çıkar. Süpernatant ile 6 mL taze kültür orta yerine.
- Mikroskop altında birincil BMSCs gözlemlemek. Bunu, her 5-7 d BMSCs geçiş.
- Kuluçka makinesi hücreleri al. Hücreler mikroskopla gözlemlemek ve hücre sayfa yapımı için uygun hücreleri seçin. BMSCs % 80 - % 90 izdiham ulaştığınızda, hücreleri numaralı seribaşı hücreler olarak seçilebilir.
- Kültür orta kültür çanak kaldırın. Yavaşça 2 mL sıcak PBS hücrelerle yıkayın. Tüm PBS kültür çanak kaldırmak ve yapmak emin Hayır sıvı kalır. Yemek için 2 mL % 0.25 tripsin (veya başka bir dissociating çözüm) ekleyin ve 3 dk 37 ° C'de kuluçkaya.
- Tripsin etkisi kültür orta 2 mL ekleyerek durdurmak ve yavaşça çanak hücrelerden yıkayın. Hücre süspansiyon yeni 15 mL santrifüj tüpüne aktarın. Centrifugate hücreleri 225 x g 5 min için de.
- Süpernatant kaldırın. 3 mL % 10 (w/v) sükroz çözeltisi içeren hücreleri resuspend.
Not: % 10 (w/v) sükroz çözüm hücreleri yıkamak için aşağıdaki adımlarda bir tek tip hücre-hidrojel karışım elde etmek için kullanılır. - Hücre süspansiyon 10 µL Aspire edin ve hücre ile bir hemasitometre saymak. Bir sonraki adım için gerekli hacim hesaplamak. Bir hücre tablo için üç milyon BMSCs kullanılır.
- Üç milyon hücreleri ayıklamak ve bir yeni 15 mL santrifüj tüpüne aktarabilirsiniz. Senaryo Özeti 225 x g 5 min için santrifüj kapasitesi.
- Süpernatant kaldırın. 1 mL % 10 (w/v) sükroz çözeltisi içeren hücreleri resuspend. Hücre süspansiyon bir 1,5 mL santrifüj tüpüne aktarın.
Not: 1,5 mL santrifüj tüpü kullanarak hücre hidrojel karışım hazırlamak için faydalıdır. - 5 dk. tamamen süpernatant kaldırmak ve hücre tortu elde etmek için 260 xg de hücreleri santrifüj kapasitesi.
4. BMSCs ve RAD16 hazırlanması-ben peptid hidrojel karışımı
Not: Şekil 1B inşaat çok katmanlı hücre yapısının şematik için bkz.
- 20 µL % 10 (w/v) sükroz çözüm 1.5 mL santrifüj tüpü ekleyin. Yavaşça BMSCs resuspend ve bir tek tip süspansiyon elde edilir.
Not: herhangi bir kabarcıklar resuspension sırasında oluşturmaz. - RAD16 20 µL eklemek-Ben peptid hidrojel süspansiyon üstündeki. Hafifçe karıştırın RAD16-ben peptid ve hücre süspansiyon pipet ucu. Yavaşça hücre süspansiyon ve hidrojel birlikte karıştığında, karışımı bir kaç kez pipette.
- Doku gemisinden DPP iskele al ve yavaşça kültür orta bir pipet ucu ile Aspire edin.
Not: DPP iskele tam olarak hücre hidrojel karışımı eklemeden önce rehydrated olun. - Karışım Aspire edin ve eşit DPP iskele ekleyin.
Not: Karışım hacmi hakkında olurdu 40-50 µL. Bu karışımı 10 µL teker teker ortadan itibaren iskele dışa doğru eklemek için tavsiye edilir. - 1 mL kültür ortamının doku taşıyıcı altýna ekleyin. 37 ° C kuluçka 5 min için hücre levha koymak.
- Kuluçka makinesi hücre sayfasından çıkar. Yavaşça kültür orta 4 mL kültür çanak ekleyin ve hücre sayfası bırakın. Statik kültür 2 h 37 ° C kuluçka hücre levha koymak.
5. bir dinamik kültür sistemi kullanarak 3D çok katmanlı hücre sayfasının Vitro kültür
Not: Şekil 1 c 3D dinamik sistem bir şematik için bkz.
- Peristaltik pompa, gaz Satım donanımları, 500 mL Cam şişe, perfüzyon kültür konteyner ve bağ tüpler de dahil olmak üzere dinamik perfüzyon sistemi hazırlamak. Şekil 2' de gösterildii gibi dinamik perfüzyon sistemi monte.
- Kültür orta 200 mL steril cam şişe ekleyin. Hücre kültür konteyner odanın içine yerleştirin.
Not: üst yüzey hücre sayfasının yönüne dikkat edin. - Kültür orta 3 mL doku kapsayıcı içinde ekleyin ve konteyner kapatın. Dinamik perfüzyon sistemi da kuluçka makinesine koy ve pompa başlar. Peristaltik pompa debisi kültür 8 mL/dak. 48 h için dinamik perfüzyon sistemi hücre sayfasında ayarlayın.
6. çok katmanlı MSC cep sayfası alma
- Otoklav doku taşıyıcı bileşenleri için 30 min 1,5 mL santrifüj tüpleri, forseps ve dişli forseps dahil olmak üzere, 121 ° C'de ve aletler.
- Giriş kanalı konteyner kültür ortamına temini durdurmak için cam şişe dışarı çıkarmak.
Not: kültür konteyner boş olduğunda peristaltik pompa durdurun. - Kültür konteyner hücre sayfasından çıkar ve bir kültür tabak koyun.
- Bir forseps doku taşıyıcı hareketsiz başka bir dişli forseps beyaz gerginlik yüzüğü siyah tabanından ayırmak için kullanırsınız. Son olarak, çok katmanlı BMSCs hücre sayfası elde etmek.
- Kısa koruma için her hücre sayfa 1.5 mL santrifüj tüpü forseps ile transfer edilebilir. DPP iskele santrifüj tüpü iç duvarına bitişik ve hücre levha yayıldı out santrifüj tüpü mümkün olduğu kadar.
- Yavaşça kültür orta 1 mL hücre sayfası sokmak için santrifüj tüpü ekleyin. Santrifüj tüpü kapağı kapatın ve hücre sayfa 4 ° C'de depolayın
Not: Hücre sayfası nakledilen veya en kısa zamanda analiz gerekir. Bu 4 h hücre sayfasında kullanmak için tavsiye edilir.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Çok katmanlı kök hücre sayfası inşaat şematik resim 1' de gösterilen. Hücre sayfası iskele PLA2 decellularization yöntemi tarafından hazırlanması için ilk adımdır. İskele üzerinde bağlı olarak, geçici 3D hücre yapısı kök hücre RAD16-1 peptid hidrojel ile karışımı ile inşa edilmiştir. Uygun kök hücre bioactivity ve en iyi mekanik gücü ile bir çok katmanlı hücre sayfası elde etmek için hücre sayfası dinamik perfüzyon sisteminde kültürlü. Dinamik beslenme kaynağı altında kök hücre çoğalırlar ve çok katmanlı hücre sayfası içinde hücre temas kurmak için izin verilir ve son kararlı çok katmanlı hücre levha ürün elde edilebilir sonra ~ 24-72-saat ekimi.
Bu durumda, hücre sayfası iskele DPP PLA2 decellularization yöntemi tarafından hazırlanmıştır. Kurutulmuş DPP görünümünü düz, pürüzsüz ve yarı saydam (Şekil 3A). PLA2belirli lyse etkisi sayesinde, türdeş olmayan hücreleri tamamen doğal kolajen DPP iskele içinde ultrastructure iyi korunmuş (Şekil 3B) ve bu korumak için önemlidir kaldırılabilir mekanik güç ve biyouyumluluk iskele. Ayrıca, iskele kök hücre büyümesini desteklemek ve in vivo rejenerasyon13artırmak için bir büyüme faktörü kontrol yayın sistemi değiştirilebilir.
Kök hücre ~ % 80-%90 izdiham ulaştığınızda, hücreler kültür çanak izole edilmiştir ve % 10 sükroz çözümle yıkanmış. Santrifüjü sonra hücreleri RAD16 ile karıştırılır-ben peptid hidrojel ve rehydrated DPP iskele eklendi. Geçici bir çok katmanlı yapı bir iki saatlik statik kültür takip oluşur. Son olarak, çok katmanlı BMSC levha ürün (Şekil 4) 48 saat kültür dinamik perfüzyon sistemi aşağıdaki kazanılır. DPP iskele desteğiyle, hücre sayfası forseps ile kolayca manipüle edilebilir ve bu geçici olarak 1,5 mL tüp 4 ° C'de kültür ortamda 4 saat muayene veya nakli (Şekil 4) önce korunabilir. Sonuç gösterir boyama ayirt BMSCs CD90 ve CD29 için kök hücre işaretleri son derece olumludur. Hücre sayfası inşaat, çok katmanlı hücre sayfası Haritayı yüksek seviye CD29 ve CD90 içinde BMSCs sonra (Şekil 5).

Resim 1 : Çok katmanlı kök hücre sayfası oluşturma akış çizelgesi. (A)PLA2 decellularized yöntemini kullanarak, doğal hücre dışı matrisler DPP iskele iyi korunmuş olmakla birlikte FPP türdeş olmayan hücrelerde yok edilir. DPP iskele (B) göre geçici çok katmanlı hücre yapısı kök hücre karıştırma ve peptid hidrojel kendi kendine montaj inşa edilmiştir. (Takip etmek,C) hücre sayfası bir 3D dinamik sistem kültürlü ve kök hücre çoğalırlar ve dinamik beslenme kaynağı altında hücre temas kurmak bekleniyor. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2 : Doku taşıyıcı ve dinamik perfüzyon sistemi. (A) Bu paneli gösterir 13 mm çaplı doku taşıyıcı. (B) Bu panel montaj dinamik perfüzyon sistemi gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
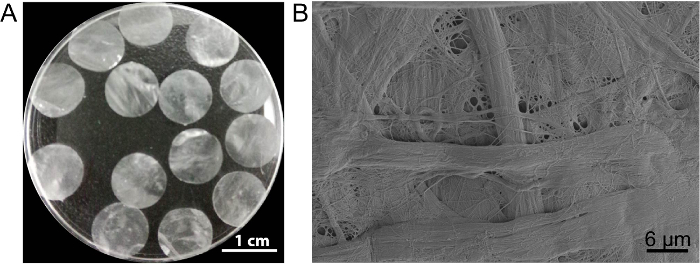
Şekil 3 : Görünüm ve DPP ultrastructure. (A) Bu panel 10.5 mm çap DPP iskele görünümünü gösterir. (B) Bu panel DPP iskele taramalı elektron mikroskobu (SEM) sonucu temsilcisi bir görüntüsünü gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
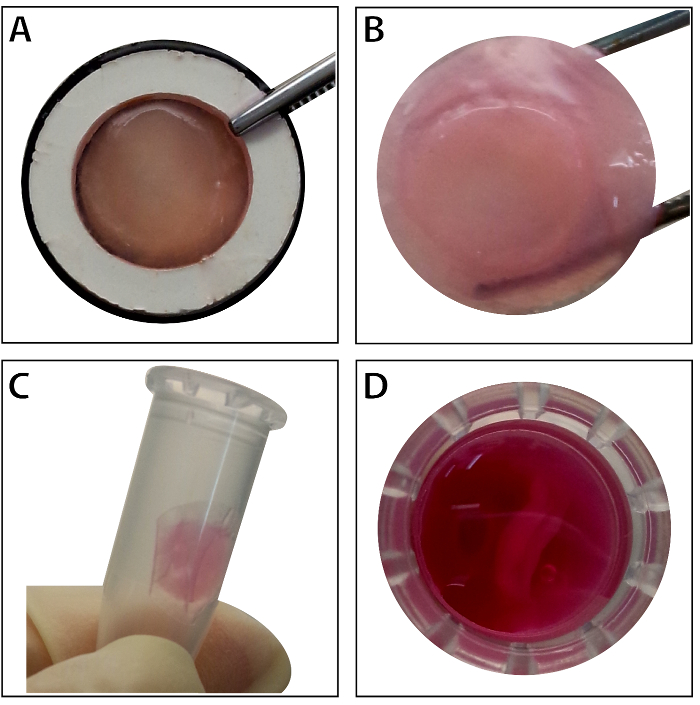
Şekil 4 : Çok katmanlı BMSC sayfası görünümünü. Çok katmanlı BMSC görünümünü sayfa içinde doku taşıyıcı (A) Bu panel gösterir. (B) olduğu gibi çok katmanlı BMSC sayfası forseps tarafından düzenlenmektedir. (C - D) Çok katmanlı hücre sayfası geçici olarak kullanmadan önce 1,5 mL tüp içinde korunmuş olacak. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
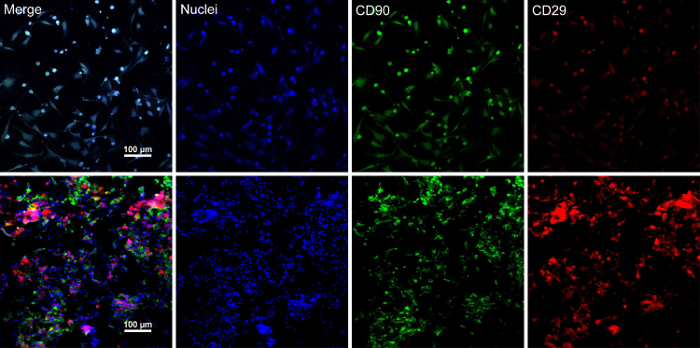
Şekil 5 : BMSC işaretleri ifadenin sonuçlarını boyama ayirt. (A) Bu panel gösterir ayirt BMSCs sonuçlar hücre sayfası inşaat önce boyama. (B) Bu panel sonuçları çok katmanlı BMSC sayfa bölümünün boyama ayirt gösterir. CD90 (yeşil) ve CD29 (kırmızı) olumlu BMSCs ve hücre sayfasını ifade edildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Mevcut iletişim kuralı çok katmanlı bir MSC sayfası oluşturmak için verimli bir yöntem bildirir. Bu hücre sayfasını en iyi mekanik güç, yüksek hücre tohumlama yoğunluğu ve olumlu kök hücre bioactivity sergiler. BMSCs örnek olarak kullanarak, 3D hücre yapısı hızlı bir şekilde RAD16 ile inşa edilmiştir-Ben peptid hidrojel. Dinamik perfüzyon sistemi kültürlü sonra çok katmanlı BMSC sayfası başarıyla alındı ve kök hücre işaretlerinin yüksek bir ifade BMSCs korumak.
Geçici çok katmanlı hücre yapısını oluşturma Protokolü'nün kritik bir adımdır. RAD16-ben ticari hidrojel peptid, ve % 1 amino asit ve % 99 sudan oluşmaktadır. Çeşitli çalışmalarda bu peptid hidrojel doğal ECM çevre taklit edebilir ve kök hücre çoğalması ve hayatta kalma15,16,17için yararlı olduğunu bildirdi. Mevcut protokolünde bir üç milyon MSC süspansiyon (20 µL % 10 sükroz çözüm) RAD16 20 µL ile karışık oldu-ben peptid hidrojel. Hücre süspansiyon ve peptid hidrojel hacim oranı 1:1 idi. Bu peptid hidrojel çevre pH değerine duyarlıdır ve pH değeri asit için tarafsız değiştiğinde peptid molekülleri otomatik olarak 3D ağ kuracaktı. Hücre yüzeyine yüklü parçacıklar içerdiğinden, hücre karışımı sıvıyı hidrojel etkileri vardır bir kısa sürede hücreleri bile karıştırma değiştirildi. Olumlu bir hücre hidrojel hücre süspansiyon ve peptid hidrojel bile bir karışımı olmalı ve iskele eşit olarak eklenecek hücre karışımı sağlar. Araştırmacılar karışımı koşulu numaralı seribaşı cep telefonu numarasını, sukroz çözüm cilt ve peptid hidrojel birim onların gerçek ihtiyaca göre değiştirerek optimize edebilirsiniz. % 10 sükroz çözüm hücrelerle yıkama anlamaya faydalıdır ve eşit olarak hücre hidrojel karışımı karıştırma Protokolü'nün önemli adımlardır ve düzensiz bir karışımı büyük hücre kaybı ve kararsız bir geçici çok katmanlı yapısı neden olabilir.
Peptid hidrojel ağ uzun vadeli çok katmanlı hücre yapısını korumak ve hücre için güçlü değil hücre hidrojel karışımı DPP iskele üzerine ekledikten sonra çok katmanlı hücre sayfa yapısı mekanik gücü zayıf sayılır, çünkü bağlantıları ve ECM salgıları hücre sayfası kararlılığını geliştirmek için ihtiyaç vardır. Ayrıca, kültür orta dinamik infiltrasyonu çoğalırlar ve yetersiz beslenme kaynağı hücre apoptosis neden ve hücre yoğunluğu azaltmak iken çok katmanlı hücre yapısı içinde hücre temas kurmak için kök hücre kolaylaştırabilir hücre13sayfa. Bu nedenle, dinamik perfüzyon sistemi çok katmanlı hücre sayfa yapısı istikrar için önemlidir. Ayrıca, kültür orta uygun akış hızı belirli kök hücre tipi ve yoğunluğu tohum hücre göre ayarlanmalıdır. Ayrıca, zayıf mekanik bağlantı DPP iskele ve çok katmanlı hücre yapısı arasındaki çok katmanlı hücre katmanları ve iskele bölümü neden olabilir mevcut inşaat yöntemi sınırlandırılması kalır. Bu nedenle, daha fazla çalışmalar 3D hidrojel iskele ve DPP iskele mekanik biyouyumluluk geliştirmek için gereklidir.
Şimdiye kadar doku mühendisliği bilim adamları coculturing endotel hücreleri18 gibi verimli beslenme kaynağı sistemleri vitro, kurulması ve gözenekli iskele19kullanarak üzerinde yoğunlaştık. Ancak, geleneksel statik 3D kültür sistemi içinde 3D yapısı içinde beslenme geçirgenliği düşüktür ve kök hücre canlılığı büyük ölçüde etkilenir. Bu durumda, dinamik perfüzyon sistemi kullanarak kök hücre canlılığı korumak için yeterli beslenme kaynağı sağlayabilir. Bu iletişim kuralını kullanan, çok katmanlı BMSC sabıkası geliştirilmiş kardiyak fonksiyon ve anjiogenezi bir sıçan miyokard infarktüsü modeli13' te. Kök hücre levha ürün yüksek hücre yük ve olumlu kök hücre özellik inşa doku rejenerasyonu için önemlidir. Bu verimli inşa yöntemi kullanarak çok katmanlı kök hücre sayfaları farklı türde numaralı seribaşı kök hücre tipleri, epitel kök hücre sayfa, nöral kök hücre levha veya kardiyak kök hücre sayfası gibi değiştirerek inşa. Daha fazla keşifler ve alternatifler çok katmanlı kök hücre sayfasına uygulamaları daha fazla doku rejenerasyonu için genişletmek için bekleniyor.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar ifşa gerek yok.
Acknowledgments
Bu eser Ulusal Doğa Bilimleri Vakfı Çin tarafından (grant numarası 31771064); desteklenmiştir Bilim ve teknoloji planlama projesi, Guangdong Eyaleti (grant numaraları 2013B010404030, 2014A010105029 ve 2016A020214012); Bilim ve teknoloji planlama proje Guangzhou (grant numarası 201607010063); ve lisans yenilik ve Girişimcilik Eğitim programı (grant numarası 201610559028); Ulusal Bilim Vakfı (sayı 31800819 vermek) Çin genç bilim adamları için.
Materials
| Name | Company | Catalog Number | Comments |
| Phospholipase A2 | Sigma-Aldrich | P6534 | |
| Sodium deoxycholate | Sigma-Aldrich | D6750-100G | |
| Phosphate buffer | Gibco BRL | 89033 | |
| Penicillin streptomycin / amphotericin | Gibco BRL | 15640055 | |
| Buffer bicarbonate | Sigma-Aldrich | C3041 | |
| Table concentrator | Changzhou Aohua Instrument Co. | KT20183 | |
| Dulbecco's Modified Eagle Medium(DMEM) | Corning Cellgro | 10-014-CVR | |
| South American fetal bovine serum | Gibco BRL | 10270-106/P30-3302 | |
| L-Glutamine | Corning Cellgro | 25-005-CI | |
| 0.25% Trypsin/2.21 mM EDTA | Corning Cellgro | 25-053-CI | |
| Biosafety cabinet | Esco,Singapore | AC2-2S1 | |
| Constant temperature incubator | Esco,Singapore | CLS-170B-8 | |
| Centrifuge tube | Corning | 430790 | |
| EP tube | Axygen | 31617934 | |
| Centrifugal machine | TOMOS | 1-16R | |
| Sucrose | Sigma-Aldrich | S9378-500G | |
| Pura Matrix | BD | 354250 | |
| Dynamic perfusion culture system | Minucells and Minutissue | D-93077 | |
| Peristaltic pump | Ismatec | IPC N8 | |
| Pump tubing | Ismatec | Nr.1306 | |
| MINUSHEET 1300 | Regensburg | tissue carrier components | |
| MINUSHEET | Regensburg | dynamic perfusion system | |
| MINUSHEET 0006 | Regensburg | gas exchange equipment | |
| MINUSHEET 0002 | Regensburg | 500 mL glass bottle | |
| MINUSHEET 1301 | perfusion culture container |
References
- Miyahara, Y., et al. Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nature Medicine. 12 (4), 459-465 (2006).
- Narita, T., et al. The use of cell-sheet technique eliminates arrhythmogenicity of skeletal myoblast-based therapy to the heart with enhanced therapeutic effects. International Journal of Cardiology. 168 (1), 261-269 (2013).
- Narita, T., et al. The Use of Scaffold-free Cell Sheet Technique to Refine Mesenchymal Stromal Cell-based Therapy for Heart Failure. Molecular Therapy. 21 (4), 860-867 (2013).
- Matsuo, T., et al. Efficiently Piled-Up Cardiac Tissue-Like Sheets With Pluripotent Stem Cell-Derived Cells Robustly Promotes Cell Engraftment and Ameliorates Cardiac Dysfunction After Myocardial Infarction. Circulation. 128 (22), (2013).
- Alshammary, S., et al. Impact of cardiac stem cell sheet transplantation on myocardial infarction. Surgery Today. 43 (9), 970-976 (2013).
- Chen, G. P., et al. The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness. Journal of Biomedical Materials Research Part A. 67a (4), 1170-1180 (2003).
- Cerqueira, M. T., et al. Human Adipose Stem Cells Cell Sheet Constructs Impact Epidermal Morphogenesis in Full-Thickness Excisional Wounds. Biomacromolecules. 14 (11), 3997-4008 (2013).
- Sasagawa, T., Shimizu, T., Sekiya, S., Yamato, M., Okano, T. Comparison of angiogenic potential between prevascular and non-prevascular layered adipose-derived stem cell-sheets in early post-transplanted period. Journal of Biomedical Materials Research Part A. 102 (2), 358-365 (2014).
- Ishii, M., et al. Multilayered adipose-derived regenerative cell sheets created by a novel magnetite tissue engineering method for myocardial infarction. International Journal of Cardiology. 175 (3), 545-553 (2014).
- Godier-Furnemont, A. F., et al. Composite scaffold provides a cell delivery platform for cardiovascular repair. Proceedings of the National Academy of Sciences of the United States of America. 108 (19), 7974-7979 (2011).
- Liu, Y., et al. Electrospun nanofibrous sheets of collagen/elastin/polycaprolactone improve cardiac repair after myocardial infarction. American Journal of Translational Research. 8 (4), 1678-1694 (2016).
- Arana, M., et al. Epicardial delivery of collagen patches with adipose-derived stem cells in rat and minipig models of chronic myocardial infarction. Biomaterials. 35 (1), 143-151 (2014).
- Wang, Y., et al. Preparation of high bioactivity multilayered bone-marrow mesenchymal stem cell sheets for myocardial infarction using a 3D-dynamic system. Acta Biomaterialia. 72, 182-195 (2018).
- Wu, Z., et al. The use of phospholipase A(2) to prepare acellular porcine corneal stroma as a tissue engineering scaffold. Biomaterials. 30 (21), 3513-3522 (2009).
- Degano, I. R., et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation. Biomaterials. 30 (6), 1156-1165 (2009).
- Lampe, K. J., Heilshorn, S. C. Building stem cell niches from the molecule up through engineered peptide materials. Neuroscience Letters. 519 (2), 138-146 (2012).
- Cui, X. J., et al. Transplantation of Mesenchymal Stem Cells with Self-Assembling Polypeptide Scaffolds Is Conducive to Treating Myocardial Infarction in Rats. Tohoku Journal of Experimental Medicine. 222 (4), 281-289 (2010).
- Jun, I., et al. Spatially Assembled Bilayer Cell Sheets of Stem Cells and Endothelial Cells Using Thermosensitive Hydrogels for Therapeutic Angiogenesis. Advanced Healthcare Materials. 6 (9), (2017).
- Chen, C. H., et al. Porous tissue grafts sandwiched with multilayered mesenchymal stromal cell sheets induce tissue regeneration for cardiac repair. Cardiovascular Research. 80 (1), 88-95 (2008).



