ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Een protocol voor de bereiding van poly (pentafluorfenyl acrylaat) (poly(PFPA)) geënt silica kralen wordt gepresenteerd. Vervolgens wordt het functionalized oppervlak van poly(PFPA) geïmmobiliseerd met antilichamen en met succes gebruikt voor de scheiding van de eiwitten door middel van immunoprecipitation.
Abstract
We laten zien een eenvoudige methode om te bereiden poly (pentafluorfenyl acrylaat) (poly(PFPA)) geënt silica kralen voor antilichaam immobilisatie en latere immunoprecipitation (IP)-toepassing. Het poly(PFPA) geënte oppervlak is bereid via een eenvoudige stappen. In de eerste stap, wordt 3-aminopropyltriethoxysilaan (APTES) gestort als een linker molecuul op het oppervlak van siliciumdioxide. In de tweede stap, poly(PFPA) homopolymeer, gesynthetiseerd via de omkeerbare toevoeging en versnippering keten overdracht (vlot) polymerisatie, aan de linker molecule door de reactie van de uitwisseling tussen de eenheden pentafluorfenyl (PFP) is geënt op de polymeer en de amine groepen op APTES. De afzetting van APTES en poly(PFPA) op de silica deeltjes zijn bevestigd door X-ray photoelectron spectroscopy (XPS), evenals gecontroleerd door het deeltje grootte aanpast gemeten via Dynamische lichtverstrooiing (DLS &). Om de oppervlakte hydrophilicity van de parels, de gedeeltelijke vervanging van de poly(PFPA) met poly(ethylene glycol) amine-matiemaatschappij (amino-PEG) wordt ook uitgevoerd. De PEG-gesubstitueerde poly(PFPA) geënt silica kralen zijn vervolgens geïmmobiliseerd met antilichamen voor IP-applicatie. Een antilichaam tegen proteïne kinase RNA-geactiveerd (PKR) is werkzaam voor demonstratie, en IP-efficiëntie wordt bepaald door het westelijke bevlekken. De resultaten van de analyse weergeven dat het antilichaam geïmmobiliseerd kralen inderdaad kunnen worden gebruikt voor het verrijken van PKR, terwijl niet-specifieke eiwitinteractie minimaal zijn.
Introduction
Reactieve polymeren borstels hebben veel belangstelling in de afgelopen jaren ontvangen. Ze kunnen worden gebruikt om te immobiliseren functionele moleculen op organische of anorganische materialen maken van geactiveerde oppervlakken met applicaties op gebieden zoals opsporing en scheiding1,2,3,4, 5. Onder de reactieve polymeren gemeld, zijn die met pentafluorfenyl ester eenheden vooral handig als gevolg van hun hoge reactiviteit met amines en weerstand tegen hydrolyse6. Één dergelijke polymeer is poly(PFPA) kan, en het gemakkelijk matiemaatschappij na polymerisatie met moleculen bevat primaire of secundaire amines7,,8,,9,10. In een voorbeeld, waren poly(PFPA) borstels reageerde met amino-spiropyrans maken van licht-responsieve oppervlakken7.
De voorbereiding van de poly(PFPA) en haar toepassingen zijn beschreven in een aantal eerdere publicaties6,7,8,9,10,11,12 ,13,14,15,16,17. In het bijzonder rapporteerden Theato en medewerkers de synthese van poly(PFPA) borstels via zowel "enten te" en "enten van" methoden7,8,10,11,12 . In de "enten te" aanpak, een poly (methylsilsesquioxaan)-poly (pentafluorfenyl acrylaat) (poly(MSSQ-PFPA)) hybride polymeer was gesynthetiseerde8,10,11,12. De poly(MSSQ)-component was in staat om de sterke adhesie van de vorm met een aantal verschillende organische en anorganische oppervlakken, waardoor het poly(PFPA) onderdeel vormen van een borstel-laag op het gecoate oppervlak van materiaal. In de "enten van" aanpak, oppervlak geïnitieerd omkeerbare toevoeging en versnippering keten overdracht (SI-vlot) polymerisatie te bereiden poly(PFPA) borstels7werkzaam was. In dit geval, was een agent van de postoverdracht oppervlakte geïmmobiliseerdet keten (SI-CTA) eerst covalent gekoppeld aan het substraat via silica-silane reactie. De geïmmobiliseerdet SI-CTA deelgenomen vervolgens in de SI-vlot polymerisatie van PFPA monomeren, genereren van dichtbevolkte verpakte poly(PFPA) borstels met stabiele covalente verbinding met het substraat.
Door gebruik te maken van de borstels van de poly(PFPA) gesynthetiseerd via SI-vlot polymerisatie, we onlangs aangetoond de immobilisatie van antilichamen op de poly(PFPA) geënt silica deeltjes en hun latere toepassing in eiwit zuivering18. Het gebruik van poly(PFPA) borstels voor antilichaam immobilisatie werd gevonden voor het oplossen van een aantal kwesties in verband met de huidige eiwit scheiding via IP. Conventionele IP is afhankelijk van het gebruik van eiwitten A/G als een linker voor antilichaam immobilisatie19,20,21. Aangezien het gebruik van eiwitten A/G de antilichamen worden verbonden met een specifieke oriëntatie toestaat, wordt hoge doel antigeen herstelcapaciteit bereikt. Echter, het gebruik van eiwitten A/G lijdt aspecifieke eiwit interactie evenals het verlies van antistoffen tijdens het herstel van de eiwitten, die beide tot een hoog niveau van achtergrondgeluiden bijdragen. U kunt oplossen door deze tekortkomingen, is directe crosslinking van de antilichamen aan een stevige steun onderzocht22,23,24. De efficiëntie van deze technieken is meestal minder intensief als gevolg van de willekeurige oriëntatie van de kruisverwijzende antilichamen. Voor de poly(PFPA) geënt substraat is de immobilisatie van antilichamen blijvend, bereikt door middel van uitwisseling reactie tussen PfP-eenheden en amine functionaliteiten op antilichamen. Hoewel de antilichaam-oriëntatie nog steeds willekeurig is, profiteert het systeem met vele reactieve PfP-sites, controleerbaar door de mate van polymerisatie. Bovendien toonden we die door de gedeeltelijke vervanging van PfP-eenheden met amino-PEG, oppervlakte hydrophilicity kan worden afgestemd, verdere verbetering van de herstelcapaciteit van de eiwitten van de systeem-18. Over het geheel genomen bleken de poly(PFPA) geënt silica deeltjes een effectief alternatief voor traditionele IP met redelijke efficiëntie alsmede veel schoner achtergrond.
In deze bijdrage rapporteren we een alternatieve methode voor te bereiden op poly(PFPA) geënte oppervlak antilichaam immobilisatie en IP-applicatie. In eenvoudige stappen, zoals wordt geïllustreerd in Figuur 1, een APTES linker molecuul wordt eerst gestort op het oppervlak van silica, dan het poly(PFPA) polymeer is covalent gekoppeld aan de linker molecule door de reactie tussen de PfP-eenheden op de polymeer en de amine functies op APTES. Deze voorbereiding methode zorgt voor de permanente crosslinking van poly(PFPA) aan de oppervlakte van een substraat, maar vermijdt de vele complicaties geassocieerd met SI-CTA synthese en SI-vlot polymerisatie van poly(PFPA) borstels. Gedeeltelijke vervanging van de PfP-eenheden met amino-PEG kan nog steeds worden uitgevoerd, waardoor "fine-tuning" van het polymeer borstel oppervlakte-eigenschappen. Laten we de poly(PFPA) geënt silica kralen dus bereid kunnen worden geïmmobiliseerd met antilichamen en kan worden gebruikt voor eiwitverrijking via IP. De gedetailleerde kraal voorbereiding procedure, antilichaam immobilisatie en IP-testen worden beschreven in dit artikel, voor lezers die geïnteresseerd zijn in het zoeken naar een alternatief voor conventionele eiwit A/G op basis van IP.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. bereiding van Poly(PFPA) homopolymeer
- Herkristallisatie van AIBN
- 5 g 2,2'-azobis(2-methylpropionitrile) (AIBN) combineren met 25 mL van methanol in een bekerglas van 250 mL. Dompel het bekerglas in een oliebad 60 ° C, en vervolgens krachtig roer het mengsel met een roer-bar tot AIBN is volledig opgelost.
- Filtreer de warme oplossing door filterpapier (5-8 μm deeltje retentie) en bewaar het filtraat bij 4 ° C tot laat langzaam de kristallen te vormen.
- De recrystallized AIBN verzamelen door filtratie. De verzamelde combineren met 25 mL van de verse methanol en herhaal het proces van herkristallisatie.
- De 2 x recrystallized AIBN in een vacuüm oven bij kamertemperatuur (RT) 's nachts droog. Het produkt opslaat in het donker bij <-10 ° C.
- Synthese van benzyl dithiobenzoate25
- Bereiden een 500 mL drie-nek Rondbodemkolf uitgerust met een magnetische roer-bar, een refluxing condensor, een trechter met kraan en een rubber tussenschot. Verbind de kolf met het stikstof gas lijn door de refluxing condensor heen en spoelen de binnenkant lucht met stikstof. Plaats een thermometer via het septum. 41 mL (0.041 mol) van 1 M oplossing van bromide (en fenylmagnesiumbromide) in tetrahydrofuraan (THF) via een spuit via het dezelfde septum toevoegen.
- Warm de fenylmagnesiumbromide bromide (en) oplossing tot 40 ° C in een oliebad. Voeg vervolgens 3.1 g (0.041 mol) van koolstofdisulfide via de trechter langzaam, de oplossing van de maximumtemperatuur bij 40 ° C.
- 7.1 g (0.042 mol) benzyl bromide (en) toevoegen aan het resulterende mengsel via de trechter meer dan 15 min. verhoging van de temperatuur van de reactie tot 50 ° C. Blijven roeren bij deze temperatuur voor 45 min.
- Breng het reactiemengsel in een separatory trechter en Verdun met 15 mL ijs koud water. Uitpakken van het product door toevoeging van 15 mL diethylether en verwijder de onderste laag water. Herhaal de extractie met diethylether nog tweemaal.
- Was de gecombineerde organische fasen met overvloedige hoeveelheid water en pekel (oplossing van 50% (m/v) NaCl in water) en droog van het product over watervrij magnesium-sulfaat.
- Verwijder het oplosmiddel in vacuüm bij 35 ° C met een rotatieverdamper.
- Het zuiveren van het product door kolom-chromatografie met behulp van 400 mL silicagel (poriegrootte 60 Å, 63-200 mesh deeltjesgrootte) en petroleumether als het eluent, opbrengst 5 g benzyl dithiobenzoate (BDB) als rode olie. Bevestig de zuiverheid van het product door 1H NMR (400 MHz, CDCl3): δ 8.02-7,99 (2 H, m), 7.55-7,50 (1 H, m), 7.41-7.29 (7 H, m), 4,60 (2 H, s).
- Synthese van poly(PFPA) via vlot polymerisatie9,26
- Verkrijgbare PFPA monomeer bevat een kleine hoeveelheid remmers. Voordat de polymerisatie, door de remmers te verwijderen door het monomeer passeren een wegwerp injectiespuit vol met fundamentele aluminiumoxide.
- Voeg 0.4 mg (0.0024 mmol) recrystallized AIBN, 4,3 mg (0,018 mmol) van BDB, 1012 mg (4,25 mmol) van de Inhibitor van de omwenteling-vrije PFPA en 0,7 mL van watervrij anisol over in een maatkolf van 20 mL Schlenk.
- Verbind de kolf met Schlenk lijn en ontgas het mengsel met ten minste drie cycli van de freeze-pomp-dooi. Kort, bevriezen het reactiemengsel in een bad met vloeibare stikstof. Toepassing vacuüm om te verwijderen van het gas in headspace. De erlenmeyer vervolgens verwijdert uit de buurt van vloeibare stikstof om de inhoud te ontdooien op RT.
- Plaats de kolf in een oliebad 70 ° C en gedurende 4 uur onder N2 purge reageren.
- Voor het verbreken van de reactie, de kolf uit het oliebad verwijderen en de inhoud van de reactie in de lucht blootstellen.
- Neerslaan van het polymeer in koude methanol, vervolgens het herstelde polymeer in een vacuüm oven op 40 ° C's nachts droog.
- Gebruiken voor het meten van het molecuulgewicht van het polymeer, gelpermeatiechromatografie (GPC). Gebruik THF als de mobiele fase bij 35 ° C met een 1 mL/min stroom tarief en teken de ijkcurve met behulp van monodispers polystyreenstandaards. Verwerven van GPC meting, los het polymeer in THF (1-2 mg/mL) en filter door 0.2 micrometer wegwerp polytetrafluorethyleen (PTFE) filter. Injecteren 100 μl van het monster in de GPC-instrument. De retentietijd van de te meten monster omzetten in molecuulgewicht met behulp van de ijkcurve polystyreen.
2. bereiding van Poly(PFPA) matiemaatschappij SiO2 kralen
- Behandeling van SiO2 kralen met APTES
- SiO2 deeltjes zijn beschikbaar in de vorm van een waterige suspensie van 5% (m/v). 0,8 milliliters SiO2 schorsing combineren met 40 mg APTES en 8 mL van methanol in een flesje van 20 mL Scintillatie uitgerust met een roer-bar.
- Laat de reactie om verder te gaan op RT voor 5 h met krachtig roeren.
- Breng de oplossing over in een conische buis. Matiemaatschappij SiO2 kralen om te isoleren van de APTES, centrifugeren van de oplossing bij 10.000 x g gedurende 5 minuten en verwijder het supernatant. Het wassen van de kralen door opnieuw verspreiden ze in 3 mL verse methanol. Schudden van de buis met de hand voor het mengen, maar indien nodig, de spreiding te verbeteren met het ultrasoonapparaat in een waterbad voor een paar seconden. Centrifugeer de kralen bij 10.000 x g gedurende 5 min. Verwijder het supernatant en herhaal de wassen stap één meer tijd.
- Combineer de gewassen SiO2 kralen met dimethylsulfoxide (DMSO) 3 mL methanol. Schud het mengsel met de hand, of indien nodig voor een paar seconden, totdat de kralen zijn volledig gedispergeerd in DMSO Bewerk ultrasone trillingen ten. Centrifugeer de kralen bij 10.000 x g gedurende 5 min en deze vervolgens verwijdert het supernatant. Herhaal de stap om te zorgen voor volledige oplosmiddel uitwisseling van methanol aan DMSO.
Opmerking: De uiteindelijke schorsing bevat de APTES matiemaatschappij SiO2 kralen gedispergeerd in 4 mL van DMSO. - Om te controleren de korrelgrootteverdeling, door DLS analyses uit te voeren. Neem een druppel van de schorsing in stap 2.1.4 en plaats bereid in een wegwerp UV cuvette. Verdun het monster door het invullen van de Cuvet met verse DMSO totdat er 2/3 vol. Plaats het monster in de kaarthouder van de cel om te beginnen van data-acquisitie. Voor deeltje grootte meten, gebruikt u de volgende setup-parameters: temperatuur: 25 ° C; Equilibratietijd: 120 s; Duur van de meting: automatische.
- Om te controleren de oppervlakte samenstelling, door de XPS analyses uit te voeren. Een kleine steekproef van de opschorting opgesteld in stap 2.1.4 in vacuüm oven op 40 ° C's nachts droog. Neem de gedroogde polymeer en pack gelijkmatig op een monsterhouder 0,5 x 0,5 cm. Het monster in de hoge Vacuuemcel (10-8 torr) laden en data-acquisitie beginnen. Voor het bijzondere XPS-instrument gebruikt, het genereren van de photoelectrons met behulp van een monochromatische Al Kα X-ray geëxploiteerd op 15 kV en 6,7 mA, en verzamelen hybride modus vergroting met de analyzer op een 50 eV geeft energie voor hoge resolutie spectra, en een 100 eV doorgeven energie voor elementaire enquêtes.
- Enten van poly(PFPA) naar APTES matiemaatschappij SiO2 kralen
- Bereid de oplossing van de poly(PFPA) door het oplossen van 20 mg poly(PFPA) in 2 mL zuiver DMSO in een flesje van 20 mL scintillatie.
Opmerking: In deze studie, een relatief laag moleculair gewicht poly(PFPA) (20 kg/mol) wordt gebruikt. Dus, ondanks de hoge polymeer concentratie (10 mg/mL), geen bewijs van polymeer crosslinking wordt waargenomen. Als een hoger moleculair gewicht polymeer wordt gebruikt, dan polymeer oplossing concentratie moet mogelijk worden aangepast om te voorkomen dat mogelijke crosslinking. - Voeg 1 mL APTES matiemaatschappij SiO2 kralen geschorst in DMSO (uit stap 2.1.4) aan de oplossing van poly(PFPA). Reageren op RT voor 1 h met krachtig roeren.
- De poly(PFPA) geënt SiO2 kralen isoleren door centrifugeren bij 10.000 x g gedurende 5 min, gevolgd door het verwijderen van de bovendrijvende substantie. Het wassen van de kralen door 3 mL DMSO en meng door beide schudden met de hand of enkele seconden van ultrasoonapparaat toe te voegen. Centrifugeer de kralen bij 10.000 x g gedurende 5 min en deze vervolgens verwijdert het supernatant. Wassen van de poly(PFPA) geënt SiO2 parels met DMSO tweemaal herhalen
- Wassen van de kralen twee keer meer met drievoudige gedestilleerd water (TDW). In deze stap de kralen combineren met 3 mL TDW en meng door het schudden met de hand of enkele seconden van ultrasoonapparaat. Centrifugeer de kralen bij 10.000 x g gedurende 5 min en deze vervolgens verwijdert het supernatant.
- Uitvoeren om te controleren de korrelgrootteverdeling, DLS volgens de procedure die is beschreven in stap 2.1.5. Uitvoeren om te controleren de oppervlakte chemie, XPS volgens de procedure die is beschreven in stap 2.1.6.
- Bereid de oplossing van de poly(PFPA) door het oplossen van 20 mg poly(PFPA) in 2 mL zuiver DMSO in een flesje van 20 mL scintillatie.
3. bereiding van SiO2 kralen geënt met PEG-gesubstitueerde Poly(PFPA)
- Ter voorbereiding van de poly(PFPA) oplossing, los 20 mg poly(PFPA) in 2 mL zuiver DMSO in een flesje van 20 mL scintillatie.
- Ter voorbereiding van PEG oplossing, los amine-matiemaatschappij PEG in 1 mL van DMSO. De exacte hoeveelheid PEG gebruikt wordt bepaald door de gewenste mate van PfP-substitutie, bepaald door de onderstaande vergelijking:
Bedrag van amino-PEG (g/g-poly(PFPA)) = (N_poly(PFPA) x % PEG-Sub) x (MW_PEG / MW_poly(PFPA))
waarbij N_poly(PFPA) = poly(PFPA) mate van polymerisatie
PEG-Sub % = percentage PEG vervangen
MW_PEG = molecuulgewicht van amino-PEG
MW_ poly(PFPA) = molecuulgewicht van poly(PFPA) - Breng de PEG-oplossing over de poly(PFPA) oplossing. Reageren op RT voor 1 h met krachtig roeren.
- Ter voorbereiding van APTES matiemaatschappij SiO2 kralen geschorst in DMSO, volg dezelfde stappen die worden weergegeven in stap 2.1. Breng 1 mL van de schorsing van de parel in de PEG-gesubstitueerde poly(PFPA) oplossing bereid in stap 3.3. Laat de enting tussen poly(PFPA) en APTES matiemaatschappij SiO2 kralen om verder te gaan op RT voor 1 h met krachtig roeren.
- Het isoleren van de kralen door centrifugeren bij 10.000 x g gedurende 5 min, gevolgd door het verwijderen van de bovendrijvende substantie. Het wassen van de kralen door 3 mL DMSO en meng door beide schudden met de hand of enkele seconden van ultrasoonapparaat toe te voegen. Centrifugeer de kralen bij 10.000 x g gedurende 5 min en deze vervolgens verwijdert het supernatant. Herhaal de DMSO wash tweemaal.
- De kralen twee keer meer met TDW wassen. In deze stap de kralen combineren met 3 mL TDW en meng door het schudden met de hand of enkele seconden van ultrasoonapparaat. Centrifugeer de kralen bij 10.000 x g gedurende 5 min en deze vervolgens verwijdert het supernatant.
- De kralen bij 40 ° C in een vacuüm oven's nachts droog.
4. antilichaam immobilisatie op Poly(PFPA) geënt SiO2 kralen
Opmerking: Dezelfde procedure is gebruikt ongeacht percentage PEG substitutie op poly(PFPA). Bereiden fosfaatgebufferde zoutoplossing (PBS) door het oplossen van PBS tablet in TDW. Bereiden van 0,1% (v/v) fosfaatgebufferde zoutoplossing met Tween-20 (PBST) door toevoeging van 1/1000 van Tween-20 aan PBS.
- Voeg toe 5 mg poly(PFPA) geënt SiO2 kralen aan een 1,5 mL microcentrifuge buis.
- Het wassen van de kralen door 800 µL van PBS en meng goed door vortexing toe te voegen. Centrifugeer de kralen bij 10.000 x g bij RT voor 1 min. Verwijder het supernatant en herhaal de stap van wassen drie keer.
- Voeg 350 µL van verse PBS, 50 µL 0,1% (v/v) PBST en 6.67 µg van het antilichaam. Incubeer ~ 20 h op een rotator bij 4 ° C.
- Wassen van de kralen als u wilt verwijderen niet-afhankelijke antistoffen. De parels op 400 x g centrifugeren en 4 ° C voor 1 min. het supernatant verwijderen en Voeg 400 µL van lysis buffer zorgvuldig. Zachtjes resuspendeer de kralen op en neer waarbij eveneens voor vijf keer.
Opmerking: Lysis buffer die wordt gebruikt om te wassen van de kralen moet tevens gebruikt tijdens lysis van de cel en IP, behalve dat de toevoeging van dithiothreitol en protease inhibitor zijn optioneel, (zie stap 5). - Herhaal deze stap van wassen drie keer. Na de definitieve wash, verwijder de bovendrijvende vloeistof zoveel mogelijk.
5. cel Lysis en Immunoprecipitation
- Voorbereiding van lysis buffer en was buffer
- Bereiden de lysis-buffermengsel (50 mM Tris-HCl (pH 8,0), 100 mM KCl, 0,5% (v/v) NP-40, 10% (v/v) glycerol, 1 mM dithiothreitol (DTT) en protease inhibitor cocktail).
- Het was buffer (50 mM Tris-HCl (pH 8,0), 100 mM KCl, 0,1% (v/v) NP-40 en 10% (v/v) glycerol) voor te bereiden.
- Opslaan van de bufferoplossingen bij 4 ° C.
- Voorbereiding van de cellen
- Zaad van de cellen (HeLa cellen) één of twee dagen vóór de IP-experiment, en de cellen bij 37 ° C en 5% CO2groeien.
- Ongeveer 1.4 x 107 cellen met een cel schraper en overdracht in een conische tube van 15 mL verzamelen. Centrifuge de cellen bij 380 x g bij RT voor 3 min. Verwijder het supernatant en resuspendeer met 1 mL koude PBS en overdracht in een tube van 1,5 mL microcentrifuge.
- Centrifugeer de cellen bij 10.000 x g bij 4 ° C gedurende 30 s. verwijderen het supernatant netjes. Cel pellets kunnen worden achtergelaten bij-80 ° C na het verwijderen van de bovendrijvende substantie.
- Voorbereiding van cel lysates
- Resuspendeer de pellet cel met 400 µL van de lysis-buffermengsel. Bewerk ultrasone trillingen ten de cellen met behulp van een ultrasonicator.
- Na het ultrasoonapparaat, vortex kort en centrifuge de lysate bij 20.000 x g bij 4 ° C gedurende 10 minuten.
- Het supernatant overbrengen in een nieuwe 1,5 mL centrifugebuis.
- Immunoprecipitation
- 300 µL van cel lysate overbrengen eerder bereid antilichaam geïncubeerd poly(PFPA) geënt SiO2 parels. Behouden 30 µL van de cel lysate als voorbeeld voor de invoer in een nieuwe microcentrifuge buis. Opslaan van het input monster bij 4 ° C.
Opmerking: De totale hoeveelheid eiwit in cel lysate moet ongeveer 4 mg. - Incubeer de lysate/kralen mengsel gedurende 3 uur op een rotator bij 4 ° C.
- Centrifugeer het mengsel bij 400 x g bij 4 ° C voor 1 min. Verwijder het supernatant en Voeg 400 µL van was buffer zorgvuldig. Zachtjes resuspendeer de kralen op en neer waarbij eveneens ongeveer vijf keer.
- Herhaal deze stap van wassen drie keer. Na de definitieve wash, verwijder de bovendrijvende vloeistof zoveel mogelijk.
- 2 x natrium dodecyl sulfaat (SDS) laden kleurstof (25% (v/v) glycerol, 0,1% (g/v) bromo fenol blauw (BPB), 60 mM Tris-HCl (pH 6.8), 2% (g/v) SDS en 2,75 mM 2-mercaptoethanol) voor te bereiden. Winkel 2 x SDS laden kleurstof bij-20 ° C. 30 µL van 2 x SDS laden kleurstof toevoegen aan de kralen en de opgeslagen invoer monster en verwarm ze gedurende 10 minuten bij 95 ° C.
- Na Verwarming, analyseren van het monster met behulp van Western blotting27of opslaan van het monster bij-20 ° C.
- 300 µL van cel lysate overbrengen eerder bereid antilichaam geïncubeerd poly(PFPA) geënt SiO2 parels. Behouden 30 µL van de cel lysate als voorbeeld voor de invoer in een nieuwe microcentrifuge buis. Opslaan van het input monster bij 4 ° C.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Een schema voor de bereiding van poly(PFPA) geënt SiO2 kralen, met of zonder PEG vervanging is weergegeven in Figuur 1. Als u wilt controleren de APTES en de poly(PFPA) enten proces, blote SiO2 kralen, APTES matiemaatschappij SiO2 kralen en poly(PFPA) geënt SiO2 kralen worden gekenmerkt door zowel DLS (Figuur 2) en XPS (Figuur 3). IP-efficiëntie van de parels worden bepaald door het westelijke bevlekken. Figuur 4 toont het westelijke bevlekken resultaten voor IP met behulp van 1% PEG-gesubstitueerde poly(PFPA) geënt kralen, waar de kralen worden geïncubeerd met geen antilichamen, een niet-specifieke antilichaam of anti-PKR antilichaam. Figuur 5 toont de westelijke bevlekkende resultaten voor het gebruik van IP-0% PEG-gesubstitueerde poly(PFPA) geënt kralen en 1% PEG-gesubstitueerde poly(PFPA) geënt kralen, beide geïncubeerd met anti-PKR antilichamen.

Figuur 1: Schema voor de bereiding van poly(PFPA) geënt SiO2 kralen met behulp van APTES als een linker-molecuul. (een) Poly(PFPA) geënt kralen. (b) gedeeltelijk PEG-gesubstitueerde poly(PFPA) geënt kralen. Klik hier voor een grotere versie van dit cijfer.

Figuur 2: DLS metingen voor (a) kale SiO2 kralen (SiO2), (b) APTES matiemaatschappij SiO2 kralen (APTES-SiO2) en (c) poly(PFPA) geënt SiO2 kralen (poly (PFPA)-SiO2), verspreide in DMSO. De Z-gemiddelde diameter (d) en de polydispersiteit index (PDI) van elk monster worden gemeld. Klik hier voor een grotere versie van dit cijfer.

Figuur 3: XPS spectra voor kale SiO2 kralen (SiO2), APTES matiemaatschappij SiO2 kralen (APTES-SiO2), en poly(PFPA) geënt SiO2 kralen (poly (PFPA)-SiO2). De pieken onderzocht overeenkomen met (een) Si 2 p, (b) O 1s, (c) N 1s, en (d) F 1s. Klik hier voor een grotere versie van dit cijfer.

Figuur 4: Western blotting resultaten voor IP met behulp van 1% PEG-gesubstitueerde poly(PFPA) geënt kralen, behandeld met geen antilichaam (lane 2), een mengsel van niet-specifieke antilichaam, normale konijn IgG lane (3) of anti-PKR antilichaam (lane 4). Lane 1 toont de input eiwit mengsel voordat IP. Klik hier voor een grotere versie van dit cijfer.

Figuur 5: Western blotting resultaten voor IP met behulp van 0% PEG-gesubstitueerde poly(PFPA) geënt kralen (lane 2) en 1% PEG-gesubstitueerde poly(PFPA) geënt kralen (lane 3), beide zijn behandeld met een anti-PKR antilichamen. Lane 1 toont de input eiwit mengsel voordat IP. Klik hier voor een grotere versie van dit cijfer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De synthese van poly(PFPA) geënt SiO2 kralen wordt geïllustreerd in Figuur 1. Door APTES als een linker-molecuul, kunnen poly(PFPA) borstels covalent geënt op SiO2 substraat bereid worden via een eenvoudige stappen. Hoewel sommige van de PfP-units worden opgeofferd voor de reactie met APTES, een groot aantal van de PfP-eenheden naar verwachting blijven beschikbaar voor latere reactie met amino-PEG of antilichamen. De PfP-groepen staan bekend om te vormen van de lage energie oppervlakken zodat poly(PFPA) borstels niet solvate goed in water28 doen. Voor IP-applicatie, de antilichamen moeten worden geïmmobiliseerd op de borstels van de poly(PFPA), en de reactie van deze uitwisseling gebeurt in waterige bufferoplossing oog op het behoud van de activiteit van de antilichamen. Zoals gemeld in onze vorige publicatie, kunt gedeeltelijke vervanging van de PfP-eenheden met hydrofiele moleculen zoals amine-matiemaatschappij PEG oppervlakte hydrophilicity, wat leidt tot verhoogde antilichaam immobilisatie efficiëntie18verbeteren. In deze studie, gedeeltelijk gesubstitueerd PEG poly(PFPA) is ook bereid en vervolgens naar de SiO2 oppervlakte met behulp van het molecuul APTES linker geënt. Over het geheel genomen kunt de methoden geïllustreerd in afbeelding 1 de voorbereiding van de poly(PFPA) geënt oppervlakken met verschillende graden van PEG substitutie. Deze polymeer borstels met afstembare oppervlakte-eigenschappen bieden een ideaal platform voor antilichaam immobilisatie en latere IP-applicatie.
Het voorbereidingsproces kraal wordt gecontroleerd door zowel Distributielijsten als XPS. De resultaten van de Distributielijsten voor verschillende functionalized SiO2 kralen in DMSO worden samengevat in Figuur 2. De kale SiO2 kralen vertonen hydrodynamische diameter van 666 nm, in overleg met de fabrikant gemeld kraal grootte (0.676 μm; SD = 0,03 μm). Na de APTES behandeling, de diameter kraal stijgt tot 740 nm; en met de poly(PFPA) behandeling, verhoogt de kraal diameter verder tot 1889 nm. Het is belangrijk erop te wijzen dat de polydispersiteit index (PDI) voor de poly(PFPA) geënt kralen vrij groot is (PDI = 0.76), die is indicatief van slechte kwaliteit monster met grote aggregaten. Hoewel de DLS-curve alleen een nano-sized piek toont, kan kleine hoeveelheid aggregaten aanwezig zijn in de opschorting. De functionalized SiO2 kralen worden ook onderzocht door XPS oppervlak samenstelling (Figuur 3) bepalen. Na de APTES behandeling, N 1s piek die is gekoppeld aan de amine groepen op APTES wordt gedetecteerd. En volgende poly(PFPA) behandeling, F 1s piek die is gekoppeld aan de PfP-eenheden op het polymeer wordt gedetecteerd. Deze gegevens tonen samen de succesvolle functionalization van de SiO2 oppervlakte, eerst met APTES, dan met poly(PFPA).
Om aan te tonen dat de poly(PFPA) geënt kralen worden voor eiwitverrijking via IP gebruikt kunnen, we 1% PEG-gesubstitueerde poly(PFPA) geënt kralen gebruikt, en hen geïncubeerd met geen antilichamen, een niet-specifieke konijn IgG antilichamen mengsel of anti-PKR antilichaam. Cel lysate met het doel PKR was gewonnen uit de cel, en PKR verrijking vervolgens via IP met behulp van de drie typen kralen werd uitgevoerd. Om te bepalen IP-efficiëntie, werden de geëlueerd EiwitSteekproeven geanalyseerd tegen twee verschillende antilichamen via het westelijke bevlekken. Anti-PKR antilichaam werd gebruikt voor het visualiseren van het bedrag van PKR hersteld. En anti-GAPDH (glyceraldehyde-3-fosfaat dehydrogenase) antilichaam werd gebruikt als een negatieve controle zoals GAPDH is een overvloedige eiwit dat niet met PKR communiceert. Zoals aangetoond in Figuur 4, kralen geïmmobiliseerd met geen antilichamen of aspecifieke antilichaam mengsel resultaat in geen PKR herstel. In tegenstelling, kunnen de kralen geïncubeerd met anti-PKR antilichaam met succes verrijken PKR, zoals aangegeven door de aanwezigheid van een sterke band van PKR en de afwezigheid van GAPDH band. Deze resultaten stellen voor PEG-gesubstitueerde poly(PFPA) borstels kunnen inderdaad worden matiemaatschappij met antilichamen en gebruikt voor selectieve verrijking van doel eiwit. Opmerking Wanneer eiwit herstel efficiëntie van verschillende kraal systemen worden vergeleken, de IP-experimenten, alsmede de latere westelijke bevlekken analyses gelijktijdig moet gebeuren. Wegens de inherente verschillen bij het uitvoeren van deze experimenten, gegevens die zijn verkregen op afzonderlijke proeven moet je niet rechtstreeks vergelijken.
Zoals gemeld vóór, speelt de oppervlakte hydrophilicity van poly(PFPA) borstels een sleutelrol in de IP-efficiëntie18. Figuur 5 toont het westelijke bevlekken gegevens voor IP hersteld EiwitSteekproeven met behulp van PEG-gesubstitueerde poly(PFPA) geënt kralen van 0% en 1% PEG-gesubstitueerde poly(PFPA) geënt kralen. In beide gevallen waren de kralen met anti-PKR antilichamen geïmmobiliseerd. Terwijl het gebruik van 0% PEG-gesubstitueerde poly(PFPA) in lage PKR herstelcapaciteit resulteert, toont de 1% PEG-gesubstitueerde poly(PFPA) significante verbetering, aangegeven door de selectieve verrijking van het doel PKR over doelsoort GAPDH. In overleg met onze vorige publicatie18verhoogd de behandeling van PEG de oppervlakte hydrophilicity van de poly(PFPA) borstel, waardoor meer PfP-eenheden toegankelijk voor antilichaam immobilisatie, leidt tot de waargenomen verbetering in IP-efficiëntie. Let op, het percentage PEG vervanging gemeld in deze studie kan niet rechtstreeks worden vergeleken met die gemeld in onze vorige studie waarmee SI-vlot gesynthetiseerd poly(PFPA) borstels. De twee gevallen dienst zeer verschillende polymeer borstel bereidingswijzen, zodat het bedrag van de PfP-eenheden beschikbaar met gelijke PEG laden verwachting zeer verschillend. Echter de opmerkingen van de twee studies kwalitatief, eens beide oppervlakte hydrophilicity als een parameter van de belangrijke controle voor het hoge IP-efficiëntie aan te wijzen.
Terwijl oppervlakte hydrophilicity invloed op de hoeveelheid antistoffen gehechtheid aan de borstels van de poly(PFPA), heeft het ook een significant effect op IP-achtergrond als gevolg van niet-specifieke verrijking. In een typische IP-experiment, worden veel wassen stappen uitgevoerd om het verwijderen van niet-afhankelijke eiwitten. Wanneer de kralen zijn zeer hydrofobe, zoals degenen met 0% PEG substitutie, ze de neiging om vorm grote aggregaten, die moeilijk te splitsen. In dit geval, niet-specifieke proteïnen kunnen worden gevangen in de statistische structuren, en wassen kan niet voldoende verwijderen, leidt tot een toename in de achtergrond. Dus, bij het uitvoeren van IP, het is belangrijk voor het optimaliseren van de kraal oppervlakte eigenschap, en aandacht moet worden besteed aan de zorgen van dat de kralen zijn redelijk verspreid.
Globaal, we laten zien een eenvoudige stappen ter voorbereiding van de poly(PFPA) geënt SiO2 kralen, en toonde dat de oppervlakte hydrophilicity van de parels verfijnd met de gedeeltelijke vervanging van de PfP-eenheden met amino-PEG worden kan. Deze polymeer borstels werden met succes gebruikt voor doel eiwitverrijking via IP, presenteren zich als een alternatief voor traditionele eiwit A/G op basis van IP-techniek. Wij verwachten poly(PFPA) borstels om toepassing te vinden op veel andere gebieden waarbij Biomolecuul immobilisatie.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Dit werk werd ondersteund door Agentschap voor ontwikkeling defensie (Grant nr. UD170039ID).
Materials
| Name | Company | Catalog Number | Comments |
| 2,2-Azobisisobutyronitrile, 99% | Daejung Chemicals | 1102-4405 | |
| Methyl alcohol for HPLC, 99.9% | Duksan Pure Chemicals | d62 | |
| Phenylmagnesium bromide solution 1.0 M in THF | Sigma-Aldrich | 331376 | |
| Carbon disulfide anhydrous, ≥99% | Sigma-Aldrich | 335266 | |
| Benzyl bromide, 98% | Sigma-Aldrich | B17905 | |
| Petroleum ether, 90% | Samchun Chemicals | P0220 | |
| Ethyl ether, 99% | Daejung Chemicals | 4025-4404 | |
| Magnesium sulfate anhydrous, powder, 99% | Daejung Chemicals | 5514-4405 | |
| Pentafluorophenyl acrylate | Santa Cruz Biotechnology | sc-264001 | contains inhibitor |
| Aluminium oxide, activated, basic, Brockmann I | Sigma-Aldrich | 199443 | |
| Sodium Chloride (NaCl) | Daejung Chemicals | 7548-4400 | |
| Anisole anhydrous, 99.7% | Sigma-Aldrich | 296295 | |
| Silica nanoparticle | Microparticles GmbH | SiO2-R-0.7 | 5% w/v aqueous suspension |
| 3-Aminopropyltrimethoxysilane, >96.0% | Tokyo Chemical Industry | T1255 | |
| Dimethyl sulfoxide for HPLC, ≥99.7% | Sigma-Aldrich | 34869 | |
| Amino-terminated poly(ethylene glycol) methyl ether | Polymer Source | P16082-EGOCH3NH2 | |
| Phosphate buffered saline tablet | Takara | T9181 | |
| Tween-20 | Calbiochem | 9480 | |
| Tris-HCl (pH 8.0) | Invitrogen | AM9855G | |
| KCl | Invitrogen | AM9640G | |
| NP-40 | VWR | E109-50ML | |
| Glycerol | Invitrogen | 15514-011 | |
| Dithiothreitol | Biosesang | D1037 | |
| Protease inhibitor | Merck | 535140-1MLCN | |
| Bromo phenol blue | Sigma-Aldrich | B5525-5G | |
| Tris-HCl (pH 6.8) | Biosolution | BT033 | |
| Sodium dodecyl sulfate | Biosolution | BS003 | |
| 2-Mercaptoethanol | Gibco | 21985-023 | |
| PKR Antibody | Cell Signaling Technology | 12297S | |
| GAPDH Antibody | Santa Cruz Biotechnology | sc-32233 | |
| Normal Rabbit IgG | Cell Signaling Technology | 2729S | |
| HeLa | Korea Cell Line Bank | 10002 | |
| Sonicator | DAIHAN Scientific | WUC-D10H | |
| Ultrasonicator | BMBio | BR2006A | |
| Centrifuge I | Eppendorf | 5424 R | |
| Centrifuge II | LABOGENE | 1736R | |
| Rotator | FINEPCR | ROTATOR/AG | |
| Vacuum oven | DAIHAN Scientific | ThermoStable OV-30 | |
| Gel permeation chromatography (THF) | Agilent Technologies | 1260 Infinity II | |
| X-ray photoelectron spectrometer | Thermo VG Scientific | Sigma Probe | |
| Dynamic light scattering | Malvern Instruments | ZEN 3690 |
References
- Johnsson, B., Löfås, S., Lindquist, G. Immobilization of proteins to a carboxymethyldextran-modified gold surface for biospecific interaction analysis in surface plasmon resonance sensors. Analytical Biochemistry. 198 (2), 268-277 (1991).
- Kurzawa, C., Hengstenberg, A., Schuhmann, W. Immobilization method for the preparation of biosensors based on pH shift-induced deposition of biomolecule-containing polymer films. Analytical Chemistry. 74 (2), 355-361 (2002).
- You, C. C., et al. Detection and identification of proteins using nanoparticle-fluorescent polymer 'chemical nose' sensors. Nature Nanotechnology. 2 (5), 318-323 (2007).
- Roberts, M. W., Ongkudon, C. M., Forde, G. M., Danquah, M. K. Versatility of polymethacrylate monoliths for chromatographic purification of biomolecules. Journal of Separation Science. 32 (15-16), 2485-2494 (2009).
- Sandison, M. E., Cumming, S. A., Kolch, W., Pitt, A. R. On-chip immunoprecipitation for protein purification. Lab on a Chip. 10 (20), 2805-2813 (2010).
- Das, A., Theato, P. Activated Ester Containing Polymers: Opportunities and Challenges for the Design of Functional Macromolecules. Chemical Reviews. 116 (3), 1434-1495 (2016).
- Choi, J., et al. Functionalization and patterning of reactive polymer brushes based on surface reversible addition and fragmentation chain transfer polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 50 (19), 4010-4018 (2012).
- Kessler, D., Jochum, F. D., Choi, J., Char, K., Theato, P. Reactive surface coatings based on polysilsesquioxanes: universal method toward light-responsive surfaces. ACS Applied Materials & Interfaces. 3 (2), 124-128 (2011).
- Son, H., et al. Penetration and exchange kinetics of primary alkyl amines applied to reactive poly(pentafluorophenyl acrylate) thin films. Polymer Journal. 48 (4), 487-495 (2016).
- Kessler, D., Roth, P. J., Theato, P. Reactive surface coatings based on polysilsesquioxanes: controlled functionalization for specific protein immobilization. Langmuir. 25 (17), 10068-10076 (2009).
- Kessler, D., Theato, P. Reactive surface coatings based on polysilsesquioxanes: defined adjustment of surface wettability. Langmuir. 25 (24), 14200-14206 (2009).
- Kessler, D., Nilles, K., Theato, P. Modular approach towards multi-functional surfaces with adjustable and dual-responsive wettability using a hybrid polymer toolbox. Journal of Materials Chemistry. 19 (43), 8184-8189 (2009).
- Eberhardt, M., Mruk, R., Zentel, R., Theato, P. Synthesis of pentafluorophenyl(meth)acrylate polymers: new precursor polymers for the synthesis of multifunctional materials. European Polymer Journal. 41 (7), 1569-1575 (2005).
- Jochum, F. D., Forst, F. R., Theato, P. PNIPAM copolymers containing light-responsive chromophores: a method toward molecular logic gates. Macromolecular Rapid Communications. 31 (16), 1456-1461 (2010).
- Schattling, P., Pollmann, I., Theato, P. Synthesis of CO2-responsive polymers by post-polymerization modification. Reactive & Functional Polymers. 75, 16-21 (2014).
- He, L., Szameit, K., Zhao, H., Hahn, U., Theato, P. Postpolymerization modification using less cytotoxic activated ester polymers for the synthesis of biological active polymers. Biomacromolecules. 15 (8), 3197-3205 (2014).
- Arnold, R. M., McNitt, C. D., Popik, V. V., Locklin, J. Direct grafting of poly(pentafluorophenyl acrylate) onto oxides: versatile substrates for reactive microcapillary printing and self-sorting modification. Chemical Communications. 50 (40), 5307-5309 (2014).
- Son, H., Ku, J., Kim, Y., Li, S., Char, K. Amine-Reactive Poly(pentafluorophenyl acrylate) Brush Platforms for Cleaner Protein Purification. Biomacromolecules. 19 (3), 951-961 (2018).
- Cullen, S. E., Schwartz, B. D. An improved method for isolation of H-2 and Ia alloantigens with immunoprecipitation induced by protein A-bearing staphylococci. The Journal of Immunology. 117 (1), 136-142 (1976).
- Sisson, T. H., Castor, C. W. An improved method for immobilizing IgG antibodies on protein A-agarose. Journal of Immunology Methods. 127 (2), 215-220 (1990).
- Peritz, T., et al. Immunoprecipitation of mRNA-protein complexes. Nature Protocols. 1 (2), 577-580 (2006).
- Zhang, Z., Chen, S., Jiang, S. Dual-functional biomimetic materials: nonfouling poly (carboxybetaine) with active functional groups for protein immobilization. Biomacromolecules. 7 (12), 3311-3315 (2006).
- Yao, Y., et al. NHS-ester functionalized poly(PEGMA) brushes on silicon surface for covalent protein immobilization. Colloids and Surfaces B: Biointerfaces. 66 (2), 233-239 (2008).
- Ma, J., et al. Facile fabrication of microsphere-polymer brush hierarchically three-dimensional (3D) substrates for immunoassays. Chemical Communications. 51 (31), 6749-6752 (2015).
- Chong, Y., et al. Thiocarbonylthio compounds [SC (Ph) S− R] in free radical polymerization with reversible addition-fragmentation chain transfer (RAFT Polymerization). Role of the free-radical leaving group (R). Macromolecules. 36 (7), 2256-2272 (2003).
- Jochum, F. D., Theato, P. Temperature- and Light-Responsive Polyacrylamides Prepared by a Double Polymer Analogous Reaction of Activated Ester Polymers. Macromolecules. 42 (16), 5941-5945 (2009).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. JoVE. , Cambridge, MA. (2018).
- Chua, G. B. H., Roth, P. J., Duong, H. T. T., Davis, T. P., Lowe, A. B. Synthesis and Thermoresponsive Solution Properties of Poly[oligo(ethylene glycol) (meth)acrylamide]s: Biocompatible PEG Analogues. Macromolecules. 45 (3), 1362-1374 (2012).
Tags
Chemie kwestie 141 Poly (pentafluorfenyl acrylaat) 3-aminopropyltriethoxysilaan reactieve polymeren borstel na polymerisatie functionalization immobilisatie van het antilichaam immunoprecipitationErratum
Formal Correction: Erratum: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification
Posted by JoVE Editors on 04/30/2019.
Citeable Link.
An erratum was issued for: Preparation of Poly(pentafluorophenyl acrylate) Functionalized SiO2 Beads for Protein Purification. Throughout the article, the term "3-aminopropyltriethoxysilane" has been replaced with "3-aminopropyltrimethoxysilane", and "APTES" with "APTMS".
The Keywords were updated from:
Poly(pentafluorophenyl acrylate), 3-aminopropyltriethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
to:
Poly(pentafluorophenyl acrylate), 3-aminopropyltrimethoxysilane, reactive polymer brush, post-polymerization functionalization, antibody immobilization, immunoprecipitation
The Abstract was updated from:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltriethoxysilane (APTES) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTES. The deposition of APTES and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
to:
We demonstrate a simple method to prepare poly(pentafluorophenyl acrylate) (poly(PFPA)) grafted silica beads for antibody immobilization and subsequent immunoprecipitation (IP) application. The poly(PFPA) grafted surface is prepared via a simple two-step process. In the first step, 3-aminopropyltrimethoxysilane (APTMS) is deposited as a linker molecule onto the silica surface. In the second step, poly(PFPA) homopolymer, synthesized via the reversible addition and fragmentation chain transfer (RAFT) polymerization, is grafted to the linker molecule through the exchange reaction between the pentafluorophenyl (PFP) units on the polymer and the amine groups on APTMS. The deposition of APTMS and poly(PFPA) on the silica particles are confirmed by X-ray photoelectron spectroscopy (XPS), as well as monitored by the particle size change measured via dynamic light scattering (DLS). To improve the surface hydrophilicity of the beads, partial substitution of poly(PFPA) with amine-functionalized poly(ethylene glycol) (amino-PEG) is also performed. The PEG-substituted poly(PFPA) grafted silica beads are then immobilized with antibodies for IP application. For demonstration, an antibody against protein kinase RNA-activated (PKR) is employed, and IP efficiency is determined by Western blotting. The analysis results show that the antibody immobilized beads can indeed be used to enrich PKR while non-specific protein interactions are minimal.
The fourth paragraph of the Introduction was updated from:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTES linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTES. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
to:
In this contribution, we report an alternative method to prepare poly(PFPA) grafted surface for antibody immobilization and IP application. In a simple two-step process, as illustrated in Figure 1, an APTMS linker molecule is first deposited onto the silica surface, then the poly(PFPA) polymer is covalently attached to the linker molecule through the reaction between the PFP units on the polymer and the amine functions on APTMS. This preparation method allows for the permanent crosslinking of poly(PFPA) to a substrate surface, but avoids the many complications associated with SI-CTA synthesis and SI-RAFT polymerization of poly(PFPA) brushes. Partial substitution of the PFP units with amino-PEG can still be performed, allowing fine-tuning of the polymer brush surface properties. We show the poly(PFPA) grafted silica beads thus prepared can be immobilized with antibodies and used for protein enrichment via IP. The detailed bead preparation procedure, antibody immobilization, and IP testing are documented in this article, for readers interested in seeking an alternative to conventional Protein A/G based IP.
Step 2.1 of the Protocol was updated from:
Treatment of SiO2 beads with APTES
to:
Treatment of SiO2 beads with APTMS
Step 2.1.1 of the Protocol was updated from:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTES and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
to:
SiO2 particles are available in the form of a 5% (w/v) aqueous suspension. Combine 0.8 mL of SiO2 suspension with 40 mg of APTMS and 8 mL of methanol in a 20 mL scintillation vial equipped with a stir bar.
Step 2.1.3 of the Protocol was updated from:
Transfer the solution to a conical tube. To isolate the APTES functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
to:
Transfer the solution to a conical tube. To isolate the APTMS functionalized SiO2 beads, centrifuge the solution at 10,000 x g for 5 min, then remove the supernatant. Wash the beads by re-dispersing them in 3 mL of fresh methanol. Shake the tube by hand for mixing, but if necessary, improve the dispersion by sonication in a water bath for a few seconds. Centrifuge the beads at 10,000 x g for 5 min. Remove the supernatant and repeat the wash step one more time.
Step 2.1.4 of the Protocol was updated from:
NOTE: The final suspension contains the APTES functionalized SiO2 beads dispersed in 4 mL of DMSO.
to:
Combine the methanol washed SiO2 beads with 3 mL of dimethyl sulfoxide (DMSO). Shake the mixture by hand, or if necessary sonicate for a few seconds, until the beads are fully dispersed in DMSO. Centrifuge the beads at 10,000 x g for 5 min, then remove the supernatant. Repeat the step to ensure complete solvent exchange from methanol to DMSO.
NOTE: The final suspension contains the APTMS functionalized SiO2 beads dispersed in 4 mL of DMSO.
Step 2.2 of the Protocol was updated from:
Grafting poly(PFPA) to APTES functionalized SiO2 beads
to:
Grafting poly(PFPA) to APTMS functionalized SiO2 beads
Step 2.2.2 of the Protocol was updated from:
Add 1 mL of APTES functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
to:
Add 1 mL of APTMS functionalized SiO2 beads suspended in DMSO (from Step 2.1.4) to the poly(PFPA) solution. React at RT for 1 h with vigorous stirring.
Step 3.4 of the Protocol was updated from:
To prepare APTES functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTES functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
to:
To prepare APTMS functionalized SiO2 beads suspended in DMSO, follow the same steps shown in Step 2.1. Transfer 1 mL of the bead suspension into the PEG-substituted poly(PFPA) solution prepared in Step 3.3. Allow the grafting between poly(PFPA) and APTMS functionalized SiO2 beads to proceed at RT for 1 h with vigorous stirring.
The first paragraph of the Representative Results was updated from:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTES and poly(PFPA) grafting process, bare SiO2 beads, APTES functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
to:
A schematic for the preparation of poly(PFPA) grafted SiO2 beads, with or without PEG substitution is shown in Figure 1. To monitor the APTMS and poly(PFPA) grafting process, bare SiO2 beads, APTMS functionalized SiO2 beads, and poly(PFPA) grafted SiO2 beads are characterized by both DLS (Figure 2) and XPS (Figure 3). IP efficiencies of the beads are determined by Western blotting. Figure 4 shows the Western blotting results for IP using 1% PEG-substituted poly(PFPA) grafted beads, where the beads are incubated with no antibody, a non-specific antibody, or anti-PKR antibody. Figure 5 shows the Western blotting results for IP using 0% PEG-substituted poly(PFPA) grafted beads and 1% PEG-substituted poly(PFPA) grafted beads, both incubated with anti-PKR antibodies.
Figure 1 was updated from:
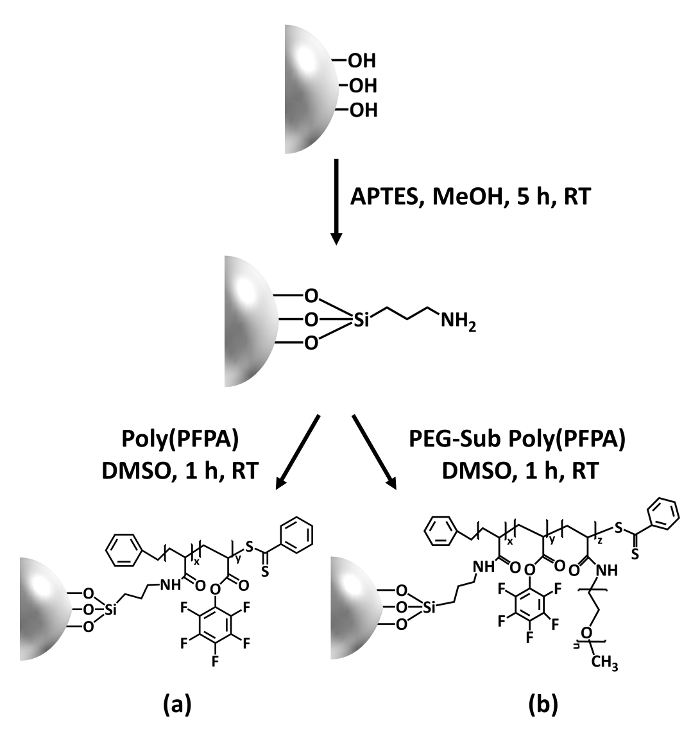
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTES as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
to:
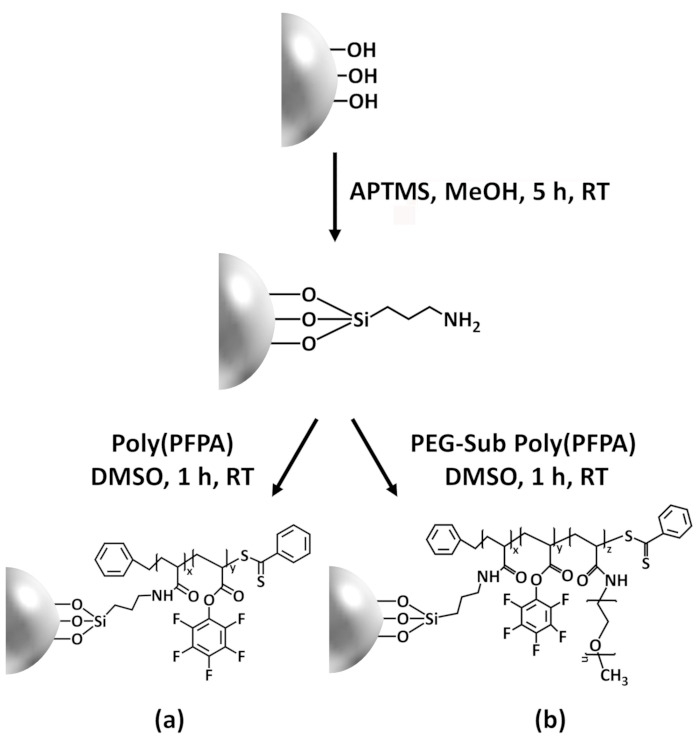
Figure 1: Schematic for the preparation of poly(PFPA) grafted SiO2 beads using APTMS as a linker molecule. (a) Poly(PFPA) grafted beads. (b) Partially PEG-substituted poly(PFPA) grafted beads.
Figure 2 was updated from:
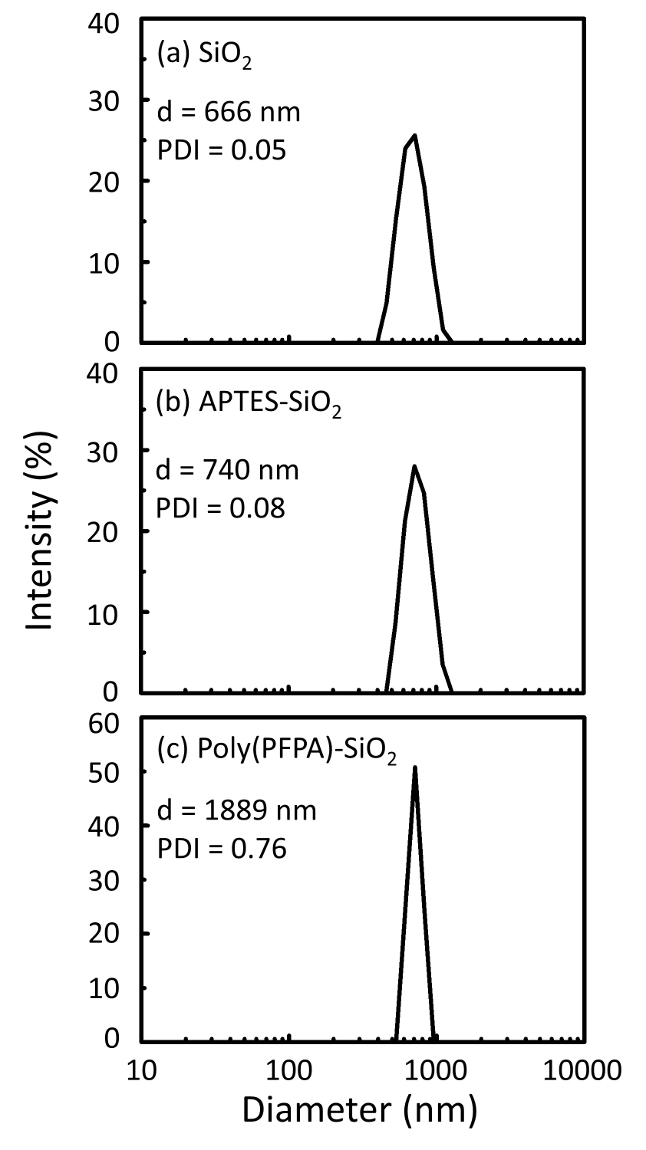
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTES functionalized SiO2 beads (APTES-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
to:
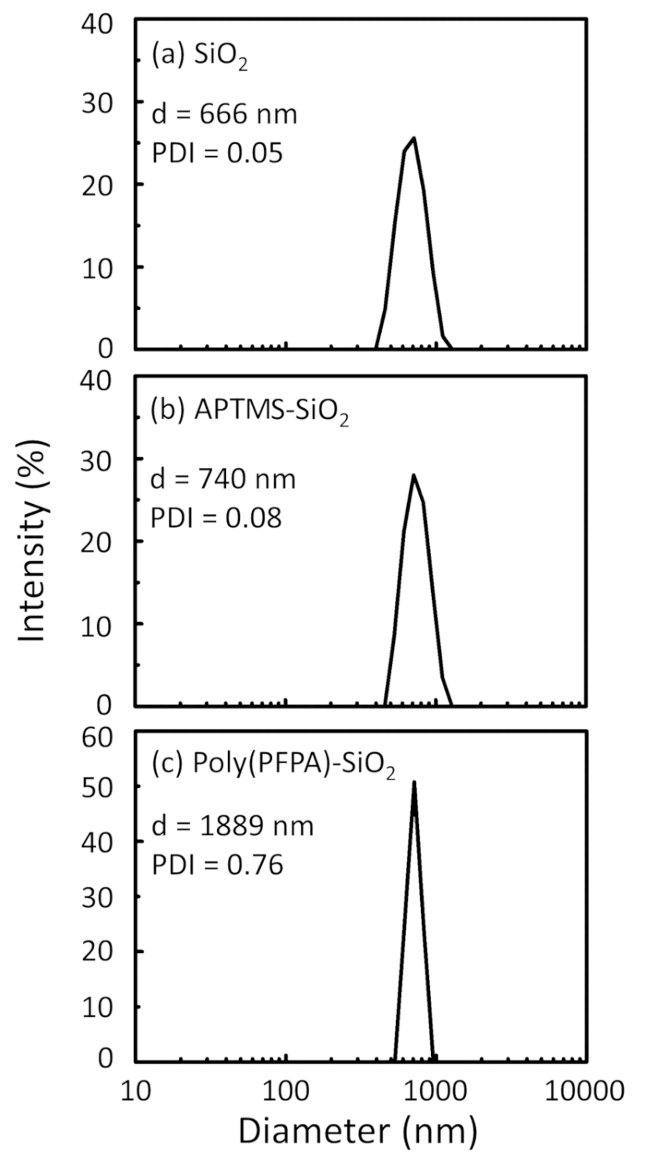
Figure 2: DLS measurements for (a) bare SiO2 beads (SiO2), (b) APTMS functionalized SiO2 beads (APTMS-SiO2), and (c) poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2), dispersed in DMSO. The Z-average diameter (d) and polydispersity index (PDI) of each sample are reported.
Figure 3 was updated from:
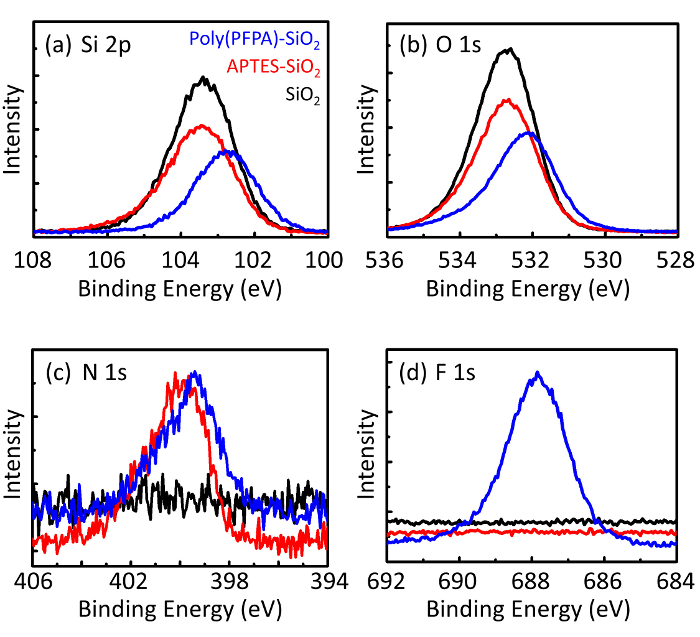
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTES functionalized SiO2 beads (APTES-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
to:
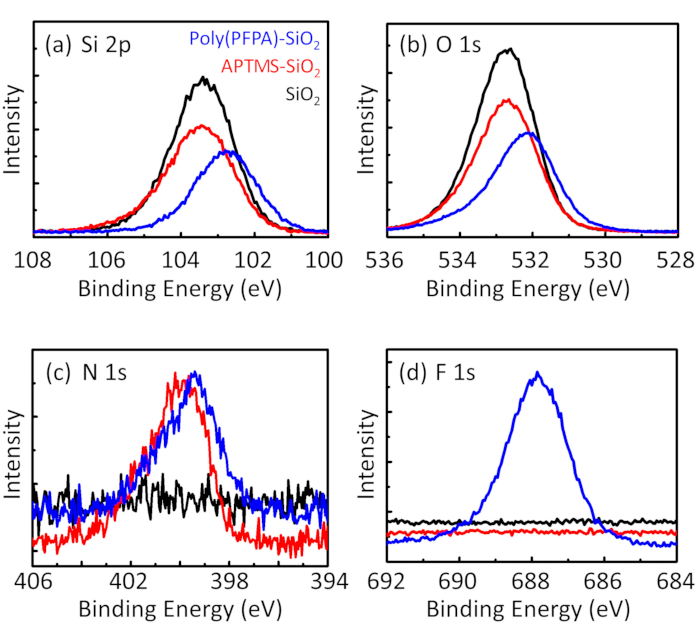
Figure 3: XPS spectra for bare SiO2 beads (SiO2), APTMS functionalized SiO2 beads (APTMS-SiO2), and poly(PFPA) grafted SiO2 beads (poly(PFPA)-SiO2). The peaks examined correspond to (a) Si 2p, (b) O 1s, (c) N 1s, and (d) F 1s.
The first and second paragraphs of the Discussion were updated from:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTES as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTES, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTES linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTES treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTES treatment, N 1s peak associated with the amine groups on APTES is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTES, then with poly(PFPA).
to:
The synthesis of poly(PFPA) grafted SiO2 beads is illustrated in Figure 1. By employing APTMS as a linker molecule, poly(PFPA) brushes covalently grafted to SiO2 substrate can be prepared via a simple two-step process. Although some of the PFP units are sacrificed for the reaction with APTMS, a large number of the PFP units are expected to remain available for later reaction with either amino-PEG or antibodies. The PFP groups are known to form low energy surfaces so poly(PFPA) brushes do not solvate well in water28. For IP application, the antibodies need to be immobilized on the poly(PFPA) brushes, and this exchange reaction is done in aqueous buffer solution in order to preserve the activity of the antibodies. As reported in our previous publication, partial substitution of the PFP units with hydrophilic molecules such as amine-functionalized PEG can improve surface hydrophilicity, leading to increased antibody immobilization efficiency18. In this study, partially PEG substituted poly(PFPA) is also prepared, then grafted to the SiO2 surface using the same APTMS linker molecule. Overall, the methods illustrated in Figure 1 allow the preparation of poly(PFPA) grafted surfaces with different degrees of PEG substitution. These polymer brushes with tunable surface properties provide an ideal platform for antibody immobilization and subsequent IP application.
The bead preparation process is monitored by both DLS and XPS. The DLS results for various functionalized SiO2 beads in DMSO are summarized in Figure 2. The bare SiO2 beads exhibit hydrodynamic diameter of 666 nm, in agreement with the manufacturer reported bead size (0.676 μm; SD = 0.03 μm). After APTMS treatment, the bead diameter increases to 740 nm; and with poly(PFPA) treatment, the bead diameter further increases to 1889 nm. It is important to point out that the polydispersity index (PDI) for the poly(PFPA) grafted beads is rather large (PDI = 0.76), which is indicative of poor quality sample containing large aggregates. Although the DLS curve only shows one nano-sized peak, small amount of aggregates may be present in the suspension. The functionalized SiO2 beads are also examined by XPS to determine surface composition (Figure 3). Following APTMS treatment, N 1s peak associated with the amine groups on APTMS is detected. And, following poly(PFPA) treatment, F 1s peak associated with the PFP units on the polymer is detected. Together these data show the successful functionalization of the SiO2 surface, first with APTMS, then with poly(PFPA).



